中国是梨原产国,也是世界第一产梨大国,梨产量占世界总产量的2/3,出口量约占世界总出口量的1/6,中国梨在世界梨产业发展中具有举足轻重的作用[1]。重庆作为砂梨适宜种植区和长江流域砂梨主产区,2018年栽培面积维持在3.6×104 hm2,总产量为47.3×105 t。在实际生产栽培中,梨树受到黑斑病、黑星病、轮纹病、炭疽病等多种真菌性病害的影响,梨树病害已成为制约世界梨产业发展的主要因素[2]。其中,梨黑斑病是一种广泛发生的世界性病害,尤其是在日本、韩国和中国南部砂梨产区发病严重[1]。梨黑斑病是由链格孢属(Alternaria sp.)真菌引起的一种病害[3],主要侵染梨树叶片、嫩枝和果实,造成早期落叶、果实畸形、龟裂,甚至落果,严重影响梨树产量和梨果品质[4]。目前,防治黑斑病的方法主要是使用甲基托布津、多菌灵等化学药剂,长期使用这些化学药剂,不仅造成环境污染,同时也使部分菌株对化学药剂敏感性降低,防治效果下降。而且,由于梨树童期长,遗传背景复杂,大部分品种自交不亲和等特性,传统的抗病育种成本高、效率低。通过分子生物学发掘梨抗病基因,利用分子抗病育种培育抗病良种可以缩短育种年限,提高育种效率,是解决梨黑斑病危害的有效途径。
富亮氨酸重复序列受体样蛋白激酶(The leucine-rich repeats receptor-like protein kinase,LRR-RLK)是植物中已知的最大的一类跨膜类受体蛋白激酶[5],它由胞外LRR结构域、单次跨膜域和胞内激酶结构域组成。1990年,Walker等[6]从玉米中首次发现LRR-RLK,之后越来越多的LRR-RLK被挖掘[7]。在拟南芥中,通过测序分析鉴定出至少223个LRR-RLKs[8],其中超过30个通过遗传和生化研究确定了其功能[9]。目前,已有研究表明,LRR-RLKs的功能主要包括两个方面:一是在植物的生长发育过程中发挥作用,如形态发生、器官形成和激素调节; 二是参与植物生物和非生物胁迫应答反应[10]。Kim等[11]和Stahl等[12]研究发现,LRR-RLKs中的BRI1、BAK1和CLV1在植物的生长和发育过程中发挥决定性的作用,而FLS2等其他LRR-RLKs基因参与了植物自身防御反应[13]。
目前,已通过转录组测序获得梨黑斑病抗病相关基因,但还需通过抗病基因精细定位与基因表达、功能验证等方法相结合筛选梨黑斑病抗病关键基因。
本研究利用同源基因克隆方法获得一个LRR-LRK类抗病相关基因,利用生物信息学、Southern Blot、亚细胞定位等方法对该基因展开分析,同时,利用实时荧光定量PCR技术分析该基因在梨黑斑病诱导下的表达情况,为进一步研究其在梨抗病防御中的作用提供理论依据。
1 材料与方法 1.1 材料“黄花梨”(Pyrus pyrifolia)、“爱宕梨”(Pyrus pyrifolia)、“翠玉梨”(Pyrus pyrifolia)、“黄冠梨”(Pyrus pyrifolia×Pyrus bretschneideri)均来自重庆市农业科学院果树研究所梨资源圃。RNA提取试剂盒(Hipure Total RNA Mini Kit)、DNA提取试剂盒(HiPure SF Plant DNA Maxi Kit)、质粒提取试剂盒(HiPure Plasmid Micro Kit)等购自Magen(中国)。Southern blot试剂盒购自Roche(美国)。反转录试剂盒(PrimeScriptTM RT reagent Kit)、荧光染料(TB GreenTM Premix Ex TaqTM)等购自TaKaRa(中国)。PCR试剂、TGEM-T-easy、T4连接酶、大肠杆菌DH5α等购自TSINGKE(中国)。
梨黑斑病病原菌由重庆市农业科学院果树研究所早熟梨课题组分离保存。
1.2 方法 1.2.1 PpEMS1全长CDS的克隆利用Hipure Total RNA Mini Kit(双柱法)提取“黄冠梨”叶片总RNA,参照PrimeScriptTM RT reagent Kit说明书反转录合成cDNA。根据白梨基因组数据库,应用软件primer5.0设计PpEMS1全长引物PpEMS1-f和PpEMS1-r,以黄冠cDNA为模板,进行PCR扩增,电泳产物回收后连接TGEM-T-easy载体,并通过热激转化法转入大肠杆菌DH5α,涂布于LB/Amp固体培养基。挑取单菌落进行PCR验证,并将阳性菌液送擎科生物技术有限公司进行测序。
1.2.2 生物信息学分析利用vector软件对测序结果进行分析,寻找最大开放阅读框(Open reading frame,ORF); 利用SMART在线数据库对蛋白结构域进行分析; 利用ExPASY网站在线分析蛋白基本性质分子量、pI、氨基酸残基组成、亲疏水性等; 在线(http://wolfopsort.org/)预测亚细胞定位; 在线(http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)预测核定位信号; 利用ClustalX 2.0和MEGA 5.0构建PpEMS1与拟南芥部分已知功能LRR-RLKs家族基因的系统进化树。
1.2.3 PpEMS1的表达分析采集黄花和爱宕嫩叶,以叶脉为中心,在叶背分别用无菌针头创伤后接种梨黑斑病病原菌和无菌水,放置培养箱中。分别于1、2、3、4、5、6、7和8 d后提取叶片总RNA。
以RNA为反转录模板,参照PrimeScriptTM RT reagent Kit说明反转录合成cDNA。根据PpEMS1保守序列区设计荧光定量PCR引物E1-f和E1-r,以持家基因Actin为内参基因,应用life technologies公司生产的7500Fast荧光实时定量PCR仪(美国)进行荧光定量PCR分析(表 1)。
PCR反应体系(12 µL)为6 µL TB Green Premix Ex Taq、1 µL cDNA、特异引物各0.3 µL和ddH2O 4.4 µL。反应程序为94℃ 3 min; 94℃ 30 s,60℃ 15 s,72℃ 30 s,40个循环; 72℃ 10 min。
1.2.4 Southern Blot分析采集“黄冠梨”、“黄花梨”、“爱宕梨”、“翠玉梨”嫩叶,利用HiPure SF Plant DNA Maxi Kit提取基因组DNA,并用BglⅡ和EcoR V完全酶切。根据PpEMS1保守序列区设计杂交探针,并与酶切产物在尼龙膜上杂交。探针标记、杂交及信号检测等操作均按照杂交试剂盒(DIG High Primer DNA Labeling and Detection Starter KitⅠ,Roche)说明书进行。
1.2.5 PpEMS1烟草瞬时表达分析设计包含酶切位点KpnⅠ/BamHⅠ的引物,以测序正确质粒为模板扩增PpEMS1,并回收电泳产物。同时用KpnⅠ/BamHⅠ酶切电泳回收产物和pSAT6-mRFP-N1载体,酶切产物用T4连接酶进行连接,得到pSAT6-PpEMS1:mRFP-N1融合表达载体。进一步用KpnⅠ/XbaⅠ和KpnⅠ/SpeⅠ对中间载体Psat6-PpEMS1:mRFP-N1、Psat6-mGFP-N1和植物表达载体PLGN-35s-nos进行酶切,酶切产物经连接后得到表达载体PLGN-PpEMS1:mRFP-35s-nos和PLGN-mGFP-35s-nos,转入大肠杆菌DH5α,提取阳性克隆单菌落质粒酶切验证后测序,测序结果正确的质粒转化农杆菌。提取农杆菌阳性单菌落置于kan抗性的LB培养基,放于28℃摇床中震荡培养24 h,转速220 r/min。离心后重悬菌体,调节OD值至1。采用注射法进行本氏烟表皮转化,24℃培养3 d后共聚焦显微镜观察荧光信号。
2 结果 2.1 PpEMS1全长CDS克隆根据PpEMS1的全长引物PpEMS1-f和PpEMS1-r,以“黄冠”cDNA为模板扩增获得约3 800 bp的基因片段(图 1),经测序分析,该基因全长3 894 bp。

|
| M:DNA maker; L1:扩增片段 图 1 PpEMS1的CDS全长克隆 |
ExPASY ProtParam tool在线预测分析表明,PpEMS1蛋白分子量为140.59 kD; 理论等电点为5.42;该蛋白由20种氨基酸组成,其中Leu含量最多,Ser、Glu、Pro、Ala等含量较为丰富,Trp含量最少,碱性带正电荷的氨基酸共128个,酸性带负电荷的氨基酸共100个,整个蛋白为带正电碱性蛋白; 半衰期大于10 h; 不稳定系数为32.95,属稳定蛋白; 平均亲水性为0.041,属亲水性蛋白。
2.2.2 PpEMS1蛋白结构域分析SMART在线数据库分析显示:PpEMS1蛋白激酶除具有引导信号肽SP外,还包括LRR-RLKs典型的亮氨酸重复结构域(Leucine-rich repeats,LRRs)、单跨膜结构域(Single transmembranous domain,STM)以及激酶活性结构域(Kinase domain,KD),其LRRs属于胞外LRRs结构(图 2)。说明该蛋白激酶属于LRR-RLK家族。
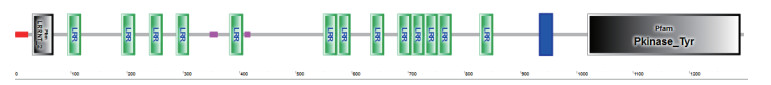
|
| 表示跨膜结构域域; 表示信号肽; Pfam表示蛋白结构域 图 2 PpEMS1蛋白保守结构域预测分析 |
Psort在线预测分析显示该蛋白位于细胞质膜的得分最高; NLS预测显示该蛋白激酶氨基酸序列1 261-1 294处为核定位序列。
2.2.4 PpEMS1系统进化树分析通过查阅文献和NCBI数据库比对,获得拟南芥(Arabidopsis thaliana)部分已知功能LRR-RLK相关基因,运用MEGA5.0软件构建NJ系统进化树(图 3),PpEMS1与拟南芥AtEMS1亲缘关系最近,其次是AtBIR1。AtEMS1参与调控花药体细胞及生殖细胞形态建成,AtBIR1参与调控植物抗性相关信号通路,与细胞防御反应相关。

|
| 图 3 PpEMS1系统进化树分析 |
实时荧光定量PCR分析表明,“黄花梨”(较耐)和“爱宕梨”(易感)在接种梨黑斑病病原菌1、2、3、4、5、6、7和8 d后,“黄花梨”中,该基因的表达呈现先下降后逐渐升高,在6 d时达到最高点,之后逐渐降低; “爱宕梨”中,该基因的表达基本呈现先上升后下降的趋势,在4 d的时候达到最高点。同时,4 d之前该基因的表达量在“爱宕梨”中均高于“黄花梨”,4 d后“黄花梨”中均高于“爱宕梨”(图 4)。
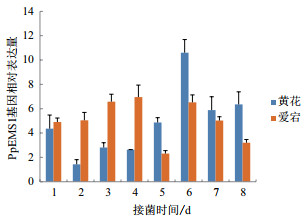
|
| 图 4 “黄花梨”和“爱宕梨”接种梨黑斑病不同时期后PpEMS1的表达分析 |
对“黄冠梨”(HG)、“黄花梨”(HH)、“爱宕梨”(AD)、“翠玉梨”(CY)4个品种进行Southern Blot分析,结果(图 5)表明,在“黄冠梨”、“黄花梨”、“翠玉梨”中,该基因都以单拷贝形式存在,在“爱宕梨”中以多拷贝形式存在。
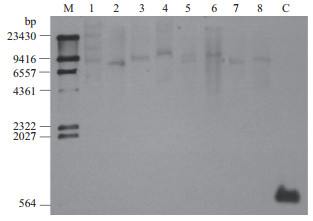
|
| M:Marker; 1:AD-BglⅡ; 2:HH-BglⅡ; 3:CY-BglⅡ; 4:HG-BglⅡ; 5:AD-EcoRV; 6:HH-EcoRV; 7:CY-EcoRV; 8:HG-EcoRV; C:阳性片段 图 5 PpEMS1的Southern Blot分析 |
构建基因与绿色荧光蛋白GFP的融合表达载体,经测序验证,获得正确融合表达载体。载体转入农杆菌后通过注射法瞬时侵染本氏烟,注射后培养48 h,对本氏烟进行DAPI染色,在激光共聚焦显微镜下观察叶片中基因的定位情况(图 6)。对照组中GFP蛋白在细胞膜和细胞核均存在,试验组融合蛋白荧光信号在细胞膜和细胞核中均有表达。

|
| A:农杆菌介导mGFP质粒在本氏烟叶片中瞬时表达; B:农杆菌介导PLGN-2×35S-PpEMS1质粒在本氏烟叶片中瞬时表达 图 6 PpEMS1蛋白激酶的亚细胞定位 |
本研究从“黄冠梨”克隆获得一个预测为富亮氨酸重复序列受体样蛋白激酶EMS1的基因,暂命名为PpEMS1。Southern blot分析表明,在“黄花梨”、“翠玉梨”、“黄冠梨”中,该基因都以单拷贝形式存在,在“爱宕梨”中以多拷贝形式存在。实时荧光定量PCR分析表明,该基因受梨黑斑病诱导上调表达。该蛋白激酶具有一段NLS,亚细胞定位显示融合蛋白在细胞质膜和细胞核均有表达,推测该蛋白激酶合成后可能分别在质膜和核膜发挥作用。
黑斑病病原菌可以在花期和果实生长发育时期通过各种途径潜伏侵染,也可以通过气孔和伤口侵染叶片,对果实和叶片造成伤害。当病原菌侵入健康的植物细胞和组织后,寄主植物细胞的正常生理功能遭到破坏,病原菌不仅夺取寄主植物的营养物质和水分,同时还给植物施加机械压力并产生有害代谢产物,如酶、毒素等,使植株产生病症。病原菌要侵入植物内,必须克服植物细胞壁的障碍,病原菌通过产生降解酶穿透细胞壁,破坏寄主细胞结构,有利于病原菌侵入。
已有多项研究表明,受体蛋白激酶参与植物的抗病防御过程。Song等[14]研究表明,水稻Xa21对水稻黄单胞菌具有抗病作用; 在拟南芥中,FLS2与细菌鞭毛蛋白的感知有关[15]; 富亮氨酸重复序列受体蛋白激酶BIR2是植物免疫系统中BAK1的负调控因子[16]; NIK1参与了植物抗病毒免疫反应过程[17]。
在拟南芥中,EMS1受体蛋白激酶被证实与小孢子细胞及绒毡层细胞分化有关,EMS1通过信号调节控制生殖细胞和周边体细胞的命运[18]。在柑橘中,EMS受体蛋白激酶受柑橘溃疡病诱导表达,推测该蛋白激酶可能参与植物的抗病防御过程[19]。目前只鉴定出少数LRR-RLKs类蛋白激酶的配体,TPD1是EMS1蛋白激酶的一种小富半胱氨酸蛋白配体[20],可以与EMS1相互作用,诱导EMS1磷酸化,进而引起细胞内一些列生理生化反应[21]。研究表明,拟南芥β-碳酸酐酶(βCAs)是EMS1激酶的下游互作蛋白,其中βCA1和βCA4协同EPF2和CO2响应分泌蛋白共同调节气孔的发育和运动[22-23]。在植物木质部纤维中,富亮氨酸重复序列受体样蛋白激酶PXC1参与了植物细胞壁的形成[24],EMS1与细胞分化相关,它是否也参与到植物次生细胞壁的形成,并在病原菌侵染细胞壁时发挥作用,有待进一步研究。
4 结论从“黄冠梨”中克隆获得一个LRR-RLK家族基因PpEMS1,它以不同拷贝数存在于不同梨基因组中,其蛋白作为跨膜蛋白,主要在细胞膜发挥作用,可能参与了梨黑斑病抗病防御过程。
| [1] |
杨晓平, 陈启亮, 张靖国, 等. 梨黑斑病及抗病育种研究进展[J]. 果树学报, 2017, 34(10): 1340-1348. |
| [2] |
Zhang H, Wang Y, Zhang C, et al. Isolation, characterization and expression analysis of resistance gene candidates in pear(Pyrus spp.)[J]. Scientia Horticulturae, 2011, 127(3): 282-289. DOI:10.1016/j.scienta.2010.10.016 |
| [3] |
常有宏, 刘永锋, 王宏, 等. 梨黑斑病病菌的致病条件[J]. 江苏农业学报, 2008(3): 316-320. DOI:10.3969/j.issn.1000-4440.2008.03.020 |
| [4] |
李云飞, 陈雪娇, 张爱芳, 等. 砀山梨黑斑病分子检测技术研究[J]. 中国农学通报, 2016, 32(4): 150-154. |
| [5] |
Shiu SH, Bleecker AB. Receptor-like kinases from Arabidopsis form a monophyletic gene family related to animal receptor kinases[J]. Proc Natl Acad Sci USA, 2001, 98(19): 10763-10768. DOI:10.1073/pnas.181141598 |
| [6] |
Walker JC, Zhang R. Relationship of a putative receptor protein kinase from maize to the S-locus glycoproteins of Brassica[J]. Nature, 1990, 345(6277): 743-746. DOI:10.1038/345743a0 |
| [7] |
Gao LL, Xue HW. Global analysis of expression profiles of rice receptor-like kinase genes[J]. Mol Plant, 2012, 5(1): 143-153. DOI:10.1093/mp/ssr062 |
| [8] |
Lehti-Shiu MD, Zou C, Hanada K, et al. Evolutionary history and stress regulation of plant receptor-like kinase/pelle genes[J]. Plant Physiol, 2009, 150(1): 12-26. DOI:10.1104/pp.108.134353 |
| [9] |
Torii KU. Leucine-rich repeat receptor kinases in plants:structure, function, and signal transdution pathways[J]. International Reciew of Cytology, 2004, 234: 1-46. DOI:10.1016/S0074-7696(04)34001-5 |
| [10] |
Brummell DA, Catala C, Lashbrook CC, et al. A membrane-anchored E-type endo-1, 4-beta-glucanase is localized on Golgi and plasma membranes of higher plants[J]. Proc Natl Acad Sci USA, 1997, 94(9): 4794-4799. DOI:10.1073/pnas.94.9.4794 |
| [11] |
Kim TW, Wang ZY. Brassinosteroid signal transduction from receptor kinases to transcription factors[J]. Annu Rev Plant Biol, 2010, 61: 681-704. DOI:10.1146/annurev.arplant.043008.092057 |
| [12] |
Stahl Y, Simon R. Peptides and receptors controlling root development[J]. Philos Trans R Soc Lond B Biol Sci, 2012, 367(1595): 1453-1460. DOI:10.1098/rstb.2011.0235 |
| [13] |
Greeff C, Roux M, Mundy J, et al. Receptor-like kinase complexes in plant innate immunity[J]. Front Plant Sci, 2012, 3: 209. |
| [14] |
Song WY, Wang GL, Chen LL, et al. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21[J]. Science, 1995, 270(5243): 1804-1806. DOI:10.1126/science.270.5243.1804 |
| [15] |
Gomez-Gomez L, Boller T. FLS2:an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis[J]. Mol Cell, 2000, 5(6): 1003-1011. DOI:10.1016/S1097-2765(00)80265-8 |
| [16] |
Halter T, Imkampe J, Mazzotta S, et al. The leucine-rich repeat receptor kinase BIR2 is a negative regulator of BAK1 in plant immunity[J]. Curr Biol, 2014, 24(2): 134-143. DOI:10.1016/j.cub.2013.11.047 |
| [17] |
Zorzatto C, Machado JP, Lopes KV, et al. NIK1-mediated translation suppression functions as a plant antiviral immunity mechanism[J]. Nature, 2015, 520(7549): 679-682. DOI:10.1038/nature14171 |
| [18] |
Zhao DZ, Wang GF, Speal B, et al. The excess microsporocytes1 gene encodes a putative leucine-rich repeat receptor protein kinase that controls somatic and reproductive cell fates in the Arabidopsis anther[J]. Genes Dev, 2002, 16(15): 2021-2031. DOI:10.1101/gad.997902 |
| [19] |
段敏杰, 陈善春, 周鹏飞, 等. 柑橘溃疡病相关基因CitEX3的克隆与表达分析[J]. 西南师范大学学报:自然科学版, 2016, 41(5): 213-218. |
| [20] |
Huang J, Zhang T, Linstroth L, et al. Control of Anther cell differentiation by the small protein ligand TPD1 and its receptor EMS1 in Arabidopsis[J]. PLoS Genet, 2016, 12(8): e1006147. DOI:10.1371/journal.pgen.1006147 |
| [21] |
Jia G, Liu X, Owen HA, et al. Signaling of cell fate determination by the TPD1 small protein and EMS1 receptor kinase[J]. Proc Natl Acad Sci USA, 2008, 105(6): 2220-2225. DOI:10.1073/pnas.0708795105 |
| [22] |
Engineer CB, Ghassemian M, Anderson JC, et al. Carbonic anhydrases, EPF2 and a novel protease mediate CO2 control of stomatal development[J]. Nature, 2014, 513(7517): 246-250. DOI:10.1038/nature13452 |
| [23] |
Hu H, Boisson-Dernier A, Israelsson-Nordström M, et al. Erratum:carbonic anhydrases are upstream regulators of CO2-controlled stomatal movements in guard cells[J]. Nature Cell Biology, 2011, 12(1): 87-93. |
| [24] |
Wang J, Kucukoglu M, Zhang L, et al. The Arabidopsis LRR-RLK, PXC1, is a regulator of secondary wall formation correlated with the TDIF-PXY/TDR-WOX4 signaling pathway[J]. BMC Plant Biol, 2013, 13: 94. DOI:10.1186/1471-2229-13-94 |





