目前抗生素污染导致严重的环境问题[1],包括生态风险和人类潜在的健康风险[2]。四环素(Tetracycline,TC)作为一大类被广泛使用的抗生素,占总抗生素使用量的29%[3],并且在临床上超过70%的四环素以活性形式被释放到环境中[1]。美国在139条河流中有一半都检测到了TC的存在[4],并且不同地点样品中TC含量也有较大差别[5]。洪波等[6]用高效液相(HPLC-UV)技术测定水样品中的四环素类、喹诺酮类等6种抗生素,检测限(Limit of detection,LOD)为2.00-8.00 μg/kg。在不同环境样品中的土霉素和四环素含量也有报道,其LOD分别为0.08和9 μg/kg[7],同时在食品样品中TC检出量为5-25 μg/kg[8],两者远远低于微生物学抑菌实验中TC的LOD(25 μg/kg)[9],但在江苏省的牛粪中TC检出量达到了0.52 mg/kg[10]。孙刚等[11]研究结果表明,鸡粪中土霉素含量高达11.25 mg/kg,超过了TC的平均含量(0.58 mg/kg)。根据欧盟的法规,抗生素的环境浓度应在10 μg/kg以下,目前对于四环素和四环素衍生物的评估浓度在450-900 μg/kg范围内,比欧盟规定浓度高了约45-90倍[12]。抗生素的超规定浓度的暴露造成了环境中微生物的耐药性,而抗生素耐药菌是否对其他环境暴露毒性因子(如纳米材料)有抗性还知之甚少。
纳米材料[13-14]作为新型污染物,其造成的污染已逐步成为严峻的环境问题[15],在土壤和水中均被检出[16]。污水处理厂中产生的污泥、纳米农药的应用、纳米诱导的土壤修复和扩散排放等都造成了土壤环境中纳米材料的残留[16];同时在市政污水中也检测到了纳米材料的存在[10]。纳米材料的暴露会对微生物造成毒性,其中TiO2-NPs的抑菌原理研究较为清楚,TiO2-NPs经光照接触微生物,光照后在其表面产生活性氧物质(ROS)(如羟自由基,超氧根离子和过氧化氢),最终导致微生物的超氧化[17-18]。同时TiO2-NPs存在尺寸效应,它的毒性随粒径变化而变化,较小的颗粒会更容易聚集,从而导致与细胞接触的表面积增加,更有利于其在细胞上的附着并抑制细胞内和细胞外物质运输[19],甚至可能导致细胞代谢的中断或死亡[20],这些研究表明TiO2-NPs对微生物存在很强的毒性。另一方面,环境中大肠杆菌比枯草芽孢杆菌对TiO2-NPs更敏感[21],表明大肠杆菌更容易受到TiO2-NPs的伤害。目前对于耐药大肠杆菌的抗性机制研究,多数是从抗生素的种类和浓度着手,忽略了其他环境因子的影响。本研究以敏感菌和耐药菌为实验对象,探究了纳米TiO2和四环素对大肠杆菌生长的影响。
1 材料与方法 1.1 材料菌种为从鸡粪中分离出的大肠杆菌(M13),由本实验室保存。质控大肠杆菌ATCC25922购自广东环凯微生物科技有限公司。纳米二氧化钛,购自上海麦克林生化科技有限公司(Macklin Biochemical Co.Ltd),Bioscreen C(全自动生长曲线分析仪)来自芬兰Bio-screen公司,FE-SEM(场发射扫描电镜)型号为SIGMA500。
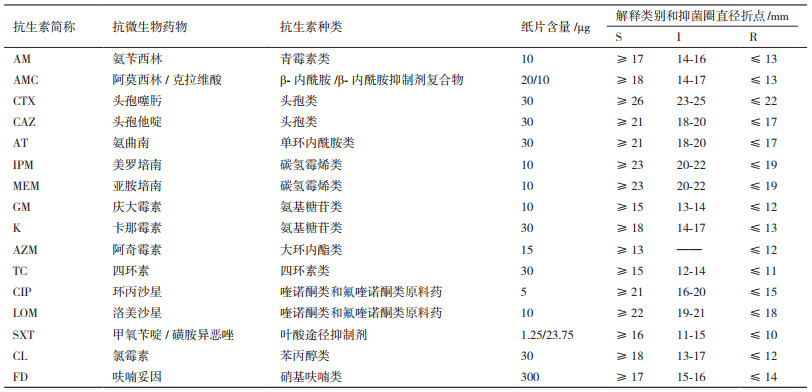
1.2 方法 1.2.1 耐药性测试根据美国临床实验室标准化协会(Clinical and laboratory standards institute,CLSI)手册,选用了16种抗生素研究耐药大肠杆菌的耐药性,如表 1所示。药敏试验采用纸片扩散法(药敏纸片购自杭州微生物试剂有限公司),将Escherichia coli ATCC25922作为对照菌株,大肠杆菌M13作为实验菌株。实验过程依据CLSI操作,菌液利用比浊管校正OD600=0.6,利用游标卡尺测量抑菌圈的直径。抑菌圈直径每个测3次,取平均值。
TiO2-NPs配制的终浓度分别为125、250、500、1 000、2 000、4 000 mg/L,命名为Ti1、Ti2、Ti3、Ti4、Ti5、Ti6;TC配制的浓度为0.125、0.25、0.5、1、2、4 mg/L,命名为TC1、TC2、TC3、TC4、TC5、TC6。生长曲线的测定方法参照之前的研究[22],将质控菌ATCC25922和M13分别接种到LB培养液中,接菌量为5%,总体系为250 μL,每个样品3个平行。本实验采用的是Bioscreen C,内装2块微孔板共200个孔,每孔的容积为400 μL,在600 nm下进行测样。其参数设定:37℃,150 r/min,40 h,每20 min测定一次OD值。
选取Bioscreen C测出的数据,通过下式计算TiO2-NPs和TC对两菌株的抑菌率[23]:

式中:Xs为抑菌率,A表示空白菌液吸光度值,B表示样品菌液吸光度值。
1.2.3 FE-SEM实验方法按照场发射电镜制备方法对样品进行预处理,处理方法参照Jeon等[24]的研究,将质控菌ATCCC25922和M13接种至LB液体培养基中,37℃,180 r/min条件下培养至对数期。取菌液在3 000 r/min离心3 min收集菌体,PBS清洗2-3次,加入4%的戊二醛静置过夜,离心去上清,PBS清洗2-3次后进行乙醇梯度脱水,最后用适量的100%叔丁醇悬浮菌体,样品预处理之后,在FE-SEM上样进行观察。
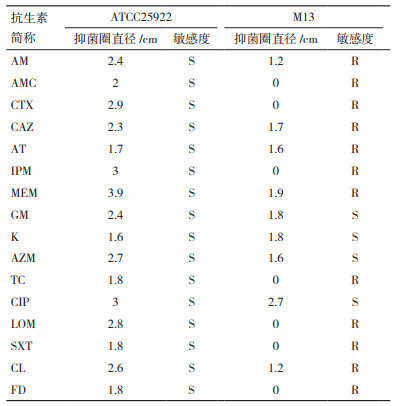
2 结果 2.1 M13耐药性分析本实验对大肠杆菌M13、质控菌ATCC25922进行药敏测试,并用游标卡尺测量抑菌圈直径,根据美国临床实验室标准研究所出版的《药敏实验指南》的标准判定菌株对不同药物的敏感性。如表 2和图 1所示,大肠杆菌M13对12种抗生素表现出抗性R,其中四环素(TC)、阿莫西林/克拉维酸(AMC)、头孢噻肟(CTX)、美罗培南(IPM)、呋喃妥因(FD)、甲氧苄啶/磺胺异恶唑(SXT)、洛美沙星(LOM)7种抗生素未发现抑菌圈,表明M13对这7种抗性很强,对庆大霉素(GM)、卡那霉素(K)、环丙沙星(CIP)、阿奇霉素(AZM)表现出敏感S。质控菌ATCC25922全为S,证明ATCC25922对所有抗生素敏感,进一步说明实验的准确性。

|
| CL:氯霉素;AZM:阿奇霉素;FD:呋喃妥因;MEM:亚胺培南;CTX:头孢噻肟;CAZ:头孢他啶;AMC:阿莫西林/克拉维酸;IPM:美罗培南;AM:氨苄西林;GM:庆大霉素;LOM:洛美沙星;CIP:环丙沙星;K:卡那霉素;AT:氨曲南;SXT:甲氧苄啶/磺胺异恶唑;TC:四环素。每个抑菌直径均测3次平行,取其平均值 图 1 大肠杆菌M13和ATCC25922药敏试验图片 |
图 2中A和E表示四环素对敏感菌ATCC25922和耐药菌M13的生长的影响,对敏感菌ATCC25922的抑制作用相对较强;B和F表示TiO2-NPs对ATC-C25922和M13的生长的影响,敏感菌ATCC25922在A3-A6浓度生长完全被抑制,而耐药菌M13在M1-M3浓度下生长几乎不受抑制,在M4-M6浓度下生长抑制作用在逐步增强;C和G表示不同浓度的TC中加入500 mg/L的TiO2-NPs,结果表明敏感菌ATCC25922生长几乎完全被抑制,而耐药菌M13的生长在25 h后出现抑制现象;D和H表示不同浓度的TiO2-NPs中加入0.5 mg/L的TC,结果与BF(TiO2-NPs单独暴露)的生长曲线趋势相近,说明在TiO2-NPs存在的前提下TC的加入对ATCC25922和M13作用并不明显。图CG与AE相比则可以看出,在TC存在的前提下TiO2-NPs的加入对敏感菌抑制作用增强,而对耐药菌生长抑制变化不大。这些结果表明TiO2-NPs要比TC具有更强的细胞毒性,而且TiO2-NPs的加入增强了四环素对敏感菌ATCC25922的生长抑制作用。
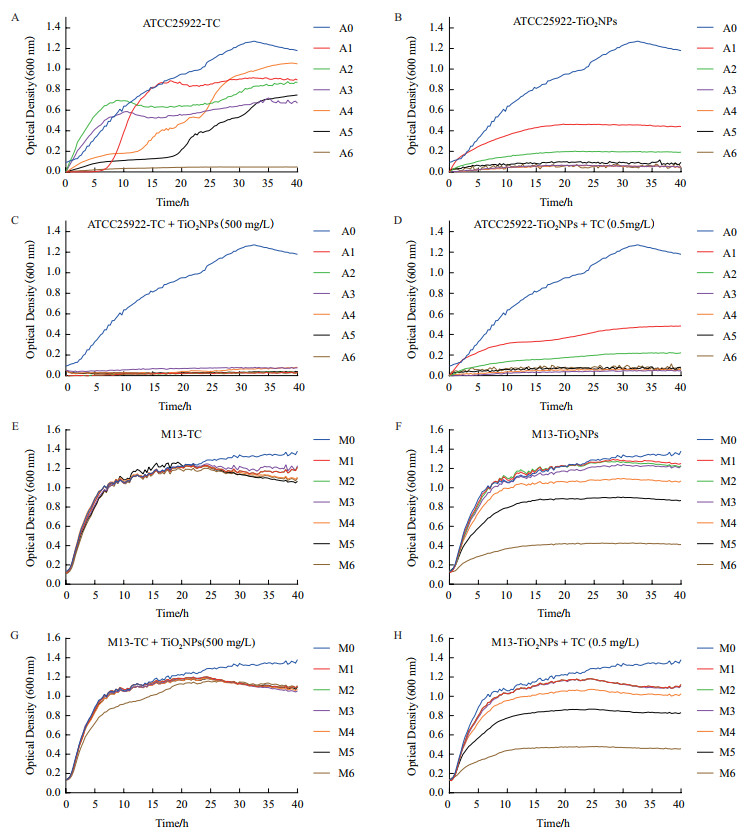
|
| A-D:敏感菌ATCC25922;E-H:耐药菌M13(0-6:表示添加0、0.125、0.25、0.5、1、2、4 mg/L的TC或0、125、250、500、1 000、2 000、4 000mg/L的TiO2-NPs) 图 2 TiO2-NPs和TC对大肠杆菌生长的影响 |
图 3是TiO2-NPs和TC在单独及共暴露条件下对敏感菌ATCC25922和耐药菌M13抑菌率的影响。从图 3-A中可以看出TiO2-NPs单独和联合暴露下对其抑菌率在80%-100%之间,其中在不同浓度的TC中加入500 mg/L的TiO2-NPs时,与单独添加TC相比,其抑菌性出现了明显的升高,而在不同浓度的TiO2中添加0.5 mg/L的TC时,其抑菌率达到了90%以上。从图 3-B可看出总体抑菌率在40%以下,单独添加TiO2-NPs要比TC具有更强的抑菌性,不同浓度梯度的TC加入500 mg/L的TiO2-NPs与TC单独暴露下箱线图相似,其抑菌率都在40%以下且略高于TC。从整体上可以看出,TiO2-NPs和TC对耐药菌M13的抑菌率要低于敏感菌,表明耐药菌M13不仅对抗生素具有抗性,同时对纳米TiO2也具有一定的抗性。
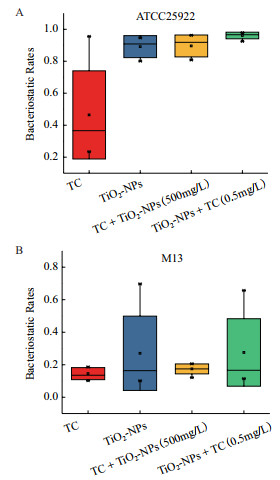
|
| 图 3 TC和TiO2-NPs对大肠杆菌的抑菌率 |
在模拟太阳光催化试验研究光催化剂负载效应时发现,0.5 g/L的TiO2-NPs对大肠杆菌抑菌效率较高[25]。该结果与用太阳能反应器研究TiO2-NPs抑制悬浮的大肠杆菌结果一致[26]。故本实验选取了500 mg/L的TiO2-NPs作为观察对象,如图 4,结果发现敏感菌ATCC25922菌体损伤严重,不仅有穿孔,菌体的表面也出现了严重的破损。耐药菌只出现了穿孔现象,再一次证明了TiO2-NPs对敏感菌的的伤害更强,而对于耐药菌损伤程度则小很多,穿孔现象的产生可能是TiO2-NPs颗粒产生的活性自由基对细胞壁和细胞膜的破坏,造成的菌体损伤。从表观上可以看出耐药菌M13对TiO2-NPs存在一定程度的耐受性。

|
| a和c是加入TiO2-NPs前后的敏感菌ATCC25922的形态;b和d是加入TiO2-NPs前后的耐药菌M13的形态 图 4 TiO2-NPs对大肠杆菌菌体形态的影响 |
微生物产生耐药的本质是细菌在抗菌药物压力下,受多种调控因子调控,多重耐药机制并存的适应性机制[27]。抗生素耐药性的出现和扩散是不可避免的[28]。其耐药机制主要有3种:外排泵、抗生素失活以及核糖体保护机制[29]。外排泵机制是细菌中耐药性存在最多的一种耐药机制,它是通过阻止抗生素在作用于自身靶细胞前排出抗生素,最终使细胞避免抗生素的伤害。在存在翻译抑制性TC的情况下,细菌获得抗性取决于AcrAB-TolC多药外排泵,其能将少量的TC排出细胞外,让细菌得以维持最低限度的蛋白合成功能,并且可以启动TetA表达,进而菌株表现出TC抗性[30]。本实验通过药敏测试发现了耐药菌对TC具有抗性,从生长曲线和抑菌率中发现,在所有选择浓度的TC单独暴露下,耐药菌的生长几乎不受抑制,外排泵可能是耐药菌中四环素抗性的的主要调控因子。
有研究发现纳米TiO2在较低浓度下就达到了抑菌效果[31],与本实验TiO2-NPs在低浓度下暴露的结果一致。TiO2-NPs在低于500 mg/L单独暴露时,对敏感菌的抑菌率为54%-80%,高于500 mg/L暴露时,对敏感菌的抑菌率为92%-100%;而耐药菌在其浓度低于500 mg/L时,对敏感菌的抑菌率在10%左右,高于500 mg/L时,对耐药菌的抑菌率为20%-40%,实验结果与张明等[32]的研究一致,说明TiO2-NPs对于耐药菌和敏感菌都有生长抑制作用,对敏感菌作用更强。在TiO2-NPs高浓度暴露下,耐药菌的抑菌率依然没有达到60%以上,说明耐药菌对TiO2-NPs也存在一定的抗性机制。从而可推测细菌的一些对抗生素的抗性机制,对TiO2-NPs也适用。
TC是具有多个可电离官能团的两性分子,如三羰基甲烷、酚二酮和二甲氨基,这有助于增加它们与金属氧化物的结合[33]。研究发现TC和TiO2-NPs不仅抑制微生物生长[34-35],而且在共暴露时还发现了毒性增强效应[36]。同时在研究TC对TiO2-NPs在溶液里的行为时发现,TC吸附后导致TiO2-NPs的表面电荷增加,当TC浓度逐渐升高时,TiO2-NPs会发生聚集现象并逐渐增强[37]。由于TiO2-NPs存在尺寸效应,它的毒性随粒径变化而变化,较小的颗粒聚集之后会增加与细胞接触的表面积,更有利于其在细胞上的附着并抑制细胞内和细胞外物质运输[19],从而导致细胞代谢的中断或死亡[20],这些研究均说明TC和TiO2-NPs之间存在协同作用,会增强对微生物的毒性作用,与本研究结果一致。在本研究中两者在共暴露情况下有增强其毒性的效应,如对菌株生长抑制作用增强。
微生物之间的基因水平转移是微生物获得耐药基因的一种重要途径,包括游离DNA和可移动元件的获取。例如,质粒、转座子、整合子、基因盒和噬菌体等[38]。换而言之,即使是非致病微生物的耐药基因也可以作为致病微生物的生态基因库[39]。最新研究发现,细菌之间在细胞膜被破坏后,通过质粒进行耐药性的传播,耐药菌通过质粒将自身含有的抗性传给敏感菌使其获得耐药性[30]。本研究对敏感菌ATCC25922和耐药菌M13的形貌观察中均发现,在低剂量500 mg/L的TiO2-NPs浓度下,部分细胞出现穿孔现象亦或是破损;也有部分细胞生长良好,表明TiO2-NPs对细胞壁和细胞膜具有一定的损伤作用,造成携带有耐药的遗传物质泄露,在一定程度上会促进耐药性的传播[40-41]。
4 结论本研究对鸡粪中分离出的大肠杆菌M13和质控菌株(E.coli ATCC25922)进行药敏测试发现,M13具有12重抗性且包含TC抗性。与单独添加梯度浓度四环素相比,纳米TiO2的加入进一步抑制了敏感菌的生长,而耐药菌变化不大。TiO2-NPs单独和联合暴露下对M13的抑菌率均在40%以下,而敏感菌在80%-100%之间,耐药菌M13除了耐抗生素,对纳米TiO2也存在抗性,说明微生物对抗生素和其它环境毒性因子的抗性机制存在着一些共性。
| [1] |
Pan M, Chu L. Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops[J]. Ecotoxicology and Environmental Safety, 2016, 126: 228-237. DOI:10.1016/j.ecoenv.2015.12.027 |
| [2] |
Daghrir R, Drogui P, Dimboukou-Mpira A, et al. Photoelectrocata-lytic degradation of carbamazepine using Ti/TiO2 nanostructured electrodes deposited by means of a pulsed laser deposition process[J]. Chemosphere, 2013, 93(11): 2756-2766. DOI:10.1016/j.chemosphere.2013.09.031 |
| [3] |
Wammer KH, Slattery MT, Stemig AM, et al. Tetracycline photolysis in natural waters: loss of antibacterial activity[J]. Chemosphere, 2011, 85(9): 1505-1510. DOI:10.1016/j.chemosphere.2011.08.051 |
| [4] |
Kim KR, Owens G, Kwon SI, et al. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment[J]. Water, Air, & Soil Pollution, 2011, 214(1-4): 163-174. DOI:10.1007/s11270-010-0412-2 |
| [5] |
田甜甜, 王瑞飞, 杨清香. 抗生素耐药基因在畜禽粪便-土壤系统中的分布, 扩散及检测方法[J]. 微生物学通报, 2016, 43(8): 1844-1853. |
| [6] |
洪波, 曾春芳, 高峰, 等. 高效液相色谱-紫外法测定水产品中四环素类, 喹诺酮类抗生素残留[J]. 湖南农业科学, 2013(21): 24. |
| [7] |
Cháfer-Pericás C, Maquieira A, Puchades R, et al. Multiresidue determination of antibiotics in feed and fish samples for food safety evaluation. Comparison of immunoassay vs LC-MS-MS[J]. Food Control, 2011, 22(6): 993-999. DOI:10.1016/j.foodcont.2010.12.008 |
| [8] |
Cháfer-Pericás C, Maquieira A, Puchades R. Fast screening methods to detect antibiotic residues in food samples[J]. TrAC Trends in Analytical Chemistry, 2010, 29(9): 1038-1049. DOI:10.1016/j.trac.2010.06.004 |
| [9] |
Virolainen NE, Pikkemaat MG, Elferink JA, et al. Rapid detection of tetracyclines and their 4-epimer derivatives from poultry meat with bioluminescent biosensor bacteria[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11065-11070. DOI:10.1021/jf801797z |
| [10] |
Westerhoff P, Song G, Hristovski K, et al. Occurrence and removal of titanium at full scale wastewater treatment plants: implications for TiO2 nanomaterials[J]. Journal of Environmental Monitoring, 2011, 13(5): 1195-1203. DOI:10.1039/c1em10017c |
| [11] |
孙刚, 袁守军, 彭书传, 等. 固相萃取-高效液相色谱法测定畜禽粪便中的土霉素, 金霉素和四环素[J]. 环境化学, 2010, 29(4): 739-743. |
| [12] |
Sayılkan F, Asiltürk M, Kiraz N, et al. Photocatalytic antibacterial performance of Sn4+-doped TiO2 thin films on glass substrate[J]. Journal of Hazardous Materials, 2009, 162(2-3): 1309-1316. DOI:10.1016/j.jhazmat.2008.06.043 |
| [13] |
Zhu Z, Cai H, Sun DW. Titanium dioxide(TiO2)photocatalysis technology for nonthermal inactivation of microorganisms in foods[J]. Trends in Food Science & Technology, 2018, 75: 23-35. |
| [14] |
Athanasekou CP, Likodimos V, Falaras P. Recent developments of TiO2 photocatalysis involving advanced oxidation and reduction reactions in water[J]. Journal of Environmental Chemical Engineering, 2018, 6(6): 7386-7394. DOI:10.1016/j.jece.2018.07.026 |
| [15] |
Huang Z, Maness PC, Blake DM, et al. Bactericidal mode of titanium dioxide photocatalysis[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2000, 130(2-3): 163-170. DOI:10.1016/S1010-6030(99)00205-1 |
| [16] |
Sani-Kast N, Scheringer M, Slomberg D, et al. Addressing the complexity of water chemistry in environmental fate modeling for engineered nanoparticles[J]. Science of the Total Environment, 2015, 535: 150-159. DOI:10.1016/j.scitotenv.2014.12.025 |
| [17] |
Sunada K, Watanabe T, Hashimoto K. Studies on photokilling of bacteria on TiO2 thin film[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2003, 156(1-3): 227-233. DOI:10.1016/S1010-6030(02)00434-3 |
| [18] |
Suresh AK, Pelletier DA, Doktycz MJ. Relating nanomaterial properties and microbial toxicity[J]. Nanoscale, 2013, 5(2): 463-474. DOI:10.1039/C2NR32447D |
| [19] |
Wang Z, Lee YH, Wu B, et al. Anti-microbial activities of aerosolized transition metal oxide nanoparticles[J]. Chemosphere, 2010, 80(5): 525-529. DOI:10.1016/j.chemosphere.2010.04.047 |
| [20] |
Wang N, Guo X, Xu J, et al. Pollution characteristics and environmental risk assessment of typical veterinary antibiotics in livestock farms in Southeastern China[J]. Journal of Environmental Science and Health, Part B, 2014, 49(7): 468-479. DOI:10.1080/03601234.2014.896660 |
| [21] |
Erdem A, Metzler D, Cha DK, et al. The short-term toxic effects of TiO2 nanoparticles toward bacteria through viability, cellular respiration, and lipid peroxidation[J]. Environmental Science and Pollution Research, 2015, 22(22): 17917-17924. DOI:10.1007/s11356-015-5018-1 |
| [22] |
Rossi-Rodrigues BC, Brochetto-Braga MR, Tauk-Tornisielo SM, et al. Comparative growth of trichoderma strains in different nutritional sources, using bioscreen c automated system[J]. Brazilian Journal of Microbiology, 2009, 40(2): 404-410. DOI:10.1590/S1517-83822009000200035 |
| [23] |
Ren N, Li R, Chen L, et al. In situ construction of a titanate-silver nanoparticle-titanate sandwich nanostructure on a metallic titanium surface for bacteriostatic and biocompatible implants[J]. Journal of Materials Chemistry, 2012, 22(36): 19151-19160. DOI:10.1039/c2jm32434b |
| [24] |
Jeon CO, Lee DS, Park JM. Microbial communities in activated sludge performing enhanced biological phosphorus Removal in a sequencing batch reactor[J]. Water Research, 2003, 37(9): 2195-2205. DOI:10.1016/S0043-1354(02)00587-0 |
| [25] |
Rizzo L, Della Sala A, Fiorentino A, et al. Disinfection of urban wastewater by solar driven and UV lamp-TiO2 photocatalysis: Effect on a multi drug resistant Escherichia coli strain[J]. Water Research, 2014, 53: 145-152. DOI:10.1016/j.watres.2014.01.020 |
| [26] |
Fernández P, Blanco J, Sichel C, et al. Water disinfection by solar photocatalysis using compound parabolic collectors[J]. Catalysis Today, 2005, 101(3-4): 345-352. DOI:10.1016/j.cattod.2005.03.062 |
| [27] |
Rosi-Marshall EJ, Kelly JJ. Antibiotic stewardship should consider environmental fate of antibiotics[M]. ACS Publications, 2015.
|
| [28] |
Dodd MC. Potential impacts of disinfection processes on elimination and deactivation of antibiotic resistance genes during water and wastewater treatment[J]. Journal of Environmental Monitoring, 2012, 14(7): 1754-1771. DOI:10.1039/c2em00006g |
| [29] |
Zhu YG, Johnson TA, Su JQ, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences, 2013, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
| [30] |
Nolivos S, Cayron J, Dedieu A, et al. Role of AcrAB-TolC multidrug efflux pump in drug-resistance acquisition by plasmid transfer[J]. Science, 2019, 364(6442): 778-782. DOI:10.1126/science.aav6390 |
| [31] |
Blair JM, Webber MA, Baylay AJ, et al. Molecular mechanisms of antibiotic resistance[J]. Nature Reviews Microbiology, 2015, 13(1): 42. DOI:10.1038/nrmicro3380 |
| [32] |
张嘉明, 张洪光, 吴瑞, 等. 二氧化钛纳米棒的制备及抗菌性能研究[J]. 中国无机分析化学, 2018, 8(6): 68-70. DOI:10.3969/j.issn.2095-1035.2018.06.016 |
| [33] |
Chen WR, Huang CH. Transformation of tetracyclines mediated by Mn(Ⅱ)and Cu(Ⅱ)ions in the presence of oxygen[J]. Environmental Science & Technology, 2008, 43(2): 401-407. DOI:10.1021/es802295r |
| [34] |
Reyes C, Fernandez J, Freer J, et al. Degradation and inactivation of tetracycline by TiO2 photocatalysis[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2006, 184(1-2): 141-146. DOI:10.1016/j.jphotochem.2006.04.007 |
| [35] |
Iswarya V, Bhuvaneshwari M, Alex S A, et al. Combined toxicity of two crystalline phases(anatase and rutile)of Titania nanoparticles towards freshwater microalgae: Chlorella sp.[J]. Aquatic Toxicology, 2015, 161: 154-169. DOI:10.1016/j.aquatox.2015.02.006 |
| [36] |
Wang Z, Wang S, Peijnenburg W J. Prediction of joint algal toxicity of nano-CeO2/nano-TiO2 and florfenicol: independent action surpasses concentration addition[J]. Chemosphere, 2016, 156: 8-13. DOI:10.1016/j.chemosphere.2016.04.072 |
| [37] |
Qi N, Wang P, Wang C, et al. Effect of a typical antibiotic(tetracycline)on the aggregation of TiO2 nanoparticles in an aquatic environment[J]. Journal of Hazardous Materials, 2018, 341: 187-197. DOI:10.1016/j.jhazmat.2017.07.046 |
| [38] |
Nwosu VC. Antibiotic resistance with particular reference to soil microorganisms[J]. Research in Microbiology, 2001, 152(5): 421-430. DOI:10.1016/S0923-2508(01)01215-3 |
| [39] |
Salyers A, Shoemaker NB. Reservoirs of antibiotic resistance genes[J]. Animal Biotechnology, 2006, 17(2): 137-146. DOI:10.1080/10495390600957076 |
| [40] |
Chen Z, Zhang Y, Gao Y, et al. Influence of dissolved organic matter on tetracycline bioavailability to an antibiotic-resistant bacter-ium[J]. Environmental Science & Technology, 2015, 49(18): 10903-10910. DOI:10.1021/acs.est.5b02158 |
| [41] |
Wang Z, Sun Y, Wang D, et al. In situ fabrication of silver nanoparticle-filled hydrogen titanate nanotube layer on metallic titanium surface for bacteriostatic and biocompatible implantation[J]. International Journal of Nanomedicine, 2013, 8: 2903. |