2. 西南民族大学青藏高原研究院,成都 610041
2. Qinghai-Tibet Research Institute, Southwest University of Nationalities, Chengdu 610041
类志贺邻单胞菌(Plesiomonas shigellode)属于弧菌科邻单胞菌属,在鱼类、哺乳动物及人类肠道中均有发现,主要引起人感染性腹泻及食物中毒[1-3]。类志贺邻单胞菌革兰氏染色为阴性,是人类重要的肠炎性病原,可引起急性肠胃炎、腹泻等症状,同时也可以引起败血症、脑膜炎、腹膜炎、蜂窝组织炎和肺炎等肠外感染症状[4-6]。类志贺邻单胞菌在水环境中广泛分布,被认为是多种水产动物消化道炎症的新病原,是一种世界性分布的细菌[7-13]。除了可以感染人类外,类志贺邻单胞菌对水生动物也具有一定的致病性,如中华鳖、草鱼和黄颡鱼等都有被其感染而引起死亡的报道。其中,黄颡鱼(Pelteobagrus fulvidraco)是一种在我国各大水系干支流及附属水体的江河、湖泊、池塘中广泛分布的小型无鳞鱼类,营养价值高,是目前大力发展的名优淡水养殖品种之一。近年来,抗生素在水产养殖中的应用越来越广泛,虽然在疾病防控中发挥着重要作用,但是由于抗生素的滥用,导致细菌耐药情况及药物残留越来越严重,给人身体健康造成了一定的危害。目前,国内没有对从黄颡鱼体内分离的类志贺邻单胞菌进行耐药表型及耐药基因检测的报道。本试验对黄颡鱼分离菌株L-1进行了鉴定、耐药表型与耐药基因检测,以期为该菌所致疾病的防治及耐药机理的深入研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试验动物于四川省某水产市场发现一条黄颡鱼,出现头腹部及鳍部溃烂、出血、肝脏肿大以及出血等现象,体长15 cm,体重45 g。
1.1.2 主要试剂及仪器Mueller-Hinton琼脂、LB肉汤,青岛高科园海博生物技术有限公司生产;药敏纸片,杭州微生物试剂有限公司生产;1.1×T3 Super PCR MIX、4S Red Plus Nucleic Acid Stain、细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司生产;DL2000 Marker,宝生物工程(大连)有限公司生产;电泳仪、凝胶成像系统,Bio-RAD USA公司生产;PCR仪,Eppendorf Germany公司生产。
1.2 方法 1.2.1 细菌分离及形态观察用0.75%的无菌生理盐水冲洗濒临死亡的黄颡鱼,对其进行剖检,无菌采取黄颡鱼的肝脏,于琼脂平板上划线,35℃恒温培养20 h,挑取菌株L-1于平板划线纯化3次,挑取颜色、形状相近的单菌落经过3次液体LB肉汤培养基传代后用50%的甘油保种备用。进行革兰氏染色鉴定:用草酸铵结晶紫初染、碘液媒染、95%乙醇脱色、番红染色液复染,干燥后于光学显微镜下观察并记录。
1.2.2 生理生化鉴定依据《伯杰氏系统细菌学手册》[14]中细菌鉴定的方法,采用细菌微量生化鉴定管对待测菌株L-1进行各项生化指标的测定。
1.2.3 引物的设计与合成参照文献设计类志贺邻单胞菌23S rRNA基因特异性引物[15];(aph(3')-Ⅱa、ant(3")-Ⅰa、aac(6')-Ⅰb和aac(3)-Ⅱa)4种氨基糖苷类抗生素耐药基因引物[16]、(Sul1、Sul2和Sul3)3种磺胺类抗生素耐药基因引物[17]、(TEM)1种β-内酰胺类抗生素耐药基因引物[18]及16S rDNA基因的引物。引物由生工生物工程(上海)股份有限公司合成。
1.2.4 细菌基因组DNA提取按照细菌基因组DNA试剂盒说明书提取菌株L-I及参考菌株粪肠球菌、嗜水气单胞菌、沼泽红假单胞菌、柠檬酸杆菌、乳酸片球菌总DNA,其浓度及质量于紫外分光光度计检测合格后(D260 nm/D280 nm=1.8-2.0),-20℃保存备用。
1.2.5 PCR扩增及系统进化树构建采用16S rDNA基因引物进行PCR扩增,PCR扩增条件为98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s,共35个循环;72℃再延伸2 min。以6种细菌总DNA为模板,以23S rRNA基因的特异性引物进行PCR扩增。PCR扩增条件为98℃预变性2 min;98℃变性10 s,61℃退火15 s,72℃延伸30 s,共35个循环;72℃再延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测,于凝胶成像系统下观察。16S rDNA基因的PCR产物由生工生物工程(上海)股份有限公司测序。将菌株L-I的16S rDNA测序结果与已知GenBank数据库中核苷酸序列进行BLAST比对,通过Neighbor-Joining方法,构建菌株L-I系统进化树。采用Mega 6.0软件对以上序列进行同源性分析。23S rRNA基因PCR产物经1%琼脂糖凝胶电泳,观察扩增条带与目的片段是否一致。
1.2.6 人工感染试验于四川省成都市某水产市场购买健康黄颡鱼50尾,体重在50±10 g范围内,在实验室消毒后清洗干净的鱼缸内适应性饲养7 d,随后随机分为对照组和试验组进行试验。将接种于LB肉汤培养基的菌种L-1放于35℃、110 r/min摇床培养20 h,随后12 000 r/min离心5 min收集菌体,用无菌生理盐水洗涤两次,并制备成浓度为5×107 CFU/mL的菌悬液。用无菌注射器抽取150 μL的菌悬液,对黄颡鱼进行腹腔注射,对照组注射等量的无菌生理盐水,连续观察7 d,及时对死鱼体内的病原菌进行分离鉴定。
1.2.7 药敏试验采用K-B纸片扩散法进行药敏试验,根据美国临床实验室标准委员会(CLSI/NCCLS)执行标准判定结果。将保种的菌株L-1接种于灭菌生理盐水中,并与麦氏比浊管比较,将菌液浓度调整到0.5麦氏单位。取少量菌液均匀涂布鱼MH琼脂平板上,将药敏片紧贴在平板表面,于35℃培养20 h后测定抑菌圈直径。药敏试验采用的抗生素药物有庆大霉素、哌拉西林、卡那霉素、米诺环素、四环素、头孢哌酮、头孢曲松、苯唑西林、氨苄西林、头孢他啶、羧苄西林、头孢呋辛、头孢唑林和克林霉素。
1.2.8 耐药基因检测以菌株L-I总DNA为模板,以不同的耐药基因引物进行PCR扩增。PCR扩增条件为98℃预变性2 min,98℃变性10 s,51-63℃退火15 s,72℃延伸30 s,共35个循环,72℃再延伸2 min。PCR产物经1%琼脂糖凝胶电泳,观察耐药基因扩增条带与目的片段是否一致。
2 结果 2.1 细菌分离及形态观察菌株L-1在LB培养基上培养20 h后,形成半透明较小菌落,表面光滑、湿润。革兰氏染色发现,菌株L-1被染为红色,形态为短杆状,单个或者成对排列,表明菌株L-I为革兰氏阴性菌。
2.2 生理生化鉴定分离菌株L-1的生理生化特征为氧化酶、硝酸钾、半乳糖、色氨酸、精氨酸和葡萄糖反应为阳性,V-P、硫化氢、七叶苷、甘露醇、明胶液化、柠檬酸和阿拉伯糖反应为阴性。结果显示,菌株L-1与类志贺邻单胞菌具有相似的表型特征。
2.3 细菌分子生物学鉴定分离菌株L-1的16S rDNA基因经PCR扩增获得1 461 bp的片段,与预期相符(图 1)。将菌株L-1的16S rDNA基因正反测序序列拼接后提交至NCBI,获得GenBank登录号为MK348531。在NCBI中采用BLAST,对菌株L-I的16S rDNA基因序列进行分析,构建系统进化树。菌株L-I与NCBI中的类志贺邻单胞菌BY160512菌株相似性为99%,与类志贺邻单胞菌T2菌株相似性为98%。在系统发育树中,菌株L-I与类志贺邻单胞菌T2菌株位于同一分支(图 2)。应用类志贺邻单胞菌23S rRNA基因的特异性引物,对菌株L-I和参考菌株进行特异性扩增。PCR扩增结果显示,仅菌株L-I在280 bp左右存在目的条带,参考菌株粪肠球菌、嗜水气单胞菌、沼泽红假单胞菌、柠檬酸杆菌和乳酸片球菌均未扩增出(图 3),表明仅有L-I存在23S rRNA基因。因此,综合形态观察及分子生物学鉴定可判定菌株L-I为类志贺邻单胞菌。

|
| M:DL2000 Marker;1:the strain L-1 图 1 菌株L-1的16S rDNA基因扩增结果 |

|
| 图 2 菌株L-1系统进化树 |
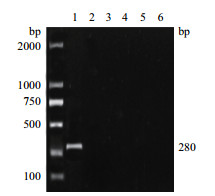
|
| 1:菌株L-1;2:粪肠球菌;3:嗜水气单胞菌;4:沼泽红假单胞菌;5:柠檬酸杆菌;6:乳酸片球菌;M:DL2000 Marker 图 3 六种菌株的23S rRNA基因扩增结果 |
利用浓度为5×107 CFU/mL的菌悬液和生理盐水分别对试验组和对照组各25尾黄颡鱼进行感染,试验组有20尾黄颡鱼出现头腹部及鳍部溃烂、出血、肝脏肿大以及出血等现象,感染率为80%,死亡15尾,死亡率为60%;对照组黄颡鱼未出现死亡及发病。
对患病的黄颡鱼进行细菌分离鉴定,结果表明所分离的致病菌同为类志贺邻单胞菌。
2.5 药敏试验K-B纸片法药敏试验结果显示,菌株L-1对β-内酰胺类药物中的头孢曲松、头孢哌酮、头孢他啶、哌拉西林敏感,对苯唑西林、氨苄西林和羧苄西林耐药;对氨基糖苷类药物中的庆大霉素、卡那霉素敏感;对四环素类药物中的米诺环素敏感,对四环素中度敏感;对林克胺类药物中的克林霉素耐药(表 1)。
耐药基因PCR扩增结果显示,菌株L-1扩增出耐药基因Sul2、TEM、ant(3")-Ⅰa和aac(6')-Ⅰb,大小约为790 bp、720 bp、280 bp和480 bp,与预期相符,耐药基因aph(3')-Ⅱa、aac(3)-Ⅱa、Sul1、Sul3均未检出(图 4)。
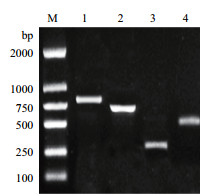
|
| 1:Sul2 drug resistance gene;2:TEM drug resistance gene;3:ant(3")-Ⅰa drug resistance gene;4:aac(6')-Ⅰb drug resistance gene;M:DL2000 Marker 图 4 菌株L-1的Sul2、TEM、ant(3")- Ⅰa、aac(6')-Ⅰb耐药基因扩增结果 |
类志贺邻单胞菌是一种革兰氏阴性、能运动、兼性厌氧的细菌,该菌最先是从一位肠胃炎患者的粪便中分离出来。该菌也可感染赤麻鸭、犬,引起肠道疾病,导致死亡[19]。类志贺邻单胞菌在我国许多种水产动物体中存在,给水产养殖业造成经济损失的同时也给消费者带来了一定的健康安全隐患。
目前,鉴定类志贺邻单胞菌主要依据16S rDNA基因PCR扩增。张新艳等[20]利用类志贺邻单胞菌23S rRNA基因特异性引物,对草鱼体内分离的类志贺邻单胞菌和弧菌科水产常见病菌,如副溶血弧菌、创伤弧菌等进行特异性PCR扩增,只有类志贺邻单胞菌在目的片段处有条带,其余参考菌株均未扩增出目的条带。本试验分别对菌株L-1的16S rDNA基因和23S rRNA基因进行扩增,16S rDNA基因PCR扩增序列比对及系统进化树结果与类志贺邻单胞菌一致,只有菌株L-1的23S rRNA基因扩增条带与目的片段一致,参考菌株均未扩增出。综上可判断菌株L-1为类志贺邻单胞菌。
目前,关于类志贺邻单胞菌对抗生素耐药性的报道,如左跃等[21]从黄颡鱼体内分离的两株类志贺邻单胞菌对卡那霉素、氨苄西林等4种抗生素耐药;杨星等[22]从患病大鲵体内分离的类志贺邻单胞菌对氨苄西林、苯唑西林等6种抗生素耐药;张效平等[23]从江鳕体内分离的类志贺邻单胞菌对头孢曲松、哌拉西林和庆大霉素等11种抗生素耐药。本研究中黄颡鱼分离菌株L-1对苯唑西林、氨苄西林、羧苄西林耐药等4种抗生素耐药。这些结果显示:β-内酰胺类抗生素的耐药性较普遍,这可能与β-内酰胺类抗生素的广谱特性及大量使用有关;耐药表型存在一定的差异,这可能与菌株来源不同,养殖场抗生素的使用情况有关。
在人类发现抗生素之前,耐药性及耐药基因在自然界存在数量非常少,但是抗生素的大量使用,加速了耐药性的传播。其中,耐药基因在细胞间的转移是耐药性全球播散的最主要的遗传基础[24]。黄伟德等[25]广西凡纳滨对虾源副溶血弧菌中ant(3")-Ⅰ、Sul1和TEM耐药基因检出率分别为6.70%、43.30%和13.30%。廖成水等[26]鸡源致病性沙门氏菌新近分离株中Aph(3')-Ⅱa、BlaTEM-1、Sul1、Sul2和Sul3检出率分别为50.00%、28.57%、58.70%、41.30%和21.74%。赖海梅等[27]肉鸡沙门氏菌中Sul1、Sul2和Sul3耐药基因检出率分别为43.48%、100.00%和60.87%。本试验中,黄颡鱼分离菌株L-1中检出Sul2、TEM、ant(3")-Ⅰa、aac(6')-Ⅰb耐药基因。这些结果显示:磺胺类耐药基因、β-内酰胺类耐药基因、氨基糖苷类耐药基因检出率较高,磺胺类耐药基因检出率最高,这可能与磺胺类药物的大量使用有关;耐药基因检测结果存在一定差异,这可能是由于不同耐药基因在不同细菌之间的转移情况不同导致的。耐药表型和耐药基因的报道,如张楠驰等[28]在门多萨假单胞菌的药敏试验和耐药基因检测中,β-内酰胺类耐药基因与相应的耐药表型一致,本试验中β-内酰胺类耐药基因TEM与苯唑西林、氨苄西林和羧苄西林3种β-内酰胺类抗生素耐药显示其具有一致性。
4 结论本试验对黄颡鱼分离菌株L-1进行了鉴定、耐药表型及耐药基因检测,确定该菌株为类志贺邻单胞菌,该菌对黄颡鱼具有较强的致病性,对苯唑西林、氨苄西林和克林霉素等耐药,可以选用头孢曲松、头孢哌酮、头孢他啶、哌拉西林、庆大霉素和卡那霉素等药物进行防治。但是由于细菌易产生耐药性,在加强水质管控和合理设置饲养密度,提高个体免疫力的同时,要定期轮换用药,科学用药。
| [1] |
Brenner DJ, Krieg NR, Staley JT. Bergey's manual of systematic bacteriology(Vol. 2)[M]. New York: Springer, 2005: 740-744.
|
| [2] |
涂传树, 钟小兵, 张科, 等. 一起类志贺邻单胞菌食物中毒的调查[J]. 现代预防医学, 2013, 40(21): 3936-3937. |
| [3] |
李富祥, 王传禹, 杨仕标, 等. 1株犬类志贺邻单胞菌的分离鉴定及序列分析[J]. 中国兽医学报, 2012, 12: 1824-1827. |
| [4] |
Ueda Y, Suzuki N, Furukawa T, et al. Bacteriological studies of traveller sdiarrhoea[J]. The Journal of the Japonese Association for Infectious Diseases, 1992, 66(10): 1422-1438. |
| [5] |
Shah N, Du Pont HL, Ramsey DJ. Global etiology of travelers diarrhea:systematic review from 1973 to the present[J]. The American Journal of Tropical Medicine and Hygiene, 2009, 80(40): 609-614. |
| [6] |
Schneider F, Lang N, Reibke R, et al. Plesiomonas shigelloides pneumonia[J]. Medecine et Maladies Infectieuses, 2009, 39(60): 397-400. |
| [7] |
Krovacek K, Eriksson L, Gonzalez-Rey M, et al. Isolation, biochemical and serological characterization of Plesiomonas shigelloides from freshwater fish in Northern Europe[J]. Comparative Immunology, Microbiology & Infectious Diseases, 2000, 23(1): 45-51. |
| [8] |
Sugita H, Akamura T, Deguchi Y. Identification of Plesiomonas shigelloides isolated from freshwater fish with the microplate hybri-dization method[J]. Journal of Food Protection, 1993, 56(11): 949-953. DOI:10.4315/0362-028X-56.11.949 |
| [9] |
Herrera FC, Santos JA, Otero A, et al. Occurrence of Plesiomonas shigelloides in displayed portions of saltwater fish determined by a PCR assay based on the hugA gene[J]. International Journal of Food Microbiology, 2006, 8(2): 233-240. |
| [10] |
Gu W, Levin RE. Quantitative detection of Plesiomonas shigelloides in clam and oyster tissue by PCR[J]. International Journal of Food Microbiology, 2006, 111(1): 81-86. |
| [11] |
尹昌宏, 黎显明, 徐玉凤, 等. 鱼类中类志贺邻单胞菌携带状况调查[J]. 中国人畜共患病杂志, 1991, 7(1): 40-41. |
| [12] |
Clark RB, Janda JM. Plesiomonas and human disease[J]. Clin Microbiol Newsl, 1991, 13: 49-52. DOI:10.1016/0196-4399(91)90034-S |
| [13] |
Demondind SS, Nunes MP, Ricciardi ID. Occurrence of Plesiomonas shigelloides in water environments of Rio de Janeiro city[J]. Men Inst Oswaldo Cruz, 1995, 90: 1-4. DOI:10.1590/S0074-02761995000100002 |
| [14] |
布坎南RE, 吉本斯NE. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1984.
|
| [15] |
Gonzalez-Rey C, Svenson SB, Bravo L, et al. Specific detection of Plesiomonas shigelloides isolated from aquatic environment animals and human diarrhoeal cases by PCR based on 23S rRNA gene[J]. FEMS Immunol Med Microbiol, 2000, 29: 107-113. DOI:10.1111/j.1574-695X.2000.tb01512.x |
| [16] |
张安云.细菌对氨基糖苷类药物耐药基因四重PCR检测试剂盒研制[D].雅安: 四川农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10626-2007208689.htm
|
| [17] |
周万蓉.细菌对磺胺类药物耐药基因三重PCR检测试剂盒研制[D].雅安: 四川农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10626-2007208854.htm
|
| [18] |
赵静, 王利, 邱翔, 等. 小肠结肠炎耶尔森菌对磺胺类和β-内酰胺类抗生素的耐药性研究[J]. 黑龙江畜牧兽医, 2014, 7: 156-158. |
| [19] |
陈维刚, 王强, 牛李丽, 等. 赤麻鸭类志贺邻单胞菌感染的诊治[J]. 四川畜牧兽医, 2006, 12: 47. |
| [20] |
张新艳, 樊海平, 曾占壮. 草鱼致病性类志贺邻单胞菌的分子鉴定及快速检测[J]. 福建农业学报, 2013, 28(7): 634-638. DOI:10.3969/j.issn.1008-0384.2013.07.003 |
| [21] |
左跃, 易弋, 夏杰, 等. 2株黄颡鱼源类志贺邻单胞菌的分离与鉴定[J]. 江苏农业科学, 2013, 41(9): 199-201. DOI:10.3969/j.issn.1002-1302.2013.09.080 |
| [22] |
杨星, 曾令兵, 李瑞伟, 等. 患病大鲵类志贺邻单胞菌的分离鉴定[J]. 水生生态杂志, 2014, 35(1): 91-95. |
| [23] |
张效平, 杨星, 李小义, 等. 江鳕类志贺邻单胞菌的分离鉴定及药敏试验[J]. 水产科学, 2018, 37(4): 533-538. |
| [24] |
李娟, 阚飙. 耐药基因的流动及耐药性的传播[J]. 中国预防医学杂志, 2017, 51(10): 873-877. |
| [25] |
黄伟德, 肖双燕, 黎姗梅, 等. 广西凡纳滨对虾源副溶血弧菌耐药性和耐药基因的检测[J]. 西南农业学报, 2018, 31(9): 1979-1988. |
| [26] |
廖成水, 程相朝, 张春杰, 等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学, 2011, 47(7): 751-755. |
| [27] |
赖海梅, 刘书亮, 邹立扣, 等. 肉鸡屠宰场多重耐药沙门氏菌Ι类整合子与磺胺类耐药基因(Sul1、Sul2和Sul3)的检测[J]. 食品科学, 2014, 35(24): 178-183. DOI:10.7506/spkx1002-6630-201424034 |
| [28] |
张楠驰, 方庆, 王利. 一株门多萨假单胞菌的分离鉴定及药物敏感性分析[J]. 中国畜牧兽医, 2019, 46(6): 1832-1840. |





