黄绿卷毛菇(Floccularia luteovirens)作为青藏高原高寒草原与草甸生态系统中最具有代表性的真菌之一[1],不仅是名贵食药用真菌,而且也是重要的高原生物资源[2]。青藏高原是黄绿卷毛菇最主要的发生地,黄绿卷毛菇主要生长在矮嵩草草甸,高山嵩草、异针茅草原化草甸,嵩草杂草类草甸,垂穗披碱草草甸[3]。对于黄绿卷毛菇菌丝体的培养,早期的研究发现黄绿卷毛菇菌丝对碳源的利用以红糖为最佳,以酵母膏为最佳氮源,适宜的碳氮比为20-50:1[4]。此后的研究结果显示,该菌适宜碳源为蔗糖,氮源为蛋白胨,适宜的碳氮比为10:1,最佳矿质营养元素是硫酸镁[5],最适pH为6.5,在暗处培养生长最佳[6]。然而黄绿卷毛菇菌丝体的人工培养困难,产量低且菌丝体生物量发酵培养方面未见报道,人工种植目前尚未成功[7]。
内生真菌广泛存在植物的组织中,它与植物之间存在着复杂的分子调控机制[8],研究表明内生真菌可以提高植物的分蘖数,增加植物的地上和地下的生物量[9]。矮嵩草、二柱头藨草和高山嵩草是青藏高原高寒草甸中的建群种[10]。目前对青藏高原植物的内生真菌研究比较少,张苗苗等[11]对甘肃省甘南州玛曲草原的线叶嵩草进行内生真菌的分离及其抗菌性质的研究,分离到7株内生真菌且部分具有抗菌活性。Zhang等[12]对祁连的3种灌木土壤的真菌多样性进行研究,采用培养和分子鉴定的方法对菌种进行了鉴定。
本实验以黄绿卷毛菇生境中的矮嵩草为研究对象,采取黄绿卷毛菇0 cm、10 cm、20 cm及对照处的矮嵩草,通过传统培养法与宏基因组测序法,研究黄绿卷毛菇生境中矮嵩草的内生真菌多样性,确定黄绿卷毛菇在植物中的内生真菌的地位。
1 材料与方法 1.1 材料 1.1.1 矮嵩草样品本实验所用矮嵩草2018年8月采自青海省海北州海晏县(海拔3 200 m)高寒嵩草草甸。
1.1.2 培养基PDA培养基:200 g土豆,20 g葡萄糖,20 g琼脂,1 000 mL水。
1.2 方法 1.2.1 矮嵩草植物的处理与消毒传统法使用5株植物,植物叶子、基部、根各选取3份。其中叶子选取1 cm长度,基部除去其包被鞘,根部选取1-1.5 cm长度。对选取的植物组织用自来水冲洗3次,蒸馏水漂洗3次,除去表面灰尘泥土。
宏基因组法选取距黄绿卷毛菇0 cm、10 cm、20 cm及对照处的矮嵩草,分为主根、侧根、基部,样品编号为:F-Z0、F-C0、F-J0、F-Z10、F-C10、F-J10、F-Z20、F-C20、F-J20、F-ZD、F-CD及F-JD。植物组织同传统法作相同处理。
植物组织用5.25%次氯酸钠浸泡5 min,用无菌水漂洗4次以充分除去残留的次氯酸钠,再使用0.1%氯化汞浸泡植物组织5 min,最后用无菌水漂洗3次。
1.2.2 DNA提取内生真菌培养使用PDA培养基,经过分离纯化后采用CTAB法[13]提取DNA,使用ITS1和ITS4扩增真菌的ITS序列[14],送至上海生物工程有限公司测序。宏基因组法采用CTAB[13]法提取植物根总DNA,检测合格的DNA样品由上海生物工程有限公司进行16S rRNA基因的V3-V4可变区扩增并测序,采用Illumina MiseqTM平台进行双末端测序。
1.2.3 数据处理对于测序结果使用的软件有BioEdit、Sequencher、MEGA7,数据库使用NCBI(https://www.ncbi.nlm.nih.gov/)数据库。多样性指数、丰富度指数、均匀度指数计算采用柴新义等方法[15]。
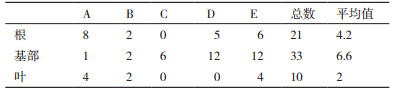
2 结果 2.1 传统分离培养法 2.1.1 内生真菌的分离传统方法经过分离鉴定得到66株内生真菌,在真菌的分布上,基部(6.6)>根(4.2)>叶(2)(表 1)。
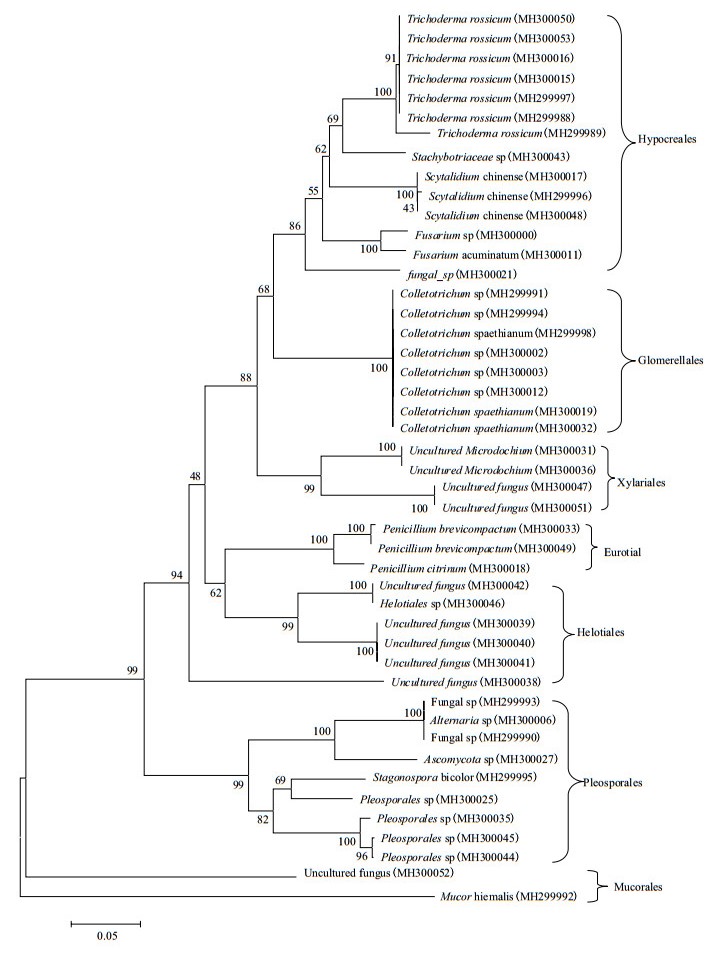
分离鉴定的66株菌均为子囊菌,分布于7目10属,结果如表 2所示,包括木霉属(Trichoderma)、Stachybotriaceae、柱顶孢霉属(Scytalidium)、镰刀菌属(Fusarium sp)、刺盘孢属(Colletotrichum)、微座孢属(Microdochium sp.)、青霉菌属(Penicillium)、毛霉属(Mucor)、链格孢属(Alternaria alternata)、壳多孢属(Stagonospora)。其中,壳多孢属(Stagonospora)21株,占所分离菌株的31.82%,为优势菌属。
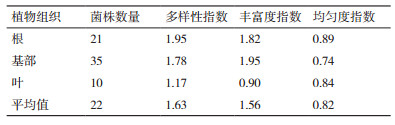
对传统法培养的内生真菌的多样性进行分析见表 3,根的多样性指数(1.95) > 基部的多样性指数(1.78) > 叶片的多样性指数(1.17)。在丰富度指数上,基部的丰富度指数(1.95) > 根的丰富度指数(1.82) > 叶的丰富度指数(0.90)。根的均匀度指数(0.89) > 叶子的均匀度指数(0.84) > 基部的均匀度指数(0.74),表明矮嵩草中不同的组织中,内生真菌的数量种类是存在差异的。
传统分离方法内生真菌相对丰度结果见表 4。主要分离到的是优势菌株:Stagonospora bicolor、Trichoderma rossicum、Colletotrichum sp.、uncultured fungus和Pleosporales sp.。在根组织中Stagonospora bicolor(7.58)和uncultured fungus的相对多度最高(7.58),基部中Stagonospora bicolor相对多度最高(24.24),叶子中Colletotrichum sp.的相对多度最高(7.58)。表明在矮嵩草植物中不同组织中的内生真菌优势菌株是不同的。
采用邻接法(Neighbor-Joining methods,NJ)构建进化树如图 1,从进化树可以看出所有菌株可以分为3个分支,其中毛霉属Mucor和uncultured fungus MH30052分别占据2个分支,剩下的一支可以分类到6个大类。66株菌的NCBI登陆号为MH299988-MH300053。未分离到黄绿卷毛菇。
|
| 标尺 0.05 为进化距离 图 1 基于ITS基因部分序列构建的部分菌株的Neighbour-Joining系统进化树 |
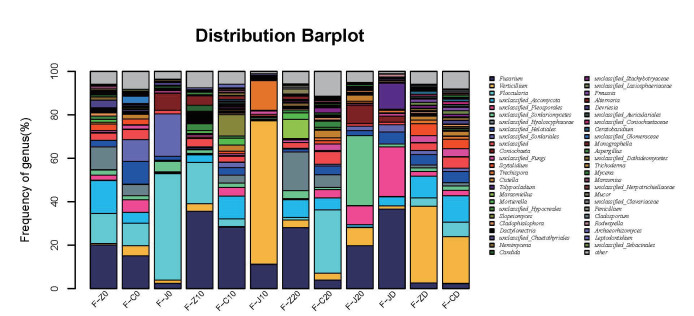
宏基因组法,12份样品的OTU在属的水平上展示如图 2,在各个样品之间,属的分布是不同的,占比最多的是Fusarium。
|
| 横轴为各样品的编号,纵轴为相对丰度比例。颜色对应此分类学水平下各物种名称,不同色块宽度表示不同物种相对丰度比例 图 2 属水平所有样本群落结构分布图 |
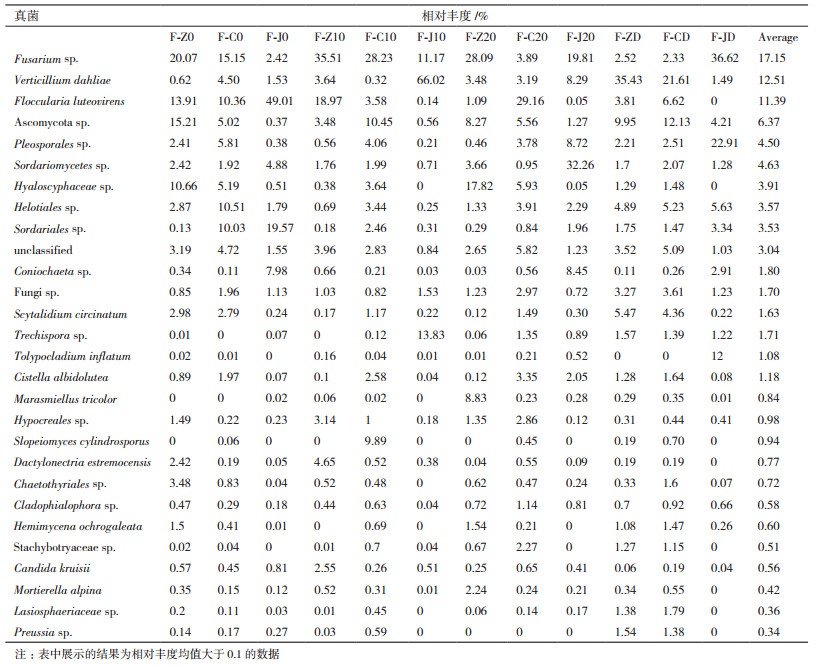
基于宏基因组测序结果,其中12个样品共分离鉴定到种水平的OTU数目为587,Fusarium sp相对丰度是最高的,平均值为17.15;而在传统分离的方法中,uncultured fungus和Stagonospora bicolor是相对多度最高,均为7.58(表 5)。此外,虽然使用的是相同的组织样品,对于多数的内生真菌是比较难培养的,传统法中分离的菌种占宏基因组的1.70%(10/587)。
宏基因组的结果分析显示见表 6,12份根的样品中,不同样品的多样性指数,丰富度指数,均匀度指数是不同的。多样性指数平均值为3.13、丰富度指数平均值为39.08、均匀度指数平均值为0.48。矮嵩草植物的不同组织中,多样性指数、丰富度指数、均匀度指数表现为:侧根 > 主根 > 基部。
传统分离方法所得到的全部菌株均分类到子囊菌中,而宏基因组法分析丰度如图 3所示,其进化组成关系中内生真菌的组成中有子囊菌门(Ascomycota)占77.21%、担子菌门(Basidiomycota)占16.21%,剩下的6.58%为unclassified真菌,传统法未分离到担子菌的内生真菌。表明在传统分离真菌的过程中,子囊菌真菌是属于易培养的真菌,而担子菌真菌不易被培养。

|
| 图中是丰度前100个物种进化分类树,并将丰度前20个物种(以星号标出)所对应的门按不同的颜色标出,圈和星号的大小代表丰度大小。外围环为热力图,每一环为一个样本(组),每个样本对应一种颜色。颜色深浅随物种丰度变化 图 3 GraPhlAn绘制的分类和系统发育信息可视化图 |
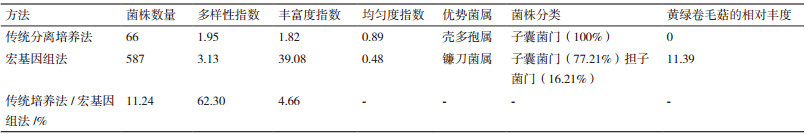
传统法共分离到66株内生真菌,均分类到子囊菌门中,优势菌属为壳多孢属,而宏基因组法共检测到587种内生真菌,内生真菌的组成中有子囊菌门、担子菌门,且传统多样性指数(1.63) < 宏基因组法的均值(3.13),传统法丰富度指数(1.56) < 宏基因组的均值(39.08),传统法均匀度指数(0.82) > 宏基因组的均值(0.48),如表 7所示。
本研究利用传统分离培养法并结合宏基因法,对青藏高原地区矮嵩草植物内生真菌多样性进行了研究。传统方法分离到66株内生真菌,远远多于张苗苗等[11]对甘肃省甘南州玛曲草原的线叶嵩草内生真菌的分离,共分离到7株内生真菌分别为镰刀菌属Fusarium、枝顶孢属Acremonium sp、黑团孢霉属Periconia sp。在本研究中也分离到了镰孢属,但并没有分离到枝顶孢属和黑团孢霉属这两属的内生真菌。但在本研究中还分离出其它属的内生真菌,多样性结果分析结果显示,在矮嵩草植物中,根和基部的多样性指数大于叶子的多样性指数,基部和根的丰富度指数均大于叶片,表明矮嵩草的内生真菌主要分布于基部和根,叶子分布较少,这可能与根际土壤微生物群落对植物体的作用有关[16]。
传统培养与直接PCR法对菌根真菌的研究在其它植物中有相关的报道[17],而宏基因组法对矮嵩草植物内生真菌的研究未见相关报道,12组根样品共检测到587种内生真菌,而且内生真菌的组成存在差异,表明不同个体的内生真菌的组成可能存在差异。世界上大部分真菌在实验室很难培养出来[18],传统分离方法分离的菌株占宏基因组的1.70%(10/587),很大一部分的真菌并未被分离出来,这可能是因为培养技术只能培养很少一部分微生物,大部分微生物难以培养,纯培养技术不能精确反映环境微生物的真实生存状况[19]。研究内生真菌本身,传统方法更为可靠具有后续研究的优势[20],但面对未开发的真菌,特别是担子菌纲的真菌,很大的不足还是缺乏宿主系统[21]。利用宏基因组技术可以探明内生真菌群落的组成[22],且能够更有效、更可靠地评估真菌的丰富度[23]。在对传统与宏基因组的多样性指数、丰富度指数、均匀度指数的比较分析上,传统方法多样性指数和丰富度指数是低于宏基因组法的均值,而在均匀度指数上传统法大于宏基因组法,这样的结果可能是由于真菌的对培养基的选择,筛选出来的真菌是在PDA中的优势菌株和易培养菌株,这与Elizabeth等[24]所说明的培养的方法低估了内生真菌的多样性相类似,不同的方法存在着某种特殊的偏好性。而这些菌株的分布比较大,所以会造成指标的偏离,不能真实的展示内生真菌的多样性和差异性。所以推测环境因素对植物内生真菌的影响以及个体差异可能体现在那些非优势菌株中的变化上,而不是优势菌株。
通过两种方法的比较发现,传统分离培养法未分离到黄绿卷毛菇,而宏基因组法分离到相对丰度为11.39的黄绿卷毛菇,可能原因为黄绿卷毛菇生长缓慢,需要加富营养,而传统的培养法用PDA平板培养,未能达到自然生境中的营养要求。关于黄绿卷毛菇人工种植目前尚未成功,菌根类型的研究及确定将是今后研究的方向。
4 结论传统分离培养法共分离鉴定得到66株内生真菌均为子囊菌门(Ascomycota),优势种群为Stagonospora bicolor;宏基因组法检测到587种内生真菌,子囊菌门占77.21%、担子菌门(Basidiomycota)占16.21%,剩下的6.58%为unclassified真菌,优势种群为Fusarium sp.。传统法多样性指数和丰富度指数均小于宏基因组法,均匀度指数大于宏基因组法。黄绿卷毛菇生境的矮嵩草植物中,蕴含着丰富的内生真菌资源,黄绿卷毛菇为优势内生真菌种群之一。
| [1] |
赵联正. 青藏高原黄绿蜜环菌的研究概述[J]. 食用菌, 2015, 37(1): 1-3. DOI:10.3969/j.issn.1000-8357.2015.01.001 |
| [2] |
谢红民, 刁治民, 邓君. 青藏高原黄绿蜜环菌资源现状及可持续发展的研究[J]. 汉江师范学院学报, 2005, 25(6): 67-70. DOI:10.3969/j.issn.1008-6072.2005.06.021 |
| [3] |
卢素锦, 李军乔, 陈刚, 等. 青海黄绿蜜环菌植被类型及伴生植物的初步调查[J]. 食用菌, 2006, 28(3): 4-5. DOI:10.3969/j.issn.1000-8357.2006.03.003 |
| [4] |
朱锦福, 刁治民, 王生财, 等. 不同营养条件对黄蘑菇菌丝生长的影响[J]. 青海科技, 2004, 11(6): 28-30. DOI:10.3969/j.issn.1005-9393.2004.06.010 |
| [5] |
周连玉. 黄绿蜜环菌的研究概述[J]. 安徽农学通报, 2010, 16(3): 52-53. DOI:10.3969/j.issn.1007-7731.2010.03.023 |
| [6] |
蔡箫, 张颖, 王晓立. 黄绿蜜环菌培养基优化及人工培养条件研究[J]. 安徽农学通报, 2013(20): 33-34. DOI:10.3969/j.issn.1007-7731.2013.20.014 |
| [7] |
史强强, 党军, 苑祥, 等. 黄绿蜜环菌菌种分离及人工培养研究[J]. 食品工业科技, 2015, 36(20): 180-182. |
| [8] |
袁志林, 章初龙, 林福呈. 植物与内生真菌互作的生理与分子机制研究进展[J]. 生态学报, 2008, 28(9): 4430-4439. DOI:10.3321/j.issn:1000-0933.2008.09.043 |
| [9] |
刘慧, 陈薇, 周勇, 等. 内生真菌和丛枝菌根真菌对羊草生长的影响[J]. 植物生态学报, 2015, 39(5): 477-485. |
| [10] |
Wang L, Yu HY, Zhang Q, et al. Response of aboveground biomass of alpine grass-lands to clirnate changes on the Qinghai-Tibet Plateau[J]. Journal of Geographical Sciences, 2018, 28(12): 1953-1964. |
| [11] |
张苗苗, 张蓉, 陈伟, 等. 线叶嵩草内生真菌抗植物病原真菌活性测定[J]. 草业科学, 2009, 26(7): 122-126. |
| [12] |
Zhang JZ, Chen XR, Yang CD, et al. A study on the diversity of soil cultured fungi in the alpine grassland of Eastern Qilian Mountains[J]. Acta Prataculturae Sinica, 2010, 19(2): 124-132. |
| [13] |
旦巴, 何燕, 卓嘎, 等. SDS法和CTAB法提取西藏黄籽油菜干种子DNA用于SSR分析[J]. 西藏科技, 2011, 8: 9-11. |
| [14] |
田恩静.中国球盖菇科几个属的分类与分子系统学研究[D].长春: 吉林农业大学, 2011. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGVL201108001033.htm
|
| [15] |
柴新义, 张雪艳, 王梓燕, 等. 中国特有的三种榆科植物枝条内生真菌菌群多样性[J]. 菌物学报, 2017, 36(10): 1346-1354. |
| [16] |
Ali MA, Naveed M, Mustafa A, et al. The good, the bad, and the ugly of rhizosphere microbiome[M]. Probiotics and Plant Health. Singapore: Springer, 2017.
|
| [17] |
Allen TR, Millar T, Berch SM, et al. Culturing and direct DNA extraction find different fungi from the same ericoid mycorrhizal roots[J]. New Phytologist, 2003, 160(1): 255-272. DOI:10.1046/j.1469-8137.2003.00885.x |
| [18] |
Arnold LD. Valuable secondary metabolites from fungi[M]. Biosynthesis and Molecular Genetics of Fungal Secondary Metabolites. New York: Springer, 2014.
|
| [19] |
闫晓睿, 杨超, 安明彪, 等. 8种贵州药用植物内生放线菌的分离及多样性研究[J]. 微生物学通报, 2018, 45(12): 2673-2683. |
| [20] |
Albrectsen BR, Siddique AB, Decker VHG, et al. Both plant genotype and herbivory shape aspen endophyte communities[J]. Oecologia, 2018, 187: 535-545. DOI:10.1007/s00442-018-4097-3 |
| [21] |
Karwehl S, Stadler M. Exploitation of fungal biodiversity for discovery of novel antibiotics[J]. Current Topics in Microbiology & Immunology, 2016, 398: 303-338. |
| [22] |
Huang CL, Jian FY, Huang HJ, et al. Deciphering mycorrhizal fungi in cultivated Phalaenopsis microbiome with next-generation sequencing of multiple barcodes[J]. Fungal Diversity, 2014, 66(1): 77-88. DOI:10.1007/s13225-014-0281-x |
| [23] |
Sota T, Kagata H, Ando Y, et al. Metagenomic approach yields insights into fungal diversity and functioning[M]. Species Diversity and Community Structure. Tokyo: Springer, 2014.
|
| [24] |
Elsebai MF, Tejesvi MV, Pirttilä AM. Endophytes as a novel source of bioactive new structures[M]. Advances in Endophytic Research. New Delhi: Springer, 2014.
|