食用菌为一种种类繁多、营养丰富并易培养的微生物,早在神农氏百草经中就有关于食用菌药理活性的记载。现代医学研究表明食用菌中含有大量的营养成分和活性物质,如蛋白质、多糖、酚类、黄酮、维生素及生物碱等,在抗氧化[1]、抗肿瘤[2]、消炎[3]及治疗糖尿病[4]等方面有很好的疗效。Boonsong等[5]报道香菇、平菇和黑木耳等5种常见食用菌中的总多酚和总黄酮具有很好的抗氧化能力;Xu等[6]指出一些食用菌中的多糖、黄酮等成分具有预防肿瘤的功能。另外,食用菌的抗炎特性也有报道[7]。科学家预测,食用菌可能会成为新一代的“生物制剂”,为人类健康造福。但是,目前关于各食用菌的活性成分含量、抗氧化以及抗肿瘤活性的比较研究的还比较少。因此,本实验选取日常生活中常见的6种食用菌-海鲜菇(Hypsizygus marmoreus)、香菇(Lentinus edodes)、茶树菇(Agrocybe cylindracea)、杏鲍菇(Pleurotus ostreatus)、平菇(Flammulina velutipes)、金针菇(Volvaria volvacea)为实验材料,采用5种抗氧化活性检测体系和5株肿瘤细胞对上述食用菌提取物的抗氧化活性和肿瘤增殖抑制活性进行全面、细致的评价,旨在为进一步深入研究和开发利用食用菌提供实验依据。
1 材料与方法 1.1 材料 1.1.1 材料海鲜菇、香菇、茶树菇、杏鲍菇、平菇和金针菇购自大型超市,由专业人士鉴定;
1.1.2 细胞株人肝癌细胞HepG2、人胃癌细胞SGC-7901、人肺癌细胞NCI-H460、人乳腺癌MDA-MB-231细胞、人肝细胞LO2购自中科院上海细胞库。
1.1.3 试剂与仪器胎牛血清、胰蛋白酶,美国Hyclone公司;DMEM培养基、RPMI-1640培养液,美国Gibico公司;Resazuri,美国Sigma公司;96孔板,NEST公司;其他药品和试剂均为国产分析纯。
Spectra Max2酶标仪,美国Molecular Devices公司;Thermo Form 311型CO2培养箱,美国Thermo Scientific公司;水浴锅,上海亚荣生化仪器厂;全自动高压灭菌器,日本三洋电机公司;5840R冷冻离心机,Gene公司。
1.2 方法 1.2.1 样品制备将各食用菌切成小块状,然后采用家用榨汁机将其榨成汁液,用低温离心机4℃,5 000 r/min离心10 min,取上清,0.22 μm无菌滤膜抽滤后保藏于-20℃冰箱,备用。
1.2.2 多酚含量测定多酚含量测定采用Folin-Ciocalteu测定法[8]。取0.1 mL样品提取液于试管中,加入2.8 mL蒸馏水和0.1 mL 1.0 mol /L Folin-Ciocalteu试剂,混合均匀,静止8 min后加入2 mL 7.5%碳酸钠溶液,摇匀,混合液密封室温下置于避光处,2 h后于765 nm波长测定吸光值,平行测定3次,以水做空白,没食子酸做标准曲线,建立的回归方程为:y=0.002 8x+0.003 5(0-200 μg/mL,R2=0.998 9),式中:y为吸光度值,x为没食子酸浓度(μg/mL)。不同提取物中多酚含量以每升样品中所含的相当于没食子酸的量进行计算。
1.2.3 总黄酮含量测定[9]精确量取1 mL样品提取液于10 mL的容量瓶中,先加入0.3 mL的5%亚硝酸钠溶液,摇匀静置6 min,再加入0.3 mL的10%的硝酸铝溶液,摇匀静置6 min,然后加4 mL 4%的氢氧化钠溶液,分别用蒸馏水稀释至刻度,静置15-20 min,在波长510 nm下测定吸光值,平行测定3次,以蒸馏水作为空白,芦丁做标准曲线,建立的回归方程为:y= 0.011 6x+0.015 1(0-64 μg/mL,R2= 0.997 5),式中:y为吸光度值,x为芦丁浓度(μg/mL)。不同提取物中总黄酮含量以每升样品中所含的相当于芦丁的含量进行计算。
1.2.4 DPPH自由基清除能力测定[10]取0.5 mL适当浓度样品溶液和4.5 mL 60 μmol /L的DPPH甲醇溶液,充分混匀后于室温下密封避光静置30 min,以甲醇做空白,于517 nm下测吸光值。DPPH自由基清除率计算公式如下:
DPPH自由基清除率=[(A0-A1)/A0]×100%
式中:A0为对照管的吸光度值;A1为样品管的吸光度值。
1.2.5 清除羟基自由基(·OH)测定采用邻二氮菲-Fe2+氧化法[11]。向反应管中依次加入5 mmol/L邻二氮菲溶液1.0 mL,PBS缓冲液(pH 7.4)3.8 mL和不同浓度样液1.0 mL,充分混匀,加5 mmol/L硫酸亚铁1.5 mL,混匀,加0.1%的过氧化氢1.0 mL,加水稀释至10 mL,37℃保持30 min,536 nm下测定其吸光度,记作A样;同上操作,不加双氧水作为未损伤管,测吸光值记为A未损;不加样品液作为损伤管,测吸光度为A损伤。按下式计算对·OH清除率:
·OH清除率(%)=[(A样品-A损伤)/(A未损-A损伤)]×100
1.2.6 清除亚硝酸盐(NO2-)测定采用盐酸萘乙二胺法[12]。向反应管中依次加入5 μg/mL的亚硝酸钠3.0 mL,pH 3.0柠檬酸-磷酸氢二钠缓冲液5.0 mL和不同浓度样液2.0 mL,混匀,于37℃保温15 min,取出后立即加入0.4%对氨基苯磺酸2 mL,摇匀,静置3-5 min,加入0.2%盐酸萘乙二胺1.0 mL,混匀,静置15 min,在538 nm波长处测定吸光度。分别以相应浓度样液做空白试验。按下式计算清除率:
清除率(%)=(A空白-A样品)/A空白×100
1.2.7 总抗氧化能力(T-AOC)测定[13]取一定量的样品液,按南京建成生物工程研究所T-AOC测定试剂盒说明书测定样品提取液的T-AOC。
1.2.8 总还原力测定采用普鲁士蓝法[13]。向反应管中依次加入0.2 mol/L磷酸钠缓冲液(pH6.6)2.5 mL,1%铁氰化钾溶液2.5 mL和不同浓度样液1.0 mL,混匀后于50℃保温20 min,快速冷却,加入2.5 mL 10%三氯乙酸之后混匀,于5 000 r/min转速下离心10 min,取上层液体2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1%三氯化铁,混匀,在700 nm下测定吸光度,吸光度越大,还原力越强。以同浓度样品溶液代替样品做空白试验。
1.2.9 各食用菌抑制肿瘤细胞增殖的活性测定采用Alamar blue法检测各提取物体外抗肿瘤活性,具体实验方法参照文献[14],具体过程如下:将处于对数生长期的细胞传代,将细胞接种于96孔板上,每孔加入100 μL细胞悬液,空白组中加入100 μL不含细胞的培养基,放入37℃,5% CO2恒温培养箱中培养过夜,使细胞完全贴壁生长。然后对照组加入100 μL DMEM培养基,实验组加入100 μL含10%胎牛血清的DMEM培养基稀释的各食用菌提取物,24 h后Alamar blue法检测细胞的成活率,置于570 nm的激发波长和590 nm的发射波长下检测荧光值。公式如下:抑制率=[(空白对照荧光值-样品荧光值)/(空白对照荧光值-无细胞空白荧光值)]×100%。
1.2.10 数据处理采用SPSS 19.0统计分析软件进行单因素方差分析,数据以x± s表示。
2 结果 2.1 不同食用菌中总酚及黄酮含量不同食用菌提取物中总多酚及黄酮含量,见表 1。金针菇和茶树菇提取物中多酚含量最高(分别为283.54和272.70 mg/L);香菇次之(216.04 mg/L);平菇、杏鲍菇和海鲜菇最低(分别为159.74、158.72和155.76 mg/L)。黄酮含量在金针菇、茶树菇中(49.79和27.84 mg/L)比较高;香菇和杏鲍菇次之(19.56和11.54 mg/L);平菇和海鲜菇最低(分别为6.20和5.19 mg/L)。
采用试剂盒测定个食用菌提取物的总抗氧化能力(表 1),结果显示各食用菌的总抗氧化能力不同,其中茶树菇和香菇最强(22.94±4.29和20.10±3.09 U/L),海鲜菇和平菇的能力最弱(2.59±0.76和3.21±1.21 U/L)。而总还原能力是评估抗氧化剂活性的一个重要指标。样品还原能力越强,吸光值越大。从表 1中可以看出,茶树菇、香菇和金针菇的总还原力比较高(0.26±0.06、0.233±0.05和0.207±0.03),平菇和杏鲍菇最低(0.073±0.01和0.061±0.01)。从两指标综合看来,茶树菇和香菇的具有很好的抗氧化活性。
2.2.2 清除DPPH自由基能力DPPH·自由基属于比较稳定的有机物自由基,广泛应用于测定纯抗氧化剂或植物提取物的体外抗氧化活性。不同食用菌的DPPH·自由基清除能力如表 2所示,不同品种食用菌的DPPH·自由基清除能力之间存在较大差异。DPPH·自由基清除能力最强的是金针菇,清除率为48.8%,杏鲍菇的清除能力最弱,为2.39%,6个供试品种的DPPH·自由基清除能力为2.39%-48.8%,变幅为46.4%。
各食用菌提取物对羟基自由基也具有不同的清除能力(表 2),其中金针菇的清除能力最强(75.12%±10.35%),香菇和茶树菇最低(47.98%±9.76%和51.55%±5.32%),6个供试品种的OH·清除能力为47.89%-75.12%,变幅为27.23%。同时本研究也检测了各食用菌对O2-·的清除能力(表 2),发现并无明显差异,供试样品的清除能力为52.11%-59.42%,变幅仅为7.31%。
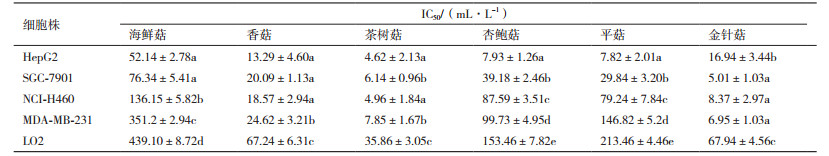
2.3 六种食用菌提取物对肿瘤细胞体外增殖的影响不同浓度的食用菌提取物对HepG2、SGC-7901、NCI-H460、MDA-MB-231和MCF-7细胞增殖的抑制率的IC50值,见表 3。结果表明,茶树菇对HepG2和NCI-H460的增殖活性最强,IC50分别是4.62±2.13和4.96±1.84 mL/L,而金针菇对SGC-7901和MDA-MB-231细胞的增殖活性最强,IC50的分别是5.01±1.03和6.95±1.03 mL/L,6种食用菌提取物对几种肿瘤细胞增殖的抑制能力要强于其对正常肝细胞LO2增殖的抑制能力,说明各食用菌提取物的细胞毒性很低,具有很好的抗肿瘤活性开发前景。
通过化学方法测定天然产物清除自由基能力,是一种常用于评价天然产物的抗氧化活性方法。常见的自由基系统有:DPPH·自由基系统、ABTS+·自由基系统、羟基自由基以及O2-·自由基系统[15-18]。应用多种自由基系统测定药物的抗氧化能力,能够较为准确地反映该药物的体外抗氧化能力。本研究采用多种自由基系统检测6种常见食用菌的抗氧化活性,结果显示各食用菌对各自由基具有一定的清除能力,茶树菇和金针菇在各方面的抗氧化活性都比较强。邱军强等[19]研究显示金针菇的碱水提取物具有很强的DDPH自由基清除率,并且提取物的抗氧化活性主要与多酚含量有关;孙延芳等[20]也指出茶树菇多酚的抗氧化活性优于研究的其他几种食用菌。本文对各食用菌的总黄酮和总酚含量的测定结果比较发现金针菇、茶树菇和香菇的含量很高,这与检测的抗氧化活性和抗细胞增殖活性的强弱是有一定的关系。
利用现代药理学理论和实验,来验证传统药用菌的药理活性并寻找到活性目标成分,是将其开发为保健食品或药品的必经之路。本研究对常见6种食用菌提取物的抗肿瘤活性进行了比较,结果证实,在实验浓度内,各食用菌对受测肿瘤细胞株均有一定程度的增殖抑制活性,其中各食用菌对HepG2细胞普遍有比较好的抑制作用,而对正常肝细胞增殖活性基本上无影响。食用菌中含有多糖、酚类、蛋白类等多种成分,对抗肿瘤作用的研究很多[20],本研究对常见食用菌进行多组肿瘤细胞株的抗肿瘤测定,为进一步开发高附加值的保健品提供理论依据。
4 结论(1) 测定的6种食用菌在不同的抗氧化途径中均有良好的抗氧化活性,其中茶树菇和金针菇在各方面的抗氧化活性都比较强,而其多酚和黄酮含量也是最高的。(2)测定的6种食用菌对正常肝细胞LO2的毒性均较低,对测定的肿瘤细胞株均显示出不同的抗肿瘤增殖活性,其中各食用菌对HepG2细胞普遍有比较好的抑制作用,作用最强的是金针菇和茶树菇。
| [1] |
Li Z, Chen X, Lu W, et al. Anti-oxidative stress activity is essential for Amanita caesarea mediated neuroprotection on glutamate-induced apoptotic HT22 cells and an Alzheimer's disease mouse model[J]. Inter J Mol Sci, 2017, 18(8): pii:E1623. DOI:10.3390/ijms18081623 |
| [2] |
Prateep A, Sumkhemthong S, Suksomtip M, et al. Peptides extracted from edible mushroom:Lentinus squarrosulus induces apoptosis in human lung cancer cells[J]. Pharmaceutical Biology, 2017, 55(1): 1792-1799. DOI:10.1080/13880209.2017.1325913 |
| [3] |
Muszynska B, Grzywacz-Kisielewska A, Kala K, et al. Anti-inflammatory properties of edible mushrooms:A review[J]. Food Chemistry, 2018, 243: 373-381. DOI:10.1016/j.foodchem.2017.09.149 |
| [4] |
Xiong M, Huang Y, Liu Y, et al. Antidiabetic activity of ergosterol from pleurotus ostreatus in KK-A(y)Mice with spontaneous type 2 diabetes mellitus[J]. Molecular Nutrition & Food Research, 2018, 62(3): 1-34. |
| [5] |
Boonsongab S, Klaypraditab W, Wilaipun P. Antioxidant activities of extracts from five edible mushrooms using different extractants[J]. Agriculture and Natural Resources, 2016, 50(2): 89-97. DOI:10.1016/j.anres.2015.07.002 |
| [6] |
Xu T, Robert B, Joshua D. The cancer preventive effects of edible mushrooms[J]. Anticancer Agents, 2012, 12(10): 1255-1263. DOI:10.2174/187152012803833017 |
| [7] |
Bożena M, Agata G, Katarzyna K, et al. Anti-inflammatory properties of edible mushrooms:A review[J]. Food Chemistry, 2018, 243(15): 373-381. |
| [8] |
刘禹, 段江莲, 李为琴, 等. 高粱米不同溶剂提取物的抗氧化活性研究[J]. 中国粮油学报, 2013, 28(6): 36-39. DOI:10.3969/j.issn.1003-0174.2013.06.008 |
| [9] |
Wang W, Li J, Zhang H, et al. Phenolic compounds and bioactivity evaluation of aqueous and methanol extracts of Allium mongolicum Regel[J]. Food Science Nutrition, 2019, 7(2): 779-787. DOI:10.1002/fsn3.926 |
| [10] |
Kuspradini H, Wulandari I, Putri AS, et al. Kusuma, phytochemical, antioxidant and antimicrobial properties of Litsea angulata extracts[J]. F1000 Res, 2018, 7: 1839. DOI:10.12688/f1000research.16620.1 |
| [11] |
李利华. 芹菜不同部位总黄酮含量测定及其抗氧化活性[J]. 食品研究与开发, 2013, 34(7): 12-15. |
| [12] |
李利华. 苹果皮不同溶剂提取物抗氧化活性研究[J]. 现代食品科技, 2012, 28(11): 1471-1473. |
| [13] |
陈子涵, 蒋继宏, 鞠秀云, 等. 各食用米中活性成分及其抗氧化活性[J]. 食品工业科技, 2018, 39(3): 71-75. |
| [14] |
Yang S, Liu J, Chen Y, et al. Reversal effect of Tween-20 on multidrug resistance in tumor cells in vitro[J]. Biomedicine & Pharmacotherapy, 2012, 66(3): 187-194. |
| [15] |
Brand-Williams W, Cuvelier M, Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30. |
| [16] |
Cano A, Alcaraz O, Acosta M, et al. On-Line antioxidant activity determination comparision of hydrophilic and lipophilic antioxidant activity using the ABTS+ assay[J]. Redox Report, 2002, 7(2): 103-109. DOI:10.1179/135100002125000334 |
| [17] |
Magnani L, Gaydou EM, Hubaud JC. Spectrophotometric measurement of antioxidant properties of flavones and flavonols against superoxide anion[J]. Analytica Chimica Acta, 2000, 411(1): 209-216. |
| [18] |
陈开旭, 王为兰, 刘军, 等. 食用菌活性成分抗肿瘤作用的研究进展[J]. 生物技术通报, 2015, 31(3): 35-42. |
| [19] |
邱军强, 张华, 刘迪迪, 等. 9种食用菌碱水提取物的抗氧化活性比较研究[J]. 食品研究与开发, 2017, 38(15): 1-5. DOI:10.3969/j.issn.1005-6521.2017.15.001 |
| [20] |
孙延芳, 刘艳凯, 梁宗锁, 等. 6种食用菌多酚及其抗氧化活性研究[J]. 广东农业科学, 2011, 16: 76-78. |