2. 青海省农林科学院青海大学省部共建三江源生态与高原农牧业国家重点实验室 青藏高原生物技术教育部重点实验室 青海省马铃薯育种重点实验室,西宁 810016
2. Qinghai Academy of Agriculture and Forestry Sciences/State key Laboratory of Plateau Ecology and Agriculture/Key Laboratory of Qinghai-Tibetan Plateau Biotechnology of Ministry of Education/Key Laboratory of Potato Breeding of Qinghai, Xining 810016
马铃薯(Solanum tuberosum)是继小麦、水稻、玉米之后全球第四大粮食作物,深受人们喜爱[1]。随着经济发展,逐步机械化是收获马铃薯的发展方向,但在马铃薯收获、装运和贮藏等一系列过程中造成薯块不同程度的机械损伤,使薯块的腐烂速度加快,为贮藏带来不便。因此,增加薯块的机械强度及其受损后的愈合能力显得尤为重要[2]。
4-香豆素辅酶A连接酶(4CL)是苯丙氨酸类化合物合成中不可缺少的酶,它能够活化香豆酸及其衍生物生成相应的硫代酯,这些酯类化合物是合成黄酮类化合物、异黄酮类化合物、木质素类化合物、花青素类化合物、香豆素化合物、二苯乙烯类化合物的中间体[3-5]。其中,木质素是植物组织的重要结构成分,它赋予植物机械强度,并保护植物免受各种致病菌的侵害[6]。
目前,4CL已在许多植物中被克隆,存在于一个小的基因家族中,有2-5名成员[7]。拟南芥中4CL有4个成员,均在苯丙氨酸代谢途径中具有重叠而独特的作用,其中,At4CL1和At4CL2是植物正常生长所必需的[8]。4CL在水稻中有5个成员,其中Os4CL2在花药中特异表达并在紫外光照射下被强烈激活,可能参与黄酮类化合物的形成[9]。杨树中的Pt4CL1主要参与木质部组织中木质素的生物合成,而Pt4CL2与其他类苯丙烷的形成有关[10]。木质素含量与植物茎秆的抗倒伏有关,过表达Mu4CL15的香蕉中木质素含量高于野生型,并且转基因植株茎杆的物理强度显著增强[11]。
目前,马铃薯4CL的研究主要集中在苯丙氨酸类化合物合成方面,尚不清楚苯丙氨酸类化合物在马铃薯抗晚疫病中的作用,对马铃薯St4CL开展深入研究,有助于我们进一步了解其作用机理。本研究采用同源克隆方法,以青海省主栽品种青薯9号为材料,克隆St4CL,进行生物信息学分析,通过荧光定量分析St4CL在马铃薯青薯9号不同组织和不同品种中的表达情况,以期为St4CL的功能验证奠定基础。
1 材料与方法 1.1 材料马铃薯品种L1192-4、青薯2号、青薯9号、青薯10号、青薯11号、下寨65、陇薯6号、陇薯7号均由青海省农林科学院生物技术研究所提供,其特性见表 1。
RNA prep Pure多糖多酚植物总RNA提取试剂盒、反转录试剂盒、克隆载体PLB以及DNA凝胶回收试剂盒等购自天根公司;大肠杆菌感受态细胞DH5α、高保真聚合酶以及荧光定量检测试剂盒等购自TaKaRa公司。
1.2 方法 1.2.1 St4CL的克隆提取马铃薯青薯9号块茎总RNA,并进行反转录。以青海省农林科学院生物技术研究所转录组数据中差异基因4CL序列为参考,设计引物St4CL-F和St4CL-R(表 2),进行PCR扩增。PCR反应体系为2×FastTaq PCR Master Mix 10 μL、引物各0.5 μL、cDNA 2 μL和ddH2O 7 μL。PCR扩增程序为95℃ 3 min;95℃ 20 s,71℃ 20 s,72℃1 min,共35个循环;72℃ 5 min;4℃保存。PCR产物经2%琼脂糖凝胶电泳进行检测,回收目的条带,与PLB载体重组,转化大肠杆菌感受态细胞DH5α中,涂板于含有氨苄(Amp)的LB培养基上,37℃过夜。挑取单克隆筛选阳性,送上海生工公司测序。
采用DNAMAN软件拼接St4CL测序序列,利用ExPAsy-ProtParam(http://web.expasy.org/protparam)和SOPMA(https://npsa_sopma.html)等在线工具对蛋白质的理化性质和二级结构进行预测。采用Psort prediction(http://psort1.hgc.jp/form.html)和PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线工具预测亚细胞定位和分析启动子。采用NCBI数据库以及DNA MAN软件分析氨基酸序列,利用MEGA6.0软件采用邻近法构建系统进化树。
1.2.3 青薯9号不同组织中St4CL的表达待青薯9号长出块茎后,分别取其根、茎、叶、花、匍匐茎、块茎,提取RNA并进行荧光定量分析,3个重复,将反转录cDNA浓度稀释至200 ng/μL。荧光反应体系为10 μL TB Green Premix Ex TaqⅡ、0.4 μL qPCR4CL-F、0.4 μL qPCR4CL-R、2 μL cDNA和7.2 μL ddH2O。反应程序为两步法:95℃ 30 s;95℃ 10 s,60℃ 32 s,共40个循环。每个组织反应重复3次,采用2-ΔΔCT法进行数据分析。
1.2.4 不同马铃薯品种中St4CL的表达分析分别将L1192-4(紫色)、青薯2号、青薯9号、青薯10号、青薯11号、下寨65、陇薯6号、陇薯7号种于花盆中,各3盆,待其出苗1个月,取其嫩叶,参照1.2.3进行荧光定量PCR分析。
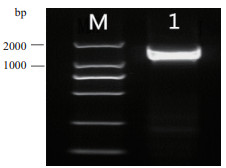
2 结果 2.1 青薯9号中St4CL的克隆以马铃薯青薯9号块茎的cDNA为模板进行PCR扩增,经2%琼脂糖凝胶电泳检测后,获得一条大小为1 800 bp左右的条带(图 1),与预期大小一致。经测序发现,St4CL的CDS长度为1 710 bp,编码569个氨基酸。
|
| M:DNA marker,1:St4CL 图 1 马铃薯St4CL的检测 |
St4CL的CDS长度为1 710 bp,编码569个氨基酸,其蛋白分子质量约为61.83 kD,等电点为5.53,分子式为C2782H4430N726O825S18,其中含量最高为丙氨酸(Ala),占8.6%,含量最低为色氨酸(Trp),占0.2%,不含吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。该蛋白的平均疏水性(GEAVY)为0.068,蛋白不稳定指数为34.68,属于稳定的疏水性蛋白。
2.2.2 St4CL蛋白的亚细胞定位与二级结构分析亚细胞定位预测结果显示,该蛋白定位在叶绿体的类囊体膜上。St4CL蛋白的二级结构主要由4种构象组成,分别为无规则卷曲(Cc)、α-螺旋(Hh)、延伸连(Ee)、β-折叠(Tt),其中,无规则卷曲占比例最高为43.76%,含有249个氨基酸,β-折叠占比例最低为7.56%,含有43个氨基酸。
2.2.3 St4CL的启动子顺式作用元件的分析使用Plant Care对St4CL基因起始密码子上游1 500 bp处的启动子序列进行分析发现(表 3),除了包含转录相关的基本元件之外,还含有多种与逆境响应相关的顺式作用元件,如脱落酸响应元件、厌氧诱导元件、赤霉素响应元件以及与干旱和黄酮类生物合成相关的MYB结合位点。
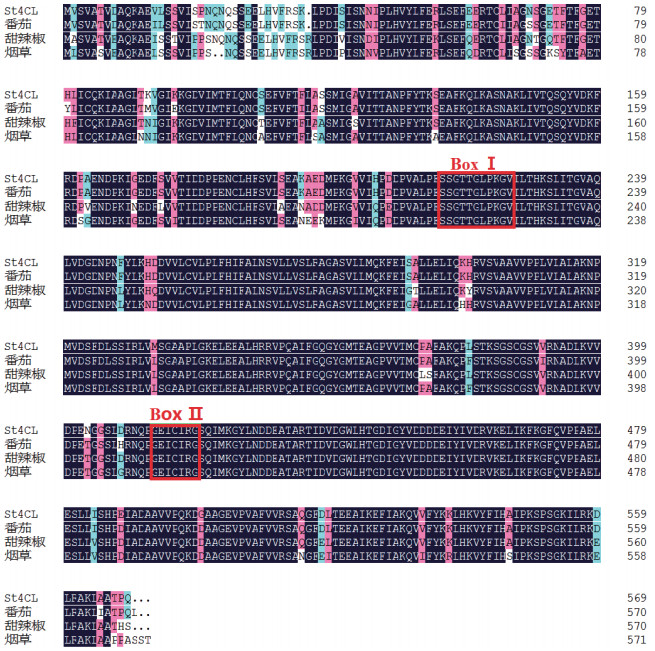
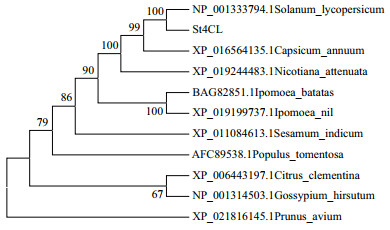
使用DNAMAN软件对St4CL、番茄、甜辣椒以及烟草的4CL蛋白进行比对(图 2),发现St4CL蛋白与番茄(NP_001333794.1)、甜辣椒(XP_016564135.1)、烟草(XP_019244483.1)的4CL蛋白相似性分别达到97%、93%和90.67%,并具有2个高度保守基序BoxⅠ(SSGTTGLPKGV)和BoxⅡ(GEICIRG)。使用MEGA6.0采用邻近法对St4CL蛋白及其他不同植物中的同源序列构建系统发育树(图 3),结果表明,St4CL蛋白和番茄、甜辣椒、烟草聚在一个分支,其中马铃薯与番茄的亲缘关系最近,与棉花、柑橘的亲缘关系较远。
|
| 红色方框表示高度保守区 图 2 4CL氨基酸多重序列比对 |
|
| 图 3 St4CL与相关植物4CL同源蛋白的系统进化分析 |
经分析青海省农林科学院生物技术研究所RNA-seq数据(图 4)发现,当青薯9号受到晚疫病侵染时,St4CL的表达呈下降-上升-下降的趋势,但整体呈下降趋势,说明该基因可能响应晚疫病菌的胁迫。
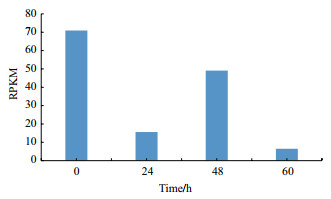
|
| 图 4 St4CL的RNA-seq数据分析 |
通过对青薯9号不同组织中St4CL的表达进行qRT-PCR分析(图 5)发现,该基因在青薯9号各组织中均有不同程度的表达,具有明显的组织特异性,其中,叶片中的表达量最高,花次之,而根中的表达量最低。

|
| 图 5 St4CL在青薯9号不同组织中的表达 |
为进一步了解St4CL在不同马铃薯品种中的表达情况,对其进行qRT-PCR分析(图 6),发现St4CL在青薯10号中表达量最高,L1192-4次之,青薯2号与下寨65表达量最低。

|
| 图 6 St4CL在不同品种中的表达 |
4CL是苯丙烷类代谢途径中的关键酶,广泛存在于各种植物中,主要是与调控木质素的合成有关[12]。本研究采用同源克隆方法获得了马铃薯青薯9号4CL同源基因的CDS序列,命名为St4CL,其CDS长度为1 710 bp,编码569个氨基酸。利用生物信息学对所获得的St4CL氨基酸序列进行分析发现,该蛋白的平均疏水性(GEAVY)为0.068,蛋白不稳定指数为34.68,属于稳定的疏水性蛋白。亚细胞定位表明,该蛋白位于叶绿体的类囊体膜上,但可信度为80.7%,后续需要进一步进行验证。多序列比对发现,该蛋白含有植物中4CL蛋白所共有的2个肽基序BoxⅠ和BoxⅡ,其中BoxⅠ是4CL催化反应中能够与AMP结合的功能域,而BoxⅡ中心的Cys残基被认为直接参与催化反应[13]。系统进化分析表明,St4CL蛋白与番茄、甜辣椒、烟草等茄科植物的亲缘关系较近,与柑橘、棉花、毛白杨等非茄科的亲缘关系较远。Alberstein等[14]发现,番茄中的4CL蛋白与木质素合成有关,当其与查尔酮合成酶结合时能够生成柚皮素。4CL在被炭疽病菌侵染的未成熟甜辣椒果实中的表达上调,从而来诱导果实中咖啡基-5-羟色胺的合成[15]。茉莉酸甲酯和创伤能够诱导烟草中Nt4CL表达,从而调节植株发育过程[16]。不同发育阶段中棉花的Gh4CL1表达量不同,在开花后15 d和20 d的表达量较高,说明该基因调控棉花纤维细胞伸长[17]。启动子分析表明,St4CL启动子区域含有多种与逆境响应相关的顺式作用元件,如脱落酸响应元件、赤霉素响应元件以及与干旱和黄酮类生物合成相关的MYB结合位点,说明该启动子元件具有多样性,可以为进一步研究St4CL的表达特点提供基础。李萌等[18]研究白桦4CL启动子的表达发现,经过瞬时侵染的白桦茎段被染成蓝色,说明其可能参与白桦木质部的发育。
众多研究表明,4CL表达具有组织特异性,如柑橘中的Cit4CL1在幼果中的表达最高,根中最低,Cit4CL2在幼茎中表达最高,根中最低,而Cit4CL3却在根中表达最高,幼茎与幼果中最低[19],桂花中的4CL在花瓣中的表达量最高,并且不同花期该基因的表达量不同,导致花青素含量也不同[20],维管束植物卷柏中的Sm4CL1和Sm4CL2均在根中的表达最高,其中Sm4CL2参与对羟基苯基和愈疮木脂素亚基的生物合成[21]。陈夏晔等[22]研究发现,Nt4CL在烟草叶片中高表达,而研究烟草叶片中高表达基因对降低烟叶木质素含量和烟草危害性具有重要意义。贾彩虹等[23]研究表明,将反义4CL基因转入毛白杨中并测定木质素含量,转基因株系的木质素含量低于对照41.37%。将刺槐GRP1.8启动子与从毛白杨中克隆的反义4CL连接构建融合基因并转入烟草发现,转基因烟草中木质素的含量较野生型平均降低了13.7%[24]。为确定St4CL在青薯9号中的组织表达特性,本研究采用实时荧光定量PCR技术检测其在各组织中的表达情况。结果显示St4CL在叶片和紫花中的表达量最高,在根中的表达较低,且系统进化树分析表明St4CL与烟草4CL亲缘关系较近,推测该基因不仅花青素的合成有关,可能还与木质素的合成有关。
晚疫病是导致马铃薯产量下降的重要原因之一,该病是由致病疫霉菌侵染引起,Fritzemeier等[25]发现,用致病疫霉菌Pi1和Pi4分别侵染含有抗晚疫病Pi1的马铃薯叶片发现,两组叶片中4CL表达量急剧增加后又急剧下降,但受Pi1感染的叶片中4CL表达量急剧下降后又开始增加,而受Pi4感染的叶片中4CL表达下降后趋于稳定。通过对青海省农林科学院生物技术研究所前期RNA-Seq数据分析发现,4CL为晚疫病差异基因,当其受到晚疫病胁迫后,该基因的表达先下降后上升再下降,这可能是由于本实验选择的材料本身对晚疫病具有一定的抗病性。通过实时荧光定量PCR技术对St4CL在不同马铃薯品种中的表达量进行测定发现,该基因在L1192-4中表达较高,由于L1192-4品种马铃薯为紫色,该基因与花青素合成相关而使其表达量升高。张蕾等[26]采用RNAi技术将草莓果实中Fa4CL沉默后对果实中的花色素苷进行测定发现,花色素苷含量明显降低。St4CL在高抗晚疫病品种青薯10号中表达最高,在感病品种下寨65中的表达量最低,从尹军良[27]与青海省农林科学院生物技术研究所晚疫病抗性试验结果中发现,马铃薯晚疫病田间抗性青薯10号 > 陇薯7号 > 青薯9号 > 陇薯6号 > 青薯11号 > 青薯2号 > 下寨65。而且4CL参与香豆素合成途径,与其他苯丙烷类代谢物质一样,具有许多生物学功能,能够抵御多种病原菌对植物的侵害,增强植物抗病性,棉花中Gh4CL参与了棉花对链格孢菌的抗性反应[28]。推测4CL不仅与苯丙氨酸类化合物合成相关而且与晚疫病菌的抗性相关。目前在茄科植物中关于4CL的研究主要在烟草上,对马铃薯中4CL相关报道较少,克隆St4CL可以进一步为研究马铃薯中苯丙烷代谢与晚疫病抗性研究等过程提供帮助。目前,已构建St4CL的表达载体,为明确St4CL在马铃薯中的功能和作用机制提供基础。
4 结论成功克隆了马铃薯St4CL的CDS区,St4CL是稳定的疏水性蛋白,主要分布在叶绿体的类囊体膜上,启动子中含有许多逆境响应元件。推测St4CL不仅参与木质素和花青素合成,还可能参与马铃薯抗晚疫病。
| [1] |
李明, 谢海娟, 叶广继, 等. 马铃薯光敏色素作用因子基因PIF4的克隆及表达分析[J]. 分子植物育种, 2018, 16(19): 6193-6201. |
| [2] |
王连平, 席与芳, 王汉荣, 等. 外源处理对机械损伤甘薯块根木质素合成的影响[J]. 江西农业学报, 2004, 16(1): 20-24. DOI:10.3969/j.issn.1001-8581.2004.01.005 |
| [3] |
胡尚连, 曹颖, 黄胜雄, 等. 慈竹4CL基因的克隆及其生物信息学分析[J]. 西北农林科技大学学报:自然科学版, 2009, 37(8): 204-210. |
| [4] |
Vogt T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010, 3(1): 2-20. DOI:10.1093/mp/ssp106 |
| [5] |
Awasthi P, Mahajan V, Jamwal VL, et al. Characterization of the gene encoding 4-coumarate:CoA ligase in Coleus forskohlii[J]. J Plant Bioch Biotech, 2018, 28(2): 203-210. |
| [6] |
Hakeem KR, Rehman RU, Tahir I. Plant signaling:Understanding the molecular crosstalk[M]. India: Springer New Delhi, 2014.
|
| [7] |
Tang YH, Liu F, Mao KQ, et al. Cloning and characterization of the key 4-coumarate CoA ligase genes in Boehmeria nivea[J]. South African Journal of Botany, 2018, 116: 123-130. DOI:10.1016/j.sajb.2018.02.398 |
| [8] |
Li Y, Kim JI, Pysh L, et al. Four isoforms of Arabidopsis thaliana 4-coumarate:CoA ligase(4CL)have overlapping yet distinct roles in phenylpropanoid metabolism[J]. Plant Physiology, 2015, 169(4): 2409. |
| [9] |
Sun HY, LI Y, Feng SQ, et al. Analysis of five rice 4-coumarate:coenzyme Aligase enzyme activity and; stress response for potential roles in lignin and flavonoid biosynthesisin rice[J]. Biochemical & Biophysical Research Communications, 2013, 430(3): 1151-1156. |
| [10] |
Hu WJ, Kawaoka A, Tsai CJ, et al. Compartmentalized expression of two structurally and functionally distinct 4-coumarate:CoA ligase genes in Aspen(Populus tremuloides)[J]. Proceedings of the National Academy of Sciences of the USA, 1998, 95(9): 5407-5412. DOI:10.1073/pnas.95.9.5407 |
| [11] |
常胜合, 孙威, 许桂莺, 等. 利用4-香豆酸:CoA连接酶基因Mu4CL15提高香蕉植株的倒伏抗性[J]. 分子植物育种, 2017, 15(12): 4905-4911. |
| [12] |
姜勇, 胡尚连, 曹颖, 等. 青杨4CL基因的克隆及生物信息学分析[J]. 西南农业学报, 2016, 29(7): 1547-1553. |
| [13] |
Stuible H, Kombrink E. Identification of the substrate specificity-conferring amino acid residues of 4-coumarate:Coenzyme A ligase allows the rational design of mutant enzymes with new catalytic properties[J]. Journal of Biological Chemistry, 2001, 276(29): 26893-26897. DOI:10.1074/jbc.M100355200 |
| [14] |
Alberstein M, Eisenstein M, Abeliovich H. Removing allosteric feedback inhibition of tomato 4-coumarate:CoA ligase by directed evolution[J]. Plant J, 2012, 69(1): 57-69. DOI:10.1111/j.1365-313X.2011.04770.x |
| [15] |
Kiyoon K, Kyungjin L, Ishihara A, et al. Induced synthesis of caffeoylserotonin in pepper fruits upon infection by the anthracnose fungus, Colletotrichum gloeosporioides[J]. Scientia Horticulturae, 2010, 124(2): 290-293. DOI:10.1016/j.scienta.2009.12.036 |
| [16] |
Lee D. Two divergent members of a tobacco 4-coumarate:coenzyme A ligase(4CL)gene family. cDNA structure, gene inheritance and expression, and properties of recombinant proteins[J]. Plant Physiology, 1996, 112(1): 193-205. DOI:10.1104/pp.112.1.193 |
| [17] |
倪志勇, 吕萌, 范玲. 棉花Gh4CL1基因克隆及表达[J]. 西北植物学报, 2010, 30(5): 876-882. |
| [18] |
李萌, 哈努拉·塔斯肯, 陈卓, 等. 白桦4CL基因启动子克隆及表达分析[J]. 中国农学通报, 2017, 33(5): 29-34. |
| [19] |
申晚霞, 王志彬, 薛杨, 等. 柑橘4CL基因家族的结构及其功能分析[J]. 园艺学报, 2019, 46(6): 1068-1078. |
| [20] |
母洪娜, 孙陶泽, 徐晨, 等. 桂花(Osmanthus fragrans Lour.)4-香豆酸辅酶A连接酶(4CL)基因克隆与表达分析[J]. 分子植物育种, 2016, 14(3): 536-541. |
| [21] |
Liu XY, Wang PP, Wu YF, et al. Cloning and functional characterization of two 4-coumarate:CoA ligase genes from Selaginella moellendorffii[J]. Molecules, 2018, 23(3): 595-606. DOI:10.3390/molecules23030595 |
| [22] |
陈夏晔, 彭宣祥. 普通烟草Nt4CL基因家族的生物信息学分析[J]. 贵州农业科学, 2018, 46(8): 11-15. DOI:10.3969/j.issn.1001-3601.2018.08.004 |
| [23] |
贾彩红, 王宏芝, 杜克久, 等. 抑制4CL基因表达的转基因毛白杨中木质素含量与茎杆颜色的关系[J]. 农业生物技术学报, 2004, 12(6): 621-624. DOI:10.3969/j.issn.1674-7968.2004.06.001 |
| [24] |
赵艳玲, 陆海, 陶霞娟, 等. GRP1. 8融合反义4CL1基因调控烟草木质素生物合成[J]. 北京林业大学学报, 2003, 25(4): 16-20. DOI:10.3321/j.issn:1000-1522.2003.04.004 |
| [25] |
Fritzemeier KH, Cretin C, Kombrink E, et al. Transient induction of phenylala-nine ammonia-lyase and 4-coumarate:CoA ligase mRNAs in po-tato leaves infected with virulent or avirulent races of Phytophthora infestans[J]. Plant Physiol, 1987, 85(1): 34-41. DOI:10.1104/pp.85.1.34 |
| [26] |
张蕾, 林晓, 罗赟, 等. RNAi沉默Fa4CL基因对草莓果实花色苷代谢的影响[J]. 果树学报, 2015, 32(3): 434-439. |
| [27] |
尹军良.西北地区马铃薯主栽品种的抗晚疫病性评价及致病疫霉菌候选核心RXLR效应基因的鉴定[D].杨凌: 西北农林科技大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018973513.htm
|
| [28] |
张珊珊, 翟伟卜, 郭慧敏, 等. 香豆素合成途径关键酶基因Ghpal、Ghc4h和Gh4cl在棉花抗链格孢菌中的作用[J]. 植物病理学报, 2017(2): 73-82. |