2. 湖北中烟工业有限责任公司, 武汉 430030
2. Hubei tobacco industry limited liability company. Wuhan 430030
烟草(Tobacco), 属于茄科烟草属植物, 在世界范围内有60余种[1], 有一大部分原产地为南美洲, 现在我国南北各省区广为栽培种植[2], 烟草含有茄尼醇、多糖、氨基酸、芦丁、绿原酸、有机酸等多种活性成分[3], 并且研究已证明烟草具有十分重要的药用价值, 具有消肿、解毒等功效, 在调节神经系统、改善心血管疾病也有显著疗效[4], 其很多作用与烟草中多糖密切相关。
多糖是一种高分子聚合物, 它一般是由醛糖和酮糖通过缩合而形成的, 拥有抗氧化、抗肿瘤、免疫调节、降血脂及降血糖[5]等多种生物活性。硒元素是生命必需的微量元素, 具有抗衰老、抗肿瘤、调节机体免疫力、影响人和动物的生殖发育、解毒等生物学功能[6]。硒在体内以硒代半胱氨酸的形式构成谷胱甘肽过氧化物酶的活性中心, 可清除自由基, 抑制脂氧化或过氧化[7]。有研究表明将多糖进行硒衍生化后, 发现其体外抗氧化活性比无硒衍生化多糖的明显增强[8]。
本研究通过对烟叶中多糖进行提取精制后制备烟叶多糖硒化衍生物, 并评价其体外抗氧活性大小, 以期对烟叶多糖的开发利用提出参考。
1 材料与方法 1.1 材料烟叶:四川凉山烤后烟样, 品种为云烟87, 等级为C3F, 石油醚(沸程30-60℃)、无水乙醇、氯仿、正丁醇、氯化钠、硝酸、亚硒酸钠、氯化钡、氢氧化钠、硫酸钠皆为分析纯, DEAE-52纤维素, 北京索莱宝科技有限公司, 透析袋(分子量3 500 Da), 北京索莱宝科技有限公司。
KQ5200DE型数控超声清洗器, 昆山市超声仪器有限公司, 旋转蒸发器RE-52AA, 上海亚荣生化仪器厂, UV8100B紫外可见分光光度计, 北京莱伯泰科技仪器有限公司, 自动馏分收集器BSZ-160F, 上海之信仪器有限公司, LYOVAC GT2冷冻干燥机, 德国莱宝公司。
1.2 方法 1.2.1 烟叶粗多糖的提取将烟叶研磨碎裂后过40目筛, 用石油醚浸泡3 h, 抽滤, 加入80%乙醇于70℃进行回流提取2次, 2 h/次, 抽滤, 60℃烘干粉碎备用。
取一定量上述处理过烟叶, 按照设定的料液比1:35(g:mL)在温度60℃、超声功率400 W的条件下进行超声辅助提取10 min, 冷却至室温, 抽滤取滤液, 在60℃旋转蒸发浓缩至体积的1/4, 加入4倍体积无水乙醇, 醇沉8 h以上。再经8 000 r/min离心10 min, 取沉淀, 得烟叶粗多糖。
1.2.2 烟叶粗多糖的精制分离取烟叶粗多糖用蒸馏水溶解, 配置成粗多糖溶液, 用Sevage法去除蛋白质[9], 加入多糖溶液体积的1/3 Sevage试剂(V氯仿:V正丁醇=4:1), 充分震荡后静置30 min, 离心取上清液, 弃去下层变性蛋白质, 然后重复上述操作, 至到两液分层处无白色浑浊出现, 旋蒸除掉残留的Sevage试剂。取无蛋白的烟叶多糖溶液, 加入1.5%的无磷活性炭进行脱色, 在60℃条件下, 缓慢搅拌30 min后, 抽滤, 将滤液放入处理好的透析袋中, 每8 h换一次水, 透析72 h。
透析完成后将溶液用微孔过滤膜进行抽滤, 取溶液装至已处理好的DEAE-52纤维素柱中, 分别用0、0.10、0.20、0.30、0.40和0.50 mol/L的NaCl溶液以2.00 mL/min流速进行梯度洗脱, 自动馏分收集器收集洗脱液, 每梯度收集20管, 每管6 min, 采用硫酸-苯酚法隔管检测洗脱液的吸光度。洗脱液进行减压浓缩后放入透析袋中, 每8 h换一次水, 透析72 h。冷冻干燥后得精制烟叶多糖。
1.2.3 烟叶多糖硒化衍生物的制备参照王小莉[10]方法, 稍作修改。准确称取烟叶精制多糖100 mg于三角瓶中, 加入浓度为0.5%的HNO3溶解, 加修饰剂Na2SeO3和催化剂BaCl2进行反应6 h, 调节pH至7-8, 再加入Na2SO4以除去未反应的Ba2+, 将溶液透析至无Se为止, 最后加入4倍体积的无水乙醇得醇沉物, 沉淀冷冻干燥, 得到烟叶多糖硒化衍生物。
1.2.4 红外光谱的测定取少量烟叶精制多糖和烟叶多糖硒化衍生物分别与适量的溴化钾粉末混合, 烘干, 压片, 用傅里叶变换红外光谱仪(FT-IR)进行扫描检测, 扫描区间为500-4 000 cm-1。
1.2.5 硒化烟叶多糖取代度的测定(1) 硒标准曲线的绘制 取1 000 µg/mL标准硒溶液, 分别移取0、0.20、0.40、0.60、0.80、1.00 mL到具塞比色管中, 分别加5.00 mL蒸馏水, 5% EDTA-Na2溶液1.00 mL, 晃动均匀后加入浓度为1.0 mol/L的盐酸溶液调至pH 2-3, 再加入4.00 mL浓度为0.5%的3, 3'-二氨基联苯胺溶液, 晃动均匀后, 放置暗处20 min, 再加入浓度为5%的NaOH溶液调节至中性, 最后加入5.00 mL甲苯震荡2 min, 静置分层, 取甲苯层在420 nm处测吸光度。以硒含量为横坐标, 吸光度为纵坐标绘制标准曲线图。
(2) 硒化烟叶多糖取代度的测定 准确称取50 mg烟叶多糖硒化衍生物于具塞试管中, 加入3.00 mL混酸(V硝酸:V高氯酸=4:1), 盖上表面皿浸泡过夜, 次日加热消解至消化液出现浅棕色, 冷却后加0.50 mL的双氧水, 再加热到出现白烟, 后冷却至室温, 用约10.00 mL蒸馏水冲洗瓶壁, 再加热赶酸至剩余体积为1-2 mL, 再加入6 mol/L混酸, 定容至10.00 mL, 晃动均匀。取2.00 mL溶液按1.2.5.1方法测硒含量, 得其含量为M1。

(1) 样品对·DPPH自由基清除作用 参照冯书珍[11]方法, 稍作修改。分别取浓度为0.10、0.20、0.30、0.40、0.50 mg/mL的样品溶液, 加入·DPPH乙醇溶液2.00 mL晃动均匀。在25℃左右的暗处放置30 min, 用分光光度计在517 nm处测量其吸光度。用蒸馏水取代样品溶液为空白实验, 以无水乙醇代替样品溶液为对照实验, 以不同浓度抗坏血酸作为阳性对照。测试进行3次, 取平均值。按下式进行计算清除率:

式中:A样品为样品的吸光度; A空白为蒸馏水的吸光度; A对照为无水乙醇的吸光度
(2) 样品对·OH自由基清除率的测定 参照郭青枝[12]方法, 稍作修改。分别取浓度为0.10、0.20、0.30、0.40和0.50 mg/mL的样品溶液, 加入FeSO4溶液2.00 mL晃动均匀后再加入水杨酸溶液2.00 mL, 最后加2.00 mL的H2O2溶液, 在37℃反应1 h后, 在波长510 nm测其吸光度, 蒸馏水替代样品溶液为空白实验, 以不同浓度抗坏血酸为阳性对照。进行3次, 取平均值。按下式计算清除率:
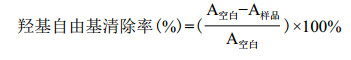
式中:A样品为样品的吸光度; A空白为蒸馏水的吸光度;
(3) 样品对O2-·自由基清除能力 参照周浓[13]及冯书珍[11]方法, 稍作修改。分别取浓度为0.10、0.20、0.30、0.40和0.50 mg/mL的样品溶液2.00 mL, 预热后加入pH为8.2的Tris-HCl缓冲液3.00 mL、0.30 mL邻苯三酚使其均匀后, 25℃反应5 min后加入1.00 mL的HCl终止反应, 在299 nm波长下测定吸光度。蒸馏水替代样品溶液为空白实验, 邻苯三酚代替样品溶液为对照实验, 以不同浓度的抗坏血酸为阳性对照。进行3次, 取平均值。按下式计算清除率:
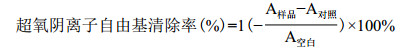
式中:A样品为样品的吸光度; A空白为蒸馏水的吸光度; A对照为邻苯三酚的吸光度
2 结果 2.1 烟叶精制多糖的制备由图 1可知, 当用100 g烟末进行超声辅助提取, 经过脱色、脱蛋白等步骤的精制后, 多糖的洗脱液在管数60-80、80-100中间出现了紫外吸收峰, 说明当利用0.30 mol/L、0.40 mol/L的NaCl溶液洗脱时会在DEAE-52纤维素中洗脱下来两种烟叶多糖组分, 经透析袋透析, 浓缩, 冷冻干燥, 得干燥烟叶精制多糖, 分别记为TPP1和TPP2, 得两种多糖的提取率分别为1.21%和2.54%。
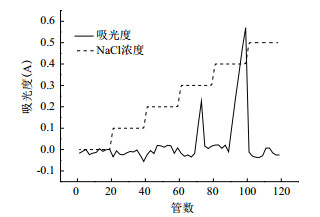
|
| 图 1 烟叶多糖经DEAE-52精制洗脱曲线 |
图 2分别是的TPP1和TPP2的红外光谱图, 从图中可分析推测得出烟叶精制多糖可能的结构特征。其谱图分析如下:两种多糖分别在3 600-3 200 cm-1范围内有特征峰, 说明两种多糖中存在-OH[14]; 两种多糖分别在1 638和1 640 cm-1有强吸收峰是由C=O的伸缩振动引起的[15]; 在1 200-1 430 cm-1范围的吸收峰是由于C-O的伸缩振动和O-H的变角振动引起的[16]; 两个红外图谱中均无1 541 cm-1吸收峰, 说明它们不含有蛋白质[17]。

|
| 图 2 烟叶多糖TPP1和TPP2的红外图谱 |
图 3是多糖硒化后的红外光谱图, 对比图 2可以看到两个图谱分别在在864 cm-1、858 cm-1处出现吸收峰, 由文献[18]对比知识可知为Se=O的吸收峰, 证明形成了硒化多糖。
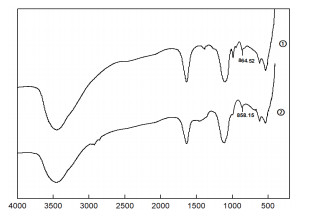
|
| 图 3 烟叶多糖硒化衍生物Se-TPP1和Se-TPP2的红外图谱 |
分光光度法的检测原理是:在微酸性条件下硒元素与3, 3’-二氨基联苯胺络合生成黄色物质, 此黄色络合物在420 nm处有强吸收, 被甲苯等有机溶剂萃取后用分光光度法进行检测。本方法常用来检测水、植物等所含的微量硒元素, 也常被用于检测多糖中的硒。硒标准品浓度与其吸光度的标准曲线见图 4, 带入1.2.5(2)公式测得其两种烟叶多糖硒化衍生物取代度分别为:0.20, 0.24。
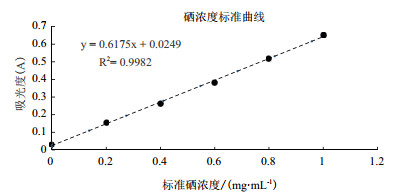
|
| 图 4 硒含量标准曲线 |
烟叶多糖及其硒化衍生物对·DPPH自由基的清除作用变化图(图 5)所示, 所有样品都呈现出一种剂量依赖关系, 并且都表现出随着样品浓度浓度的增加·DPPH自由基清除率提升的情况, 并且在浓度达到0.50 mg/mL时, Se-TPP2的清除率最大达到65.91%。并且在相同浓度下富硒化修饰后的烟叶多糖比烟叶多糖的·DPPH自由基清除能力强, 说明富硒化修饰可以增加烟叶多糖对·DPPH自由基清除率的作用。另外从图中可知, 在浓度为0.50 mg/mL时, Se-TPP1的清除率相比于TPP1的清除率增加了17.41%, Se-TPP2的清除率相比TPP2增加了37.57%, 从2.3可知, TPP1的取代度小于TPP2, 说明取代度越大, 则烟叶多糖经硒化衍生化后的样品·DPPH自由基清除率增加率越大。
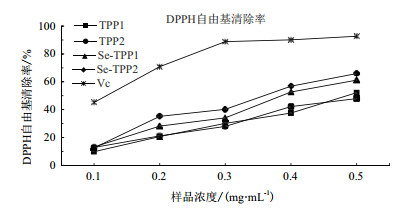
|
| 图 5 烟叶多糖硒化衍生物对·DPPH自由基的清除作用 |
烟叶多糖及其硒化衍生物对·OH自由基的清除作用变化图(图 6)所示, 所有样品都呈现出一种剂量依赖性, 在图中浓度范围内, 都表现出随着样品浓度浓度的增加·OH自由基清除率提升的情况。并且在浓度达到0.50 mg/mL时, Se-TPP2的清除率最大达到60.11%。在相同浓度下富硒化修饰后的烟叶多糖比烟叶多糖的·OH自由基清除能力强, 说明富硒化修饰可以增加烟叶多糖对·OH自由基清除率的作用。另外从图中可知, 在浓度为0.50 mg/mL时, Se-TPP1的清除率相比于TPP1的清除率增加了21.21%, Se-TPP2的清除率相比TPP2增加了25.76%, 从2.3可知, TPP1的取代度小于TPP2, 说明取代度越大, 则烟叶多糖经硒化衍生化后的样品·OH自由基清除率增加率越大。

|
| 图 6 烟叶多糖硒化衍生物对羟基自由基的清除作用 |
烟叶多糖及其硒化衍生物对O2-·自由基的清除作用变化图(图 7)所示, 所有样品都呈现出一种剂量依赖性, 在图中浓度范围内, 都表现出随着样品浓度的增加O2-·自由基清除率提升的情况, 并且在浓度达到0.50 mg/mL时, Se-TPP2的清除率最大达到64.51%。在相同浓度下富硒化修饰后的烟叶多糖比烟叶多糖的O2-·自由基清除能力强, 说明富硒化修饰可以增加烟叶多糖对O2-·自由基清除率的作用。另外从图中可知, 在浓度为0.50 mg/mL时, Se-TPP1的清除率相比于TPP1的清除率增加了27.27%, Se-TPP2的清除率相比TPP2增加了25.11%, 从2.3可知, TPP1的取代度小于TPP2, 说明取代度越大, 则烟叶多糖经硒化衍生化后的样品O2-·自由基清除率增加率越小。
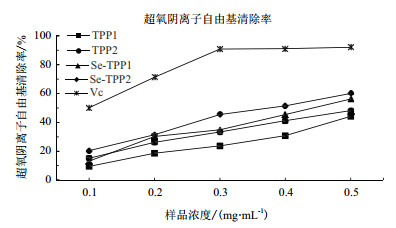
|
| 图 7 烟叶多糖硒化衍生物对超氧阴离子自由基的清除作用 |
本研究采用超声辅助提取, 它的原理是利用超声波的机械波把植物细胞的细胞壁及整个生物体进行破碎, 从而使植物体内的多糖成分释放出去, 溶解到溶剂中达到提取的目的。相比于提取多糖常用的热水浸提、微波提取和酶提取方法, 超声辅助提取的操作简单, 用时较短, 耗费较低, 吴杨洋等[19]通过运用4种方法提取松茸多糖, 通过对比发现, 超声辅助提取的多糖提取率最高, 蛋白质含量最低。
根据多糖的性质不同采用不同的分离方法对多糖进行分离, 因为烟叶多糖中存在着许多不同极性大小的多糖, 在DEAE-52纤维素柱的吸附程度不同, 用不同浓度的盐溶液洗脱下来多糖, 从而达到分离的目的。本研究采用此方法进行多糖分离发现通过0.30、0.40 mol/L的NaCl洗脱时可以得到2种多糖TPP1和TPP2。杨强[20]提取银杏果多糖时, 采用DEAE-52纤维素柱进行洗脱分离时, 得到2种银杏果多糖GBSP1和GBSP2, 武忠伟等[21]提取虫草多糖时, 发现使用DEAE-32纤维桩进行分离时, 可以得到两种分子量相近的多糖, 与本实验结果一致。
多糖生物活性的发挥与其结构有着不可分割的联系, 因此通过对多糖进行修饰能够改变其理化性质(如溶解性、物性等)及其结构, 可以影响多糖的生理活性。本研究对烟叶多糖进行了富硒化修饰, 研究其修饰前后对体外抗氧化活性的影响, 结果表明富硒化修饰后的烟叶多糖的活性大于未修饰的烟叶多糖。陈浒华[22]研究富硒化黄芪多糖体外氧化作用时发现, 富硒化黄芪多糖的清除能力大于为富硒化的, 并且黄芪富硒化多糖杭氧化活力与多糖浓度和硒含量成正相关性, 与本实验结果一致。说明经富硒化修饰后的多糖可以提高原多糖的活性。另外, 两种多糖的硒化取代度不同, 慕星星等[23]通过研究不同取代度蕨麻硒多糖对体外抗氧化活性的影响发现, 随着取代度的增加蕨麻硒多糖对O2-·、·OH和·DPPH自由基的清除能力有明显增加, 与本实验结果基本一致。
4 结论运用超声辅助提取方法对烟叶中的多糖成分进行提取, 经过脱色、脱蛋白处理后, 利用DEAE-52纤维素柱对多糖分离出了2种组分TPP1和TPP2, 对2种多糖组分进行硒衍生化处理, 经红外光谱分析可得硒衍生化成功, 测得取代度分别为0.20, 0.24;后对其进行了体外抗氧化活性实验, 发现经硒衍生化后的烟叶多糖比未修饰的多糖的活性增高, 因此对烟叶中多糖成分进行提取分离后, 再经富硒化衍生化后的多糖可以有效提高其抗氧化活性; 并且取代度大的烟叶多糖硒化衍生物对·DPPH自由基和·OH的清除率的增加率变大, 但对O2-·自由基的清除率增加率变小。
| [1] |
赵瑾, 王超杰. 低次烟叶的综合开发与利用[J]. 烟草科技, 1997(2): 26-27. |
| [2] |
董国忠. 烟草的综合开发利用[J]. 中国畜牧杂志, 1990(6): 61-64. |
| [3] |
刘启顺, 陈玮, 巩凤芹, 等. 硒化魔芋葡甘寡糖的合成及其抗氧化活性[J]. 食品科学, 2018, 11(8): 1-8. |
| [4] |
王磊, 杜菲, 孙卉, 等. 人体硒代谢与硒营养研究进展[J]. 生物技术进展, 2015, 5(4): 285-290. DOI:10.3969/j.issn.2095-2341.2015.04.06 |
| [5] |
田友清, 丁平, 张云庆. 烟草药用研究概述[J]. 中国药业, 2015, 24(9): 126-128. |
| [6] |
陈浒华.黄芪多糖的硒化修饰及其体外抗氧化作用的研究[D].南京: 南京农业大学, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10307-1012272043.htm
|
| [7] |
宓鹤鸣, 位华, 柳正良. 烟草的本草考证及药用研究进展[J]. 药学实践杂志, 2005(6): 321-325. DOI:10.3969/j.issn.1006-0111.2005.06.001 |
| [8] |
饶国华, 赵谋明, 等. 低次烟叶蛋白质提取工艺研究[J]. 西北农林科技大学学报:自然科学版, 2005(11): 67-72. |
| [9] |
杨琛琛.不同类型烟叶多糖的提取、结构及其性质研究[D].郑州: 郑州轻工业学院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10462-1014340991.htm
|
| [10] |
王小莉.香加皮多糖提取纯化及其在烟草中的保润增香效应研究[D].郑州: 河南农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10466-1018272026.htm
|
| [11] |
冯书珍, 等. 海藻多糖的单糖组成对体外抗氧化活性的影响[J]. 天然产物研究与开发, 2019, 31(1): 116-121, 169. |
| [12] |
郭青枝, 赵二劳, 白建华. 沙棘叶提取物抗氧化性能研究[J]. 化学与生物工程, 2008(3): 58-59. DOI:10.3969/j.issn.1672-5425.2008.03.016 |
| [13] |
周浓, 刘亚, 解万翠, 等. 牛蒡多糖提取工艺及其体外抗氧化活性的研究[J]. 食品研究与开发, 2015, 36(16): 44-48. DOI:10.3969/j.issn.1005-6521.2015.16.011 |
| [14] |
Chawananorasest K, Saengtongdee P, Kaemchantuek P. Extraction and characterization of Tamarind(Tamarind indica L.)seed polysaccharides(TSP)from three difference sources[J]. Molecules, 2016, 21(6): 775-784. DOI:10.3390/molecules21060775 |
| [15] |
袁洁, 王磊, 等. 红花多糖超声提取的条件优化及其红外光谱分析[J]. 食品安全质量检测学报, 2019, 10(2): 351-357. DOI:10.3969/j.issn.2095-0381.2019.02.012 |
| [16] |
Pu JB, Xia BH, Hu YJ, et al. Multi-optimization of ultrasonic-assisted enzymatic extraction of atratylodes macrocephala polysaccharides and antioxidants using response surface methodology and desirability function approach[J]. Molecules, 2015, 20(12): 22220-22235. DOI:10.3390/molecules201219837 |
| [17] |
Zhang F, Lin Li H, Xie JH. A mini-review of chemical and biolo-gical properties of polysaccharides from Momordica charantia[J]. International Journal of Biological Macromolecules, 2016, 92: 246-253. DOI:10.1016/j.ijbiomac.2016.06.101 |
| [18] |
Zhu ZY, Liu F, Gao H, et al. Characterization and antitumor activity of a polysaccharide from Sarcodia ceylonensis[J]. Molecules, 2014, 19(8): 10863-10876. DOI:10.3390/molecules190810863 |
| [19] |
吴杨洋, 田淑雨, 鹿士峰, 等. 不同提取方法对松茸多糖理化性质及抗氧化活性的影响[J]. 食品安全质量检测学报, 2018, 9(19): 5164-5170. DOI:10.3969/j.issn.2095-0381.2018.19.026 |
| [20] |
杨强.银杏果多糖的提取分离及功能特性研究[D].沈阳: 沈阳农业大学, 2013.
|
| [21] |
武忠伟, 刘明久, 窦艳萍, 等. 虫草多糖醇沉和DEAE-32纤维素柱层析特性研究[J]. 食品科学, 2008(2): 86-90. DOI:10.3321/j.issn:1002-6630.2008.02.012 |
| [22] |
陈浒华.黄芪多糖的硒化修饰及其体外抗氧化作用的研究[D].南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012272043.htm
|
| [23] |
慕星星, 石继鹏, 王铖博, 等. 不同取代度蕨麻硒多糖的制备、表征及体外抗氧化活性[J]. 食品工业科技, 2019(1): 1-16. |




