油茶(Camellia oleifera Abel.)隶属山茶科(Theaceae), 是富含油脂且具有栽培价值的一类山茶属植物[1], 为我国食用四大木本油料作物之首, 与油橄榄、油棕、椰子齐名, 具有较高的经济生态效益[2], 素有“绿色金库”和“铁杆庄稼”之称[3]。中国是油茶的原产地也是主产地, 栽培历史悠久, 主要种植于南方地区, 尤以江西、湖南和广西等省居多, 面积约400万hm2, 仅少量分布在日本、越南和马来西亚等国家[4]。油茶药用历史可追溯到公元前三世纪, 民间常采摘其果实榨油以供食用滋补, 油茶籽油(茶油)营养丰富, 其不饱和脂肪酸含量高达90%, 且含有角鲨烯、植物甾醇、维生素、类黄酮及茶多酚等多种次生代谢活性产物, 易被人体消化和吸收, 医食兼备。现代科学研究表明, 长期食用茶油可以预防心脑血管疾病、延缓动脉粥样硬化、促进肠胃吸收、提高免疫力以及调理人体内分泌系统, 同时对高血压、肥胖症等有明显疗效, 被誉为“东方橄榄油”和“油中软黄金”, 现收载于《中国医药宝典》[5]。
迄今为止, 油茶的主要研究多集中于花粉萌发、良种选育、苗木嫁接、组织培养和遗传多样性等方面, 而其药理成分和生物活性等相关研究还比较薄弱, 尤其是海南油茶, 目前关于该栽培种的研究报道较少, 致使其产业发展一直处于相对落后的阶段。经调查统计, 海南岛油茶种植面积约6万亩, 该省为油茶资源分布的最南端, 地处亚热带区域, 琼州海峡使之与大陆隔离, 气候条件较为特殊, 在环境因素和遗传特性的双重控制下, 海南油茶表型变异丰富[6], 故而其茶油品质可能也会不同于其他地区。因此, 本研究以海南油茶与大陆优良品系油茶为样本, 经压榨工艺得到茶油, 采用气相色谱-质谱联用(GC-MS)、高效液相色谱(HPLC)技术对其脂肪酸和活性成分的组成及相对含量进行检测分析, 然后通过DPPH自由基(DPPH·)清除法、ABTS自由基(ABTS·)清除法、羟基自由基(OH·)清除法和FRAP还原法研究茶油提取物的抗氧化能力, 并比较不同种油茶间品质差异性, 旨在对日后油茶种质资源收集保存、优良品系筛选以及生产工艺优化等奠定基础, 并为茶油药用价值评价提供科学理论参考依据, 同时深入了解海南油茶的品质特征、稳定性及可控性, 可为促进海南油茶产业的发展作出贡献[7]。
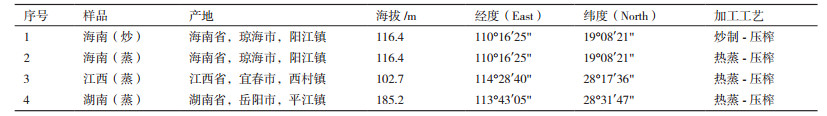
1 材料与方法 1.1 材料 1.1.1 植物样品供试油茶待蒴果微裂时分别采摘自海南、江西和湖南3省, 参照当地榨油方式统一进行处理。同时采用热蒸-压榨工艺(大陆地区)和炒制-压榨工艺(海南地区)进行处理得到不同的茶油用于比较分析, 样品来源及加工工艺见表 1。
1, 1-二苯基-2-2苦基肼(DPPH, 美国Sigma公司); 2, 2-联氮-二(3-乙基-苯并噻唑-1-6-磺酸)二铵盐(ABTS, 日本东京化成工业株式会社); 多酚类物质标准品(纯度>99%)均购自成都瑞芬思生物科技有限公司; 2, 4, 6-三吡啶基三嗪购自上海麦克林试剂有限公司; 甲醇、乙睛均为色谱纯, 购自广州化学试剂厂; 其他试剂均为国产分析纯。
1.1.3 仪器气相色谱-质谱联用仪(Agilent 7890B-7000B, 美国Agilent公司); 高效液相色谱仪(Waters e2695, 美国Waters公司); 电子分析天平(AS.R, 波兰Radwag公司); 数显恒温水浴锅(HH-4A, 常州金坛精达仪器制造有限公司); 旋转蒸发仪(Precision MLG6, 德国Heidolph公司); 紫外可见分光光度计(UV-2100, 上海尤尼柯仪器有限公司); 超声波清洗器(KQ5200E, 昆山超声仪器有限公司); 涡旋振荡器(SI-T25, 美国Scientific Industries公司); 烘箱(DHG-9123A, 上海一恒仪器有限公司); 高速冷冻离心机(TGL.16S, 四川蜀科仪器有限公司)等。
1.2 方法 1.2.1 茶油脂肪酸及其他化学成分GC-MS检测(1) 茶油样品的制备:样品脂肪酸甲酯化处理参考GB/T 17376-2008。样品其他化学成分检测预处理:精确称取不同种油样各10 mg, 加入适量的无水Na2SO4进行干燥, 12 000 r/min室温离心5 min, 吸取上清液至10 mL容量瓶中, 并用正己烷溶液定容至刻度, 摇匀。取1 mL样品制备液于进样瓶中, 经0.45 µm滤膜过滤, 待GC-MS检测。(2)气相色谱条件:Agilent 7890B-7000B气相色谱质谱仪, 配备HP-5MS弹性石英毛细管柱(0.25 mm×30 mm, 0.25 μm), 检测室温度保持250℃, 柱温以6℃/min从60℃升至270℃, 载气为高纯氦气(99.995%), 柱前压7.62 psi, 流量1.00 mL/min, 进样量1.00 µL, 不分流。(3)质谱条件:离子源(EI)温度230℃, 四极杆温度150℃, 发射电流34.60 µA, 电离电压70 eV, 倍增器电压2000 V, 质量范围50-450 amu[8]。(4)化合物鉴定及数据处理:在HPMSD化学工作站, 通过NIST2005标准质谱图库和WILEY275质谱图库对化合物进行鉴定, 并采用色谱峰面积归一化法计算其相对含量[9]。
1.2.2 茶油提取物中酚类化合物的HPLC检测(1) 茶油样品预处理:准确称取茶油3.00 g, 并加入9.00 mL 50%甲醇溶液, 超声震荡30 min, 然后在4000 r/min条件下离心15 min, 吸取上清液, 此步骤重复3次, 合并上清液, 45℃减压浓缩; 再用等体积正己烷萃取3次, 合并下层提取液, 45℃减压浓缩; 最后用50%甲醇提取液溶解残液, 室温保存备用。(2)标准溶液制备:精密称取多酚标准品(没食子酸、儿茶素、表儿茶素、3, 4-二羟基苯乙酸、槲皮素及山茶甙), 以甲醇为溶剂配制标准储备液, 封口, 冷藏避光保存, 检测前用流动相对标准溶液进行稀释, 过滤待上机[10]。(3)色谱条件:Waters e2695高效液相色谱仪, 配备Thermo C18分析型色谱柱(250 mm×4.60 mm, 5.00 µm); 柱温30℃, 流速1.00 mL/min, 进样量10 µL, 检测波长280 nm。流动相A为甲醇, 流动相B为0.5%乙酸溶液, 线性梯度洗脱程序为:0-10 min, 90% A; 10-18 min, 80% A; 18-28 min, 70% A; 28-36 min, 65% A; 36-42 min, 35% A; 42-49 min, 0% A和49-56 min, 90% A。
1.2.3 茶油提取物对DPPH·清除能力的测定参照Zantar等[11]所描述的方法, 取不同质量浓度的待测样品液1.00 mL于7支盛有3.00 mL DPPH溶液的离心管中, 使总体积为4.00 mL, 涡旋振荡充分混匀后, 室温下避光反应30 min, 通过紫外分光光度计用1.00 cm石英比色皿检测吸光值(517 nm), 以提取剂代替样品作为空白对照, 每个浓度样品重复测定3次, 取平均值, 清除率计算公式如下:
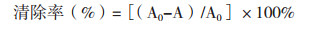
式中, A0表示空白对照的吸光值, A表示样品液的吸光值。
1.2.4 茶油提取物对ABTS·清除能力的测定略微改进Cai等[12]的实验方法, 将2.45 mmol/L过硫酸钾溶液与7.00 mmol/L ABTS储备液等量混匀, 在室温避光条件下静置12-16 h, 即ABTS工作液。使用时稀释该混合溶液, 使之OD734达到0.70 ± 0.02, 为ABTS测定液。将其与样品待测液按3:1的比例充分混匀, 室温下避光放置30 min后, 在734 nm波长下进行检测, 以提取剂代替样品作为空白对照, 平行测定3次, 按清除率公式进行计算。
1.2.5 茶油提取物对OH·清除能力的测定采用水杨酸法[13]来测定茶油提取物的OH·清除率, 取不同体积待测样品液于离心管中, 用去离子水补足至5.00 mL, 再依次加入0.05 mL 0.02 mol/L FeSO4溶液、0.10 mL 0.01 mol/L水杨酸溶液和0.05 mL 0.02 mol/L双氧水溶液, 将混合溶液放置在37℃水浴锅保温30 min后, 立即在510 nm波长处测得吸光值。空白对照为去离子水, 每组样品测定3次, 按清除率公式进行计算。
1.2.6 茶油提取物FRAP还原能力的测定参考Moghaddam等[14]的研究方法, 用去离子水将不同体积的待测样品液补足至2.00 mL, 再与3.00 mL FRAP工作液混合均匀, 于37℃恒温保持30 min, 立即检测吸光值(593 nm)。重复测定3次, 结果取平均值, 根据FRAP还原能力标准曲线计算样品FRAP值。
1.2.7 统计学处理每组样品平行测定3次, 通过SPSS软件进行单因素方差分析和LSD显著性检验, P < 0.05有统计学意义, 数据以“平均值±标准差”表示。
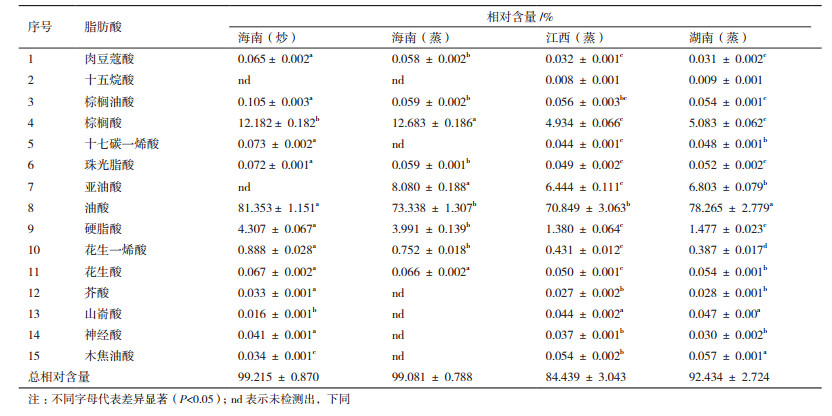
2 结果 2.1 茶油脂肪酸及其他化学成分含量 2.1.1 茶油脂肪酸含量4种茶油脂肪酸成分及相对含量见表 2, 各茶油样品间脂肪酸比例有所不同, 但主要组成成分基本无差异, 油酸均为含量最高的不饱和脂肪酸, 其次为亚油酸, 含量范围分别在70.849%-81.353%和0%-8.080%, 其中, 海南(炒)茶油中油酸含量显著高于江西(蒸)茶油; 亚油酸在海南(蒸)茶油中含量最高, 而该成分在海南(炒)茶油中却未检测出。棕榈酸和硬脂酸在饱和脂肪酸中占主要地位, 含量范围分别为4.934%-12.683%和1.380%-4.307%, 海南(蒸)茶油和海南(炒)茶油中棕榈酸和硬脂酸含量均显著高于江西(蒸)茶油。本实验所有供试材料中芥酸含量都较低, 且海南(蒸)茶油中尚未检测到该成分。
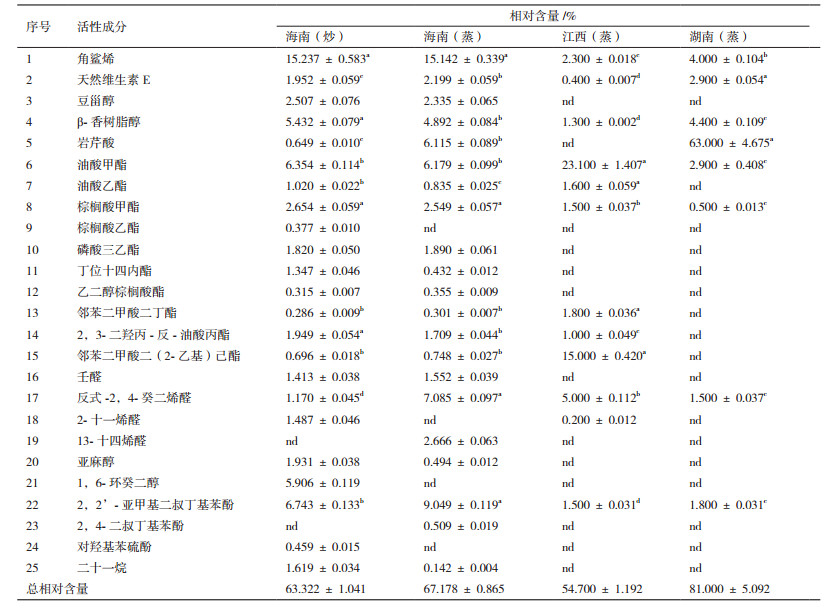
4种茶油化学成分组成及相对含量见表 3, 结果表明, 角鲨烯(2.300%-15.237%), 维生素E(0.400%-2.900%), 豆甾醇(0%-2.507%)和β-香树脂醇(1.300%-5.432%)为茶油的主要活性成分, 其中, 海南(炒)茶油和海南(蒸)茶油中角鲨烯和β-香树脂醇的含量显著高于江西(蒸)茶油; 维生素E在湖南(蒸)茶油中含量最高, 约为江西(蒸)茶油的7倍; 豆甾醇仅在海南(蒸)茶油和海南(炒)茶油中检测出, 可推测海南的气候条件有利于这4种重要活性成分的生物合成。湖南(蒸)茶油中岩芹酸的含量较高, 可达63.000%, 而江西(蒸)茶油中却未检测出, 且海南(蒸)茶油和海南(炒)茶油中该成分含量差异较为显著。
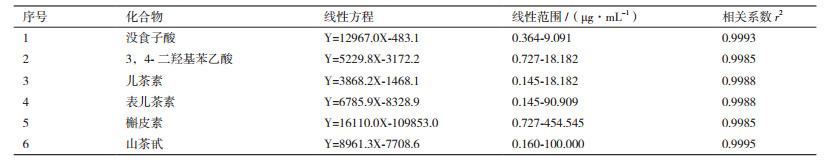
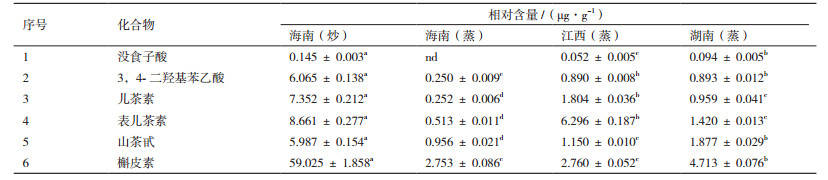
酚类物质混合标准品HPLC色谱图见图 1, 6种酚类化合物线性方程及其相对含量见表 4和5。结果可知, 4种茶油提取物中没食子酸含量均较少, 且在海南(蒸)茶油中未检测出该成分; 海南(炒)茶油提取物中3, 4-二羟基苯乙酸和儿茶素含量分别高达6.065 µg/g和7.352 µg/g, 而这两种成分含量在海南(蒸)茶油中却相对较低; 海南(炒)茶油提取物中的表儿茶素(8.661 µg/g)含量显著高于海南(蒸)茶油和湖南(蒸)茶油; 此外, 海南(炒)茶油提取物中的山茶甙(5.987 µg/g)含量也是供试茶油中最高的; 海南(炒)茶油提取物中槲皮素含量(59.025 µg/g)约为海南(蒸)茶油和江西(蒸)茶油的20倍, 差异显著。
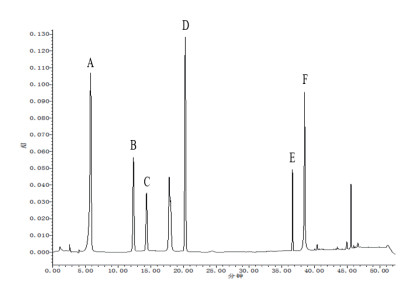
|
| 图 1 (A) 没食子酸、(B)3, 4-二羟基苯乙酸、(C)儿茶素、(D)表儿茶素、(E)山茶甙和(F)槲皮素标准品的HPLC色谱图 |
由图 2可知, 随着样品提取液浓度的减少, DPPH·清除能力也在逐步减弱, 说明二者存在剂量依赖关系。其中当提取液体积为2.50 mL时, 海南(炒)茶油提取物的自由基清除率高达98.223%, 其次是湖南(蒸)茶油, 同体积条件下其清除率为71.170%。当样品溶液稀释至30 mL时, 海南(蒸)茶油、江西(蒸)茶油和湖南(蒸)茶油提取物对DPPH·的清除率已经分别降至23.793%、17.193%和22.281%, 但是海南(炒)茶油仍为58.517%, 由此说明, 相比其他3种茶油, 海南(炒)茶油具有更强的DPPH·清除能力。
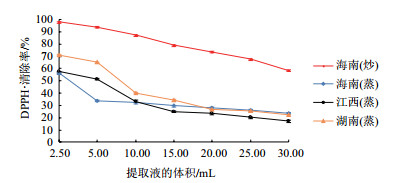
|
| 图 2 茶油提取物对DPPH·的清除能力 |
4种茶油提取物均具有一定程度的ABTS·清除活性, 且其能力随浓度改变而发生变化(图 3)。其中海南(炒)茶油、江西(蒸)茶油和湖南(蒸)茶油提取物的自由基清除活性均较强, 当提取液体积为20 mL时, 湖南(蒸)茶油提取物对ABTS·清除率为55.472%, 约是同等稀释倍数条件下海南(蒸)茶油的12倍。当样品溶液稀释至25 mL时, 海南(蒸)茶油提取物不具备ABTS·清除能力, 而其他3种茶油提取物的ABTS·清除率仍可达20%左右。
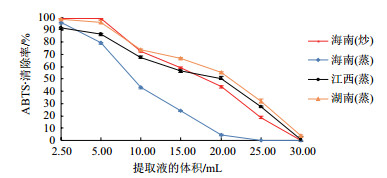
|
| 图 3 茶油提取物对ABTS·的清除能力 |
由图 4可以看出, 在反应体系中, 当茶油提取液体积在0-0.10 mL范围内时, 其OH·清除能力的量效关系增加明显, 而在0.10-0.70 mL内趋于饱和。4种茶油提取物的自由基清除能力存在较大差异(P > 0.05), 其中最强的是海南(炒)茶油, 然后依次是江西(蒸)茶油、海南(蒸)茶油及湖南(蒸)茶油。当加入的样品溶液体积为0.10 mL时, 海南(炒)茶油提取物OH·清除率为37.152%, 显著高于湖南(蒸)茶油(8.333%)。
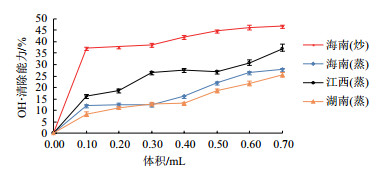
|
| 图 4 茶油对OH·的清除能力 |
如图 5所示, 样品溶液体积在0-0.25 mL范围内, 茶油提取物的还原能力增加较为迅速, 而在大于0.25 mL时有所缓慢。其中海南(炒)茶油提取物的还原能力在测试范围内显著强于其他3种茶油, 当反应体系中提取液为0.25 mL时, 其FeSO4浓度可达31.181 µm/L, 而湖南(蒸)茶油、江西(蒸)茶油、海南(蒸)茶油分别仅为9.476 µm/L、5.463 µm/L和2.980 µm/L。当加入的样品溶液为1.00 mL时, 海南(炒)茶油提取物的还原能力(47.175 µm/L)是海南(蒸)茶油的近6倍, 差异显著。
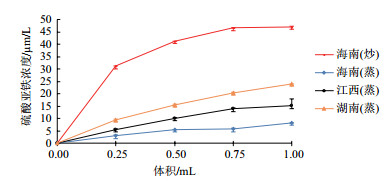
|
| 图 5 茶油提取物的总还原能力 |
茶油被誉为“油中之王”, 深度探究其功能品质和药理价值, 已成为当今研究的一个热点[15]。茶油脂肪酸组成较为丰富, 且易于吸收, 其中, 油酸是人体必需的单不饱和脂肪酸, 其含量是评价食用油质量的重要标准; 亚油酸等多不饱和脂肪酸有助于调节人体中枢神经系统, 同时还具有消炎、抗癌等功效[16-17]; 棕榈酸和硬脂酸等重要饱和脂肪酸可有效减弱粥状动脉硬化的发病率[5]。本实验供试样品中, 海南(炒)茶油油酸含量(81.353%)显著高于海南(蒸)茶油, 而亚油酸在海南(蒸)茶油中含量最高(8.080%), 该成分在海南(炒)茶油中却未检测到, 可推测二者含量与茶油加工工艺存在一定相关性。Wei等[18]研究表明茶油提取工艺是影响其不饱和脂肪酸含量的重要因素, 与本实验结果相一致。此外, 海南(蒸)茶油的棕榈酸和硬脂酸含量均显著高于江西(蒸)茶油, 但却与海南(炒)茶油差异较小, 推测该脂肪酸含量可能会随着地域气候条件的不同而产生差异, 由此可将饱和脂肪酸含量作为鉴别油茶籽产地的参考指标[19]。郑小非等[20]通过实验发现, 采用不同方法所制备的茶油之间硬脂酸含量差异并不显著, 本试验结论得到进一步验证。4种茶油样品的饱和脂肪酸、单不饱和脂肪酸及多不饱和脂肪酸组成比例均与橄榄油(15:75:1)相接近[21], 因而被国际粮农组织推荐为绿色食用油。
科学研究表明, 维生素E和角鲨烯有助于调节人体新陈代谢[22-23]; 谷甾醇对于前列腺肥大等疾病具有一定疗效[24]; 茶多酚则是一种天然抗氧化剂[25], 因此, 这些活性物质也可作为评价植物油品质的重要特征指标[26]。本研究中两种海南茶油的角鲨烯、豆甾醇、维生素E及β-香树脂醇含量均显著高于江西(蒸)茶油和湖南(蒸)茶油, 推测海南气候条件可能有助于这些次生代谢产物的生物合成, 这与Wei等[18]的结论基本相一致。角鲨烯含量在海南(炒)茶油和海南(蒸)茶油中差异不显著, 可推测加工工艺并不是影响该物质含量的重要因素, 这与杨辉等[27]的实验结论不一致。此外, 海南(炒)茶油提取物中表儿茶素含量约为海南(蒸)茶油的17倍, 槲皮素含量为海南(蒸)茶油的近20倍, 差异显著, 由此推测酚类物质含量可能会随着茶油加工工艺的不同而产生差异, 这与Moghaddam等[14]的研究结论相一致。廖义秀[10]发现不同品种茶油中酚类物质存在较大差异, 海南(炒)茶油提取物中多酚含量显著高于其他品种茶油, 归因于海南岛独特的自然条件, 其所产茶油具有更高的药用价值。
现代医学认为, 呼吸作用、阳光辐射及空气污染等因素会在人体体内生成自由基, 而过量自由基会引起衰老或导致癌症的发生[28], 但目前生物合成的自由基清除剂都存在一定毒副作用[29-30], 因此, 需从植物资源中开发天然的抗氧化药物[31]。本试验4种茶油提取物均具有不同程度的抗氧化活性, 且量效关系明显, 其中海南(炒)茶油提取物的DPPH·清除能力显著强于其他3种茶油; 海南(蒸)茶油提取物对ABTS·的清除能力是4种茶油中最弱的, 当样品提取液体积稀释至20.00 mL时, 其清除率仅为4.558%;当反应体系中茶油溶液体积小于0.10 mL时, 其OH·清除能力具有较强的剂量依赖性, 而在0.10-0.70 mL范围内趋于饱和, 且不同样品间存在较大差异; 海南(炒)茶油提取物的还原能力显著强于海南(蒸)茶油, 推测加工工艺可能是影响其抗氧化能力的关键因素。
分析以上结果, 我们还发现植物所含有的次生代谢产物与其抗氧化功能之间存在一定相关性, 且这些活性物质可能会随着植物品种、产区环境、栽培方式、采收时间及加工工艺等条件的不同而产生差异[32-33]。Zhang等[34]认为油茶蒲提取物中总多酚含量会直接影响其总还原能力; Rosa等[25]研究发现DPPH·清除作用与没食子酸含量呈正相关, 而OH·清除能力受鞣花酸含量影响较大。故推测多酚类成分可能是茶油中较为重要的抗氧化活性物质, 且各成分之间协同或拮抗作用也可能会对自由基清除能力产生一定的影响。因此, 对抗氧化机理进行深入研究, 可为天然活性物质的挖掘、合成及结构修饰等提供理论依据[35]。
4 结论综上所述, 本试验中的4种茶油提取物均具有一定程度的自由基清除能力与还原能力, 故而该植物可作为潜在抗氧化剂的天然来源, 此外, 不同产地油茶加工后的产品(茶油)营养活性成分含量丰富, 尤其是海南油茶, 其所产茶油富含不饱和脂肪酸, 且儿茶素、表儿茶素、槲皮素、山茶甙等重要酚类化合物及角鲨烯、β-谷甾醇、维生素E等次生代谢产物含量也显著高于其他茶油, 抗氧化功能也是所有供试材料中最强的, 说明此栽培种具有较高的选优潜在经济价值, 可作为除普通油茶外的重要食用油资源, 若加以开发利用和宣传推广, 将有利于促进海南油茶产业发展, 并为我国高产优质适种油茶筛选培育提供参考依据。
| [1] |
Long QZ, Huang YH, Zhong HY, et al. The quality and volatile-profile changes of camellia oil(Camellia oleifera Abel)following bleaching[J]. European Journal of Lipid Science & Technology, 2010, 110(8): 768-775. |
| [2] |
Wang ZW, Jiang C, Wen Q, et al. Deep sequencing of the Camellia chekiangoleosa transcriptome revealed candidate genes for anthocyanin biosynthesis[J]. Gene, 2014, 538(1): 1-7. DOI:10.1016/j.gene.2014.01.035 |
| [3] |
赵丽.油茶枯中抑菌物质的提取及其抑菌活性研究[D].广东: 仲恺农业工程学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-11347-1015331789.htm
|
| [4] |
Zhang S, Li XZ. Inhibition of α-glucosidase by polysaccharides from the fruit hull of Camellia oleifera Abel[J]. Carbohydrate Polymers, 2015, 115: 38-43. DOI:10.1016/j.carbpol.2014.08.059 |
| [5] |
Feás X, Estevinho ML, Salinero C, et al. Triacylglyceride, antioxidant and antimicrobial features of virgin Camellia oleifera, C. reticulata and C. sasanqua oils[J]. Molecules, 2013, 18(4): 4573-4587. DOI:10.3390/molecules18044573 |
| [6] |
袁军, 韩志强, 贺舍予, 等. 海南省油茶资源主要形态和经济性状及聚类分析[J]. 植物遗传资源学报, 2014, 15(6): 1380-1384. |
| [7] |
李丽, 吴雪辉, 寇巧花. 茶油的研究现状及应用前景[J]. 中国油脂, 2010, 35(3): 10-13. |
| [8] |
苏伟, 母雨, 齐琦, 等. 黑糯米酒及黑糯米保健酒品质分析[J]. 中国酿造, 2018, 37(12): 186-191. |
| [9] |
Adams R. Identification of essential oil components by Gas Chromatography/Quadrupole Mass Spectroscopy[M]. USA: Allured Publishing Corp, 2001.
|
| [10] |
廖义秀.茶油多酚分析及其抗氧化稳定性研究[D].长沙: 中南林业科技大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10538-1013214352.htm
|
| [11] |
Zantar S, Haouzi R, Chabbi M, et al. Effect of gamma irradiation on chemical composition, antimicrobial and antioxidant activities of Thymus vulgaris and Mentha pulegium essential oils[J]. Radiation Physics and Chemistry, 2015, 115: 6-11. DOI:10.1016/j.radphyschem.2015.05.019 |
| [12] |
Cai YZ, Luo Q, Sun M, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences, 2004, 74(17): 2157-2184. DOI:10.1016/j.lfs.2003.09.047 |
| [13] |
韦练, 郭力, 陈佳江, 等. 3, 5-二硝基水杨酸法测定石斛多糖含量的研究[J]. 时珍国医国药, 2013, 24(6): 1330-1332. DOI:10.3969/j.issn.1008-0805.2013.06.019 |
| [14] |
Moghaddam M, Miran SNK, Pirbalouti AG, et al. Variation in essential oil composition and antioxidant activity of cumin(Cuminum cyminum L.)fruits during stages of maturity[J]. Industrial Crops and Products, 2015, 70: 163-169. DOI:10.1016/j.indcrop.2015.03.031 |
| [15] |
Chen JM, Yang XQ, Huang XM, et al. Leaf transcriptome analysis of a subtropical evergreen broadleaf plant, wild oil-tea camellia(Camellia oleifera), revealing candidate genes for cold acclimation[J]. BMC Genomics, 2017, 18(1): 211. DOI:10.1186/s12864-017-3570-4 |
| [16] |
Lešić T, Pleadin J, Krešić G, et al. Chemical and fatty acid composition of cow and sheep milk cheeses in a lamb skin sack[J]. Journal of Food Composition and Analysis, 2016, 46: 70-77. DOI:10.1016/j.jfca.2015.11.007 |
| [17] |
Bork CS, Baker EJ, Lundbye-Christensen S, et al. Lowering the linoleic acid to alpha-linoleic acid ratio decreases the production of inflammatory mediators by cultured human endothelial cells[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2019, 141: 1-8. DOI:10.1016/j.plefa.2018.12.001 |
| [18] |
Wei J, Chen L, Qiu XY, et al. Optimizing refining temperatures to reduce the loss of essential fatty acids and bioactive compounds in tea seed oil[J]. Food and Bioproducts Processing, 2015, 94: 136-146. DOI:10.1016/j.fbp.2015.02.003 |
| [19] |
杨克玉, 高宏旗. 不同产地不同级别山茶籽油理化性质及脂肪酸组成比较研究[J]. 轻工科技, 2017(6): 6-7. |
| [20] |
郑小非, 万绍平, 万光, 等. 微波辐照前处理水代法工艺提取原生山茶油的试验研究[J]. 江西林业科技, 2011(5): 29-34. DOI:10.3969/j.issn.1006-2505.2011.05.011 |
| [21] |
徐雪峰, 闫浩, 张玉, 等. 油茶籽中三个主要成分的提取及其活性研究进展[J]. 包装与食品机械, 2018, 36(4): 49-53. DOI:10.3969/j.issn.1005-1295.2018.04.011 |
| [22] |
Idris CAC, Karupaiah T, Sundram K, et al. Oil palm phenolics and vitamin E reduce atherosclerosis in rabbits[J]. Journal of Functional Foods, 2014, 7: 541-550. DOI:10.1016/j.jff.2014.01.002 |
| [23] |
Fernández-Cuesta A, León L, Velasco L, et al. Changes in squalene and sterols associated with olive maturation[J]. Food Research International, 2013, 54: 1885-1889. DOI:10.1016/j.foodres.2013.07.049 |
| [24] |
Ferreetti G, Bacchetti T, Masciangelo S, et al. Effect of phytosterols on copper lipid peroxidation of human low-density lipoproteins[J]. Nutrition, 2010, 26(3): 296-304. DOI:10.1016/j.nut.2009.04.015 |
| [25] |
Rosa LADL, Alvarez-Parrilla E, Shahidi F. Phenolic compounds and antioxidant activity of kernels and shells of Mexican pecan(Carya illinoinensis)[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 152-162. |
| [26] |
聂明, 杨水平, 姚小华, 等. 不同加工方式对油茶籽油理化性质及营养成分的影响[J]. 林业科学研究, 2010, 23(2): 165-169. |
| [27] |
杨辉, 赵曼丽, 范亚苇, 等. 不同提取方法所得茶油的品质比较[J]. 食品工业科技, 2012, 33(11): 267-269, 274. |
| [28] |
Alam MN, Bristi NJ, Rafiquzzaman M. Review on in vivo and in vitro methods evaluation of antioxidant activity[J]. Saudi Pharmaceutical Journal, 2013, 21(2): 143-152. DOI:10.1016/j.jsps.2012.05.002 |
| [29] |
Li YF, Ouyang SH, Chang YQ, et al. A comparative analysis of chemical compositions in Camellia sinensis var. puanensis Kurihara, a novel Chinese tea, by HPLC and UFLC-Q-TOF-MS/MS[J]. Food Chemistry, 2017, 216: 282-288. DOI:10.1016/j.foodchem.2016.08.017 |
| [30] |
Carocho M, Ferreira ICFR. A review on antioxidants, prooxidants and related controversy:Natural and synthetic compounds, screening and analysis methodologies and future perspectives[J]. Food and Chemical Toxicology, 2013, 51: 15-25. DOI:10.1016/j.fct.2012.09.021 |
| [31] |
Wang T, Xi MQ, Guo QS, et al. Chemical components and antioxidant activity of volatile oil of a Compositae tea(Coreopsis tinctoria Nutt.)from Mt. Kunlun[J]. Industrial Crops and Products, 2015, 67: 318-323. DOI:10.1016/j.indcrop.2015.01.043 |
| [32] |
Dong HM, Zhang Q, Li L, et al. Antioxidant activity and chemical compositions of essential oil and ethanol extract of Chuanminshen violaceum[J]. Industrial Crops and Products, 2015, 76(6): 290-297. |
| [33] |
高伟, 何小三, 孙颖, 等. 不同采收方式对油茶油脂含量的影响[J]. 经济林研究, 2013(4): 177-181. DOI:10.3969/j.issn.1003-8981.2013.04.032 |
| [34] |
Zhang LL, Wang YM, Wu DM, et al. Comparisons of antioxidant activity and total phenolics of Camellia oleifera Abel. fruit hull from different regions of China[J]. Journal of Medicinal Plants Research, 2010, 4(14): 1407-1413. |
| [35] |
刘子金, 杨小波, 苏凡, 等. 七种藤黄科植物树皮抗氧化性及游离型总多酚、总黄酮含量的测定[J]. 分子植物育种, 2016(12): 3536-3543. |