2. 贵州理工学院食品药品制造工程学院, 贵阳 550003
2. College of Food and Pharmaceutical Engineering, Guizhou Institute of Technology, Guiyang 550003
镉(Cadmium, Cd)的生物半衰期长, 即使是低浓度Cd, 对人体也会造成潜在的威胁, 我国农业土壤Cd位点超标率达7%, Cd已成为我国土壤重金属污染中的首要污染物[1]。Cd胁迫导致植物体内活性氧(Reactive oxygen species, ROS)含量上升, 破坏叶绿体结构、抑制碳固定酶活性, 并通过影响蛋白酶活性而导致细胞代谢紊乱等[2-3]。另外, 抑制营养元素吸收而导致植株生长受限[4], 同时还能通过食物链危害人体健康[5]。因此, 研究缓解或解除植物中Cd毒害的措施及其机理, 是当前国内外研究的热点问题。
S是植物体内合成半胱氨酸(Cysteine, Cys)、甲硫氨酸(Methionine, Met)、还原型谷胱甘肽(Glutathione, GSH)、植物螯合素(Phytochelins, PCs)、金属硫蛋白(Metallothioneins, MTs)等硫代谢物的基本元素, 而这些物质对提升植物Cd耐受起着关键作用[6]。研究表明, Cys可通过其自身的抗氧化特性调节植物体内氧化还原水平以缓解盐胁迫诱导的大麦生长抑制[7]。充分的硫肥可保证充足的GSH供应, 以缓解因盐胁迫诱导的氧化胁迫对植物光合效率和生长的影响[8]。同时, 植物对S的吸收和同化可促进蛋白源和非蛋白源硫醇的合成, 从而提升植物对Cd的耐受性[9]。添加外源S可以提升Cd胁迫下植物体内GSH的合成, 降低ROS的积累, 减少ROS对植物叶片基质蛋白和类囊体蛋白的攻击, 调节气孔运动, 从而增强植物的光合能力[6]; 提升PCs、MTs的合成, 并与Cd结合形成螯合物, 降低Cd毒性[10-11]。
乙烯是一种气态植物激素, 在逆境胁迫下调控植物的光合作用与生长具有重要作用[12]。乙烯与S代谢互作可促进植物对各种非生物逆境胁迫的耐受性。如添加外源GSH可促进拟南芥体内乙烯的合成, 以提升植物砷耐受能力[13]; 乙烯处理可显著提升植物体内GSH含量, 以应对盐胁迫[14]; 乙烯与N或S互作, 可以促进盐胁迫下油菜的光合作用[15]。因此, 乙烯信号途径在调节植物逆境胁迫下的光合作用具有重要作用。马齿苋是一种具有清热利湿、解毒消肿、消炎、止渴、利尿作用的药用材料, 嫩茎叶可作蔬菜食用或者饲料加工, 营养价值较高。马齿苋对Cd具有一定的吸附和耐受能力[16], 但对其中的机理尚待研究。
本研究以野生马齿苋为试材, 探讨Cd胁迫下外源S与乙烯对马齿苋光合作用、氧化还原水平、内源S含量、葡萄糖含量等的影响, 同时, 施用乙烯活性抑制剂NBD, 以揭示乙烯信号途径在S诱导植物Cd耐受过程中的作用机制, 从而为乙烯和硫作为潜在的农业土壤Cd污染矫正剂奠定理论基础。
1 材料与方法 1.1 材料供试马齿苋种子购自江苏长景种业有限公司(荷兰进口)。将马齿苋种子于35℃水浴浸种处理12 h, 播于装有沙子的育苗盒中, 置于人工气候培养箱(LRH-800-GS, 天津市福元铭仪器设备有限公司)中栽种。培养箱条件:14 h白天/10 h黑夜, 昼夜温度为30℃/25℃, 相对湿度75%, 光强设置为500 µmol/(m2·s)。前期每天用自来水浇水一次, 生长1周后改用1/2 Hoagland营养液的营养液(pH6.0)浇水, 浇水量以使沙子充分湿润为准。待马齿苋幼苗长至10 cm左右时, 选择长势良好和长势一致的植株进行试验处理。
试验设置6个处理(表 1)。每个处理8盆, 每盆种植15株。胁迫处理15 d后进行指标参数测定, 每个指标测定生物学重复3次, 取平均值。
收集胁迫处理后的马齿苋叶片与根, 称取鲜重, 测量长度后, 110℃杀青1h、70℃恒温干燥、称重。干样用HNO3-HClO4(4:1 V/V)消煮(160℃)至澄清, 定容以后, 利用原子吸收分光光度计测定各组织中的Cd含量。
1.2.2 H2O2与组织硫代巴比妥酸反应物(TBARS)含量测定根据Okuda等[17]方法进行H2O2提取与含量测定。参考张志良等[18]方法测定MDA含量。
1.2.3 ATP硫酸化酶(ATP-S)、谷胱甘肽还原酶(GR)活性以及S含量测定称取1.0 g新鲜马齿苋叶片于预冷的研钵中, 加入4倍体积预冷的提取液(10 mmol/L Na2EDTA、20 mmol/L Tris-HCl(pH8.0)、2 mmol/L DTT和0.01 g/mL PVP), 于冰上研磨至匀浆, 4℃、13 400 r/min离心10 min。取上清液, 参照Khan等[19]方法测定ATP-S和GR活性。
叶片S含量测定:称取鲜重, 杀青、干燥、称重。干样用HNO3-60%HClO4(85:1, V/V)消煮(160℃)至澄清, 定容以后, 利用原子吸收分光光度计测定S含量。
1.2.4 半胱氨酸(Cys)、甲硫氨酸(Met)、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)含量测定Cys含量测定:参考Giatonde[20]方法。
Met含量测定:称取0.5 g新鲜马齿苋叶片浸于20 mL 6.0g/L的HCl溶液中, 20-24 h以后加入1.0 g的活性炭, 水浴蒸发得浓缩液, 并过滤。向滤液中依次添加0.1 mL硝普钠、2.0 mL的3%甘氨酸溶液、4.0 mL去离子水和2.0 mL 5 g/L NaOH。再添加4.0 mL磷酸溶液, 混匀, 并于450 nm处读取吸光值, 并计算Met含量[21]。
GSH与GSSG含量测定:称取0.5 g马齿苋新鲜叶片于预冷的研钵中, 加入10 mL 5%磺基水杨酸, 然后研磨成匀浆, 4℃、9 500 r/min离心10 min。量取2.0 mL上清液于离心管中, 加入2.4 mL磷酸缓冲液(0.1 mol/L, pH7.0)和160 µL 2-硫代硝基苯甲酸(5, 5'-Dithiobis-(2-nitrobenzoic acid), DTNB)。混匀, 室温静置2 min后, 在412 nm处测定其吸光值, 得GSH含量。GSSG含量则在上述反应液中添加100 µL 2-乙烯吡啶, 相同条件测得吸光值, 得GSSG含量。GSH与GSSG含量的比值即为氧化还原水平[22]。
1.2.5 葡萄糖含量测定参照Krishnaveni等[23]方法测定葡萄糖的含量。
1.2.6 氨基环丙烷羧酸合成酶(ACS)活性、乙烯含量测定利用植物氨基环丙烷羧酸合成酶(ACC)ELISA试剂盒(购自苏州江莱酶联免疫研究所)、IL8910植物乙烯(Ethylene)含量比色法定量检测试剂盒(购自上海真奥生物科技有限公司)分别测定马齿苋叶片中氨基环丙烷羧酸合成酶(ACS)活性和乙烯含量, 操作步骤详见对应的说明书。
1.2.7 光合速率、气孔导度、胞间二氧化碳浓度、蒸腾速率、Rubisco酶活性测定利用LI-6400XT便携式光合测定仪测定不同处理下马齿苋叶片的光合速率、蒸腾速率、气孔导度、胞间二氧化碳浓度, 使用人工光源, 光强为1 000 μmol/(m2·s)。
Rubisco酶活性测定:称取1.0 g新鲜叶片于4℃预冷的研钵中, 加入10 mL预冷的提取液(0.25 mol/L Tris-HCl(pH 7.8)、0.05 mol/L MgCl2、0.0025 mol/L EDTA和1% Dithiothreitol(DTT)), 研磨至匀浆。4℃、9 500 r/min离心10 min, 上清液即为含有Rubisco酶的粗提液。参考Usuda[24]的方法测定粗提液中Rubisco酶活性。
1.2.8 数据统计所得数据以平均值±标准差(n=3)表示。采用SPSS 18.0对试验数据进行统计分析, 各处理间数据采用方差分析(One way ANOVA), 利用最小显著差(LSD)法检验差异显著性(P≤0.05), 采用Microsoft Excel 2007作图。
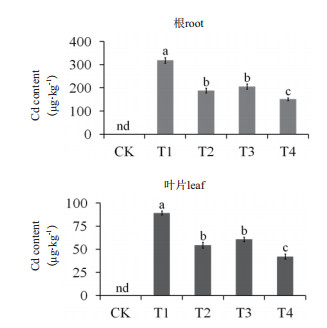
2 结果 2.1 乙烯和S对马齿苋Cd吸收的影响Cd胁迫处理以后, 马齿苋叶片与根中的Cd含量迅速上升, 添加外源S(T2)或乙烯(T3)可使根Cd含量分别下降40.89%和35.52%, 而S+乙烯处理(T4), 则可使根Cd含量降低52.53%;添加外源S(T2)和乙烯(T3)可使马齿苋叶片Cd含量分别下降38.99%和31.99%, S+乙烯处理则使叶片Cd含量下降52.75%(图 1)。结果表明, 外源S和乙烯对降低马齿苋植株中的Cd含量具有协同效应。
|
| 不同小写字母代表各组数据之间在P≤0.05水平差异显著。下同 图 1 外源S和乙烯对Cd胁迫处理后马齿苋叶片与根Cd含量的影响(nd=no data) |
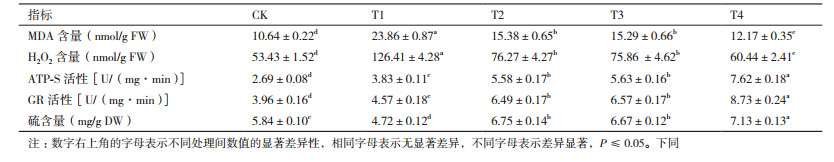
由表 2可知, Cd胁迫可使马齿苋叶片的H2O2和MDA含量迅速上升, 而添加外源S(T2)或者乙烯(T3)均可使马齿苋叶片中的H2O2含量相对Cd处理降低约40%, MDA含量则均下降约35%, 当共同添加S和乙烯(T4)时, 可使H2O2与MDA含量均降低约50%。结果表明, 外源S和乙烯均可通过降低H2O2含量, 减轻Cd胁迫导致马齿苋的膜脂质过氧化程度, 且共同添加时, 两者对解Cd毒具有协同效应。
在Cd胁迫后, 马齿苋叶片ATP-S、GR酶活性比对照分别上升了42.38%和15.40%, 而S含量则下降了19.18%;Cd胁迫下, 添加外源S(T2)则可使ATP-S、GR酶活性和S含量比对照分别提升2.07、1.64和1.16倍; 添加外源乙烯(T3)则比对照分别提升2.09、1.66和1.14倍; 同时添加S和乙烯(T4)则比对照分别提升2.83、2.20和1.22倍(表 2)。
Cd胁迫可显著提高马齿苋叶片Cys和Met含量, 外源S(T2)或乙烯(T3)对Cys和Met含量的影响相近, 可使其含量比对照分别提高约1.4倍和2.1倍, 而同时添加S和乙烯(T4), 则分别提高2.22倍和2.72倍(图 2-A和图 2-B)。

|
| 图 2 外源S和乙烯对Cd胁迫下马齿苋叶片中Cys(A)、Met(B)、GSH(C)、氧化还原水平(D)的影响 |
Cd胁迫处理(T1)与对照(CK)相比, 可提升马齿苋叶片GSH含量约26.67%, 外源S(T2)或者乙烯(T3)均可使GSH含量比对照增加约80%, 同时添加S和乙烯(T4)则增加约1.2倍(图 2-C)。
逆境胁迫条件下, GSH与GSSG的比值表示为植株的氧化还原水平(Redox state)。结果显示, Cd胁迫下马齿苋叶片的氧化还原水平与对照相比下降约3倍, 添加外源S(T2)和乙烯(T3)对马齿苋叶片氧化还原水平的影响效果相近, 均为Cd处理(T1)的3.9倍, 而同时添加S和乙烯后的马齿苋叶片氧化还原水平是Cd处理的4.55倍(图 2-D)。
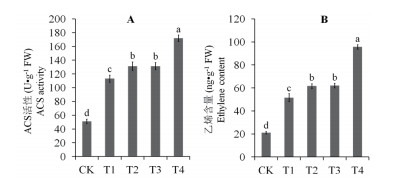
2.4 ACS活性与乙烯含量的变化Cd胁迫下, 马齿苋叶片ACS活性和乙烯含量与对照相比显著升高, 其中ACS活性提升1.21倍, 乙烯含量则提升1.43倍。添加外源S(T2)或者乙烯(T3), ACS活性较Cd处理均上升约16%, 乙烯产量则均上升约20%。同时添加外源S和乙烯(T4), 则可使ACS活性与乙烯产量分别上升51.84%和85.74%(图 3)。
|
| 图 3 外源S和乙烯对Cd胁迫马齿苋叶片ACS活性(A)与乙烯产量(B)的影响 |
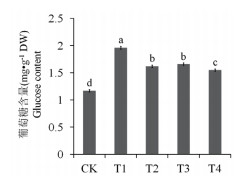
与对照相比, Cd胁迫(T1)可提升马齿苋叶片中葡萄糖含量约67.52%, 外源S(T2)或乙烯(T3)可使葡萄糖含量比Cd处理(T1)分别降低20.99%和18.07%, 同时添加S和乙烯(T4)则可使葡萄糖含量下降26.45%(图 4)。
|
| 图 4 外源S和乙烯对Cd胁迫下马齿苋叶片葡萄糖含量的影响 |
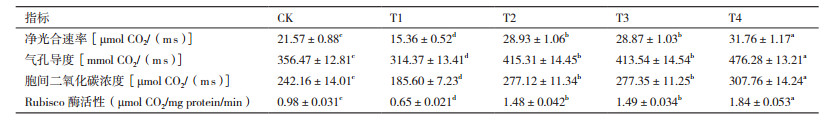
与对照相比, Cd胁迫处理可导致净光合速率、气孔导度、胞间二氧化碳浓度、Rubisco酶活性与对照相比显著降低。在Cd胁迫环境中, 添加外源S或乙烯, 均可使马齿苋叶片光合作用参数与Rubisco酶活性显著增加, 且提升效果一致。同时添加S和乙烯(T4)可使净光合速率、气孔导度、胞间二氧化碳浓度、Rubisco酶活性分别增加47.24%、33.61%、27.09%和87.76%(表 3)。
为进一步验证乙烯在S介导马齿苋Cd耐受性过程中的作用, 利用乙烯专一性活性抑制剂NBD, 研究其对Cys、Met、GSH、乙烯、Rubisco酶活性、光合速率以及干重的影响。
由图 5可知, Cd处理导致马齿苋叶片Cys、Met、GSH、乙烯含量上升, 添加外源S和乙烯(T4)可以进一步提升马齿苋叶片Cys、Met, GSH与乙烯含量。然而, 在添加NBD(T5)以后, 马齿苋叶片的Cys、Met、GSH含量迅速下降, 但仍高于Cd处理后水平, 乙烯含量则下降至对照水平以下(图 5)。结果表明, 添加NBD可导致乙烯活性和含量降低, 继而降低马齿苋叶片Cys、Met、GSH含量。

|
| 图 5 外源NBD对Cd胁迫下马齿苋叶片Cys、Met、GSH与乙烯含量的影响 |
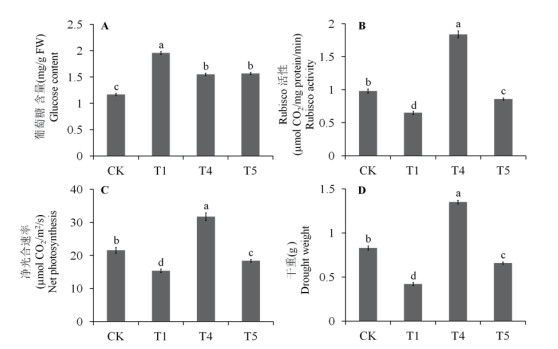
图 6结果表明, 马齿苋叶片Rubisco酶活性、光合速率、干重在Cd胁迫(T1)下显著降低, 而葡萄糖含量上升。Cd胁迫处理, 同时添加外源S和乙烯(T4), 可诱导马齿苋Rubisco酶活性、光合速率、干重显著上升, 且高于对照水平; 而葡萄糖含量相对Cd处理则急剧下降, 但仍然高于对照水平。NBD处理(T5)则可使Rubisco酶活性、光合速率、干重降低至对照水平以下, 但仍高于Cd胁迫水平; 葡萄糖含量相对Cd处理降低, 但仍高于对照水平, 与Cd胁迫下同时添加S和乙烯处理(T4)的含量水平相当(图 6)。结果表明, 乙烯活性和含量的降低, 导致外源S诱导的马齿苋叶片光合作用、Rubisco酶活性和生长的促进作用受到抑制。
|
| 图 6 外源NBD对Cd胁迫下马齿苋叶片葡萄糖含量、Rubisco酶活性、净光合速率和干重的影响 |
综上所述, 推测外源乙烯可以通过增强马齿苋体内乙烯信号途径和S同化吸收, 提升Cys、Met、GSH等硫代谢物的合成量, 提高马齿苋Cd耐受能力; 同时, 降低葡萄糖含量, 以缓解葡萄糖诱导的光合抑制效应, 从而Cd胁迫下马齿苋光合作用, 促进马齿苋在Cd胁迫环境中的生长, 缓解Cd胁迫对马齿苋造成的毒害作用。
3 讨论S是植物生长代谢必须的六大元素之一。研究表明, 植物体内的硫同化过程与植物响应Cd胁迫紧密相关, Cd胁迫下植物的S吸收增强, 提升Cys、Met、GSH等代谢物的合成量, 以应对Cd胁迫环境[25]。乙烯是高等植物体内的一种重要气体激素, 调控植物种子、根、叶、花、果实等发育过程, 可通过调节植物的碳代谢、糖代谢、激素代谢和蛋白质代谢等, 参与植物的逆境胁迫过程[12]。ACS是乙烯合成过程中的关键酶, 它的激活可以促进乙烯的合成, 从而促进植物抵御干旱、高盐、重金属等逆境胁迫[26]。
前人研究表明, 乙烯和硫的互作, 可有效降低植物对重金属Cd的吸收, 并抑制Cd诱导的氧化胁迫, 以缓解Cd对油菜、芥菜等植物的毒害[19]。本研究亦发现, 外源S和乙烯可以有效降低Cd胁迫下马齿苋叶片与根中的Cd含量, 同时H2O2与MDA含量显著下降。有研究表明添加外源硫化物可以与Cd形成难溶性稳定化合物CdS而不被植物吸收[27]。同时, 外源S可以促进水稻根细胞表面铁胶膜(Iron plaque)的形成, 并限制水稻对Cd的吸收[28]。因而, 外源S和乙烯处理后的马齿苋叶片与根中Cd含量降低, 可能与CdS和铁胶膜的形成有关。
GSH是植物体内重要的硫醇类化合物, 可以与ROS直接进行氧化还原反应而加以清除, 同时参与抗氧化剂抗坏血酸(AsA)的形成, 从而组成AsA-GSH循环(AsA-GSH), 以维持逆境胁迫下植物ROS水平的稳定[29-31]。Cys和Met是GSH合成必须的前体物质, GSSG是GSH的氧化态, 因而高水平的Cys、Met和氧化还原态(GSH/GSSG值), 对基于AsA-GSH循环的ROS清除系统的功能稳定发挥具有重要作用[6-7]。本研究中, 外源S和乙烯可以促进马齿苋叶片中Cys、Met、GSH和氧化还原态水平, 与这些硫代谢物相关的ATP-S和GR活性显著上升, 同时体内总S含量显著上升, 以满足这些硫醇化合物合成之需, 从而有效降低马齿苋叶片中ROS(H2O2)和脂质过氧化产物MDA含量, 这与Khan等[19]研究结果一致。
已有研究表明, 植物体内高水平葡萄糖可抑制叶片Rubisco酶活性, 从而影响植物光合作用[32]。Cd胁迫可诱导芥菜型油菜体内葡萄糖含量上升, 导致Rubisco酶活性降低和光合抑制现象[33]。本研究亦发现Cd胁迫可导致马齿苋叶片葡萄糖含量上升, 而Rubisco酶活性降低, 光合速率下降。添加外源S和乙烯, 均可使马齿苋叶片葡萄糖含量降低, 从而提升Rubisco酶活性和光合作用。与此同时, 发现添加外源S和乙烯可以促进马齿苋叶片乙烯合成关键酶ACS活性, 并提升了乙烯含量。Iqbal等[34]研究发现, 外源乙烯处理, 可以提升不同N营养水平下的芥菜体内乙烯含量, 降低葡萄糖含量, 从而促进芥菜Rubisco酶活性、气孔导度、胞间二氧化碳浓度、光合作用和生长发育。而缺乏乙烯受体的烟草品种, 叶片Rubisco酶活性和光合作用均受到显著影响[32]。
综上所述, 外源S和乙烯是通过诱导的植物体内乙烯信号途径参与调节葡萄糖和硫醇化合物(Cys、Met、GSH等)合成, 从而提升马齿苋叶片ROS清除能力和光合作用, 以促进马齿苋在Cd胁迫环境中的生长。
为验证上述推论的可靠性, 我们研究了乙烯活性专一性抑制剂NBD对Cd胁迫下马齿苋生长的影响。结果表明, 添加NBD(T5)以后的马齿苋叶片Cys、Met、GSH和乙烯含量与T4(同时添加S和乙烯)相比, 显著降低。同时, NBD处理导致葡萄糖含量上升, Rubisco酶活性下降, 净光合速率降低和叶片干重减小。结果证实了外源S和乙烯是通过植物体内乙烯信号途径內源硫醇物质和葡萄糖的合成, 增强SCd胁迫下植物耐光合能力。
4 结论外源S和乙烯诱导马齿苋Cd胁迫耐性的可能机理为:(1)降低植株对Cd的吸收; (2)通过提升马齿苋体内乙烯含量, 增强乙烯信号途径, 增强S同化吸收, 提升Cys、GSH等硫醇物质的含量, 从而减少活性氧的产生, 降低膜脂质过氧化程度。(3)通过降低Cd胁迫诱导的葡萄糖含量, 缓解葡萄糖诱导的植物光合抑制作用。乙烯活性抑制剂NBD的应用进一步验证了外源S和乙烯可以通过乙烯信号途径, 调节植物体内硫醇物质和葡萄糖合成, 缓解Cd胁迫对植物造成的毒害。
| [1] |
Wang WZ, Xu WH, Zhou K, et al. Research progressing of present contamination of Cd in soil and restoration method[J]. Wuhan University Journal of Natural Science, 2015(5): 430-444. |
| [2] |
Kováčik J, Babula P, Klejdus B, et al. Comparison of oxidative stress in four Tillandsia species exposed to cadmium[J]. Plant Physiology & Biochemistry, 2014, 80: 33-40. |
| [3] |
Choppala G, Ullah S, Bolan N, et al. Cellular mechanisms in higher plants governing tolerance to cadmium toxicity[J]. Critical Reviews in Plant Sciences, 2014, 33(5): 374-391. DOI:10.1080/07352689.2014.903747 |
| [4] |
Rizwan M, Ali S, Adrees M, et al. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 2017, 182(5): 90-105. |
| [5] |
Chaney RL. How does contamination of rice soils with Cd and Zn cause high incidence of human Cd disease in subsistence rice farmers[J]. Current Pollution Reports, 2015, 1(1): 13-22. DOI:10.1007/s40726-015-0002-4 |
| [6] |
Anjum NA, Umar S, Gill SS, et al. Sulfur assimilation and cadmium tolerance in plants[M]// Khan NA, Singh S, Umar S Sulfur Assimilation and Abiotic Stress in Plants. Berlin:Springer-Verlag, 2008:271-302.
|
| [7] |
Genisel M, Erdal S, Kizilkaya M. The mitigating effect of cysteine on growth inhibition in salt-stressed barley seeds is related to its own reducing capacity rather than its effects on antioxidant system[J]. Plant Growth Regulation, 2015, 75(1): 187-197. DOI:10.1007/s10725-014-9943-7 |
| [8] |
Astolfi S, Zuchi S. Adequate S supply protects barley plants from adverse effects of salinity stress by increasing thiol contents[J]. Acta Physiologiae Plantarum, 2013, 35(1): 175-181. DOI:10.1007/s11738-012-1060-5 |
| [9] |
Lancilli C, Giacomini B, Lucchini G, et al. Cadmium exposure and sulfate limitation reveal differences in the transcriptional control of three sulfate transporter(Sultr1;2)genes in Brassica juncea[J]. BMC Plant Biology, 2014, 14(1): 132. DOI:10.1186/1471-2229-14-132 |
| [10] |
Lou L, Kang J, Pang H, et al. Sulfur protects pakchoi(Brassica chinensis L.)seedlings against cadmium stress by regulating ascorbate-glutathione metabolism[J]. International Journal of Molecular Sciences, 2017, 18(8): 1628. DOI:10.3390/ijms18081628 |
| [11] |
Liang T, Ding H, Wang G, et al. Sulfur decreases cadmium translocation and enhances cadmium tolerance by promoting sulfur assimilation and glutathione metabolism in Brassica chinensis L.[J]. Ecotoxicology & Environmental Safety, 2016, 124: 129-137. |
| [12] |
Wang F, Cui X, Sun Y, et al. Ethylene signaling and regulation in plant growth and stress responses[J]. Plant Cell Reports, 2013, 32(7): 1099-1109. DOI:10.1007/s00299-013-1421-6 |
| [13] |
Fu SF, Chen PY, Nguyen QTT, et al. Transcriptome profiling of genes and pathways associated with arsenic toxicity and tolerance in Arabidopsis[J]. BMC Plant Biology, 2014, 14(1): 94. DOI:10.1186/1471-2229-14-94 |
| [14] |
Guan C, Ji J, Wu D, et al. The glutathione synthesis may be regulated by cadmium-induced endogenous ethylene in Lycium chinense, and overexpression of an ethylene responsive transcription factor gene enhances tolerance to cadmium stress in tobacco[J]. Molecular Breeding, 2015, 35(5): 1-13. |
| [15] |
Nazar R, Khan MI, Iqbal N, et al. Involvement of ethylene in reversal of salt-inhibited photosynthesis by sulfur in mustard[J]. Physiologia Plantarum, 2014, 152(2): 331-344. DOI:10.1111/ppl.12173 |
| [16] |
陈艳.不同苋菜品种对重金属累积差异和机制初探[D].广州: 暨南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10559-1013027826.htm
|
| [17] |
Okuda T, Matsuda Y, Yamanaka A, et al. Abrupt increase in the level of hydrogen peroxide in leaves of winter wheat is caused by cold treatment[J]. Plant Physiology, 1991, 97(3): 1265-1267. DOI:10.1104/pp.97.3.1265 |
| [18] |
张志良, 瞿伟菁. 植物生理学实验指导[M]. 第3版. 北京: 高等教育出版社, 2003.
|
| [19] |
Khan NA, Asgher M, Per TS, et al. Ethylene potentiates sulfur-mediated reversal of cadmium inhibited photosynthetic responses in mustard[J]. Front Plant Sci, 2016, 7(94): 1628. |
| [20] |
Gaitonde MK. A spectrophotometric method for the direct determination of cysteine in the presence of other naturally occurring amino acids[J]. Biochemical Journal, 1967, 104(2): 627-633. DOI:10.1042/bj1040627 |
| [21] |
Horn JM, Jones DB, Blum AE. Colorimetric determination of methionine in protein and foods[J]. Journal of Biological Chemistry, 1946, 166(1): 313-320. |
| [22] |
Anderson ME. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods Enzymol, 1985, 113(4): 548-555. |
| [23] |
Krishnaveni S, Balasubramanian T, Sadasivam S. Sugar distribution in sweet stalk sorghum[J]. Food Chemistry, 1984, 15(3): 229-232. |
| [24] |
Usuda H. The activation state of ribulose 1, 5-bisphosphate carboxylase in maize leaves in dark and light[J]. Plant and Cell Physiology, 1985, 26(8): 1455-1463. |
| [25] |
Muhammad JH, Wang ZQ, Zhang GP. Sulfur alleviates growth inhibition and oxidative stress caused by cadmium toxicity in rice[J]. Journal of Plant Nutrition, 2005, 28(10): 1785-1800. DOI:10.1080/01904160500251092 |
| [26] |
Achard P, Harberd NP. Integration of plant responses to environmentally activated phytohormonal signals[J]. Science, 2006, 311(5757): 91-94. DOI:10.1126/science.1118642 |
| [27] |
冯源. 重金属铅离子和镉离子在水环境中的行为研究[J]. 环境与发展, 2013, 29(3): 87-93. DOI:10.3969/j.issn.1007-0370.2013.03.030 |
| [28] |
Cao ZZ, Qin ML, Lin XY, et al. Sulfur supply reduces cadmium uptake and translocation in rice grains(Oryza sativa L.)by enhancing iron plaque formation, cadmium chelation and vacuolar sequestration[J]. Environmental Pollution, 2018, 238: 76-84. DOI:10.1016/j.envpol.2018.02.083 |
| [29] |
Lou L, Kang J, Pang H, et al. Sulfur protects pakchoi(Brassica chinensis L.)seedlings against cadmium stress by regulating ascorbate-glutathione metabolism[J]. International Journal of Molecular Sciences, 2017, 18(8): 1628. DOI:10.3390/ijms18081628 |
| [30] |
杨卫东, 李廷强, 丁哲利, 等. 旱柳幼苗抗坏血酸-谷胱甘肽循环及谷胱甘肽代谢对镉胁迫的响应[J]. 浙江大学学报:农业与生命科学版, 2014, 40(5): 551-558. |
| [31] |
Liang T, Ding H, Wang G, et al. Sulfur decreases cadmium translocation and enhances cadmium tolerance by promoting sulfur assimilation and glutathione metabolism in Brassica chinensis L.[J]. Ecotoxicology & Environmental Safety, 2016, 124: 129-137. |
| [32] |
Tholen D, Pons TL, Voesenek LA, et al. Ethylene insensitivity results in down-regulation of rubisco expression and photosynthetic capacity in tobacco[J]. Plant Physiology, 2007, 144(3): 1305-1318. DOI:10.1104/pp.107.099762 |
| [33] |
Masood A, Iqbal N, Khan MIR, et al. The coordinated role of ethylene and glucose in sulfur-mediated protection of photosynthetic inhibition by cadmium[J]. Plant Signal Behav, 2012, 7(11): 1420-1422. DOI:10.4161/psb.22079 |
| [34] |
Iqbal N, Nazar R, Syeed S, et al. Exogenously-sourced ethylene increases stomatal conductance, photosynthesis, and growth under optimal and deficient nitrogen fertilization in mustard[J]. J Exp Bot, 2011, 62(14): 4955-4963. DOI:10.1093/jxb/err204 |