牛皮杜鹃(Rhododendron chrysanthum Pall.)也称为牛皮茶, 属于杜鹃花科, 主要生长在中国长白山海拔1 000-2 506 m的岳桦林下和高山苔原带[1], 是长白山珍贵的优势种群之一[2]。长白山气候恶劣, 太阳辐射值高, 短波长光强烈, 生长在高山环境中的牛皮杜鹃长期适应并进化, 形成了独特的生理生化适应机制以抵御高寒、干旱和强辐射等逆境伤害[3]。运用蛋白质组学对牛皮杜鹃的抗寒机理研究发现, 在光合作用能量传递和蛋白质合成上表现出显著差异[4]。
近年来, 由于氟氯烃等化合物排放的增加导致大气臭氧减少, 到达地表的UV-B辐射增强[4]。UV-B辐射是长白山的主要环境胁迫因子, 不仅可以调节植物的生理过程, 也会作为胁迫信号导致植物细胞的损伤和过氧反应[5]。因此, 寻找一种能够缓解UV-B胁迫对植物伤害的方法非常重要。
祁虹等[6]发现增强UV-B辐射后, 植物叶片叶绿体膜系统会受到活性氧自由基的损伤, PSII活性受抑制, 同化物的合成减少, 抑制CO2的固定, 最终导致光合作用减弱。袁孟玲等[7]发现, 芒果成年树可通过提高SOD、POD、CAT活性以及总黄酮和多酚等物质的积累来抵御UV-B辐射造成的氧化损伤。刘晓等[8]认为, 外源茉莉酸通过提高抗氧化酶活性, 花青素含量等缓解膜损伤, 以及增大植物光合天线系统体积缓解UV-B辐射对光合器官的伤害。目前, 以茉莉酸(JA)为代表的茉莉酸类物质(JAs)被认为是植物面临生物与非生物胁迫中产生防御反应的重要信号分子[9]。Wasternack[10]研究发现茉莉酸类物质能诱导芦丁、花青素等黄酮类物质的表达, 来抵抗植物UV-B胁迫。Conconi等[11]指出, 植物对UV-B辐射的防御需要JAs信号途径的参与。但关于外源茉莉酸能够缓解UV-B辐射对植物伤害的研究仍然屈指可数。本试验为进一步研究长白山牛皮杜鹃抗紫外线胁迫的特性提供了参考。
1 材料与方法 1.1 材料牛皮杜鹃收集于中国北方长白山附近(40.10 N, 100.10 E)。运送到实验室后, 将植物保存在模拟高山环境的智能人工气候室中培养[14/10 h光周期; 18/16℃(白天/夜晚); 光子通量密度50 μmol/(m2·s)]。
1.2 方法 1.2.1 实验设计选择具有相同生长状态的牛皮杜鹃组培苗作为研究材料, 以预施加茉莉酸(50 μmol/L)的1/4MS培养基预培养牛皮杜鹃4 d作为实验组, 以1/4MS培养基培养的牛皮杜鹃作为对照组。将实验组和对照组分别在PAR和UV-B下辐射48 h。采用混合采样策略消除个体之间的差异, 本研究中进行3次生物学重复。PAR照射处理是将400 nm的滤光片(Edmund; Filter Long 2IN SQ, USA)置于培养瓶上。UV-B辐射处理是将295 nm的滤光片(Edmund; Filter Long 2IN SQ, USA)置于培养瓶上。其中PAR光源由暖白色T5x14W荧光灯(Philips, 荷兰)提供。人工UV-B辐射的来源是Ultraviolet-B TL 20W / 01RS荧光管(Philips, 荷兰)提供。样品有效接收的辐照度为UV-B:2.3 W·/m2, PAR:μmol光子/(m2·s)。
1.2.2 叶绿素荧光测定及相关参数计算利用IMAGING-PAM叶绿素荧光成像系统(Heinz Walz, 德国)对其进行叶绿素荧光参数的测定, 在相同叶龄的叶片上选取3个观测点, 暗适应20 min后对初始荧光(Fo), 最大荧光(Fm)和(Fm')以及最小荧光(Fo')进行测定并对以下参数进行计算, 同时对qP、NPQ和ETR快速光响应曲线进行测定。
光系统Ⅱ(PSⅡ)的最大量子产量[Fv/Fm=(Fm-Fo)/Fm]、
光系统Ⅱ(PSⅡ)的有效量子产量[Fv'/ Fm'=(Fm'-Fo')/ Fm']、
光系统Ⅱ(PSⅡ)的潜在活性[Fv/Fo=(Fm-Fo)/Fo]、
光化学淬灭系数[qP=(Fm'-Fs)/(Fm'-Fo')]、
非光化学淬灭系数[NPQ=(Fm-Fm')/Fm']。
1.2.3 抗氧化酶、NADPH氧化酶和丙二醛的测定将0.3 g新鲜叶片在液氮中研磨并用100 mmol/L磷酸钾缓冲液(pH 7.0-7.4)提取。根据Bradford[12]方法用牛血清白蛋白(BSA)作为标准测定蛋白质浓度。使用相应的试剂盒(南京建成生物工程研究所, 南京, 中国)测量CAT, T-SOD和NADPH氧化酶和MDA的活性。
1.2.4 花青素的测定花青素用分光光度法测定。将10 mg新鲜叶片在3.6 mL甲醇:HCl(99:1)中组成细胞匀浆, 室温下黑暗中提取72 h, 在546 nm处读取提取物的吸光度以测定花色素苷, 以叶鲜重为基础表示吸光度。
1.2.5 统计分析使用SPSS 16.0(NY, USA)进行单因子方差分析, 在结果中, 使用小写字母来标识显著差异。使用Sigmaplot 12.5绘制图表, (Systa software inc芝加哥, 伊利诺伊州, 美国)。
2 结果 2.1 外源茉莉酸对UV-B辐射下牛皮杜鹃叶绿素荧光特征的影响 2.1.1 叶绿素荧光动力学的变化图 1为不同处理下牛皮杜鹃叶片PSII模式中的Fo图像与Fm图像。表 1中, Fo为初始荧光, 不同处理后变化相对稳定。Fm为最大荧光, Fv/Fm为PSII最大光化学效率, Fv'/Fm'为PSII有效光化学效率, Fv/Fo为PSII潜在活性, 与PAR组相比UV-B辐射后分别降低20.08%、9.8%、14.26%、18.78%。表明UV-B辐射可使最大荧光和光化学效率降低, 从而使潜在活性受损伤, 最终导致光化学电子进入碳还原过程受抑制。
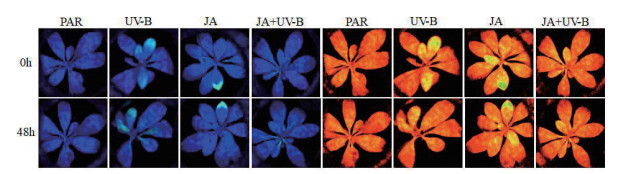
|
| 图 1 不同处理下牛皮杜鹃PSII模式中的Fo图像与Fm图像 |
qP为光化学淬灭系数, 反映PSII天线色素吸收光能后可用于光化学电子传递的部分, 在UV-B辐射后qP显著降低, 说明PSII光化学电子传递活性降低, 与Fv/Fm、Fv'/Fm'和Fv/Fo的下降相吻合。
NPQ表示PSⅡ天线色素吸收光能后不能用于光化学电子传递, 而以热能形式耗散掉未利用光能的部分, 在UV-B辐射后呈上升趋势, 说明UV-B辐射引起了过多的光抑制, NPQ上升有效减轻PSⅡ吸收UV-B而引起的光氧化。JA+UV-B处理后的Fm、Fv/Fm、Fv'/Fm'、Fv/Fo和qP数值与UV-B辐射相比显著上升并与PAR组持平, NPQ数值显著下降, 表明外源茉莉酸预处理可提高植物光系统Ⅱ的光合电子传递。
2.1.2 叶绿素荧光快速光响应曲线的变化随着光照强度的增强, JA预处理的qP快速光响应曲线呈现出最佳状态, 在光强不断增加的过程中, qP下降的幅度最小(图 2-A)。不同处理的qP快速光响应曲线随光照强度的增加呈现出不同的变化趋势(图 2-B), qP快速光响应曲线在UV-B辐射处理后下降幅度最大, JA+UV-B处理后下降幅度缓慢, 与qP动力学数值的下降表现一致。表明外施茉莉酸使植物光能利用率增强。

|
| 图 2 不同处理对牛皮杜鹃光化学淬灭系数的影响 |
随着光照强度的增强, JA预处理的NPQ快速光响应曲线与对照组相比上升幅度大, 随着光强的增加曲线达到平稳时数值较大(图 3-A)。不同处理的NPQ快速光响应曲线随光照强度的增加呈现出不同的变化趋势(图 3-B), 上升幅度大小顺序为JA+UV-B﹥JA+PAR﹥UV-B﹥PAR, 说明茉莉酸预处理后使其NPQ快速光响应曲线上升, 可有效减轻由于植株PSⅡ吸收过量的光能而引起的光能抑制, 是提高植物的抗逆反应现象, 使其具有更有效的光保护能力。

|
| 图 3 不同处理对牛皮杜鹃非光化学淬灭系数的影响 |
图 4中rETR为相对电子转移率, 曲线高低与光合速率呈正相关, 如图(图 4-A)所示随着光照强度的增强, JA预处理后rETR快速光响应曲线上升幅度增大, 曲线趋于平稳时rETR数值最高。UV-B辐射后rETR快速光响应曲线斜率最小, 趋于平稳时rETR数值最低, JA+UV-B处理后使rETR快速光响应曲线显著上升(图 4-B), 与PSII的光化学效率和潜在活性结果一致, 最终说明UV-B辐射导致光合作用原初反应过程受抑制, 而茉莉酸具有显著的缓解作用。
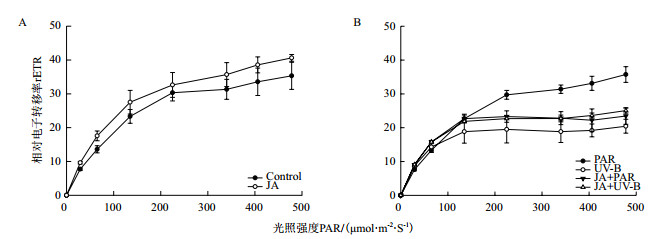
|
| 图 4 不同处理对牛皮杜鹃相对电子转移率的影响 |
对处理后新鲜叶片的CAT和SOD酶活性进行测量。CAT和SOD两种抗氧化酶是植物体内活性氧的清除剂。CAT可以将H2O2转化为H2O, 并与SOD协同反应, 使活性氧维持在最低水平, 由图(5-A)所示, JA预处理可显著提高SOD活性。UV-B辐射可显著降低CAT活性(图 5-B), 与PAR处理相比降低75.31%。JA+PAR处理使CAT活性显著升高, 是PAR处理的1.82倍。JA+UV-B处理使CAT活性维持对照水平。说明UV-B辐射导致其细胞内自由基数量增加, 活性氧含量升高, 外施茉莉酸预处理可缓解UV-B的胁迫效应。

|
| 图 5 不同处理对牛皮杜鹃抗氧化剂活性的影响 |
对牛皮杜鹃叶片进行脂质过氧化和NADPH氧化酶活性测定, 与PAR组相比, UV-B辐射使MDA含量维持在对照水平(图 6-A), NADPH氧化酶活性显著上升了48.53%(图 6-B), JA+PAR处理后MDA含量和NADPH氧化酶活性显著上升, JA+UV-B处理后MDA含量下降到对照水平, 由于长白山牛皮杜鹃叶片具有较厚的角质层和较发达的栅栏组织, 可减缓叶片受到强辐射的损伤, 而单独使用JA预处理可能导致牛皮杜鹃叶片膜脂过氧化, JA和UV-B共同处理能有效减缓叶片损伤程度的作用。
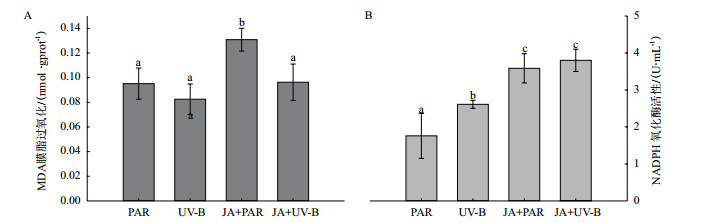
|
| 图 6 不同处理对牛皮杜鹃脂质过氧化和NADPH氧化酶活性的影响 |
对牛皮杜鹃进行花青素含量测定, 与PAR组相比, UV-B辐射使花青素含量显著降低33.13%。与UV-B辐射相比, JA+UV-B处理的花青素含量显著上升38.78%, 并与PAR处理持平(图 7)。可能是突然进行UV-B辐射使其叶片的花青素含量骤减, 外施JA预处理后植株叶片合成了大量花青素等紫外防御物质, 可吸收部分紫外线, 使进入叶肉细胞的UV-B辐射量减少, 有效地抑制UV-B辐射对叶绿体的破坏。

|
| 图 7 不同处理对牛皮杜鹃花青素含量的影响 |
UV-B辐射通常对植物的生理生化过程产生一定影响。研究人员对植物体内的光合元件进行研究, 发现UV-B辐射对光合系统的影响主要包括叶绿体类囊体膜结构受损伤、PSⅡ的活性丧失[13]、加速光系统Ⅱ核心蛋白D1和D2的降解、Rubisco酶活力下降[14]等方面。本实验中, 牛皮杜鹃叶片叶绿素荧光受到UV-B辐射的影响, 叶绿素荧光是检测光合作用的有效探针, 与电子传递, ATP合成以及CO2的固定有关, 直接反映出光合作用过程中动态变化[15]。在UV-B辐射期间, 光系统Ⅱ的Fm、Fv/Fo、光化学效率和光化学淬灭显著降低, qP和rETR快速光响应曲线下降幅度增大。与郑翔等[16]研究结果一致, 其原因可能是UV-B辐射使与PSII紧密结合的质体鲲QA过度还原[17], 从而阻碍光合电子传递速率, 抑制光合原初反应。NPQ在UV-B辐射后显著上升, 表明胁迫后光合色素吸收的光能不能全部用于光合电子传递, 大部分以热能的形式耗散掉, 从而保护植物PSII反应中心。UV-B胁迫作为外界的诱导因子可激发茉莉酸的合成途径, 同时外源茉莉酸会诱导JlPs(茉莉酸诱导蛋白组)的表达[18]。本试验结果表明, JA+UV-B处理后Fm、Fv/Fm、Fv'/Fm'、Fv/Fo和qP数值与UV-B辐射相比显著上升并与PAR组持平, 并且qP、NPQ和rETR快速光响应曲线呈现出最佳状态, 说明外源施加茉莉酸可缓解外界因素对牛皮杜鹃的伤害, 同时提高牛皮杜鹃的抗逆性, 使其更能适应苛刻的环境。
植物正常生长情况下, 体内的活性氧(ROS)产生和消除会维持动态平衡, 而UV-B辐射等逆境胁迫可能打破了这种平衡, 使其产生大量自由基和H2O2, 活性氧叠加累积会直接或间接地对脂类和不饱和脂肪酸进行攻击, MDA来自不饱和脂肪酸的降解[19], 可结合糖蛋白引起膜蛋白变性, 细胞膜的选择透过性和流动性受影响, MDA含量反映了植物受到胁迫后损伤的程度[20]。SOD是保护植物免受ROS损害的第一线酶, 将O2转化为H2O2, NADPH氧化酶途径也产生H2O2, 可引起氧化猝灭, CAT将H2O2转化为水和氧, 从而去除有毒的自由基。本试验中UV-B辐射使SOD酶活性显著提高, CAT活性显著降低, NADPH氧化酶活性显著升高, 致使H2O2含量增加。说明UV-B辐射使细胞内清除活性氧能力下降, 活性氧大量积累, 最终导致损伤出现。JA+UV-B处理后诱导CAT活性上升到对照水平并且MDA含量降低到对照水平。这与迟虹等[21]的结果一致, 茉莉酸可激发植物的抗氧化系统的活性, 进而控制体内抗氧化物质的含量, 缓解膜脂过氧化的程度, 减缓细胞受活性氧的伤害。
植物体内的抗氧化物质包括抗氧化酶主要有丙二醛(MDA)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及紫外吸收复合物等。黄酮类化合物(包括花青素)是植物抵御UV-B辐射的关键物质, 可有效吸收或过滤进入叶片的紫外光子, 黄酮类化合物的积累是植物对UV-B辐射的一种适应和保护措施[22]。本试验发现JA+UV-B处理显著增加花青素含量, 表明在UV-B辐射下进行外源茉莉酸处理可促进牛皮杜鹃体内花青素的合成, 部分吸收紫外强光, 减缓UV-B辐射对植物的伤害。正如王茹丹等[23]研究, 认为增加植物体内花青素含量可抵御UV-B辐射对叶片造成的伤害。
4 结论综上所述, UV-B辐射和外源茉莉酸预处理对各个生理指标具有显著作用, 外源茉莉酸部分抵消了UV-B辐射的负面影响, 尤其是通过增强植物光合作用, 提高抗氧化酶活性和花青素等物质的积累, 进而提高植株的防御能力。
| [1] |
Zhou X, Chen S, Wu H, et al. Biochemical and proteomics analyses of antioxidant enzymes reveal the potential stress tolerance in Rhododendron chrysanthum Pall[J]. Biology Direct, 2017, 12(1): 10. DOI:10.1186/s13062-017-0181-6 |
| [2] |
魏晶, 吴钢, 邓红兵. 长白山高山冻原植被生物量的分布规律[J]. 应用生态学报, 2004, 15(11): 1999-2004. DOI:10.3321/j.issn:1001-9332.2004.11.003 |
| [3] |
张涛, 安黎哲, 陈拓, 等. 不同海拔青海云杉与祁连圆柏叶片抗氧化系统[J]. 植物生态学报, 2009, 33(4): 802-811. DOI:10.3773/j.issn.1005-264x.2009.04.019 |
| [4] |
陈思霖.基于蛋白质组学对牛皮杜鹃抗寒机理的初探[D].四平: 吉林师范大学, 2018.
|
| [5] |
权佳锋, 涂云, 杨正聪, 等. 不同UV-B辐射强度对烤烟主要次生代谢产物的影响[J]. 山东农业科学, 2019, 51(2): 68-72. |
| [6] |
祁虹, 段留生, 王树林, 等. 全生育期UV-B辐射增强对棉花生长及光合作用的影响[J]. 中国生态农业学报, 2017, 25(5): 708-719. |
| [7] |
袁孟玲, 岳堃, 王红, 等. '台农一号'芒果成年树在增强UV-B辐射处理下的损伤及其抗氧化响应[J]. 热带作物学报, 2018, 39(9): 47-54. |
| [8] |
刘晓, 迟虹, 李倩, 等. 外源茉莉酸对UV-B胁迫下小麦抗氧化系统影响的时间和浓度效应[J]. 基因组学与应用生物学, 2015, 34(12): 2748-2756. |
| [9] |
Wasternack C. Introductory remarks on biosynthesis and diversity in actions[J]. Journal of Plant Growth Regulation, 2004, 23(3): 167-169. DOI:10.1007/s00344-004-0051-1 |
| [10] |
Wasternack C, Stenzel I, Hause B, et al. The wound response in tomato-role of jasmonic acid[J]. Journal of Plant Physiology, 2006, 163(3): 297-306. DOI:10.1016/j.jplph.2005.10.014 |
| [11] |
Conconi A, Smerdon MJ, Howe GA, et al. The octadecanoid signalling pathway in plants mediates a response to ultraviolet radiation[J]. Nature(London), 1996, 383(6603): 826-829. DOI:10.1038/383826a0 |
| [12] |
Bradford MM. A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(s 1-2): 248-254. |
| [13] |
常宗强, 祁淑云. 短期UV-B辐照对抱茎风毛菊光合作用的影响[J]. 甘肃科学学报, 2016(4): 28-33. |
| [14] |
易琦, 郭世昌, 常有礼, 等. 云南省大气臭氧变化及其对烤烟生长和化学品质的影响研究[J]. 云南大学学报:自然科学版, 2009(6): 584-591. |
| [15] |
张玉红, 陈路瑶, 刘彤, 等. 增补UV-B辐射对药用植物黄檗幼苗生长及光合生理影响[J]. 中国农学通报, 2018, 34(4): 76-82. |
| [16] |
郑翔, 江亮波, 邓邦良, 等. UV-B辐射增强和氮沉降对不同种源地乌桕叶绿素荧光参数的影响[J]. 浙江农业学报, 2018, 30(2): 248-254. DOI:10.3969/j.issn.1004-1524.2018.02.10 |
| [17] |
李雪莹. UV-B辐射增强及不同氮素水平对水稻叶片光合作用的影响[D].沈阳: 沈阳农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10157-1016144730.htm
|
| [18] |
Waldemar M, Dorota W, Andrzej LD, et al. The level of jasmonic acid in Arabidopsis thaliana and Phaseolus coccineus plants under heavy metal stress[J]. J Plant Physioh, 2005, 162: 1338-1346. DOI:10.1016/j.jplph.2005.01.013 |
| [19] |
Qiu ZB, Zhu XJ, Li FM, et al. The optical effect of a semiconductor laser on protecting wheat from UV-B radiation damage[J]. Photochemical & Photobiological Sciences, 2007, 6(7): 788-793. |
| [20] |
杜照奎, 李钧敏, 钟章成. 花生幼苗对UV-B辐射增强的生理生化响应[J]. 西南大学学报:自然科学版, 2014, 36(9): 49-56. |
| [21] |
迟虹, 岳明, 刘晓. 茉莉酸对小麦幼苗UV-B抗性的生理学效应研究[J]. 植物科学学报, 2011, 29(6): 718-726. |
| [22] |
褚润, 陈年来, 韩国君, 等. UV-B辐射增强对芦苇生长及生理特性的影响[J]. 环境科学学报, 2018, 38(5): 2074-2081. |
| [23] |
王茹丹. UV-B辐射对紫花苜蓿营养品质和抗氧化品质的影响[D].新乡: 河南师范大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10476-1018241141.htm
|





