细胞凋亡(Apoptosis), 又称程序性细胞死亡(Pragrammed cell death), 是指在一定的生理和病理情况下, 机体为了维持内环境稳定并由基因控制的有序的细胞自主性死亡形式[1-3], 与肿瘤的发生、发展与转移有密切关系, 是研究药物抗肿瘤作用机制的重要方向[4]。细胞凋亡检测对于基础研究和临床诊断具有重要意义, 目前用于体外细胞凋亡检测的方法很多, 流式细胞分析法可对单个细胞或其他生物微粒进行快速定量分析, 是定量检测细胞凋亡的重要方法之一, 其中Annexin V/PI法是目前较为流行的检测细胞凋亡的方法, 具有分析细胞量大、灵敏度高、方便快捷等优点[5-7]。
高通量实时细胞功能分析系统(xCELLigence-RTCA系统)是基于检测电子传感器阻抗变化以反映细胞生理状态的新型细胞分析系统, 测定的电阻抗转化为细胞指数(Cell index)即反映了细胞群体各种生理变化包括细胞生长、形态变化、死亡等一系列生理状态[8-9]。可在近似生理环境下实现高通量、动态、无标记检测肿瘤细胞增殖、凋亡等多项生理学功能[10]。
本研究将xCELLigence-RTCA的实时无标记技术和流式细胞术相结合, 选择非小肺癌细胞A549作为靶细胞, 以能促进A549细胞凋亡DDP作为靶分子, 采用传统的流式细胞分析技术作为平行对照, 初步确定了这种实时无标记技术联合流式细胞术的筛选体系用于肿瘤细胞凋亡筛选可行性和可靠性。
1 材料与方法 1.1 材料 1.1.1 细胞株人非小细胞肺癌细胞株A549(中国科学院上海细胞库ATCC:Cat No:CCL-185TM)。
1.1.2 主要试剂RPMI-1640培养基、胎牛血清和0.25%胰酶(Gibco); 青链霉素(Invitrogen); 胰酶购自(杭州科易生物技术有限公司); 二甲基亚砜(Dimethylsulfoxide, DMSO)(Sigma); 顺铂(cis-Dichlorodiamineplatinum(II), DDP)(阿拉丁); Annexin V-FITC/PI apoptosis kit(AP101)(联科生物)。
1.1.3 仪器设备高通量实时细胞功能分析系统(xCELLigence-RTCA)及E-Plate 96孔板(杭州艾森生物有限公司); 多色流式细胞分析仪(BD LSRFortessa); 5% CO2恒温培养箱(Thermo Scientific Cytoperm); 倒置荧光显微镜(OLYMBUS CKX31)。
1.2 方法 1.2.1 建立浓度梯度依赖性细胞动力学模型并确定给药细胞浓度取冻存的人非小肺癌细胞株A549一管, 37℃快速溶解后, 加入到培养皿中(已含10 mL培养基), 混匀后, 置于37℃, 5% CO2的孵箱中培养, 隔天换液。选取处于指数生长期的A549细胞用0.25%胰酶消化, 制备细胞悬液, 吸取10 μL细胞悬液与台盼蓝1:1混匀, 用细胞计数仪计数, 配制成终浓度分别为20 000 cells/mL、10 000 cells/mL、5 000 cells/mL、3 000 cells/mL、1 500 cells/mL的细胞悬液。
向E-Plate中加50 μL细胞培养液, 检测培养液基线, 将100 μL细胞悬液加入E-Plate, 每个浓度设4个复孔, 室温静置30 min后放入Station, 15 min进行一次CI值的测试, 连续测试24 h, 以细胞CI值为Y轴, 以时间为X轴绘制A549细胞生长曲线。
选取同上浓度的A549细胞分别于0 h、24 h进行显微成像, 观察不同浓度细胞的增殖情况, 结合细胞指数特征, 确定适合药物作用的细胞浓度。
xCELLigence-RTCA系统基于微电子阻抗变化监测细胞活性, 用细胞指数CI表示, 公式如下:

Rb(f)和Rcell(f)分别代表无细胞黏附的电阻抗和有细胞黏附的电阻抗, N代表检测到电阻抗的频点数量[11]。细胞铺板24 h内, 经过悬浮、贴壁、潜伏期、增殖并达到覆盖率为70%-80%的最佳指数生长期, 此时细胞指数处于0.5-1范围内, 表示该浓度细胞适合后续的功能性实验研究[12]。
1.2.2 xCELLigence-RTCA系统检测不同浓度顺铂对A549细胞增殖的影响选取指数生长期的A549细胞制成细胞悬液并进行细胞计数, 按照xCELLigence-RTCA系统监测确定的细胞密度接种于E-Plate 96细胞检测板中, 每15 min测定一个点, 培养26 h后分别加入终浓度为0.25、0.5、1、2、4、8、16 µg/mL的顺铂处理细胞。对照组不予顺铂处理, 每个浓度设置3个复孔。继续动态监测96 h, 每5 min记录1次。以时间为X轴, 归一细胞指数(Normalized cell index, NCI)值为Y轴绘制药物与细胞的时间/药物浓度依赖曲线图谱, 观察不同浓度顺铂对A549细胞增殖的影响, 确定顺铂作用的最佳检测时间点和时间依赖性IC50。
1.2.3 流式细胞术检测细胞凋亡情况选取指数生长期的A549细胞, 制成细胞悬液并进行细胞计数, 按照xCELLigence-RTCA系统监测确定的细胞密度接种6孔板(2.5 mL)中, 置37℃、5% CO2条件下培养26 h后, 将细胞随机分为对照组(不予顺铂处理)、顺铂处理组, 每个浓度设置3个复孔。根据xCELLigence-RTCA检测的药物与细胞的时间/药物浓度依赖曲线图谱, 选取凋亡曲线出现下降时间点、凋亡检测中间点、凋亡检测终点收集细胞, 制备密度为1×106 cells/mL的细胞悬液, 取1 mL于4℃条件下300×g离心15 min, 除去上清液, 加入Annexin V-FITC结合液195 μL重悬, 再先后加入Annexin V-FITC 5 μL和碘化丙啶染色液10 μL, 在室温下避光孵育10 min后置于冰浴中, 流式细胞仪检测。
1.2.4 统计学分析应用SPSS20.0软件对数据进行统计分析, 实验数据以x±s表示, 多组间比较采用单因素方差分析(One-way ANOVA), 组间两两比较采用最小显著性差异法(LSD法)。P < 0.05表示差异有统计学意义。
2 结果 2.1 建立浓度梯度依赖性细胞动力学模型并确定给药细胞浓度。图 1是xCELLigence-RTCA系统实时监测24 h的A549细胞浓度依赖性生长曲线模型。从中发现, 系统连续监测24 h, 不同浓度的A549细胞指数(CI值)保持继续增长趋势, 除1 500 cells/mL浓度的A549细胞指数CI值小于0.5外, 其他浓度的A549细胞指数CI值均大于0.5。

|
| 细胞铺板之后, 经过短暂的悬浮、贴壁、长短不同的潜伏期(0-6 h), 随即进入大量分裂的指数生长期(6-24 h), 在细胞达到饱和密度后, 停止生长进入平台期, 最后退化衰亡 图 1 实时监测24 h A549细胞浓度依赖性生长曲线模型 |
图 2是不同浓度A549细胞培养24 h的显微成像图, 与接种0 h相比, 培养24 h后3 000 cells/mL浓度的A549细胞密度为70%-80%左右; 1 500 cells/mL浓度的A549细胞密度为40%-50%左右; 而5 000 cells/mL、10 000 cells/mL、20 000 cells/mL浓度的A549细胞密度超过90%且细胞的形态出现皱缩。

|
| 图 2 不同浓度A549细胞显微成像图 |
综上两种实验结果, 选定3000 cells/mL浓度的A549细胞作为后续药物处理的最佳细胞浓度模型。
2.2 xCELLigence-RTCA动态监测不同浓度顺铂作用A549细胞凋亡情况A549细胞铺板增殖生长约26 h后时进行加药处理, 取此时CI值归一化为1。如图 3所示, 系统继续监测72 h顺铂作用A549细胞的时间/药物剂量依赖性曲线发现, 与对照组相比, 顺铂在作用11 h后A549细胞增殖曲线开始出现下降趋势, 作用48 h后所有A549细胞增殖曲线下降, 作用72 h后, 对照组A549细胞生长曲线开始下降。分析不同时间点顺铂作用的A549细胞存活率, 差异显著(P < 0.05)(图 4)。从图 5发现IC50值在加药24 h后保持相对稳定, 通过xCELLigence-RTCA系统软件计算顺铂作用72h的IC50值为2.614 µg/mL(图 6)。

|
| 图 3 实时监测顺铂作用A549细胞的时间/药物剂量依赖性曲线图谱 |

|
| 对照组A549细胞随着培养时间的延长, 贴壁细胞细胞量增多, 细胞指数值不断增加, 待生长96 h后曲线下降, 细胞出现凋亡; 实验组A549细胞则在不同浓度药物作用下, 随着培养时间的延长, 细胞指数呈现不同趋势的变化(P < 0.05) 图 4 不同浓度顺铂作用A549细胞不同时间的细胞存活率 |

|
| 图 5 顺铂作用后的时间依赖IC50值变化图 |
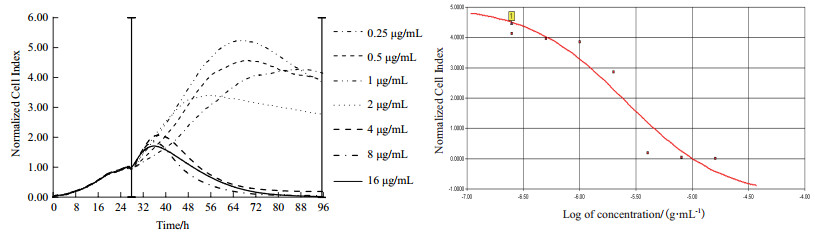
|
| 图 6 顺铂作用72 h计算的IC50值 |
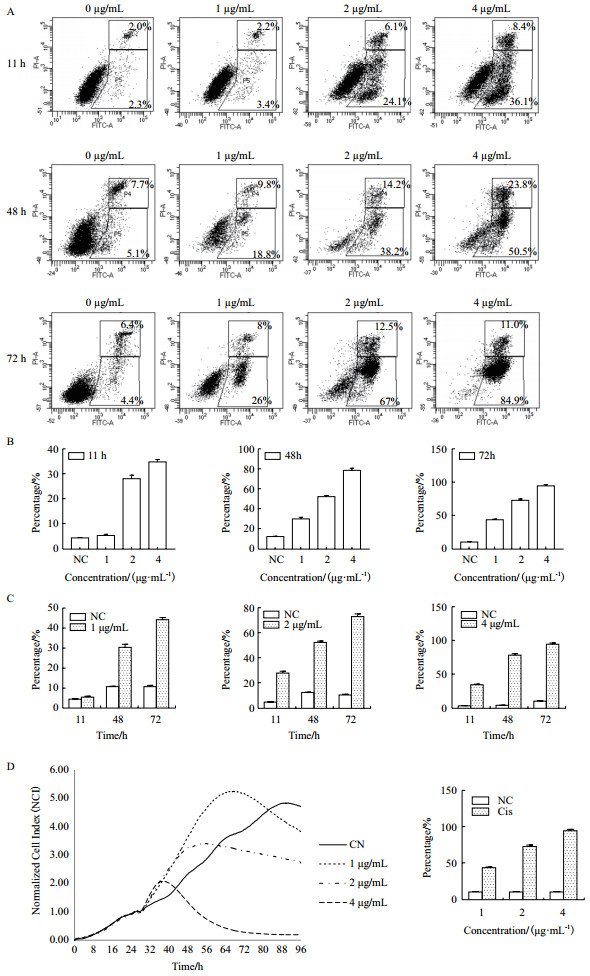
图 7为运用流式细胞术检测顺铂对A549细胞凋亡的影响结果。根据xCELLigence-RTCA系统检测的顺铂作用A549细胞凋亡结果分析, 选取1 µg/mL、2 µg/mL、4 µg/mL三种浓度顺铂分别处理A549细胞11、48、72 h, 通过流式细胞术进行细胞凋亡率检测结果如图 7-A所示, 与对照组相比:1 µg/mL顺铂作用了11 h、48 h、72 h细胞凋亡率分别为5.47%±0.29、30.4%±0.87、44.2%±0.62。2 µg/mL顺铂作用了11 h、48 h、72 h细胞凋亡率分别为28.27%±0.82、52.73%±0.65、73.43%±1.23。4 µg/mL顺铂作用了11 h、48 h、72 h细胞凋亡率分别为35%±0.57、79.1%±1.22、95.2%±1.12。
|
| A:不同浓度顺铂作用不同时间点的A549细胞凋亡流式图; B:3种浓度顺铂作用相同时间的A549细胞凋亡率统计图(P < 0.05);C:相同浓度顺铂作用不同时间的A549细胞凋亡率统计图(P < 0.05);D:顺铂作用A549细胞的时间/药物剂量依赖性曲线与凋亡率统计图(P < 0.05) 图 7 流式检测顺铂对A549细胞凋亡的影响结果 |
如图 7-B所示, 3种浓度顺铂作用11、48、72 h后, 与对照组相比, A549细胞的凋亡趋势明显, 顺铂浓度越高, A549细胞凋亡率增加趋势越显著(P < 0.05)。
2.3.2 相同浓度顺铂作用不同时间的A549细胞凋亡情况与对照组相比, 从图 7-C统计图发现:随着3种浓度顺铂作用时间的增加, A549细胞凋亡趋势呈显著性变化(P < 0.05)。
2.3.3 xCELLigence-RTCA技术辅助流式细胞术检测顺铂作用A549细胞的凋亡情况如图 7-D发现, 随着顺铂浓度的增加或顺铂作用时间的增加, A549细胞的凋亡增加趋势显著(P < 0.05), 与xCELLigence-RTCA系统监测的A549细胞的时间/药物剂量依赖性曲线结果一致。因此在细胞凋亡检测实验中, 通过分析xCELLigence-RTCA细胞功能分析系统实时监测的值, 可确定细胞凋亡的最佳检测时间点和药物浓度, 为流式细胞术的凋亡检测提供可靠的条件。
3 讨论据统计, 我国肺癌居于恶性肿瘤死亡率的首位, 其中非小细胞肺癌占全部肺癌的80%以上, 因此在人均寿命增长的同时, 恶性肿瘤已成为人类死亡的首要疾病和因素[13-15]。肺癌早期诊断率极低, 因此细胞凋亡检测对于基础研究和临床诊断具有重要意义。流式细胞分析法可对单个细胞或其他生物微粒进行快速定量分析, 是定量检测细胞凋亡的重要方法之一[7]。但是该方法检测指标单一, 仅仅给实验定格了一个最终结果, 往往由于时间点的选取不确定性, 而漏掉药物作用的瞬间反应变化, 给细胞凋亡活性检测带来了一定的难度, 因此选择合适的检测时间很重要[16]。
xCELLigence细胞功能分析系统可以进行无标记、实时、动态的监测肿瘤细胞的凋亡变化过程, 获得完整的动态曲线图谱和细胞指数值, 从而确定药物诱导肿瘤细胞凋亡的给药时间点和给药剂量, 因此也减少了因流式细胞术在给药时间和给药剂量上做的摸索[8-11]。但根据细胞指数值来确定细胞凋亡最佳检测时间点和给药剂量的研究, 国内外文献鲜少报道[17]。本研究结合xCELLigence系统监测的顺铂作用曲线和流式细胞术检测分析结果发现, 药物作用的CI值降低, 细胞凋亡趋势增加。CI值降到最低时, 细胞存活率最低。研究还发现不同剂量顺铂诱导后, A549细胞指数达到最低值所需要的时间并不相同, 流式细胞术检测细胞凋亡率的时间点和合适的药物浓度也不相同, 因此药物剂量和作用时间对细胞凋亡会产生不用的结果, 该实验结果和文献报道相一致[17], 联合两种技术为药物细胞模型的多种功能研究找到了的新手段, 为细胞凋亡检测的应用开发提供良好的平台。
4 结论在细胞凋亡检测实验中, xCELLigence-RTCA细胞功能分析系统实时监测的值可用于确定细胞出现凋亡的最佳检测时间点和药物浓度。联合流式细胞术的精准定量技术, 确定这种实时无标记细胞凋亡筛选技术体系用于肿瘤细胞凋亡筛选的可行性和可靠性, 该技术体系的建立将为药物诱导肿瘤细胞活性研究方面的应用提供支持和推广。
| [1] |
郭茜茜, 于广, 吴丹丹, 等. 细胞凋亡率检测方法的探索[J]. 免疫学杂志, 2015, 31(5): 425-429. |
| [2] |
孙建平, 谭竹钧, 韩雅莉. 细胞凋亡检测方法的研究进展[J]. 生物技术通报, 2012(1): 54-59. |
| [3] |
Kerr JF, Wyllie AH, Currie AR. Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26(4): 239-257. DOI:10.1038/bjc.1972.33 |
| [4] |
冯全服, 毕蕾, 颜晓静, 等. 川芎嗪调控肝癌细胞凋亡及对相关蛋白表达的影响[J]. 南京中医药大学学报, 2015, 31(3): 246-249. |
| [5] |
张韫, 靳耀英, 李忻, 等. 流式细胞术在细胞凋亡检测中的应用[J]. 中日友好医院学报, 2008, 22(5): 303-305. DOI:10.3969/j.issn.1001-0025.2008.05.015 |
| [6] |
张伟, 梁智辉. 双标记与双标记流式细胞术检测细胞凋亡的比较[J]. 细胞与分子免疫学杂志, 2014, 30(11): 1209-1212. |
| [7] |
Darzynkiewicz Z, Bedner E, Smolewski P. Flow cytometry in analysis of cell cycle and apoptosis[J]. Semin Hematol, 2001, 38(2): 179-193. DOI:10.1016/S0037-1963(01)90051-4 |
| [8] |
Ke N1, Wang X, Xu X, et al. The xCELLigence system for real-time and label-free monitoring of cell viability[J]. Methods Mol Biol, 2011, 740(1): 33-43. |
| [9] |
雷飞飞, 王建春, 张咏梅, 等. 实时细胞电子分析应用于复方丹参滴丸质量评价的初步研究[J]. 中成药, 2015, 37(5): 1119-1123. DOI:10.3969/j.issn.1001-1528.2015.05.045 |
| [10] |
Giaever I, Keese C. Monitoring fibroblast behavior in tissue culture with an applied electric field[J]. Proceedings of the National Academy of Sciences of the United States of America-Biological Sciences, 1984, 81(12): 3761-3764. |
| [11] |
严国俊, 裴燕芳, 朱贞宏, 等. 实时细胞电子分析技术的应用研究进展[J]. 中国药学杂志, 2014, 49(3): 169-173. |
| [12] |
Lebourgeois S, Fraisse A, Hennechart-Collette C, et al. Develop-ment of a Real-time cell analysis(RTCA)method as a fast and accurate method for detecting infectious particles of the adapted strain of Hepatitis A Virus[J]. Front Cell Infect Microbiol, 2018, 8(335): 1-11. |
| [13] |
张建新, 薛飞. 恶性肿瘤为国民恶性肿瘤为国民敲响警钟[J]. 决策与信息, 2007(7): 9. |
| [14] |
于海涛, 张春晶, 刘立琨, 等. 氯喹促进顺铂诱导的人非小细胞肺癌细胞凋亡及其机制[J]. 实验研究, 2018, 27(6): 695-701. |
| [15] |
綦晓艳, 王文武, 石斌, 等. 氮杂胞苷和顺铂联合诱导肺癌细胞凋亡及其机制探讨[J]. 肿瘤, 2015, 1(35): 858-865. |
| [16] |
范宁娟, 项萍, 段敏. 应用流式细胞仪检测细胞凋亡的种方法的比较[J]. 安徽农业科学, 2014, 42(32): 11240-11242. DOI:10.3969/j.issn.0517-6611.2014.32.005 |
| [17] |
董成亚, 孔凡虹, 李奇, 等. 基于微电子阻抗技术实时细胞监测系统在细胞凋亡检测时点选择中的应用[J]. 标记免疫分析与临床, 2016, 23(2): 197-201. |



