2. 南京农业大学食品科技学院, 南京 210095
2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095
血栓对人体健康存在极大威胁, 其由不溶性纤维蛋白、沉积的血小板、积聚的白细胞和陷入的红细胞组成。目前为止, 纳豆激酶(Nattotkinase)是微生物中唯一的纤维蛋白溶解酶[1], 它可预防血栓形成, 还能抗高血压和动脉粥样硬化[2]。将它与野樱莓、红参和经紫外线照射的香菇复配, 复合产物具有消炎和抗氧化作用, 从而能改善胰岛素分泌, 缓解2型糖尿病症状及其并发症[3]。除了溶栓能力外, 最近的研究表明纳豆激酶也可能对平滑肌活动有神经保护作用, 对阿尔茨海默症[4]、低血压和玻璃体视网膜疾病的治疗也具有潜在的作用[5]。
当前市面上纳豆激酶的主要来源是鲜纳豆, 在纳豆的深加工方面, 纳豆激酶软糖、压片糖果和胶囊等产品相继出现[6]。药品方面, 由于纳豆激酶分离纯化工艺还不完善, 纳豆激酶针剂的生产还处于探索阶段[7]。随着人们对纳豆激酶认识的深入和需求量的增加, 如何提高产酶量并实现规模化生产是纳豆激酶产业化首先需要考虑的问题, 同时也需要寻找降低成本的方法。提高生产菌种产酶方面的研究相对较多, 包括高产菌种筛选[8]、诱变[9]、培养基[10]和发酵条件优化[11]等。相对于传统固体纳豆发酵而言, 液体发酵生产纳豆激酶在工艺上更可控[12], 易实现规模化生产, 且更利于进一步富集纯化纳豆激酶。如今应用液体发酵工艺生产纳豆激酶已成为趋势, 发酵原料从最初的化学试剂, 逐渐过渡到纯天然食品原料[13-14]和加工副产物[15-17]等。以谷物、豆类或其加工副产物等作为发酵原料既能减少生产成本, 同时也能借助发酵原料本身具备的营养成分, 使发酵产物的营养价值更多样, 在此基础上进行发酵条件的优化是不错的选择。
本试验的目的在于弥补前期优化实验的不足。在前期优化中[18], 单因素水平间距较小, 结果中能反应的问题较局限且最优条件不够明显, 因此本研究在前期优化的基础上对因素顺序及因素水平稍作调整, 同样以大豆为原料, 制备的豆乳为发酵培养基进行液体发酵工艺优化。运用单因素和正交试验对发酵时间、装液量、初始pH和接菌量进行优化, 确定最佳工艺参数。
1 材料与方法 1.1 材料 1.1.1 实验材料大豆, 市售; 纳豆枯草芽孢杆菌, 实验室筛选[19]。
1.1.2 试剂尿激酶(10 000 IU/mg, 10 mg)、凝血酶(1 000 U)纤维蛋白原(1.0 g), 均为Sigma公司产品; 蛋白胨、酵母提取物, 均为英国Oxoid公司产品; 氯化钠、琼脂粉等, 均购于国药集团化学试剂有限公司。
1.1.3 仪器与设备电子分析天平(AL204), 梅特勒-托利多仪器(上海)有限公司; pH计(FE28), 梅特勒-托利多仪器(上海)有限公司; 生化培养箱(LRH-250), 上海一恒科学仪器有限公司; 超净工作台(ZHJH-011128), 上海智城分析仪器制造有限公司; 离心机(3K15), 曦玛离心机(扬州)有限公司; 生化培养箱(LRH-250), 常州中成仪器制造; 高压灭菌锅(GI36T), 致微(厦门)仪器有限公司; 恒温摇床(RH-QA), 常州中诚仪器制造有限公司; 豆浆机(RD-808T), 合肥荣事达小家电有限公司。
1.2 方法 1.2.1 制作工艺 1.2.1.1 菌种活化将-80℃保存的纳豆枯草芽孢杆菌转接至LB平板培养基, 37℃恒温培养12 h备用。
1.2.1.2 种子液培养挑取种子1环转接入装有20 mL液体LB培养基(50 mL三角瓶), 37℃、200 r/min, 摇床恒温培养12 h, 取1 mL转接至装有100 mL液体LB培养基(250 mL三角瓶), 37℃、200 r/min, 摇床恒温培养12 h备用。
1.2.1.3 发酵豆乳制作工艺流程大豆清洗→浸泡(40℃水浴6 h)→沥干加水煮制豆乳(豆水比1:8)→接种(菌液)→发酵。
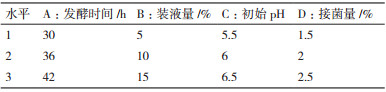
1.2.2 试验设计 1.2.2.1 单因素试验采用单因素试验对发酵时间、装液量、初始pH及接菌量4个因素进行研究, 发酵时间设为12、24、36、48、60、72、84、96和108 h共9个水平, 装液量设为50 mL/500 mL、100 mL/500 mL、150 mL/500 mL、200 mL/500 mL、250 mL/500 mL共5个水平, 初始pH设为2、4、6、8、10共5个水平, 接菌量设为1%、2%、3%、4%和5%共5个水平。每个处理重复3次, 取平均值。
1.2.2.2 正交试验设计在单因素试验的基础上, 以纳豆激酶活力作为功能评价指标, 采用四因素三水平L9(34)正交试验对发酵条件进行优化, 每个试验设3个重复。正交试验表见表 1。
取发酵豆乳样品15 mL, 9 500 r/min离心10 min, 将上清液转入空的离心管中。沉淀和上清储存于4℃备用。
1.2.3.2 尿激酶标准曲线本试验应用的琼脂糖-纤维蛋白平板法检测纳豆激酶活力, 具体方法参见Astrup[20]稍作改进, 具体如下:称取1 g琼脂加到250 mL三角瓶中, 量取100 mL PBS(10 mmol/L pH7.2)缓冲液溶解琼脂, 置于微波炉中加热溶解; 待琼脂冷却至50℃时取25 mL于灭菌的离心管中, 向离心管中加入800 μL 50 mg/mL的纤维蛋白原溶液及120 μL 10 U/mL的凝血酶, 混合均匀后迅速倒入平皿中; 37℃生化培养箱反应105 min, 以形成纤维蛋白凝块。
标准曲线的制作:参照奚晓琦[21]的方法。用打孔器打孔, 将尿激酶样品(1 562.5 IU/mL、3 125 IU/mL、6 250 IU/mL、12 500 IU/mL、25 000 IU/mL、50 000 IU/mL)各20 μL点样于新配置的纤维蛋白平板上, 放置10 min后转至37℃生化培养箱反应, 18 h后取出测定各溶解圈的垂直直径。上述操作设定3个平行组, 测量后计算溶解圈面积, 去除点样孔面积后, 取其平均值为横坐标。尿激酶标准溶液对应的活力, 取对数值, 求平均值为纵坐标, 制作尿激酶酶活标准曲线, 得尿激酶标准曲线Y=0.008 2X+2.849 4, 线性相关系数为0.996 81。式中, Y表示尿激酶活力的对数值, X表示溶解圈面积(mm2)。
1.2.3.3 纳豆激酶活力测定取待测上清20 μL按上述操作上样、反应、测量溶解圈直径, 根据尿激酶标准曲线计算纳豆激酶活力。
1.2.3.4 出渣率的测定上清液和沉淀分别称重, 计算出渣率。
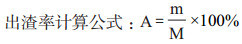
式中, A表示出渣率(%), m表示沉淀质量(g), M表示上清和沉淀总质量(g)。
1.2.3.5 发酵液终点pH值上清液作为粗酶液测pH。
1.2.4 数据处理采用Excel 2013进行作图, 运用正交设计助手进行正交试验设计和分析。
2 结果 2.1 单因素试验 2.1.1 发酵时间对纳豆激酶活力的影响由图 1-A可知发酵时间12-36 h之间, 随着发酵时间的增加, 纳豆激酶的活力持续上升, 36 h时出现第一个峰点, 纳豆激酶活力高达536 265.69 IU/mL; 36-48 h之间, 随着发酵时间的增加, 纳豆激酶的活力呈现下降趋势; 72 h处出现第二个峰点; 72 h后酶活力下降。由图 1-B可知, 出渣率在12-24 h呈现上升趋势; 24 h后呈现下降趋势。终点pH值随着发酵时间增加而增加。综合核心考察指标纳豆激酶活力和生产成本, 选择36 h作为纳豆枯草芽孢杆菌发酵产酶的最佳发酵周期。
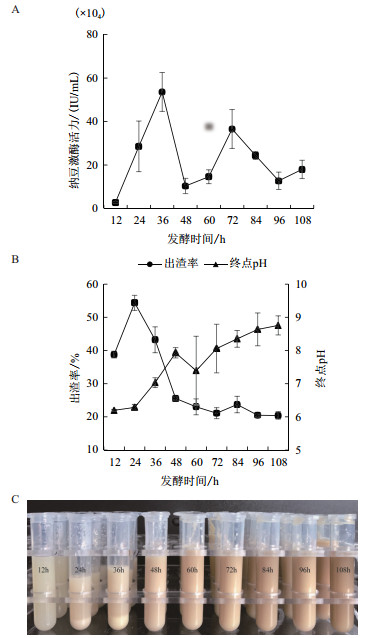
|
| A:发酵时间对纳豆激酶活力的影响; B:发酵时间对出渣率和终点pH的影响; C:不同发酵时间发酵豆乳上清 图 1 发酵时间对纳豆激酶活力、出渣率和终点pH的影响 |
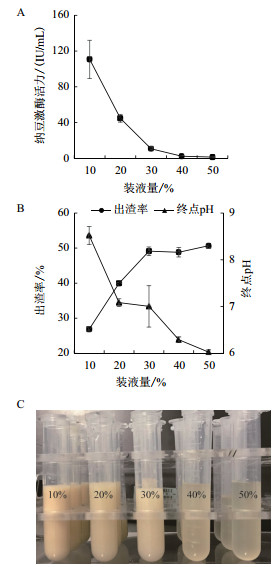
由图 2-A可知, 随着装液量的增加, 纳豆激酶活力在装液量10%-30%区间内显著下降。由图 2-B可知, 出渣率随着装液量的增加而增大, 终点pH值随着装液量的增加而减小, 未发酵豆乳初始pH为6.53, 装液量为10%的发酵豆乳发酵终点pH为8.52, 产酶量最高, 装液量为50%的发酵豆乳发酵终点pH仅为6.03, 产酶量最低。从纳豆激酶产量考虑, 确定最佳装液量为10%。
|
| A:装液量对纳豆激酶活力的影响; B:装液量对出渣率和终点pH的影响; C:不同装液量发酵豆乳上清 图 2 装液量对纳豆激酶活力、出渣率和终点pH的影响 |
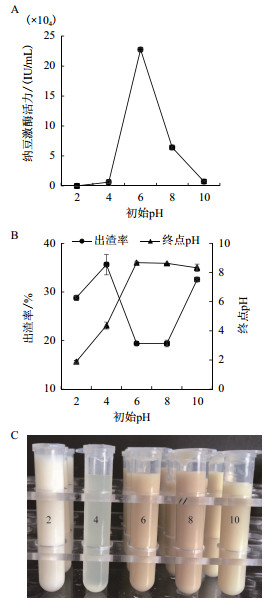
由图 3-A可知, 初始pH为6时, 发酵终点pH为8.67, 纳豆激酶活力高达227 520.77 IU/mL。由图 3-B可知, 初始pH为2和4时, 终点pH未有变化; 初始pH为6和8时, 终点pH均较高; 初始pH为10时, 终点pH有少许下降。出渣率在初始pH为4的条件下稍有上升, 初始pH为6和8的条件下均较低, 说明菌对豆渣的利用转化率高。从纳豆激酶产量考虑, 确定初始pH为6。
|
| A:初始pH对纳豆激酶活力的影响; B:初始pH对出渣率和终点pH的影响; C:不同初始pH发酵豆乳上清 图 3 初始pH对纳豆激酶活力、出渣率和终点pH的影响 |
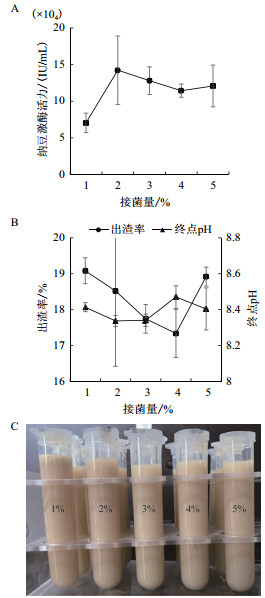
由图 4-A可知当接菌量为2%时, 产酶活力高达142 375.77 IU/mL; 由图 4-B可知出渣率均较低, 菌对豆渣的利用好, 变化幅度较以上3个因素的结果小; 终点pH均在8以上, 产酶量均较高。从纳豆激酶产量考虑, 确定接菌量为2%。
|
| A:接菌量对纳豆激酶活力的影响; B:接菌量对出渣率和终点pH的影响; C:不同接菌量发酵豆乳上清 图 4 接菌量对纳豆激酶活力、出渣率和终点pH的影响 |
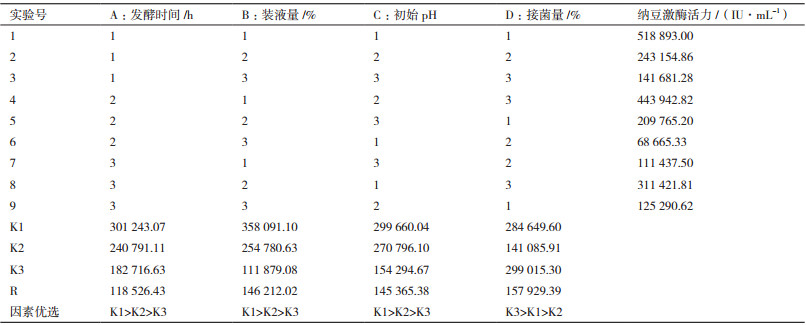
上述单因素试验结果表明, 发酵时间、装液量、初始pH和接菌量对发酵液产纳豆激酶活力均有影响。由于上述几个因素间存在交互作用, 故设计正交试验以确定其最适发酵条件。表 2为正交试验结果。正交试验表明, 四个因素对纳豆激酶活力的影响主次顺序为:接菌量>装液量>初始pH>发酵时间。理论优化方案为A1B1C1D3, 即发酵时间30 h、装液量5%、初始pH5.5、接菌量2.5%。正交试验表中无此理论配方, 配方1与理论配方最接近。为了考察理论配方与实际配方之间的差异, 需进行验证实验。
将理论配方(A1B1C1D3)和实际配方(A1B1-C1D1)进行产纳豆激酶活力验证, 理论配方酶活为498 088.32 IU/mL, 实际配方酶活为660 184.14 IU/mL。理论配方酶活与实际配方酶活相差较大, 两种配方区别在于接菌量的不同, 理论配方酶活低于实际配方酶活, 原因可能为接菌量过大不利于产酶。因此, 最优组合确定为发酵时间30 h、装液量5%、初始pH5.5、接菌量1.5%, 该条件下纳豆激酶活力为660 184.14 IU/mL, 是优化前(79 434.68 IU/mL)的8.31倍。
3 讨论发酵时间、装液量、初始pH和接菌量均会影响纳豆枯草芽孢杆菌的纳豆激酶表达量。随着发酵时间的增加, 纳豆激酶逐渐积累, 营养物质的减少和代谢废物的增多会限制微生物的生长[22], 纳豆激酶的产生后期会受到一定的限制。终点pH值随着发酵时间增加而增加, 推测可能是发酵过程中纳豆激酶及其碱性蛋白酶类产生, 同时也可能是蛋白质等大分子被分解产生碱性化合物等所致。装液量影响溶氧量, 溶氧对纳豆激酶的产生影响很大, 氧是纳豆激酶合成的决定性因素[23]。溶氧越高, 越利于菌体生长和产酶。装液量越小, 菌对豆渣的利用率越高, 出渣率就低, 同时碱性纳豆激酶产量高, 终点pH就高; 而装液量大时, 菌体的通气量受限, 进而影响菌体生长代谢和产酶, 渣的利用率较少, 纳豆激酶产量就低, 发酵终点pH低。pH影响菌体生长, 也可以影响菌体产酶, 偏中性对纳豆枯草芽孢杆菌的生长和产酶都较合适。极酸环境下菌体不生长, 也不产酶。极碱环境下, 菌体可少量生长并能少量产酶。接菌量过高或过低都不利于菌体生长, 接菌量过低时, 菌体无法充分生长, 接菌量过高时, 营养物质不足以满足菌体的生长和代谢[24], 同时可能会导致细胞生长过快, 有害产物积累, 进而影响纳豆激酶的合成[25]。
配合发酵液上清分析, 酶活较低的发酵豆乳上清较清澈且颜色较浅, 而酶活相对高的发酵豆乳上清均不透明且颜色深。原因可能为, 当菌的生命活动只是刚开始利用一部分豆乳满足自身生长和代谢时, 发酵液中酶活较低且色素产生少, 此情况发生在发酵初期、装液量高和初始pH低时。当菌开始大量产生纳豆激酶时, 色素相继大量产生, 豆乳中的营养成分分解转化, 不良风味也加重。
综上, 纳豆枯草芽孢杆菌利用豆乳生产纳豆激酶是一个动态变化的过程, 由于溶氧量影响纳豆枯草芽孢杆菌活力, 初始pH影响纳豆枯草芽孢杆菌对营养物质的吸收和代谢, 接菌量的多少又影响纳豆枯草芽孢杆菌对豆乳的利用速度, 发酵至一定时间代谢物的积累、发酵豆乳pH的变化又会随时影响菌体生长和产酶。因而只有当这些因素组合并且条件合适时, 才能实现纳豆激酶产量的最大化。
前期优化以发酵时间、装液量、接菌量和初始pH进行了单因素和正交试验。但由于接菌量和初始pH的因素间距设置较小, 接菌量未设置过大, 初始pH未涉及极酸, 因而结果能反应的问题较局限。同时考虑到发酵过程应先考虑环境是否适宜菌种生存, 再考虑接多少菌的问题。基于此, 本试验在前期优化的基础上, 调整因素顺序和因素水平。单因素试验结果与前期结果一致, 正交试验中前3个因素水平与前期优化设置一致, 初始pH因前期研究得到偏中性适合纳豆枯草芽孢杆菌产酶, 因而该因素水平依然设置为5.5、6、6.5, 接菌量的因素水平稍拉大, 3个水平设置为1.5%、2%和2.5%(前期研究为1.75%、2%和2.25%)。最终确定的最佳工艺与前期研究不同之处在于接菌量, 本次的最适接菌量为1.5%, 前一次为1.75%。由此可推断, 接菌量对产酶的影响很大, 而正交试验中, 各因素对酶活影响最大的就是接菌量, 因此认为推断正确, 结合验证试验也可说明接菌量的重要性。在最佳发酵条件下, 产酶量达660 184.14 IU/mL, 是优化前(79 434.68 IU/mL)的8.31倍, 是前期研究(429 869.34 IU/mL)的1.54倍[18]。通过本实验研究既节约了成本也提高了纳豆激酶的表达量, 对纳豆激酶的规模化生产具有显著指导意义。
本试验成功优化了豆乳制备纳豆激酶的工艺, 但在提高酶活的过程中, 也同时产生了限制产业发展的问题, 如纳豆不良风味加重, 这种不良风味也被形容为氨臭味或霉腐味, 同时发酵液颜色由乳黄色变成深褐色。不良风味伴随深褐色色素的产生直接影响食欲。目前对纳豆风味的报道中, 针对不良风味的较少, 对不良风味的成因和解决更是鲜有报道。纳豆风味方面, 不同学者得出的结论稍有差异, 这与纳豆制作工艺和检测方法有密切关联。另外, 深褐色色素可能是由大豆蛋白质以及它分解的多肽类与还原糖在大豆发酵过程中发生美拉德反应所生成, 也称蛋白黑素或类黑精[26]。类黑精具有广泛生理功能, 如抗氧化、抗肿瘤、抗菌与抗炎作用等[27]。若此色素对纳豆感官影响很大, 可考虑脱色或提取纯化该物质。综上, 目前亟待解决的是纳豆不良风味的问题, 纳豆不良风味的解决仅停留在辅料添加[28-29]、工艺优化[30]和原料筛选等方面[31-32], 探索产生不良风味的分子机制才是从根本上解决问题的方法, 这也是最值得深入研究的科学问题。
4 结论本研究通过单因素和正交试验确定了最佳发酵条件:发酵时间30 h, 装液量5%, 初始pH5.5, 接菌量1.5%。在此发酵条件下, 酶活可高达660 184.14 IU/mL, 是优化前(79 434.68 IU/mL)的8.31倍, 是前期最佳工艺下纳豆激酶表达量(429 869.34 IU/mL)的1.54倍。与前期全豆豆乳最佳工艺条件相比, 通过调整初始pH和接菌量的先后顺序, 可以在更低接菌量(前期研究, 最佳接菌量为1.75%)的基础上, 显著增加纳豆激酶表达量。
| [1] |
Peng Y, Yang X, Zhang Y. Microbial fibrinolytic enzymes:an overview of source, production, properties, and thrombolytic activity in vivo[J]. Applied Microbiology and Biotechnology, 2005, 69(2): 126-132. DOI:10.1007/s00253-005-0159-7 |
| [2] |
Hongjie C, Eileen MG, Nina R, et al. Nattokinase:A promising alternative in prevention and treatment of cardiovascular diseases[J]. Biomarker Insights, 2018, 13: 117727191878513. DOI:10.1177/1177271918785130 |
| [3] |
Hy eY, Min K, Dae K, et al. Combination of Aronia, red ginseng, shiitake mushroom and nattokinase potentiated insulin secretion and reduced insulin resistance with improving gut microbiome dysbiosis in insulin deficient type 2 diabetic rats[J]. Nutrients, 2018, 10(7): 948. DOI:10.3390/nu10070948 |
| [4] |
Toymentseva AA, Danilova IV, Tihonova AO, et al. Purification of recombinant extracellular proteases from Bacillus pumilus for β-amyloid peptide cleavage[J]. Russian Journal of Bioorganic Chemistry, 2016, 42(1): 53-58. |
| [5] |
Tyagi MG. Nattokinase enzyme; an evaluation of its cellularand potential therapeutic actions[J]. European Journal of Pharmaceutical and Medical Research, 2016, 3(1): 411-414. |
| [6] |
刘振杰, 郭伟鹏, 张菊梅, 等. 纳豆的保健功效及开发应用[J]. 热带农业工程, 2010, 34(3): 25-29. |
| [7] |
王聪, 孔繁东, 祖国仁, 等. 纳豆激酶的研究现状与展望[J]. 食品与药品, 2005, 7(1): 17-20. |
| [8] |
高泽鑫, 何腊平, 刘亚兵, 等. 大方臭豆腐中高产纳豆激酶菌株的分离鉴定[J]. 中国酿造, 2017, 36(7): 58-62. |
| [9] |
夏丽, 沙维, 张丽萍. 紫外线诱变选育高产纳豆激酶菌株的研究[J]. 农产品加工:创新版, 2010(4): 29-31, 34. |
| [10] |
臧学丽. 纳豆激酶生产菌的亚硝基胍诱变[J]. 中国农业信息, 2016(10): 134. DOI:10.3969/j.issn.1672-0423.2016.10.084 |
| [11] |
王琳, 高辰哲, 刘丹怡, 等. 响应面法优化红豆纳豆的发酵工艺[J]. 中国酿造, 2018, 37(1): 190-194. |
| [12] |
葛春蕾.高效分泌表达纳豆激酶的重组枯草芽孢杆菌的构建[D].无锡: 江南大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10295-1016265346.htm
|
| [13] |
赵谋明, 邹颖, 林恋竹, 等. 纳豆菌液态发酵荞麦产纳豆激酶及其代谢特性分析[J]. 食品科学, 2019, 40(4): 178-185. |
| [14] |
严美婷, 杜霞, 邱醒, 等. 中式纳豆制备技术的研究[J]. 中国酿造, 2017, 36(2): 175-179. |
| [15] |
Wang SL, Chen HJ, Liang TW, et al. A novel nattokinase produced by Pseudomonas sp. TKU015 using shrimp shells as substrate[J]. Process Biochemistry, 2009, 44(1): 70-76. |
| [16] |
孙岩, 王海宽, 王建玲, 等. 以豆粕为原料固态发酵产纳豆激酶工艺的优化[J]. 天津科技大学学报, 2011, 26(6): 7-11. DOI:10.3969/j.issn.1672-6510.2011.06.002 |
| [17] |
董艳山, 高丽, 何加亨, 等. 以豆粕粉为氮源的枯草芽孢杆菌液态发酵生产纳豆激酶[J]. 食品与发酵工业, 2017, 43(2): 109-114. |
| [18] |
倪楠, 辛志宏, 张丽静, 等. 全豆乳液体发酵制备纳豆激酶工艺优化[J]. 生物技术进展, 2019, 9(2): 210-215. |
| [19] |
赵仲麟, 李淑英, 聂莹, 等. 纳豆激酶生产菌株分离筛选与热稳定性分析[J]. 生物技术进展, 2013(4): 277-280. DOI:10.3969/j.issn.2095-2341.2013.04.09 |
| [20] |
Astrup T, Mullertz S. The fibrin plate method for estimating fibrinolytic activity[J]. Archives of Biochemistry & Biophysics, 1952, 40(2): 346-351. |
| [21] |
奚晓琦, 王加启, 卜登攀, 等. 纳豆芽孢杆菌的分离鉴定及纳豆激酶高产菌株的筛选[J]. 东北农业大学学报, 2009, 40(11): 69-75. DOI:10.3969/j.issn.1005-9369.2009.11.016 |
| [22] |
谭铭胜, 厉大伟, 邓元元, 等. 纳豆芽孢杆菌固体发酵条件及其优化研究[J]. 中国农学通报, 2015, 31(35): 84-90. DOI:10.11924/j.issn.1000-6850.casb15080020 |
| [23] |
Unrean P, Nguyen NHA. Metabolic pathway analysis and kinetic studies for production of nattokinasein Bacillus subtilis[J]. Bioprocess and Biosystems Engineering, 2013, 36(1): 45-56. |
| [24] |
王琳, 高辰哲, 刘丹怡, 等. 响应面法优化红豆纳豆的发酵工艺[J]. 中国酿造, 2018, 37(1): 190-194. |
| [25] |
Singh P, Shera SS, Banik J, et al. Optimization of cultural conditions using response surface methodology versus artificial neural network and modeling of L-glutaminase production by Bacillus cereus MTCC 1305[J]. Bioresource Technology, 2013, 137(6): 261-269. |
| [26] |
林晓华.曲霉型豆豉的发酵条件及挥发性成分的研究[D].南昌: 南昌大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10403-1013341763.htm
|
| [27] |
韩易, 赵燕, 徐明生, 等. 美拉德反应产物类黑精的研究进展[J]. 食品工业科技, 2019, 40(9): 339-345. |
| [28] |
王丽娜, 付华峰. 风味纳豆的研制[J]. 中国调味品, 2014(5): 94-96. DOI:10.3969/j.issn.1000-9973.2014.05.024 |
| [29] |
麻秀芳, 李小进, 董岳峰, 等. 纳豆系列咀嚼片产品工艺研究[J]. 食品工程, 2014(2): 29-31. DOI:10.3969/j.issn.1673-6044.2014.02.011 |
| [30] |
关茵, 肖然, 李春. 从工艺角度改善纳豆风味的研究[J]. 中国酿造, 2010(6): 75-77. DOI:10.3969/j.issn.0254-5071.2010.06.023 |
| [31] |
侯银臣, 惠明, 杜小波, 等. 纳豆发酵原料和工艺技术研究[J]. 农产品加工:学刊, 2012(11): 119-121. |
| [32] |
金虎, 时杰, 关品, 等. 大豆品种和混菌发酵对纳豆品质及风味改良效果研究[J]. 农产品加工, 2019, 9: 4-7. |