小G蛋白是一类广泛存在于真核生物中的单体GTP结合蛋白, 分子量为20-40 kD。小G蛋白家族成员数目庞大, 超过150多个, 根据其序列结构特征, 可被分为5个主要的亚家族:Ras、Rho、Rab、Arf和Ran[1-2]。RhoB基因属于Rho亚家族, 该亚家族蛋白在细胞骨架重组、基因表达及细胞周期等的调控中起到重要作用[3]。
RhoB与其同家族成员RhoA和RhoC的氨基酸序列同源性高达86%, 生物学功能也有重合, 如RhoA、RhoB和RhoC协同调控细胞骨架运动[4-5], 但更多的证据显示, RhoB具有许多独特于RhoA和RhoC的性质和功能。例如, RhoA和RhoC在细胞中为组成性表达, 而RhoB则表现为诱导型表达[6]。抗癌药物处理(如顺铂、洛伐他汀)、紫外线照射、EGF或PDGF刺激等均可使RhoB的表达水平迅速上调[7-11]。又如RhoA和RhoC均可促进细胞增殖, 而RhoB具有促进细胞凋亡的功能[12-13]。
RhoB在不同癌症的发生发展过程中表现出截然不同的功能。例如, 在恶性胶质瘤、非小细胞肺癌和前列腺癌等肿瘤中的相关研究显示, 其具有原癌基因的功能, 可以促进肿瘤细胞的生长或迁移[14-16]。而在肾细胞癌和胰腺癌等癌症中, RhoB表现出抑癌基因的性质, 其蛋白表达水平呈下降趋势[17-18]。因此, 深入研究RhoB蛋白的生理功能尤其是在癌症发展进程中的功能具有十分重要的意义。本实验旨在扩增人RhoB基因的ORF序列, 构建获得真核表达质粒Flag-RhoB, 并研究所构建质粒在真核细胞的表达情况和细胞亚定位, 旨为进一步研究RhoB蛋白的功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料人乳腺癌MCF7细胞、宫颈癌HeLa细胞、结直肠癌HCT116细胞、水貂肺上皮细胞Mv.1.Lu细胞、菌株DH5α为本实验室保存; 真核表达载体pCMV5作者实验室保存并改造, 在多克隆位点前插入了Flag标签的编码序列。
1.1.2 试剂总RNA提取试剂盒、PrimeScrip Ⅱ 1st Strand cDNA合成试剂盒、质粒抽提试剂盒和胶回收试剂, TaKaRa公司; 1 kb plus DNA ladder, 天根公司; pfu DNA聚合酶、dNTP、SalⅠ、XbaⅠ、T4 DNA连接酶、标准蛋白marker, Fermentas公司; DMEM培养基、胎牛血清(FBS), Gibco公司; 牛血清白蛋白(BSA)、Flag M2抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG和Alexa FluorR 488标记的羊抗兔IgG, DAPI, Sigma公司; Lipofectamine 3000, Texas red-phalloidin, Thermo Fisher公司; 酵母粉、蛋白胨和ECL显色液, 厦门鹭隆生物科技有限公司; 氨苄青霉素、Trypsin以及其他化学试剂均购自上海生工。
1.1.3 仪器设备PCR仪、核酸电泳仪、蛋白电泳及转膜系统、ChemiDoc XRS+化学发光成像系统, Bio-Rad; CO2培养箱、制冰机、-80℃冰箱, SANYO; GSD-8000成像及分析系统, 美国UVP; NanoDrop 2000超微量分光光度计、微量台式高速离心机, Thermo Fisher; 气浴恒温振荡器, 金坛市迅生仪器厂, A1R/A1激光共聚焦显微镜, 日本Nikon公司产品。
1.2 方法 1.2.1 人HEK-293T细胞总RNA的提取和cDNA第一链的合成培养在6孔板汇合度为90%的HEK-293T细胞, 1×PBS洗一次; 加入0.5 mL的RNAiso Plus, 轻轻摇匀, 然后使用移液枪吹打细胞使其脱落; 转移至离心管中, 用移液枪反复吹吸至裂解液中无明显沉淀, 室温静置5 min。加入氯仿0.1 mL, 盖紧离心管盖, 用手剧烈震荡15 s, 待溶液充分乳化无分相现象后, 再室温静置5 min。12 000 r/min低温离心15 min。吸取上清液0.15 mL, 加入等体积的异丙醇, 上下颠倒离心管混匀, 在室温静置10 min。12 000 r/min低温离心10 min。取出试管后小心弃去上清, 缓慢的沿离心管壁加入75%的乙醇1 mL, 轻轻上下颠倒洗涤离心管管壁, 12 000 r/min低温离心5 min后小心弃去乙醇。开盖室温干燥沉淀3 min, 加入20 µL RNase-free水溶解沉淀, 待沉淀完全溶解后直接反转录。
cDNA第一链的合成过程如下。在PCR管中首先配置下列反应混合液:Oligo dT引物2 µL, dNTP混合物(10 mmol/L)2 µL, RNA 2 µL, RNase free水4 µL。65℃变性5 min后, 冰上迅速冷却。简短离心后, 继续配置逆转录反应液:上述变性后反应液10 µL, 5×PrimeScriptTM Ⅱ缓冲液4 µL, RNase抑制剂0.5 µL, 逆转录酶1 µL, RNase free水4.5 µL。缓慢混匀后简短离心。42℃逆转录30 min。70℃酶灭活15 min后冰上冷却待用。
1.2.2 获得RhoB基因片段从GenBank数据库中获得人RhoB基因的mRNA序列, DNAMAN软件对该序列进行限制性酶切图谱分析, 设计引物并由南京金斯瑞生物科技有限公司合成。所设计的上游引物序列为5'-GCCGGGTCGACAAGCGGCCATCCGCAAGA AGC -3', 包含限制性内切酶SalⅠ的识别位点; 下游引物序列为5'-GCGTCTAGA TTATAGCACCTTGCAGCAGTTGA -3', 包含限制性内切酶XbaI的识别位点。培养HEK-293T细胞, 收集并提取总RNA, 逆转录获得cDNA, PCR扩增RhoB基因。PCR反应条件为:95℃预变性5 min; 95℃变性35 s, 60℃退火30 s, 72℃延伸40 s, 共30个循环; 最后72℃延伸7 min。用1.2%的琼脂糖凝胶电泳鉴定PCR产物。割胶后用胶回收试剂盒回收目的片段, 用于后续连接。
1.2.3 真核表达重组质粒Flag-RhoB的构建及双酶切鉴定将PCR产物纯化以利于后续酶切。纯化方法为:取45 µL PCR产物加入5 µL NaAc(3 mol/L)和100 µL无水乙醇, 混匀后-20℃沉淀1 h; 沉淀后离心, 12 000 r/min 10 min; 弃上清, 沉淀用70%无水乙醇洗2次, 35 µL无菌水溶解沉淀备用。
取15 µL回收的PCR产物和1 µg pCMV5空载体用SalⅠ、XbaⅠ双酶切, 37℃, 3 h。酶切体系如下:SalⅠ 0.5 µL, XbaⅠ 0.5 µL, 10×buffer 4 µL, 加入PCR产物或空载体后用水补至40 µL。
酶切后电泳回收, T4 DNA连接酶进行连接(16℃, 6 h), 连接产物转化感受态细胞DH5α涂布于LB平板, 平板含有氨苄青霉素(Amp+)。37℃培养过夜后挑取单克隆, 牙签法小提质粒并用双酶切筛选符合预期的克隆。将符合预期的克隆再次转化DH5α挑单克隆培养后用碱裂解法提质粒, 用SalⅠ和XbaⅠ再次双酶切检测, 检测符合预期的重组子送南京金斯特生物工程有限公司进行测序鉴定。
1.2.4 Flag-RhoB表达产物的Western Blotting鉴定将重组质粒用脂质体转染密度为70%的乳腺癌MCF7细胞、宫颈癌HeLa细胞或结直肠癌HCT116细胞, 转染6 h后换液, 24 h后裂解细胞, 提取总蛋白并测定浓度, 取25 mg蛋白进行Western Blotting分析。用12%的SDS-PAGE凝胶进行电泳分离后转膜(PVDF膜, 400 mA, 1.5 h)。5%的BSA室温封闭30 min; 5% BSA配制的Flag一抗室温孵育1 h; TBST buffer洗3次, 每次5 min; 1% BSA配制的二抗室温孵育1 h; TBST buffer洗3次, 每次5 min; 加入ECL显色液, 用化学发光成像系统检测。
1.2.5 Flag-RhoB表达产物的免疫荧光分析6孔细胞培养板中放入洁净盖玻片, 接种Mv.1.Lu细胞, 接种密度为5×104/孔, 培养12 h后转染; 转染24 h后PBS洗2遍, 4%的多聚甲醛室温固定15 min; PBS洗2遍, 0.25% Triton X-100室温通透5 min; PBS洗2遍, 5%的BSA室温封闭30 min; Flag抗体按1:200稀释, 室温孵育2 h; PBS洗4遍, 避光条件下, Alexa Fluor 488标记的驴抗兔二抗室温孵育1 h; PBS洗4遍, 5 µg/mL Phalloidin(使用前用PBS新鲜配置)室温孵育30 min; PBS洗4遍, 避光条件下, 1 μg/mL DAPI(使用前用PBS新鲜配置)室温孵育5 min; PBS洗两遍, 封片, 镜检。RhoB蛋白的表达用Flag抗体检测, 人IgG作阴性对照, Phalloidin染色显示细胞骨架, DAPI染色显示细胞核结构。
2 结果 2.1 人HEK-293T细胞cDNA的合成提取HEK-293T细胞总RNA, 电泳结果(图 1)显示成功获得高纯度的总RNA。使用PrimeScrip Ⅱ 1st Strand cDNA合成试剂盒进行反转录, 制备人HEK-293T细胞cDNA。

|
| M:DNA分子量marker; 1:总RNA 图 1 人HEK-293T细胞总RNA的提取 |
以制备好的cDNA为模板, 以设计好的引物PCR扩增RhoB基因, 电泳结果显示扩增出的片段大小约为590 bp, 大小符合预期(图 2)。
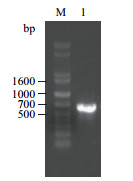
|
| M:DNA分子量marker; 1:RhoB基因的ORF序列的PCR产物 图 2 RhoB基因PCR产物电泳图 |
用SalⅠ和XbaⅠ同时将扩增获得的目的片段和pCMV5空载体酶切处理, 胶回收后连接并转化大肠杆菌DH5α琼脂糖凝胶电泳结果(图 3)显示, 双酶切后的载体和片段大小分别为4.8 kb(载体)和590 bp(目的片段), 符合预期。测序结果显示连入的RhoB基因与GenBank上的序列完全一致, 表明重组质粒构建成功。

|
| M:DNA分子量marker; 1:SalⅠ和XbaⅠ双酶切结果 图 3 重组质粒SalⅠ和XbaⅠ双酶切鉴定图 |
将空载体和重组质粒Flag-RhoB分别转染MCF7细胞、HeLa细胞或HCT116细胞进行Western Blotting分析。结果(图 4)显示, 转染了重组质粒的样品中检测到大小约为25 kD的蛋白条带, 而转染了空载体的对照组无任何信号。说明插入载体的RhoB基因成功表达, 且表达良好。
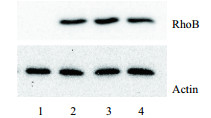
|
| 1:MCF7细胞转染空载体; 2:MCF7细胞; 3:HeLa细胞; 4:HCT116细胞 图 4 重组质粒在细胞中的表达检测 |
将重组质粒Flag-RhoB转染Mv.1.Lu细胞, 细胞免疫荧光实验初步分析RhoB蛋白在Mv.1.Lu细胞中的定位情况。免疫荧光结果(图 5)显示, Flag抗体可以检测到较强的荧光信号, 说明重组质粒表达良好。结果显示RhoB在细胞中主要定位于细胞膜上, 少量定位于细胞质中。
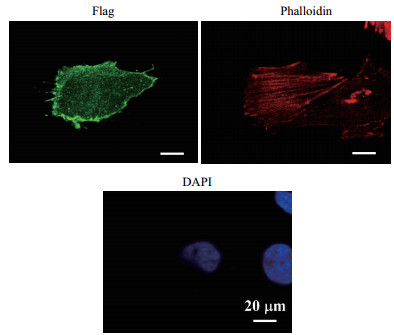
|
| 图 5 免疫荧光检测RhoB在细胞中的定位 |
尽管RhoB在肿瘤发生发展过程中表现出两面性[4], 但笔者认为更多的数据支持RhoB抑癌基因的特性。例如, Calvayrac等[19]研究发现定位于细胞质中的细胞周期蛋白激酶抑制因子p27Kip1通过结合并抑制RhoB蛋白的活性促进非小细胞肺癌的发生。Zou等[20]报道过表达RhoB通过上调PP2A的表达水平导致AKT1的去磷酸化失活, 进而抑制骨肉瘤细胞的肺转移。
另有文献报道, 敲低内源的RhoB后, 人胃癌细胞NUGC-3对抗癌药物表现出明显的药物不敏感性[21], 人咽喉癌细胞也表现出对顺铂的抗药性[22]。这些研究表明某些癌症在治疗过程中出现的抗药性很可能是由于RhoB表达量下调引起的, 提示可以在癌症治疗过程中人为提高RhoB的表达量或者以RhoB为靶点筛选合适的抗癌药物。因此, 深入阐明RhoB活性调控方式或者鉴定新的RhoB特异性效应因子有可能为癌症提供有效的治疗靶点。
本实验通过PCR技术构建了上游带有Flag标签的RhoB真核表达质粒, 可以方便开展有关RhoB的功能研究。将该质粒转染MCF7细胞、HeLa细胞和HCT116细胞, Western blotting结果表明该质粒在细胞中可以顺利表达。免疫荧光实验可以帮助判断过表达的RhoB在细胞中的亚定位, 结果显示其主要定位于细胞膜上, 胞质和胞核中也有少量分布。
在该质粒构建过程时, RhoB基因的3'端选择的是限制性内切酶XbaI。该酶的识别序列为TCTAGA, 与RhoB基因的终止密码子TGA相连会产生一段TGATCTAGA序列。这段序列中含有GATC序列, 所以需要考虑到原核生物Dam甲基化的问题。所以在设计引物时, 将RhoB的终止密码子替换成了TAA, 以避免GATC序列的产生。
4 结论成功扩增出长度为590 bp的RhoB基因的ORF序列, 并成功将其连入真核表达载体pCMV5。将重组真核表达质粒Flag-RhoB转染细胞后, 能够表达出大小为25 kD的蛋白。通过激光共聚焦显微镜观察到RhoB在细胞中主要定位于细胞膜上。
| [1] |
Palsuledesai CC, Surviladze Z, Waller A, et al. Activation of Rho family GTPases by small molecules[J]. ACS Chem Biol, 2018, 13(6): 1514-1524. DOI:10.1021/acschembio.8b00038 |
| [2] |
Peurois F, Peyroche G, Cherfils J, et al. Small GTPase peripheral binding to membranes:molecular determinants and supramolecular organization[J]. Biochem Soc Trans, 2019, 47(1): 13-22. |
| [3] |
Vega FM, Ridley AG. The RhoB small GTPase in physiology and disease[J]. Small GTPases, 2018, 9(5): 384-393. DOI:10.1080/21541248.2016.1253528 |
| [4] |
Ju JA, Gilkes DM. RhoB:Team oncogene or team tumor suppressor?[J]. Genes, 2018, 9(2): 67. DOI:10.3390/genes9020067 |
| [5] |
Narumiya S, Thumkeo D. Rho signaling research:history, current status and future directions[J]. FEBS Lett, 2018, 592(11): 1763-1776. DOI:10.1002/1873-3468.13087 |
| [6] |
Nomikou E, Livitsanou M, Stournaras C, et al. Transcriptional and post-transcriptional regulation of the genes encoding the small GTPases RhoA, RhoB, and RhoC:implications for the pathogenesis of human diseases[J]. Cell Mol Life Sci, 2018, 75(12): 2111-2124. DOI:10.1007/s00018-018-2787-y |
| [7] |
Mokady D, Meiri D. RhoGTPases-A novel link between cytoskeleton organization and cisplatin resistance[J]. Drug Resist Updat, 2015, 19: 22-32. DOI:10.1016/j.drup.2015.01.001 |
| [8] |
Koi C, Izumi H, Kurita T, et al. Lovastatin induced Kruppel like factor 2(KLF2), Kruppel like factor 6(KLF6)and Ras homolog family member B(RHOB)genes and preferentially led to viability reduction of Cisplatin-resistant cells[J]. Oncotarget, 2017, 8(63): 106429-106442. |
| [9] |
Ahn J, Choi JH, Won M, et al. The activation of p38 MAPK primarily contributes to UV-induced RhoB expression by recruiting the c-Jun and p300 to the distal CCAAT box of the RhoB promoter[J]. Biochem biophys Res Commun, 2011, 409(2): 211-216. DOI:10.1016/j.bbrc.2011.04.121 |
| [10] |
Wong VC. Nuclear EGFR and Integrator/Super Elongation Complex concurrently binds to Immediate Early Genes for gene transactivation[J]. J Cancer, 2018, 9(1): 108-116. |
| [11] |
Huang M, Satchell L, Duhadaway JB, et al. RhoB links PDGF signaling to cell migration by coordinating activation and localization of Cdc42 and Rac[J]. J Cell Biochem, 2011, 112(6): 1572-1584. DOI:10.1002/jcb.23069 |
| [12] |
Wei LJ, Li JA, Bai DM, et al. miR-223-RhoB signaling pathway regulates the proliferation and apoptosis of colon adenocarcinoma[J]. Chem Biol Interact, 2018, 289: 9-14. DOI:10.1016/j.cbi.2018.04.016 |
| [13] |
Marlow LA, Bok I, Smallridge RC, et al. RhoB upregulation leads to either apoptosis or cytostasis through differential target selection[J]. Endocr Relat Cancer, 2015, 22(5): 777-792. DOI:10.1530/ERC-14-0302 |
| [14] |
Ma Y, Gong Y, Cheng Z, et al. Critical functions of RhoB in support of glioblastoma tumorigenesis[J]. Neuro Oncol, 2015, 17(4): 516-525. DOI:10.1093/neuonc/nou228 |
| [15] |
Calvayrac O, Mazieres J, Figaro S, et al. The RAS-related GTPase RHOB confers resistance to EGFR-tyrosine kinase inhibitors in non-small-cell lung cancer via an AKT-dependent mechanism[J]. EMBO Mol Med, 2017, 9(2): 238-250. DOI:10.15252/emmm.201606646 |
| [16] |
Yoneda M, Hirokawa YS, Ohashi A, et al. RhoB enhances migration and MMP1 expression of prostate cancer DU145[J]. Exp Mol Pathol, 2010, 88(1): 90-95. |
| [17] |
Chen W, Niu S, Ma X, et al. RhoB acts as a tumor suppressor that inhibits malignancy of clear cell renal cell carcinoma[J]. PLoS One, 2016, 11(7): e0157599. DOI:10.1371/journal.pone.0157599 |
| [18] |
Tan Y, Yin H, Zhang H, et al. Sp1-driven up-regulation of miR-19a decreases RHOB and promotes pancreatic cancer[J]. Oncotarget, 2015, 6(19): 17391-17403. |
| [19] |
Calvayrac O, Nowosad A, Cabantous S, et al. Cytoplasmic p27Kip1 promotes tumorigenesis via suppression of RhoB activity[J]. J Pathol, 2019, 247(1): 60-71. |
| [20] |
Zou O, Xiao X, Liang Y, et al. miR-19a-mediated downregulation of RhoB inhibits the dephosphorylation of AKT1 and induces osteosarcoma cell metastasis[J]. J Pathol, 2019, 247(1): 60-71. |
| [21] |
Kim BK, Kim HM, Chung KS, et al. Upregulation of RhoB via c-Jun N-terminal kinase signaling induces apoptosis of the human gastric carcinoma NUGC-3 cells treated with NSC12618[J]. Carcinogenesis, 2011, 32(3): 254-261. DOI:10.1093/carcin/bgq244 |
| [22] |
Cimbora-Zovko T, Fritz G, Mikac N, et al. Downregulation of RhoB GTPase confers resistance to cisplatin in human laryngeal carcinoma cells[J]. Cancer Lett, 2010, 295(2): 182-190. DOI:10.1016/j.canlet.2010.02.025 |




