生物制品的质量控制不仅是对终产品的质量控制, 而且是对整个生产过程的连续监控, 包括原材料、中间品和制检过程的质控。细胞基质作为病毒性疫苗生产过程中必不可少的原材料, 其状态优劣直接影响疫苗产品的质量和产量。MRC-5细胞是人胚肺成纤维细胞, 可进行体外传代培养, 对多类病毒敏感[1]。自建株以来用于多种病毒性疫苗的生产和检定, 得到了良好的安全性验证, 如水痘疫苗[2]、带状疱疹疫苗[3]、甲肝疫苗[4]及狂犬疫苗[5]。但MRC-5作为二倍体细胞, 具有一定的传代寿命, 超过一定代次细胞衰老, 与传代细胞相比难以大规模生产。因此提高细胞状态和使用代次对该细胞的产业化应用具有重要意义。
细胞生长的微环境对细胞的影响极大。对于已建株的细胞系, 很多工作都是围绕优化培养而开展[6-9]。pH是细胞培养过程中一个重要参数, 并且不同细胞株有不同的pH适应范围[10-13]。根据细胞培养方式不同, 悬浮培养(包括悬浮细胞和贴壁细胞的微载体培养)使用反应器控制pH更为精确和容易, 在一定范围内的pH波动对细胞生长和产物表达不会产生太大影响[14-16]。而贴壁细胞有较多的方瓶、转瓶和细胞工厂静置培养方式, 此类容器pH可控性差, 在pH条件的优化研究中更多体现在培养起始阶段[6, 17-19], 对培养过程中pH动态变化及对细胞产生的影响研究较少。
目前较市售应用的细胞培养基多添加NaHCO3作为缓冲盐, 匹配合适的CO2浓度组成pH缓冲对体系。空气中CO2分压会影响培养液pH的稳定性。特别是在开放式培养皿培养细胞或进行高浓度的转化细胞系培养时, 需要使用CO2培养箱以保证足够的CO2分压。本实验以NaHCO3调节细胞培养基pH值, 并在pH 7.2-7.6范围配合CO2使用情况, 对MRC-5细胞连续传代过程中的细胞状态、工作代次和病毒敏感性进行检测分析, 旨在提高MRC-5细胞连续传代水平。
1 材料与方法 1.1 材料 1.1.1 细胞MRC-5细胞(ATCC)由本公司疫苗生产部提供建库, 代次为27代, 浓度为5.0×106个/mL。水痘-带状疱疹病毒(VZV)毒种, 由本公司疫苗生产部提供, 代次为32代, 滴度约为5.0 Lg PFU/mL。
1.1.2 主要试剂MEM干粉、胎牛血清、青-链霉素双抗、0.25%胰酶均购自Gibco公司; NaHCO3购自国药集团化学试剂有限公司; 台盼蓝溶液购自碧云天生物; EDTA细胞消化液、病毒稳定剂由本公司疫苗生产部提供。
1.2 方法 1.2.1 配制细胞培养液MEM干粉按照使用说明书溶解后过滤除菌, 作为基础培养基备用。按照质量体积比配制5% NaHCO3母液, 过滤除菌备用。配制细胞培养液时, 使用5%NaHCO3母液调节基础培养基pH, 添加胎牛血清10%-15%, 抗生素1%。
1.2.2 细胞复苏从液氮中取出1支冻存的MRC-5细胞, 确认批号、代次、浓度, 迅速在38±1℃水浴中融化, 复苏至T225一次性细胞培养瓶中, 轻微摇匀, 置37℃, 5% CO2浓度的细胞培养箱中连续培养3-4 d至细胞生长成片。
1.2.3 细胞传代培养复苏细胞生长成片后进行传代。吸去原细胞培养液, 添加0.25%胰酶5-10 mL消化1-2 min。加入新鲜细胞培养液重悬, 按照1:4传代比率分装细胞悬液至若干T25细胞培养瓶, 置于37℃, 5% CO2浓度的细胞培养箱中培养。
约4-5 h细胞贴壁后, 更换不同NaHCO3浓度的细胞培养基, 并对瓶盖进行封闭式(对照组, CO2气体不能进入细胞瓶)和开放式(试验组, CO2气体可以进入细胞瓶)处理。在继续培养过程中, 每隔一定的时间进行培养基pH测定并统计细胞生长密度。每组保留1-2瓶, 固定使用同一NaHCO3浓度的培养液和通气处理方式连续传代, 并在细胞收获数较低(< 0.2×105个/cm2)达不到传代要求时停止实验。
1.2.4 细胞监测每天用倒置显微镜观察细胞的生长状态, 包括细胞的形态、密度、增殖速度等, 并拍照记录。在每一次传代的同时统计收获细胞数和细胞活率。
1.2.5 病毒接种及收获取VZV毒种按照MOI=0.001-0.01接种生长成片的31代细胞, 换液后连续培养2-3 d, 待病变率达到35%-90%, 使用EDTA消化病变细胞, 1 800 r/min离心10 min, 使用稳定剂重悬, -70℃冻存备用, 进行滴度测定。
1.2.6 病毒滴定以蚀斑法测定病毒滴度。取冻存的病变细胞, 在冷冻和37±1℃条件下反复冻融3-4次, 镜检观察细胞完整率≤20%。1 800 r/min×10 min离心取上清, 对上清液进行500倍和1 000倍稀释。取预先铺满MRC-5细胞的6孔板, 每孔接种病毒上清稀释液100 μL, 吸附90 min后添加细胞维持液继续培养7 d, 统计每孔蚀斑数。
病毒滴度(PFU/mL)=n×D/V
n:每孔蚀斑数(平均值); D:稀释倍数; V:每孔接种体积。
2 结果添加不同比例NaHCO3母液(2.0%、2.5%、3.0%、3.5%和4.0%)调节MEM基础培养基pH, 配制后的完全培养液起始pH值为7.3-7.7。在2.0%和3.0%添加比例时pH分别为7.3和7.5, 选择此两种浓度设计实验, 观察CO2的使用对细胞培养液pH稳定性以及对细胞培养效果的影响。
2.1 培养条件对细胞培养液pH稳定性的影响以2.0%封闭培养作为对照组, 3%试验组同时设计封闭培养和开放培养, 监测31代次细胞培养过程中的pH变化情况并统计。图 1显示封闭培养的2%和3%两组细胞在培养2 h后pH即发生急速升高, 在8-30 h内达到最高, 2.0%组约7.7, 3.0%组约8.0, 此时培养液呈深红偏紫色。随后, pH开始下降, 在96 h后2.0%组下降至7.2-6.8, 3.0%组下降至7.3-7.1。此时培养基呈红偏黄色。而开放培养的3%组细胞培养液则相对稳定, 在连续144 h的培养过程中最高为7.5, 最低为7.2, 培养液颜色呈红偏棕黄色。
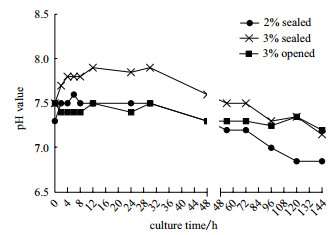
|
| 图 1 细胞培养过程中pH动态变化趋势 |
镜检观察31代细胞状态, 统计并绘制细胞生长增殖曲线。3组细胞在早期贴附、爬壁阶段(24-48 h)生长增殖相近, 均可正常贴壁增殖, 形态清晰呈典型纤维状。但在72 h汇合率开始体现出差异, 3%开放组细胞排列成形, 至96 h已有80%以上的汇合率。而封闭培养的细胞则增殖缓慢, 细胞折光性强, 3%组在培养120 h后仍未能成片(图 2)。通过31代细胞生长增殖曲线也可以看出, 开放培养的细胞从延滞期进入对数期明显快于封闭组(图 3)。
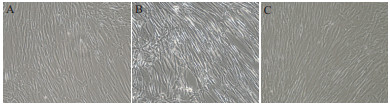
|
| A:2%封闭组细胞;B:3%封闭组细胞;C:3%开放组细胞 图 2 31代细胞生长形态 |

|
| 图 3 31代细胞生长增殖曲线 |
传代早期细胞状态和细胞数尚无明显差异, 细胞形态清晰呈典型纤维状, 成片后细胞排列整齐, 汇合率90%以上, 收获细胞数在(0.5-0.7)×105个/cm2。连续传代至31代后3组细胞收获密度均开始下滑, 细胞形态和细胞活率开始体现出差异。封闭培养细胞折光性增强, 胞内颗粒性内涵物逐渐增多, 细胞排列散乱, 生长增殖速度和细胞活率急剧下降, 至35-37代已不能成片, 收获细胞数低于阈值, 达不到继续传代要求, 见图 4。开放培养细胞形态仍保持纤维状排列, 细胞活率维持在80%以上, 细胞状态下降趋势相对缓慢, 可连续传代至41代。

|
| 图 4 连续传代细胞收获密度和细胞活率 |
取31代细胞接种VZV病毒, 观察病毒敏感性并统计产毒滴度。封闭培养细胞接毒后24 h细胞有圆缩、肿大、折光性增强, 48 h局部融合病变, 病变率约为60%-80%(图 5)。收获病变细胞后采用反复冻融法释放病毒, 噬斑法检测病毒滴度分别为4.67 Lg PFU/mL和4.60 Lg PFU/mL。开放组细胞病变与封闭组相似, 产毒滴度略高约为4.83 Lg PFU/mL, 但差异不显著(图 6, P=0.13 > 0.05)。

|
| A:2%封闭组细胞病变;B:3%封闭组细胞病变;C:3%开放组细胞病变 图 5 MRC-5细胞接种VZV病变形态 |
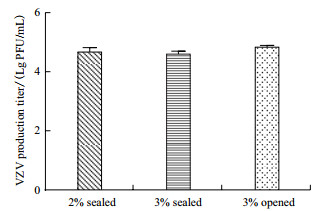
|
| 图 6 MRC-5细胞接种VZV产毒滴度 |
细胞培养基除提供细胞生长所必须的营养成分外, 还负责维持适宜的理化环境, 如pH稳定。培养基一般通过添加碳酸氢盐或其他有机缓冲盐(如HEPES), 稳定培养过程中pH变化在一个合理范围。在采用碳酸氢钠作为缓冲时, 培养液pH值取决于碳酸氢根(HCO3-)和溶解态CO2浓度之间的精密平衡。若无CO2外环境或CO2分压不足, HCO3-水解反应平衡式右移, 导致pH快速升高。而在培养过程中随着细胞生长、增殖, 细胞代谢副产物, 如乳酸逐渐累积增多, pH才会缓慢下降。这种pH值的较大起伏变化是细胞生长的不利因素。
本实验对细胞培养过程中的pH变化进行了动态监测。从pH变化曲线和对应的细胞生长曲线可以看出, 不恰当的培养方式使得碳酸氢根被过度水解消耗, 导致细胞培养液pH培养2 h就会急剧升高, 并维持至30 h左右。此时细胞生长正处于延滞期, 细胞行为处于贴附、爬壁过程中, 过高的pH环境会造成细胞贴壁率低, 细胞受损等。而在2-3 d(约48 h)后, 随着细胞增殖进入对数期, 细胞代谢加快, 密度升高, 细胞产酸增多, pH开始回落。但碳酸氢根浓度过低, 已无法起到缓冲效果, 导致培养基pH持续走低。pH大幅波动不仅对单代次细胞生长造成损伤, 而且这种损伤还可能累积影响整个细胞培养周期。高代次的封闭组细胞折光性增强, 细胞内含物、颗粒性物质增多, 细胞活率下降明显。而开放组细胞仍能保持胞质均匀清晰, 细胞骨架排列整齐, 并维持较高的细胞活率, 可连续传代至41代。两组细胞接种VZV测试产毒效果, 开放组细胞产毒滴度略高于封闭组。综上验证了稳定的pH环境对细胞代次和状态具有重要的影响, 并且这种影响会在连续的传代培养中得到累积体现。
疫苗生产用细胞基质通常包括原代细胞、二倍体细胞和连续传代细胞。MRC-5属于人类同源性二倍体细胞系, 与原代细胞相比, 可建立种子库系统进行充分鉴定和标准化, 利于质量控制; 与连续传代细胞相比, 理论上不存在致肿瘤的潜在风险[20]。但MRC-5由于传代寿命的限制, 难以大规模生产。为突破工作代次, 提升细胞状态, 可添加辅助成分进行优化研究[21-22], 但由此可能带来引入外源因子的风险以及产品安全性风险。因此为提高细胞状态选择合适的培养优化方式具有重要意义。本实验仅通过调节NaHCO3浓度配合CO2分压的使用, 显著提高了MRC-5细胞状态和连续传代能力, 在使用方瓶、或放量应用细胞工厂、转瓶培养MRC-5细胞时, 为其优化应用提供了数据支持。
4 结论通过监测贴壁细胞MRC-5静置培养过程中的pH动态变化, 发现不恰当的培养方式会导致细胞在延滞期和对数期早期受到损伤, 并且这种损伤会在连续的传代培养中积累。而通过调节NaHCO3浓度与CO2分压的使用, 可以明显提高MRC-5细胞状态和连续传代能力。
| [1] |
Jacobs JP. The status of human diploid cell strain MRC-5 as an approved substrate for the production of viral vaccines[J]. J Biol Stand, 1976, 4: 97-99. DOI:10.1016/0092-1157(76)90018-4 |
| [2] |
殷月娣, 徐建军, 王宪明, 等. MRC-5人二倍体细胞培养Oka株水痘病毒的研究[J]. 传染病信息, 2001, 14(2): 71-72. DOI:10.3969/j.issn.1007-8134.2001.02.009 |
| [3] |
Oxman MN, Levin MJ, Johnson GR, et al. A Vaccine to prevent herpes zoster and postherpetic neuralgia in older adults[J]. N Eng J Med, 2005, 352(20): 2271-2284. |
| [4] |
张现臣, 魏文进, 黄秋香, 等.一种制备甲型肝炎灭活疫苗的方法: 中国, CN102058882B[P], 2012-12-26.
|
| [5] |
张芮铭, 高正伦, 方群, 等. 狂犬病病毒PM株在人二倍体MRC-5细胞中的感染特性[J]. 中国生物制品学杂志, 2013, 26(9): 1258-1263. |
| [6] |
陈通威, 赵鹏. 不同pH值对人胚肺二倍体成纤维细胞MRC-5生长的影响[J]. 山西医科大学学报, 2014, 45(5): 347-349. |
| [7] |
Florence W, Reddy K, Nadeau I, et al. Optimization of a MRC-5 cell culture process for the production of a smallpox vaccine[J]. Cytotechnology, 2005, 49: 95-107. DOI:10.1007/s10616-005-4022-6 |
| [8] |
Arthur KB, Richard JR, Wende RR, et al. Effects of oxygen, growth state, and senescence on the antioxidant responses of WI-38 fibroblasts[J]. AGE, 2010, 32: 435-449. DOI:10.1007/s11357-010-9149-5 |
| [9] |
顾春燕, 唐彩华, 李剑波, 等. MRC-5人二倍体细胞培养条件的优化[J]. 浙江预防医学, 2015, 27(3): 257-261. |
| [10] |
Yang H, Miller W, Papoutsakis ET. Higher pH promotes megakar-yocytic maturation and apoptosis[J]. Stem Cells, 2002, 20(4): 320-328. DOI:10.1634/stemcells.20-4-320 |
| [11] |
McAdams TA, Miller WM, Papoutsakis ET. Variations in culture pH affect the cloning efficiency and differentiation of progenitor cells in ex vivo haemopoiesis[J]. Br J Haematol, 1997, 97(4): 889-895. DOI:10.1046/j.1365-2141.1997.1372951.x |
| [12] |
Teo A, Mantalaris A, Lim M. Influence of culture pH on proliferation and cardiac differentiation of murine embryonic stem cells[J]. Biochemical Engineering Journal, 2014, 90: 8-15. DOI:10.1016/j.bej.2014.05.005 |
| [13] |
Allaire A, Luong MX, Smith KP. Basic cell culture growth conditions in: Human Stem Cell Technology and Biology[M]//Stein GS, Borowski M, Luong MX, et al. A Research Guide and Laboratory Manual. Wiley-Blackwell, 2011: 34-35.
|
| [14] |
路明华, 刘俊生, 刘延亭, 等. BHK-21细胞生物反应器悬浮培养参数研究[J]. 中国动物保健, 2015, 17(12): 69-70. DOI:10.3969/j.issn.1008-4754.2015.12.033 |
| [15] |
刘金涛, 王星懿, 范里, 等. 大型反应器内pH不均一性对CHO细胞流加培养过程的影响[J]. 生物技术通报, 2015, 31(10): 236-241. |
| [16] |
肖尚, 邓崇飞, 柯军, 等. pH对重组CHO细胞生长、单抗表达及质量的影响[J]. 生物技术通报, 2015, 31(12): 256-261. |
| [17] |
袁建琴, 高斌战, 郑明学. 不同pH值对鸡胚成纤维细胞培养的影响[J]. 养殖与饲料, 2010(9): 1-5. DOI:10.3969/j.issn.1671-427X.2010.09.001 |
| [18] |
杨劲松, 杨渊. 不同pH值的培养液对兔骨髓间充质干细胞体外培养的影响[J]. 右江医学, 2004, 32(6): 519-522. DOI:10.3969/j.issn.1003-1383.2004.06.001 |
| [19] |
张训海, 张先明, 韩北芳, 等. 鸭胚成纤维细胞培养方法的初步建立[J]. 安徽农业技术师范学院学报, 2001, 15(2): 43-45. DOI:10.3969/j.issn.1673-8772.2001.02.015 |
| [20] |
药品审评中心.疫苗生产用细胞基质的技术审评一般原则[S].北京: 2005.
|
| [21] |
王培昌, 张雁冰. 白藜芦醇、染料木黄酮、姜黄素和大黄素对2BS细胞生长增殖能力的影响[J]. 中国老年学杂志, 2018, 38(22): 5510-5512. DOI:10.3969/j.issn.1005-9202.2018.22.054 |
| [22] |
Chong MP, Barritt GJ, Crouch MF. Insulin potentiates EGFR activation and signaling in fibroblasts[J]. Biochemical and Biophysical Research Communications, 2004, 322: 535-541. DOI:10.1016/j.bbrc.2004.07.150 |




