2. 西北民族大学实验教学部,兰州 730030
2. Experimental Teaching Department, Northwest Minzu University, Lanzhou 730030
动物的生长发育是由许多信号传导途径上的调控因子协同来执行的,体内几乎所有的激素都直接或间接地参与机体生长的调节[1-2]。对于生物的整个生长和分化过程起到重要调节作用的是同源盒基因在动物组织中表达出来的一种转录调节因子[3-5]。LIM同源盒3基因(LIM homeobox gene 3,LHX3)是位于脑垂体上游重要的调节因子之一[6],其蛋白产物是垂体发育和运动神经元特化所需要的神经内分泌转录因子[7-10]。LHX3因其自身的结构特点使其既可以进行自调节又可以激活垂体激素基因,包括生长激素(Growth hormone,GH)、催乳素(Prolactin,PRL)、促黄体生成素(Luteini-zing hormone,LH)、促卵泡生成激素(Follicle-stimulating hormone,FSH)和促甲状腺素(Thyrotropin,thyroid stimulating hormone,TSH)等[11],而这些激素大多与动物的生长繁殖有一定的联系[6]。由于LHX3 及其产物在垂体的早期发育及垂体激素分泌中发挥着关键的作用,如对POUIF1、PRL 和GH的调控[12],故该基因在绵羊的生长发育方面具有重要的遗传效应。插入/缺失是研究动植物基因组DNA进化和育种、种质保护、选择利用的最简单快速的分子标记之一,它不仅扩增产物带型简单清晰,稳定性和产物分离效果均明显优于SSR标记[13]; 还较SNP标记检测简单便捷,对仪器设备和技术要求较低,在电泳技术平台上即可进行[14]。因此,动植物中插入/缺失的开发、鉴定和功能分析越来越受到研究者的关注[15]。本实验以滩羊(Tan sheep,TS)、小尾寒羊(Small-tailed Han sheep,STHS)、兰州大尾羊(Lanzhou Fat-tailed sheep,LFTS)为研究对象,以LHX3作为研究影响绵羊生长发育的候选基因,寻找与绵羊生长发育相关的分子标记,为绵羊的分子选育和种质资源的有效利用提供一定的理论依据。
1 材料与方法 1.1 材料实验动物为1 269只绵羊(1-1.5岁,公母随机),生长发育正常、健康无病且同一品种绵羊的饲养管理条件相同。其中滩羊(TS,n=1 018,宁夏盐池县鑫海食品有限公司)、小尾寒羊(STHS,n=131,甘肃永靖县瑞霖科技养殖有限公司)、兰州大尾羊(LFTS,n=120,甘肃永靖县瑞霖科技养殖有限公司)。
1.2 方法 1.2.1 数据收集先将绵羊耳缘被毛刮干净,用75%酒精擦拭消毒之后用耳钳采集黄豆粒大小耳组织,放入1.5 mL离心管并加1 mL 75%乙醇,固定后带回实验室于-80℃冰箱低温保存。所有绵羊的数据测量均由同一人采样同一标准测量,包括体长(Body length,BL)、体重(Body weight,BW)、体高(Body hight,BH)、胸深(Chest depth,ChD)、胸宽(Chest width,ChW)、胸围(Chest cicumference,ChC)、管围(Cannon circumference,CaC)和十字部高(Hip width,HW)。后期根据数据统计分析,进行不同绵羊品种LHX3基因多态性与生长性状之间的关联分析。
1.2.2 基因组DNA的提取及检测采用苯酚-氯仿抽提法[16]从耳缘组织中提取总基因DNA,并用核酸测定仪测定基因组DNA的浓度和OD值。当OD值260/280在1.8-2.0之间时,则DNA质量较优,符合试验要求。
1.2.3 引物设计按照GenBank数据库中已经公布的绵羊LHX3基因的mRNA序列(GenBank:NC_019460.2),参照Zhao等[6]设计的特异性引物用于扩增不同品种绵羊的LHX3基因。引物序列为(F:5'-CTCTGAACTGCCAGGACCCA-3';R:5'-ACTCCA-CGATGCAGCCAAGA-3'),由上海生物工程科技有限公司合成。
1.2.4 PCR反应体系和扩增条件PCR扩增体系为50 μL:基因组DNA模板3.0 μL,上游引物 LHX3-F 1.5 μL,下游引物LHX3-R 1.5 μL,2×Master Mix 25 μL,ddH2O 19 μL。
为了确定引物的最佳退火温度(Tm),先利用梯度PCR进行筛选,随后在最佳Tm值下进行PCR扩增。PCR扩增程序为:94℃预变性5 min; 94℃变性45 s,61.4℃退火30 s,72℃延伸30 s,共30个循环; 72℃延伸5 min,4℃保存。采用1.5%琼脂糖凝胶对其扩增产物进行检测,并将PCR产物送上海生物工程科技有限公司进行序列测定。
1.2.5 数据统计分析方法将测序结果与绵羊LHX3基因序列(GenBank:NC_019460.2)做比对,利用网站 www.Msrcall.com计算和分析哈德-温伯格平衡(Hardy-Weinberg equilibrium,HWE)、有效等位基因数(Ne)、杂合度(He)、纯合度(Ho)、多态性信息(PIC)、基因型频率和等位基因频率。利用SPSS19.0软件进行统计检验[17],并对不同位点基因型的分布进行χ2检测,当χ2 < χ20.05时,表明该基因位点处在Hardy-Weinberg动态平衡; 当χ20.05 < χ2 < χ20.01时为Hardy-Weinberg不平衡状态[18-19]。利用PIC软件统计多态信息含量(PIC),公式如下:

Pi和Pj分别为第i个和第j个等位基因频率,n为等位基因数。当PIC > 0.5时,该突变位点处在高度多态; 当0.25 < PIC≤0.5时为中度多态; 当PIC≤0.25时为低度多态。
对于绵羊的8个生长性状按照 LHX3所表现出来的3个基因型进行统计分析,利用SPSS19.0软件的一般线性模型(GLM)分析个体基因型对绵羊生长性状的影响。Y=u+maker+gender+MG+e,式中u为群体平均值,marker为基因型效应,gender为性别效应,MG为基因型与性别的互作效应,e为随机残差。对同一品种的不同基因型进行对比分析,结果用“Mean±SE”表示。
2 结果 2.1 LHX3基因PCR扩增分析PCR产物经过1.5%琼脂糖凝胶(120 V,60 min)电泳,结果如图 1所示,LHX3基因PCR扩增产物的电泳条带清晰且无杂带,PCR产物具有3种类型:其中插入型(AA)为280 bp单一条带,缺失型(BB)为251 bp单一条带,插入/缺失型(AB)为251 bp和280 bp两个条带(图 1)。
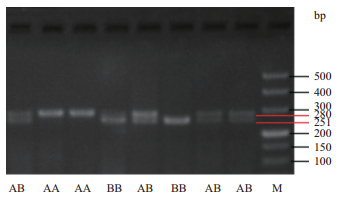
|
| 图 1 绵羊LHX3基因PCR扩增产物检测结果 |
对PCR产物进行测序,测序峰图如图 2所示,插入/缺失片段为“GCCTGGACTGTGATGGGCACCCTCCGGGGTAG”,所得到的结果与NCBI数据库中预测的结果相同(NC_019460.2:g.3107494-3107522 del GGCCTGGACTGATGGGCACCCTCCGGG)。

|
| 图 2 绵羊LHX3基因中29个bp的插入/缺失的测序图谱 |
测序结果(图 2)显示,基因型为插入/插入型(AA)的扩增片段长度为280 bp,缺失/缺失型(BB)为251 bp,经序列比对发现,其核苷酸序列与GenBank绵羊LHX3基因序列的同源度为96%以上,所扩增产物为绵羊LHX3基因片段。
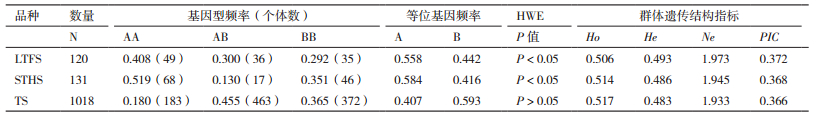
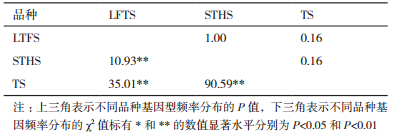
2.3 LHX3基因多态性位点分析对3个品种绵羊中的基因型频率和基因频率进行了统计分析,结果如表 1所示,这3个品种绵羊的He和Ho非常接近,Ne接近于2。对于目前的基因位点来说,LTFS和STHS处于Hardy-Weinberg平衡状态(P < 0.05),而TS处于Hardy-Weinberg不平衡状态(P > 0.05),3个绵羊品种的PIC都呈现为中等程度的多态性(0.25 < PIC≤0.5)。由表 2可以看出绵羊不同品种间基因型多态性分布的卡方独立性检验中,LFTS、STHS、TS两两之间的基因型频率与等位基因频率均具有差异(P < 0.01)。
本实验着重于考虑基因型效应对于表型值的影响程度。采用SPSS19.0软件和Grandpad Prism分析不同基因型间生长性状差异的显著性(表 3)。
由图 3可以看出,在LFTS中,BB基因型个体各生长性状均高于AA基因型和AB基因型个体,其次,LFTS的BB基因型的BL、BH这2个生长性状指标明显高于AA基因型和AB基因型(P < 0.01),而在ChD、CaC这2个生长性状指标则表现为BB基因型明显高于AB基因型(P < 0.01)。

|
| 图 3 LHX3基因不同基因型与LFTS生长性状之间的关联分析 |
由图 4可以看出,在STHS这一群体中,BB基因型各生长性状大多高于AA基因型和AB基因型,且在ChD、CaC这两个生长性状中BB基因型显著高于AB基因型(P < 0.01)。STHS的BB基因型的ChC、ChD极显著高于AA基因型(P < 0.01)。

|
| 图 4 LHX3基因不同基因型与STHS生长性状之间的关联分析 |
由图 5可以看出,TS的生长性状指标中BB基因型在BL、ChD上显著高于AB基因型(P < 0.01),BB基因型ChD、CaC这2个生长性状明显高于AA基因型(P < 0.05)。在BL这个生长性状中,AA基因型和BB基因型都表现出较高优势,且BB基因型优于AA基因型。通过以上分析可以看出该29 bp插入/缺失位点与绵羊的生长性状指标明显相关。

|
| *表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),无*表示差异不显著(P > 0.05)。此图为品种内不同基因型之间的比较 图 5 LHX3基因不同基因型与TS生长形状之间的关联分析 |
Ne、He、PIC、Ho等指标从不同角度反映了群体的遗传变异程度。一般认为群体的He与遗传多样性密切相关,群体He越高,群体的遗传变异越大,遗传多样性就越丰富,选择的潜力就越大[20]。本实验中,3个不同绵羊品种LHX3基因的Ho均在0.5左右,He均在0.49左右,Ne均在1.9左右,PIC均在0.37左右,为中度多态位点,表明在该位点的遗传变异相对较高。
根据表 1中HWE和PIC的分类,可以看出29个bp插入/缺失位点在3个不同绵羊品种中均处于中等程度多态。也就是说,29 bp的插入/缺失位点具有丰富的遗传多样性,这个位点可以用来评估绵羊遗传资源的丰富程度。LFTS和STHS品种中HWE的P值均低于0.05,造成这种情况的原因可能是选种和选配不平衡,群体数量较小并受到高度选择,导致群体偏离了HWE规律。
3.2 LHX3基因多态性与生长性状关联分析动物的生长发育过程是由众多调控因子综合作用的结果,因此对一些有着重要功能的基因结构和功能的认识显得十分重要。LHX3基因不仅对许多器官的发育和功能有重要的作用,其突变会严重影响其靶器官发育和功能[21],而且它还是非常重要的垂体转录因子,对动物的生长繁殖起重要作用,它既可以进行自调节又可以激活与动物的生长繁殖有一定的联系的垂体激素基因[6],包括GH、PRL、LH、FSH和TSH等[11]。国内外对LHX3基因的研究大多集中在患者内分泌系统、激素缺乏、肺癌相关病理研究以及对神经系统的调控作用上[22-28],关于LHX3作为改善家畜生长性状的候选基因的报道逐渐增多,LHX3基因多态性在山羊和牛上的研究已有报道[11],发现LHX3中存在插入/缺失位点,其中一些单核苷酸所呈现出来的多态性(Single nucleotide polymorphisms,SNP)位点可以影响山羊和奶牛生长性状和奶的品质[11, 29]。但关于LHX3基因多态性对绵羊生长性状的关联分析的研究并不多见。
遗传变异主要有两方面的应用,一是基于功能变异的选择; 二是将该遗传变异用于遗传评估的模型中[30]。经过分子生物学的长期发展,与之而来的是更多深入的研究,利用分子标记技术对家畜进行遗传多态性分析得到广泛运用[31-33]。插入/缺失作为一种新的遗传标记辅助选择方法,能够更加快速有效地探究LHX3基因多态性是否影响绵羊的生长发育,有研究报道了关键基因插入/缺失与家畜生长性状相关,如闫海龙等[34]发现生长激素受体(Growth hormonereceptor,GHR)基因9 bp的插入/缺失能显著提高陕北白绒山羊的体重和多个生长性状; 邬明丽等[35]报道黄牛溶酶体转录调控因子(Lysos-omal trafficking regulator,LYST)基因22 bp的插入/缺失突变能够显著影响郏县红牛的生长性状。
本实验分析了LHX3基因29 bp插入/缺失位点与绵羊生长性状之间的关系,在TS中BB基因型的个体存在诸多优良性状包括BL、BW、ChD和CaC,并且纯合子BB基因型和AA基因型比杂合子AB基因型个体有着更高的先天优势。本实验结果表明LFTS、STHS和TS中LHX3基因的3个基因型的生长性能都存在显著性差异,可见绵羊生长性能与这个插入/缺失位点之间存在一定的相关性。通过数据分析发现BB基因型有利于LFTS、STHS和TS的生长,这是一个潜在的遗传标记位点,可用于绵羊的遗传分析和优良个体选择。本实验所用样本虽然存在一定的局限性,但结果表明B等位基因是优势基因,纯合子的BB基因型个体更具有先天优势,可以在育种工作中选择。3个绵羊品种均为中度多态且数值接近,说明这3个绵羊品种中的遗传变异程度相似,具有相对较高的选择潜力。
4 结论LFTS、STHS和TS的LHX3基因中存在一个29 bp的插入/缺失(NC_019460.2:g.3107494-3107522 del GGCCTGGACTGATGGGCACCCTCCGGG)突变,该突变与生长性能相关,可以作为绵羊选育的DNA标记位点。
| [1] |
靖永杰.黄牛LHX3、PAX6基因遗传特性及其与生长性状关联分析[D].杨凌: 西北农林科技大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10712-2010050347.htm
|
| [2] |
马青, 刘彩凤, 施安, 等. GH和GHR基因多态性与滩羊生长性状的关联分析[J]. 黑龙江畜牧兽医, 2015(11): 31-34. |
| [3] |
Erb M, Lee B, Seo SY, et al. The ISL1-LHX3 complex promotes motor neuron specification by activating transcriptional pathways that enhance its own expression and formation[J]. Eneuro, 2017, 4(2). DOI:10.1523/ENEURO.0349-16.2017 |
| [4] |
Bach I, Rhodes SJ, Pearse RV, et al. P-Lim, a LIM homeodomain factor, is expressed during pituitary organ and cell commitment and synergizes with Pit-1[J]. Proceedings of the National Academy of Sciences, 1995, 92(7): 2720-2724. DOI:10.1073/pnas.92.7.2720 |
| [5] |
Hunter CS, Rhodes SJ. LIM-homeodomain genes in mammalian development and human disease[J]. Molecular Biology Reports, 2005, 32(2): 67-77. DOI:10.1007/s11033-004-7657-z |
| [6] |
Zhao HD, He S, Cao X, et al. A novel 29 bp insertion/deletion(indel)variant of the LHX3 gene and its influence on growth traits in four sheep breeds of various fecundity[J]. Archives Animal Breeding, 2017, 60: 79-85. DOI:10.5194/aab-60-79-2017 |
| [7] |
Sloop KW, Meier BC, Bridwell JAL, et al. Differential activation of pituitary hormone genes by human LHX3 isoforms with distinct DNA binding properties[J]. Molecular Endocrinology, 1999, 13(12): 2212-2225. DOI:10.1210/mend.13.12.0395 |
| [8] |
Susa T, Ishikawa A, Kato T, et al. Regulation of porcine pituitary glycoprotein hormone alpha subunit gene with LIM-homeobox transcription factor LHX3[J]. Journal of Reproduction & Development, 2009, 55(4): 425-432. |
| [9] |
Jullien N, Romanet P, Philippon M, et al. Heterozygous LHX3 muta-tions may lead to a mild phenotype of combined pituitary hormone deficiency[J]. Eur J Hum Genet, 2019, 27(2): 216-225. |
| [10] |
Mcgillivray SM, Bailey JS, Ramezani R, et al. Mouse GnRH receptor gene expression is mediated by the LHX3 homeodomain Protein[J]. Endocrinology, 2005, 146(5): 2180-2185. DOI:10.1210/en.2004-1566 |
| [11] |
刘金彪, 蓝贤勇, 徐瑶, 等.山羊LIM同源框基因LHX3分子遗传特征研究[C]//全国养羊生产与学术研讨会论文集, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgcsdw2010z1057
|
| [12] |
李栋元, 李景云, 杨具田, 等. 兰州大尾羊mtDNA D-loop和Cytb区序列分析与多态性研究[J]. 中兽医医药志, 2011, 30(5): 14-17. |
| [13] |
冯芳君, 罗利军, 李荧, 等. 水稻InDel和SSR标记多态性的比较分析[J]. 分子植物育种, 2005, 3(5): 725-730. DOI:10.3969/j.issn.1672-416X.2005.05.024 |
| [14] |
杨洁, 赫佳, 王丹碧, 等. InDel标记的研究和应用进展[J]. 生物多样性, 2016, 24(2): 237-243. |
| [15] |
吉康娜, 郅俊杰, 林丹妮, 等.基于茄子基因组重测序的InDel标记开发及应用[J/OL].植物遗传资源学报. doi:10.13430/j.cnki.jpgr,20190130001.
|
| [16] |
蔡翠翠.黄牛ACTL8基因的遗传变异及组织表达谱研究[D].杨凌: 西北农林科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10712-1016157671.htm
|
| [17] |
Li J, Zhu X, Ma L, et al. Detection of a new 20-bp insertion/deletion(indel)within sheepr, PRNDr, gene using mathematical expectation(ME)method[J]. Prion, 2017, 11(2): 143-150. DOI:10.1080/19336896.2017.1300740 |
| [18] |
康晓龙, 张莉莉, 等. FTO基因多态性及其与2个绵羊群体生长性状的相关性[J]. 西南农业学报, 2017(11): 217-222. |
| [19] |
宁素恒, 徐军, 马生虎, 等. 宁夏地区荷斯坦牛Nramp1基因多态性分析[J]. 中国奶牛, 2015(17): 24-27. DOI:10.3969/j.issn.1004-4264.2015.17.006 |
| [20] |
Zhao H, He S, Wang S, et al. Two new insertion/deletion variants of the PITX2 gene and their effects on growth traits in sheep[J]. Animal Biotechnology, 2017, 29(4): 276-282. |
| [21] |
刘金彪.山羊LHX3基因遗传变异分析及Myf5基因CDS区的克隆[D].杨凌: 西北农林科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10712-1011402758.htm
|
| [22] |
Ramzan K, Bin-Abbas B, Al-Jomaa L, et al. Two novel LHX3 mutations in patients with combined pituitary hormone deficiency including cervical rigidity and sensorineural hearing loss[J]. BMC Endocrine Disorders, 2017, 17(1): 17-29. DOI:10.1186/s12902-017-0164-8 |
| [23] |
Lin X, Li Y, Wang J, et al. LHX3 is an early stage and radiosensitivity prognostic biomarker in lung adenocarcinoma[J]. Oncology Reports, 2017, 38(3): 1482-1490. DOI:10.3892/or.2017.5833 |
| [24] |
Bhati M, Llamosas E, Jacques DA, et al. Interactions between LHX3-And ISL1-family LIM-homeodomain transcription factors are conserved in Caenorhabditis elegans[J]. Scientific Reports, 2017, 7: 4579-4594. DOI:10.1038/s41598-017-04587-8 |
| [25] |
Jin-Ho C, Chang-Woo J, Eungu K, et al. Rare frequency of mutations in pituitary transcription factor genes in combined pituitary hormone or isolated growth hormone deficiencies in Korea[J]. Yonsei Medical Journal, 2017, 58(3): 527-532. DOI:10.3349/ymj.2017.58.3.527 |
| [26] |
Dattani MT. Growth hormone deficiency and combined pituitary hormone deficiency:does the genotype matter?[J]. Clinical Endocrinology, 2005, 63(2): 121-130. DOI:10.1111/j.1365-2265.2005.02289.x |
| [27] |
Zhu X, Lin CR, Prefontaine GG, et al. Genetic control of pituitary development and hypopituitarism[J]. Current Opinion in Genetics & Development, 2005, 15(3): 332-340. |
| [28] |
Hendriks-Stegeman BI, Augustijn KD, Bakker B, et al. Combined pituitary hormone deficiency caused by compound heterozygosity for two novel mutations in the POU domain of the Pit1/POU1F1 gene[J]. Journal of Clinical Endocrinology & Metabolism, 2001, 86(4): 1545-1550. |
| [29] |
靖永杰, 王居强, 蓝贤勇, 等.牛LHX3基因的遗传变异研究[C].全国畜禽遗传标记研讨会论文集, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=7036332
|
| [30] |
de Camargo GMF. The role of molecular genetics in livestock produc-tion[J]. Animal Production Science, 2019, 59: 201-206. DOI:10.1071/AN18013 |
| [31] |
王俊杰, 赵勇, 闵令江, 等. 奶山羊品种资源现状和育种技术进展[J]. 家畜生态学报, 2017, 38(9): 7-12. DOI:10.3969/j.issn.1673-1182.2017.09.002 |
| [32] |
郭宏, 吕洋, 陈建兴, 等. 肉牛分子育种研究进展与展望[J]. 中国农业科技导报, 2014, 16(1): 24-31. |
| [33] |
杜超, 魏鹏飞, 郭妮妮, 等. 水牛产奶性状分子标记研究进展[J]. 中国畜牧杂志, 2017, 53(5): 10-16. |
| [34] |
闫海龙, 白洋洋, 王真, 等. GHR基因9-bp InDel与陕北白绒山羊体重和生长性状的关联研究[J]. 家畜生态学报, 2019, 40(2): 27-31. DOI:10.3969/j.issn.1673-1182.2019.02.005 |
| [35] |
邬明丽, 李世鹏, 高源, 等. 黄牛LYST基因InDel检测及其与生长性状的关联分析[J]. 家畜生态学报, 2019(2): 21-26. DOI:10.3969/j.issn.1673-1182.2019.02.004 |