2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
我国地方绵羊品种与同类羊相比,最典型、最突出的特性是性成熟早、肉质嫩美、抗逆性好,而它的短板在于生长速度缓慢、繁殖性能低、转化能力低下等,在传统畜牧业向现代畜牧业转型升级的过程中,地方品种绵羊没有现代化批量产出的优势,而繁殖力是制约其发展的重要因素。挖掘其影响多胎性状相关的分子标记,通过双羔分子标记本品种选育是解决繁殖力低下出现数量减少的本质问题。但大多数地方品种绵羊属季节性发情一胎单羔的动物,为了经济利益的最大化,多胎一直是人们追求的目标。双羔初生重较单羔低20%以上,但在正常饲养管理情况下,这种差距越来越小,满16个月龄时平均体重、产毛量差异均不显著,经济效益非常明显[1]。目前,对小尾寒羊及湖羊的多胎性状相关的主效候选基因研究的较多,而对于低繁殖力的地方绵羊品种的多胎性状相关的候选基因系统研究的较少。
BMPRIB基因非同义突变发生在高度保守的胞内激酶信号域编码区746(746A→G)引起氨基酸变化(249Q→R),Mulsant等[2]、Souza等[3]研究表明,该突变造成部分受体失活,抑制了BMPR-IB基因的功能,影响颗粒细胞分化,加快卵泡成熟速度,导致突变型母羊排卵数增加,引起的突变与Booroola母羊的高产表型完全相关[2, 4]。Booroola表型具有孟德尔分离模式,该突变对绵羊排卵数具有加性效应,即每增加一个拷贝将额外多排1.65枚卵,平均产羔数増加0.90-1.20只[5],在性成熟母羊中,携带FecBB的母羊最一致的特征是卵泡的直径明显小于非携带母羊,纯合非载体型(FecB+/FecB+),排卵率为1-2,排卵卵泡直径为7 mm,杂合携带者(FecBB/FecB+),排卵率为3-4,卵泡大小为4-5 mm直径[6]。因此BMPR1B基因成为目前已知的并应用于生产的绵羊高繁殖力标记基因之一。除了Booroola Merino绵羊中FecB已被证实为影响多胎性状的主效基因外,印度的Garole绵羊[7],伊朗的Kalehkoohi绵羊[8]、中国的小尾寒羊[9]、湖羊[10]、多浪羊[11]、策勒黑羊[12]中存在FecB突变,BMPR1B为主效候选基因之一。BMP4在绵羊的卵巢中发现,BMP4促进了原始卵泡的发育和原始卵泡向初级卵泡的转变[13],BMP4对绵羊颗粒细胞分泌黄体酮有较强的抑制作用,降低颗粒细胞黄体酮分泌[14],完全阻断FSH刺激作用,而促进雌激素的分泌,导致颗粒细胞的早熟分化和滤泡的成熟[15]。BMP4在正常卵泡中高表达,但在闭锁卵泡中几乎检测不到[16],Sharma等[17]研究发现BMP4基因被认为是山羊繁殖能力的候选基因,在小尾寒羊母羊、湖羊、山羊、陶寒F1、陶寒F2中BMP4基因产羔数相关[18-20],而BMP4基因对中国美利奴羊(军垦型)高繁殖力羊没有影响[21]。因此,BMP4可能会对哺乳动物的生殖功能产生影响。ADAMTS蛋白酶是一种分泌的锌金属蛋白酶,ADAMTS蛋白酶参与原胶原蛋白和血管性血友病因子的成熟,以及与形态发生、血管生成、排卵、癌症和关节炎相关的细胞外基质蛋白水解[22]。ADAMTS1的金属蛋白酶结构域具有催化活性[23]。研究发现ADAMTS1可能是新近发现的影响排卵数的基因[24]。Mittaz等[25]研究发现,ADAMTS1是由导致排卵的激素通路中的孕酮受体调控的,在敲除ADAMTS1的雌性小鼠中,雌性生殖器官畸形和繁殖能力下降,ADAMTS1缺失的雌性的生育能力存在于受损的排卵过程中,导致卵子被释放的数量减少,ADAMTS1是正常排卵发生所必需的基因,因此ADAMTS1基因在雌性生育中,在排卵的组织重塑过程中起着重要作用。
SNaPshot技术也称微测序技术,是由美国应用生物系统公司(Applied Biosystems,ABI)开发的一种SNPs多重分析技术,可实现中通量的SNPs分型[26],它具有检测速度快,准确性高,成本相对低廉等特点。目前,已经广泛地用于人类遗传疾病相关性分析[27-30]和法医学领域中的SNPs鉴定[31-32]。
本研究利用SNaPshot分型方法来检测地方品种滩羊与多胎性状相关的分子标记,统计检测的滩羊候选基因突变频率,分析中国地方品种滩羊突变频率分布情况。旨在为畜牧工作者利用分子标记改良繁殖性状、培育多羔家系提供科学资料和参考依据,为多胎性状相关分子标记的筛选构建一种快速准确、机动灵活、经济实用的检测方法,促进SNP技术在分子育种中的应用。
1 材料与方法 1.1 材料 1.1.1 供试羊群和样品采集具有产羔记录的2-5月龄的滩羊双羔实验组384只,滩羊单羔对照组144只。实验动物来自遗传系谱清晰,具有产双羔、单羔记录的羔羊,用耳号钳取耳组织5 g,放入装1 mL 70%乙醇的取样管中,带回实验室-20℃保存。
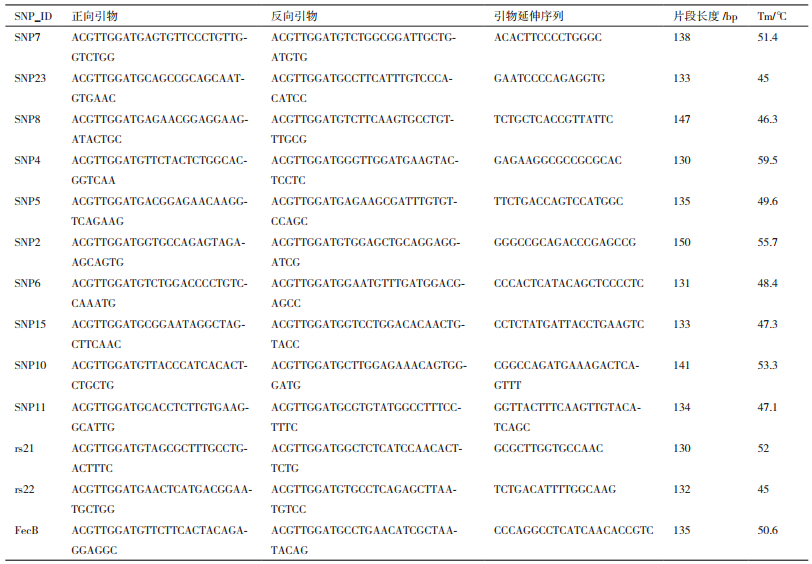
1.2 方法 1.2.1 引物设计选取BMPR1B、BMP4、ADAMTS1等3个基因所有外显子设计引物,最终筛选出13个位点,采用AssayDesigner3.1软件对3个基因的13个位点进行引物设计PCR反应和单碱基扩展引物,并交由四川栢晖生物公司合成表 1。
取1.5 mL EP管中配置PCR master mix,并振荡低速离心。在384加样孔中加入4 µL PCR master mix,最后加入1 µL模板DNA(20 ng/µL)混匀,进行实时荧光定量PCR,扩增程序:94℃ 5 min; 94℃ 20 s,56℃ 30 s,72℃ 1 min,45个循环; 72℃ 3 min。产物碱性磷酸酶处理:反应总体积为7 µL,其中PCR产物5 µL,SAP mix 2 µL。SAP Mix体系为2 µL:Water(HPLC grade)1.53 µL,10×SAP Buffer 0.17 µL,1 U/µL SAP Enzyme 0.30 µL。单碱基延伸反应,反应体系总体积9 μL:EXTEND Mix 2 µL,SAP+PCR reaction 7 µL。将点样后的Spectro CHIP芯片使用MALDI-TOF质谱仪分析,检测结果使用TYPER4.0软件获取原始数据及基因分型图,检查数据文件的完整性和正确性,将结果保存入相应存储媒介并进行分析。
1.2.3 数据分析用Plink软件分析最小等位基因、哈温平衡、卡方分析、逻辑模型等,通过Pearson卡方检验或Fisher精确检验,分析实验组和对照组在每个位点上基因型和等位基因的差异,从而分析与多胎基因的相关性。用卡方适合性检验法分析Hardy-Weinberg平衡定律,P > 0.001表示无统计学差异,符合Hardy-Weinberg平衡定律。Hapview软件分析连锁不平衡及单体型。
2 结果 2.1 SNaPshot检验的前期工作及HWP检验前期选择7个经典基因(BMPR1B、BMP4、ADAMTS1、BMP15、GDF9、INHA、MTNR1A7),利用混池扩增测序进行SNP位点初步筛选的基础上,通过软件比对及人工对峰图的判断,选取杂合峰图的位点作为候选SNP位点,共得到33个位点和8个文献位点[33](FecB、FecXG、FecXH、FecXI、FecXB、FexXO、FecXGR、FecXL)点作为候选点,共计41个位点进行SNP时间飞行质谱检测(单次检测最多30个位点),进行了两次检测,通过分型,最终确定了3个基因13个位点存在杂合情况,然后进行后续的关联分析。
Hardy-Weinberg平衡是指群体内一个位点上的基因型频率和基因频率世代保持不变,没有偏离遗传平衡状态。进行HWE检验的主要目的就是为了检验我们研究的群体是否来源于独立样本和处在一个稳定的状态,是否存在显著遗传漂变。本实验经Hardy-Weinberg平衡定律检验13个位点无统计学差异,未偏离哈迪-温伯格平衡(P > 0.001),样本来源于孟德尔遗传规律散发独立样本,该基因是群体中稳定存在的基因,13个SNPs在后续的检验中是有意义的,可进行下一步关联分析。13个SNPs位点在实验组和对照组中纯合度较高,杂合度则相对较低,表明这13个SNPs位点在群体中的变异较小。
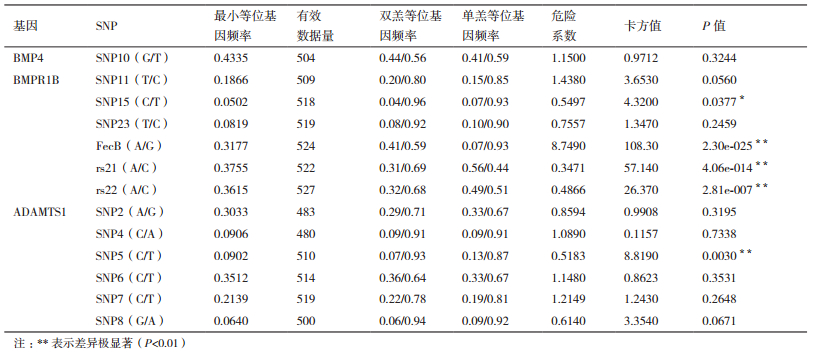
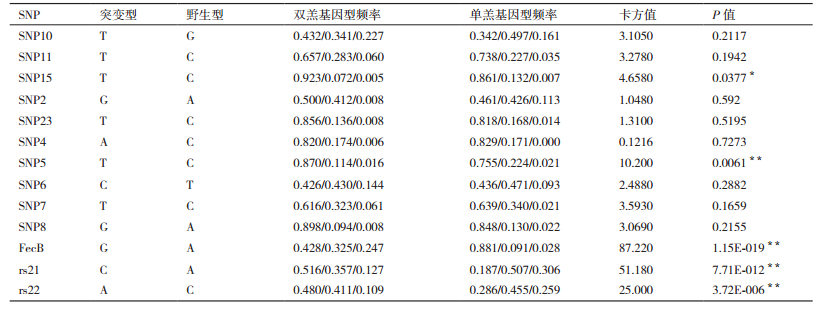
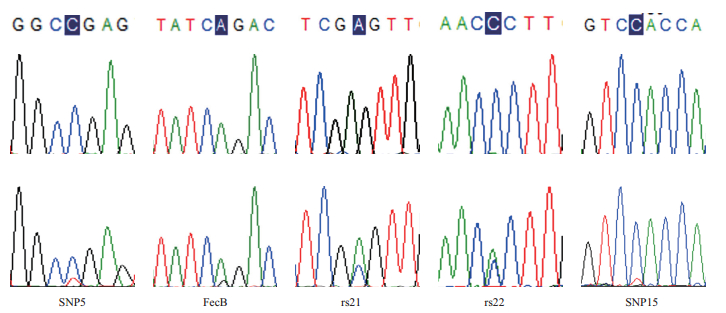
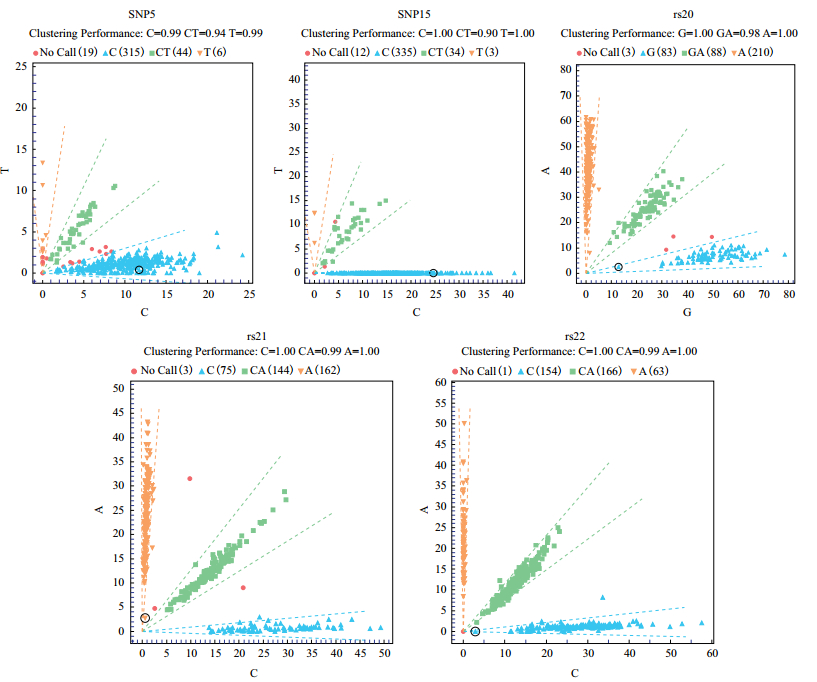
2.2 我国地方品种滩羊SNP多态性与多胎性状相关性分析通过测序序列比对结果,在3个基因中共发现13个多态位点,这些位点中不存在插入和缺失位点,其中转换位点有9个,包括3个A/G转换位点和6个T/C转换位点; 颠换位点有4个,包括A/C颠换位点3个,G/T颠换位点1个。最小等位基因率MAF > 0.05,说明选取实验群体数据与真实的大范围群体相比没有出现偏移,突变频率较低的位点在实验组-对照组间差异较大,可以得出有效结论。每个SNP的等位基因频率在单羔和双羔组中的分布差异见表 3,经过检验后,其中SNP5-C/T位点、FecB-A/G位点、rs21-A/C位点、rs22-A/C位点的等位基因在双羔组和单羔组中的分布存在极显著差异(P < 0.01),SNP15-C/T分布差异显著(P < 0.05),初步分析认为SNP5-C/T位点、FecB-A/G位点、SNP15-C/T位点、rs21-A/C位点、rs22-A/C位点与多胎性状相关,除了FecB位点是已报道的影响多胎的主效基因外[3-4],其余4个位点相关的研究内容目前尚未见报道,SNP5-T、SNP15-T、FecB-G、rs21-C、rs22-C为优势等位基因,5个位点测序结果与参考序列进行比对,做出基因碱基突变位点测序峰图与MassArray分型的散点图进行验证,其结果一致,说明结果的可靠性(图 1-2)。
|
| 图 1 5个SNPs测序图 |
|
| 图 2 Sequenom MassArray分型的散点图 |
针对该基因每个多态位点的基因型进行关联分析,发现位点SNP5-CC/TC/TT、rs21-AA/CA/CC、rs22-CC/AC/AA、FecB-AA/GA/GG基因型在双羔组和单羔组间的分布极显著差异(P < 0.01),SNP15-CC/TC/TT基因型在单羔组和双羔组间的分布显著差异(P < 0.05),野生型和突变型对双羔性状影响存在极显著性差异(P < 0.01)。
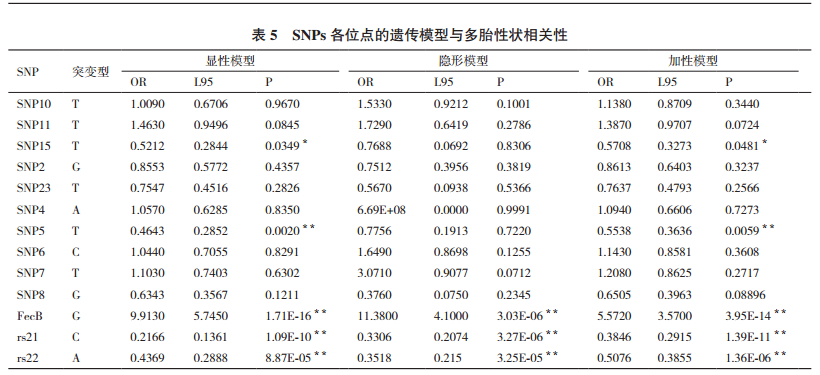
2.3 SNP位点遗传模型构建及相关性对13个位点分别行3种不同的遗传模型分析,结果显示,SNP15、SNP5、FecB、rs21、rs22位点建立的3种模型均为有意义的模型,SNP15与多胎性状的发生有显著相关性(P < 0.05),SNP5、rs21、rs22、FecB发生为极显著相关性(P < 0.01),模型预测SNP15、SNP5、rs21、rs22、FecB为与双羔性状相关的位点。
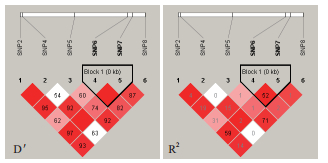
2.4 双羔组和单羔组SNP的连锁不平衡分析及单倍型的构建对符合Hardy-Weinberg平衡定律的SNPs位点,利用SHSsis在线软件[34]计算连锁不平衡系数进行连锁不平衡分析,通过D'值,观察各位点之间的连锁不平衡程度,判断是否存在连锁不平衡。在ADAMTS1的6个位点中,存在1个block构建3种单倍型,经分析发现3种单倍型都与多胎无关(P > 0.05),表 6。在BMPR1B基因中关联两个SNPs间的连锁不平衡很弱或的不存在连锁不平衡,无法构建单倍型。
|
| 图 3 ADAMTS1 6个位点连锁不平衡图谱 |
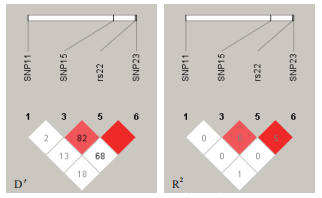
|
| 图 4 BMPR1B 4个位点连锁不平衡图谱 |
本研究在前期初步筛选的基础上,确定3个基因13个位点进行多态性分析,最终发现3个基因的13个位点均未偏离哈温平衡,5个位点(SNP15、SNP5、FecB、rs21、rs22)在双羔组和单羔组间差异显著,表明这5个位点与双羔性能有关联。本研究最终筛选的3个BMPR1B、BMP4、ADAMTS1基因都是生殖轴上己知被前人研究者证明与羊的繁殖性状相关[3, 35-36]。其中FecB位点在Booroola羊中亦证实为影响多胎的主效基因,FecB位点也是影响我国的小尾寒羊多胎性能的主效候选基因[37],FecB基因在小尾寒羊和湖羊的外显子8存在FecB突变[38],FecBB突变在滩羊中出现基因分型,发现FecBB等位基因对滩羊产仔数有非常显著的影响[39],BMPR-1B基因外显子9的杂合度可使所有母羊产仔数增加[40],周世伟等[41]对FecB基因编辑后,初生的羔羊单核苷酸交换的观察效率高达23.8%。由于收集产仔数数据需要很长时间,目前还无法收集编辑后的动物的表型数据,但认为此项发现将有助于提高动物的繁殖性状。以上研究证实FecB突变与产仔数增加有关与本实验的结果一致,主要原因沉默BMPR1B可促进细胞凋亡,而过表达BMPR1B可抑制绵羊颗粒细胞细胞凋亡[42],FecB基因突变可能改变了卵母细胞发育和卵丘颗粒细胞的增殖水平,从而提高排卵率[43]。但FecB突变在Barki和Rahmani地方绵羊品种中未检测到[44],推测可能是基因结构和品种的不同对小鼠卵巢的研究证明ADAMTS1在体内排卵和受精过程中都起着至关重要的作用,通过对贵州半细羊毛绵羊ADAMTS1基因的混池测序发现该基因可能影响繁殖性能[45],但也有研究发现ADAMTS1基因不能作为高产湖羊的候选基因[46]。本研究认为ADAMTS1基因可能是影响滩羊繁殖性状的一个候选基因,但可否作为绵羊繁殖性状的候选基因可能存在品种间的差异,还有待进一步研究。我们通过3种遗传模型分析也发现5个SNPs与双羔性能的相关性。但这5个SNP位点能否作为双羔性状的遗传标记,还需要对这些地方品种滩羊个体进行进一步验证以及如何参与绵羊双羔生产的机制仍需进一步研究探讨。
本研究关联性分析发现与双羔性状相关5个SNPs位点,即SNP5、SNP15、rs21、rs22、FecB位点,5个位点的突变可能利于生产双羔。这5个SNPs位点在群体中的变异较小,这可能与地方品种绵羊的遗传背景和本品种选育程度有关[47]; 13个位点均处于哈迪-温伯格平衡,说明试验群体在选择中不易受外界干扰,这些位点的基因序列保守性较强,在品种的选育、迁徙和遗传漂变因素作用下而处于动态平衡,他们的遗传是随机的[48],而使这5个SNPs位点能够提供较为合理的遗传信息,这可能是由于该群体在适应性方面具有遗传优势,并经过长期进化和选择达到了平衡状态,基因型频率的平衡对于群体稳定性有着直接的保证作用的。哈温平衡不但受遗传学规律的控制,而且还受外界环境的影响[49],遗传学影响表现在基因频率自然选择作用发生了变化、基因漂变,以及邻种群的基因由于杂交而正在加入到所研究的区域或是其基因成分发生了变化[48]。HWE检验是有必要的,只有哈温平衡才能验证所获得的样本是否有代表性,只有满足HWE,才能进一步推断基因与双羔的关联性。CoxDG等[50]认为不符合HWE可能是基因分型错误所致,那么在此基础上继续进行基因与性状的关联推断显然是没有意义的。
单倍型可提供比单个SNPs更为丰富的信息量,有助于低频率变异信息的利用,被称为人类进化历史的“分子化石”[51]。在复杂性状的关联研究中,单倍型比单个SNPs具有更好的统计分析效果,不同SNP位点优势等位基因型与优势等位基因种类和频率大小,单倍型均有不同程度的差别。但由于样本数量有限会导致单倍型被漏检,样本选择不全面,并且研究不够深入[52]。本研究对符合要求的SNPs位点构建了单倍型,得到了3种与双羔性能相关的单倍型,但在双羔组和单羔组间都未达到差异水平,所以我们继续以ADAMTS1和BMPR1B基因为中心,应该进一步扩大样本容量,确定我国地方绵羊品种群LDblock的精确结构,为优势选择进一步寻找证据,并为地方品种滩羊基因组多样性研究增加遗传数据,为今后推动地方品种绵羊双羔分子标记本品种选育提供参考。
4 结论本研究利用SNaPshot技术,在前期筛选的基础上,确定在3个基因13个位点上比较分析了地方品种滩羊双羔和单羔群体与多胎性状相关的分子标记,13个位点均未偏离哈温平衡,最终分析发现5个位点(SNP15、SNP5、FecB、rs21、rs22)在双羔组和单羔组间差异显著,这5个位点与多胎性状相关,构建的遗传模型也被证实,但在ADAMTS1的6个位点中的1个block构建3种单倍型都与多胎无关。在地方品种绵羊双羔群体中挖掘与多胎性状相关的分子标记,有助于双羔分子标记本品种选育,由于外血渗入对地方品种的巨大冲击,鉴定并运用双羔分子标记技术也是对本品种很大的保护。
| [1] |
Notter DR. Genetic improvement of reproductive efficiency of sheep and goats[J]. Animal Reproduction Science, 2012, 130(3-4): 147-151. DOI:10.1016/j.anireprosci.2012.01.008 |
| [2] |
Mulsant P, Lecerf F, Fabre S, et al. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merino ewes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(9): 5104-5109. DOI:10.1073/pnas.091577598 |
| [3] |
Souza CJH, MacDougall C, Campbell BK, et al. The Booroola(FecB)phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B(BMPR1B)gene[J]. Journal of Endocrinology, 2001, 169(2): R1-R6. DOI:10.1677/joe.0.169r001 |
| [4] |
Wilson T, Wu XY, Juengel JL, et al. Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor(ALK-6)that is expressed in both oocytes and granulosa cells[J]. Biology of Reproduction, 2001, 64(4): 1225-1235. DOI:10.1095/biolreprod64.4.1225 |
| [5] |
Piper LR, Bindon BM, Davis GH. The single gene inheritance of the high litter size of the Booroola Merino[J]. Genetics of Reproduction in Sheep, 1985, 115-125. |
| [6] |
Davis GH, Montgomery GW, Allison AJ, et al. Segregation of a major gene influencing fecundity in progeny of Booroola sheep[J]. New Zealand Journal of Agricultural Research, 1982, 25(4): 525-529. DOI:10.1080/00288233.1982.10425216 |
| [7] |
Polley S, De S, Brahma B, et al. Polymorphism of BMPR1B, BMP15 and GDF9 fecundity genes in prolific Garole sheep[J]. Tropical Animal Health and Production, 2010, 42(5): 985-993. DOI:10.1007/s11250-009-9518-1 |
| [8] |
Mahdavi M, Nanekarani S, Hosseini SD. Mutation in BMPR-IB gene is associated with litter size in Iranian Kalehkoohi sheep[J]. Animal Reproduction Science, 2014, 147(3-4): 93-98. DOI:10.1016/j.anireprosci.2014.04.003 |
| [9] |
Chu MX, Liu ZH, Jiao CL, et al. Mutations in BMPR-IB and BMP-15 genes are associated with litter size in Small Tailed Han sheep(Ovis aries)[J]. Journal of Animal Science, 2007, 85(3): 598-603. DOI:10.2527/jas.2006-324 |
| [10] |
Guan F, Liu SR, Shi GQ, et al. Polymorphism of FecB gene in nine sheep breeds or strains and its effects on litter size, lamb growth and development[J]. Animal Reproduction Science, 2007, 99(1-2): 44-52. DOI:10.1016/j.anireprosci.2006.04.048 |
| [11] |
史洪才, 高志英, 牛志刚, 等. 新疆多浪羊Fec-B突变检测及与产羔数的关系[J]. 农业生物技术学报, 2011, 19(2): 330-334. DOI:10.3969/j.issn.1674-7968.2011.02.019 |
| [12] |
邵勇钢, 米日尼萨汗·库尔班. 策勒黑羊BMPR-IB基因多态性与产羔数的相关性研究[J]. 中国畜牧兽医, 2012, 39(6): 221-223. DOI:10.3969/j.issn.1671-7236.2012.06.057 |
| [13] |
Guan F, Liu SR, Shi GQ, et al. Polymorphism of FecB gene in nine sheep breeds or strains and its effects on litter size, lamb growth and development[J]. Animal Reproduction Science, 2007, 99(1-2): 44-52. DOI:10.1016/j.anireprosci.2006.04.048 |
| [14] |
Pierre A, Pisselet C, Dupont J, et al. Molecular basis of bone morphogenetic protein-4 inhibitory action on progesterone secretion by ovine granulosa cells[J]. Journal of Molecular Endocrinology, 2004, 33(3): 805-817. DOI:10.1677/jme.1.01545 |
| [15] |
Monget P, Fabre S, Mulsant P, et al. Regulation of ovarian folliculogenesis by IGF and BMP system in domestic animals[J]. Domestic Animal Endocrinology, 2002, 23(1): 139-154. |
| [16] |
Shimasaki S, Zachow RJ, Li D, et al. A functional bone morphogenetic protein system in the ovary[J]. Proceedings of the National Academy of Sciences, 1999, 96(13): 7282-7287. DOI:10.1073/pnas.96.13.7282 |
| [17] |
Sharma R, Ahlawat S, Maitra A, et al. Polymorphism of BMP4 gene in Indian goat breeds differing in prolificacy[J]. Gene, 2013, 532(1): 140-145. DOI:10.1016/j.gene.2013.08.086 |
| [18] |
任立坤, 刘月琴, 张英杰, 等. 不同绵羊群体BMP4基因多态性与产羔数关系分析[J]. 河北农业大学学报, 2012, 35(1): 66-70. DOI:10.3969/j.issn.1000-1573.2012.01.014 |
| [19] |
张驰.山羊BMP4基因多态性及其与生产性状关联性的研究[D].郑州: 河南农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10466-2010270530.htm
|
| [20] |
Xu YF, Li QF, Li EL, et al. Relationship between the BMP2, BMP4, BMP6 and BMP7 gene expression and ovulation number in Hu Sheep[J]. Scientia Agricultura Sinica, 2009, 42(10): 3655-3661. |
| [21] |
杨华, 杨永林, 冯静, 等. BMP4基因作为中国美利奴羊(军垦型)多胎性能候选基因的研究[J]. 家畜生态学报, 2010, 4: 10-13. |
| [22] |
Apte SS. A disintegrin-like and metalloprotease(reprolysin-type)with thrombospondin type 1 motif(ADAMTS)superfamily:functions and mechanisms[J]. Journal of Biological Chemistry, 2009, 284(46): 31493-31497. DOI:10.1074/jbc.R109.052340 |
| [23] |
Kuno K, Terashima Y, Matsushima K. ADAMTS-1 is an active metalloproteinase associated with the extracellular matrix[J]. Journal of Biological Chemistry, 1999, 274(26): 18821-18826. DOI:10.1074/jbc.274.26.18821 |
| [24] |
徐珊珊, 于丽丽, 乐凯. 猪ADAMTS-1基因对繁殖性状的遗传效应分析[J]. 安徽农业科学, 2008, 36(24): 10374-10376. DOI:10.3969/j.issn.0517-6611.2008.24.040 |
| [25] |
Mittaz L, Russell DL, Wilson T, et al. Adamts-1 is essential for the development and function of the urogenital system[J]. Biology of Reproduction, 2004, 70(4): 1096-1105. DOI:10.1095/biolreprod.103.023911 |
| [26] |
赵春霞.一种同时检测多个单核苷酸多态性位点的新方法[J], 2003, 31(8): 906-910. http://www.cnki.com.cn/Article/CJFDTotal-FXHX200308002.htm
|
| [27] |
Li L, Tian YL, Lv XM, et al. Association analysis of IL-17A and IL-17F polymorphisms in Chinese women with cervical cancer[J]. Genetics and Molecular Research, 2015, 14(4): 12178-12183. DOI:10.4238/2015.October.9.6 |
| [28] |
Bouakaze C, Keyser C, De Martino SJ, et al. Identification and genotyping of mycobacterium tuberculosis complex species by use of a SNaPshot minisequencing-based assay[J]. Journal of Clinical Microbiology, 2010, 48(5): 1758-1766. DOI:10.1128/JCM.02255-09 |
| [29] |
叶荣菊, 黄志刚, 王讳, 等. SNaPshot技术对萎缩性胃炎IL-1B-1473单核苷酸多态性的检测[J]. 世界华人消化杂志, 2009, 17(12): 1202-1206. DOI:10.3969/j.issn.1009-3079.2009.12.007 |
| [30] |
刘小琦. 采用SNaPshot方法对中国老年黄斑变性与C2和C3基因单核苷酸多态性进行相关性研究[J]. 国际检验医学杂志, 2013, 34(3): 285-287. DOI:10.3969/j.issn.1673-4130.2013.03.012 |
| [31] |
Daniel R, Santos C, Phillips C, et al. A SNaPshot of next generation sequencing for forensic SNP analysis[J]. Forensic Science International:Genetics, 2015, 14: 50-60. DOI:10.1016/j.fsigen.2014.08.013 |
| [32] |
孙亚男, 李安, 史文斌, 等. SNaPshot技术检测Y-SNP位点O3-M122单倍群的应用[J]. 中国法医学杂志, 2013(1): 1-4. |
| [33] |
Polley S, De S, Batabyal S, et al. Polymorphism of fecundity genes(BMPR1B, BMP15 and GDF9)in the Indian prolific Black Bengal goat[J]. Small Ruminant Research, 2009, 85(2-3): 122-129. DOI:10.1016/j.smallrumres.2009.08.004 |
| [34] |
Yong Y, Lin HE. SHEsis, a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci[J]. Cell Research, 2005, 15(2): 97. DOI:10.1038/sj.cr.7290272 |
| [35] |
刘荣. 蒙古羊多羔性状候选基因ADAMTS1的遗传效应分析[J]. 现代农业, 2014, 4: 77-79. |
| [36] |
Fang XT, Xu HX, Chen H, et al. Polymorphisms of bone morphogenetic protein 4(BMP4)gene in goats[J]. Journal of Animal and Veterinary Advances, 2010, 9(5): 907-912. DOI:10.3923/javaa.2010.907.912 |
| [37] |
Fan QC, Ye LL, Liu N, et al. Relevance between BMPR-IB genotypes and litter size in Small Tail Han Sheep[J]. Animal Husbandry and Feed Science, 2011, 3(5): 6-8. |
| [38] |
刘秋月, 胡文萍, 贺小云, 等.绵羊多羔主效基因FecB高通量检测方法的建立及应用[J], 2017, 48(1): 39-51. http://www.cnki.com.cn/Article/CJFDTotal-XMSY201701005.htm
|
| [39] |
田秀娥, 孙红霞, 王永军. 三个绵羊群体BMPR-IB基因的遗传多态性及其对产羔数的影响[J]. 西北农林科技大学学报:自然科学版, 2009, 37(11): 31-36. |
| [40] |
Shokrollahi B, Morammazi S. Polymorphism of GDF9 and BMPR1B genes and their association with litter size in Markhoz goats[J]. Reproduction in Domestic Animal, 2018, 53(4): 971-978. DOI:10.1111/rda.13196 |
| [41] |
Zhou S, Yu H, Zhao X, et al. Generation of gene-edited sheep with a defined Booroola fecundity gene(FecB(B))mutation in bone morphogenetic protein receptor type 1B(BMPR1B)via clustered regularly interspaced short palindromic repeat(CRISPR)/CRISPR-associated(Cas)9[J]. Reproduction Fertility and Development, 2018, 30(12): 1616-1621. DOI:10.1071/RD18086 |
| [42] |
Yao Y, Reheman A, Xu Y, et al. miR-125b contributes to ovarian granulosa cell apoptosis through targeting BMPR1B, a major gene for sheep prolificacy[J]. Reproductive Sciences, 2019, 26(2): 295-305. DOI:10.1177/1933719118770544 |
| [43] |
Miao X, Luo Q, Zhao H, et al. Ovarian proteomic study reveals the possible molecular mechanism for hyperprolificacy of Small Tail Han sheep[J]. Scientific Reports, 2016, 6: 27606. DOI:10.1038/srep27606 |
| [44] |
El-Seedy AS, Hashem NM, El-Azrak KM, et al. Genetic screening of FecB, FecXG and FecXI mutations and their linkage with litter size in Barki and Rahmani sheep breeds[J]. Reproduction in Domestic Animal, 2017, 52(6): 1133-1137. DOI:10.1111/rda.13002 |
| [45] |
张琼娣, 宋德荣, 刘若余, 等. 贵州半细毛羊ADAMTS1基因部分外显子多态性研究[J]. 中国畜牧兽医, 2015, 42(1): 172-178. |
| [46] |
Bao J, Wang J, Gao W, et al. Association analysis between genetic variation of ADAMTS-1 gene and lambing traits in sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(9): 14. |
| [47] |
吴常信. 分子数量遗传学与动物育种[J]. 遗传, 1997, 19: 1-3. DOI:10.3321/j.issn:0253-9772.1997.z1.001 |
| [48] |
黎中宝, 李少菁, 王桂忠. 锯缘青蟹(Scylla serrata)不同种群的杂合性研究[J]. 海洋与湖沼, 2004, 35(4): 358-363. DOI:10.3321/j.issn:0029-814X.2004.04.009 |
| [49] |
王忠仁. 植物等位酶分析[M]. 北京: 科学出版社, 1996.
|
| [50] |
Cox DG, Kraft P. Quantification of the power of Hardy-Weinberg equilibrium testing to detect genotyping error[J]. Human Heredity, 2006, 61(1): 10-14. DOI:10.1159/000091787 |
| [51] |
赵凯平, 袁长征, 王红. 北京汉族人群ROR2基因SNPs等位基因及单体型频率研究[J]. 中国优生与遗传杂志, 2011(6): 11-13. |
| [52] |
李莉, 柳燕, 林源, 等. 67个X-SNP位点的分型检测和连锁不平衡检验[J]. 法医学杂志, 2011, 27(5): 337-341. DOI:10.3969/j.issn.1004-5619.2011.05.006 |