2. 中国科学院热带海洋生物资源与生态重点实验室,广州 510301
2. Key Laboratory of Tropical Marine Biological Resources and Ecology, Chinese Academy of Sciences, Guangzhou 510301
群体感应(Quorum sensing,QS)是微生物通过分泌、释放一些特定的信号分子,并通过这些信号分子的浓度变化,来感知周围环境中同类细胞密度变化而调节基因表达的现象。它可以调节许多微生物的生理活动,也可以调节不同细菌之间的关系,是微生物为适应周围环境的一种信号交流机制[1]。致病菌合成致病毒素而产生致病作用与致病菌在人体内形成生物膜而产生的对抗生素的抗性作用受到广泛关注[2],且致病病毒的合成和生物膜的形成均受群体感应系统的调控。研究发现,可以通过群体感应抑制剂介导致病菌的群体感应来控制致病菌的致病效应,使其不会产生抗性突变从而产生耐药性[3]。所以,寻找群体感应抑制剂有望从新的角度解决细菌耐药性问题[4]。因此,近年来从天然源[5-7]分离或从合成化合物[8]中筛选群体感应抑制剂的研究越来越多。
海洋微生物资源丰富且具有不同于陆地微生物的活性物质,目前的天然抗菌药物大约有2/3来自放线菌[9],放线菌的药用价值已经得到认可[10],从放线菌中分离出数百种具有不同结构或显著生物活性的化合物,其中约70%的天然衍生化合物正在临床应用中[11]。因此,以海洋放线菌为筛选对象,对其进行群体感应抑制活性研究,优化活性菌株的培养条件,对抗菌感染研究具有一定的理论和实践价值[12]。本研究对前期从连云港表层海水中分离筛选得到的一株具有较高群体感应抑制活性的海洋放线菌S. parvulus HY026[13]进行发酵培养和活性复筛,再优化其培养基成分,以提高其产生活性物质的能力,为进一步的活性物质分离纯化研究提供基础。
1 材料与方法 1.1 材料本实验所用的测试菌是实验室保存的从连云港表层海水分离所得的海洋微小链霉菌S. parvulus HY026,群体感应报告菌是由香港科技大学提供的紫色杆菌Chromobacterium violaceum 12472。
高氏一号培养基:可溶性淀粉20 g/L、硝酸钾1 g/L、氯化钠0.5 g/L、三水合磷酸氢二钾0.5 g/L、七水合硫酸镁0.5 g/L、七水合硫酸亚铁0.01 g/L、海盐33 g/L、pH 7.4-7.6,用于培养放线菌S. parvulus HY026。
牛肉膏蛋白胨培养基:牛肉膏5 g/L、胰蛋白胨10 g/L、氯化钠5 g/L、pH 7.4-7.6,用于培养报告菌紫色杆菌。
1.2 方法 1.2.1 HY026的复苏、发酵及粗提物的制备将冻存管中的菌株S. parvulus HY026转移到高氏一号液体培养基中,30℃、140 r/min振荡复苏培养5 d。从复苏菌液中吸取5 mL菌液接种到50 mL高氏一号液体培养基中相同条件下培养5 d。将发酵液用纱布过滤,分别收集滤液和菌体。滤液用等体积乙酸乙酯萃取两次,菌体用10 mL氯仿/甲醇(1:1)萃取两次。将分别合并滤液、菌体的有机相萃取液,旋转蒸发干燥得到粗提物,称重后加入一定量的甲醇或DMSO配制成50 mg/mL或100 mg/mL的粗提物样品液用于活性测定。
1.2.2 HY026粗提物群体感应抑制活性的测定采用滤纸片法测定HY026发酵产物的群体感应抑制活性。吸取100 μL生长良好的紫色杆菌液于牛肉膏蛋白胨固体培养基上,用无菌棉签均匀涂布。吸取10 μL HY026的粗提物样品液滴加到滤纸片上,风干后将滤纸片反扣到培养基上,做两组平行,以10 μL溶剂甲醇为阴性对照,以化合物呋喃酮、吡啶(50 μg)为阳性对照。将培养皿封口后置于30℃恒温培养箱中倒置培养48 h,测量紫色素抑制圈直径。
1.2.3 HY026最佳碳源的选择根据放线菌的常用碳源,选择5种不同碳源(可溶性淀粉、乳糖、玉米粉、葡萄糖、麦芽糖),采用单因子试验,进行HY026的碳源优化。每种碳源分别设置两个浓度(1%和2%),以代替原高氏一号培养基中的碳源,每个处理设两个平行。将HY026接种到配制好的各培养基中,按1.2.1中所述发酵条件进行振荡培养和代谢物的提取,以备后续的活性测试。
1.2.4 HY026最佳氮源的选择根据放线菌的常用氮源,选择5种不同氮源(KNO3、黄豆粉、胰蛋白胨、酵母粉、(NH4)2SO4),采用单因子试验,进行HY026的氮源优化。每种氮源分别设置两个浓度(1‰和2‰),以代替原高氏一号培养基中的氮源。每个处理设两个平行。将HY026接种到配制好的各培养基中,按1.2.1中的发酵条件进行振荡培养和代谢物的提取,以备后续的活性测试。
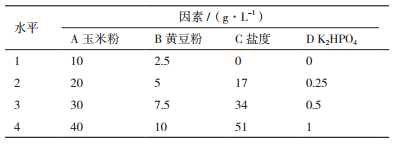
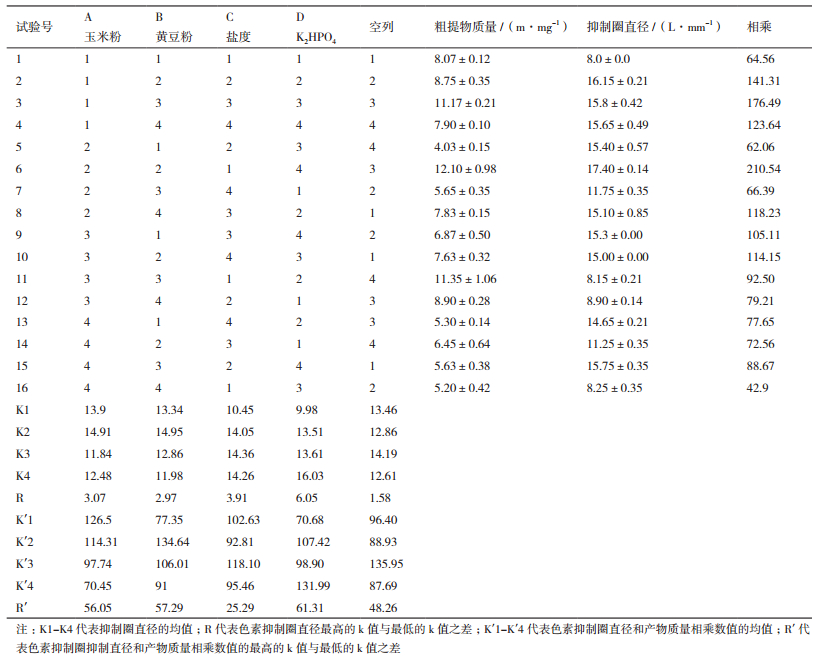
1.2.5 HY026培养基的优化在确定好最佳碳源和氮源后,以这两种碳氮源,同时选取高氏一号培养基中另外两种主要成分,设计四因素四水平L16(45)的正交实验,每个处理设3个平行,因子水平设计见表 1。将HY026接种到配制好的各培养基中进行发酵培养和代谢物提取,通过测定发酵液提取物的质量、群体感应抑制活性确定该菌株的最佳发酵培养基配方。
按照正交试验确定好的最佳培养条件配置培养基,并配置原高氏一号培养基,将HY026菌种接入这两种培养基中,各设3个平行,在30℃,140 r/min条件下培养5 d,按1.2.1中所述方法获得粗提物并配制成样品液,测定其活性。
2 结果 2.1 HY026群体感应抑制活性的复筛从50 mL HY026的高氏一号培养液中,获得7.3 mg发酵液粗提物和143.3 mg的菌体; 对HY026的菌体浸提液、发酵液粗提物以及浓缩后的萃余液进行群体感应抑制活性的测定。结果(图 1)显示,菌体浸提液、萃余液及溶剂甲醇均无活性,而粗提物具有较高的群体感应抑制活性,其抑制圈直径为14 mm。无活性、阳性对照呋喃酮与吡啶的色素抑制圈直径分别为16 mm与19.5 mm。表明菌株HY026所产生的活性物质主要存在于胞外,发酵液经两次萃取后,活性代谢产物已萃取完全。
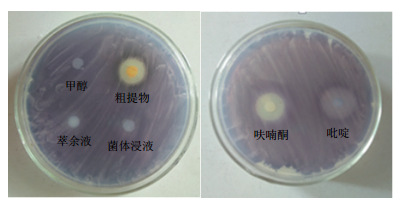
|
| 图 1 HY026的菌体浸提液、发酵液粗提物及萃余液的群体感应抑制活性 |
选择淀粉、乳糖、玉米粉、葡萄糖和麦芽糖为碳源,分别以1%和2%的浓度替代高氏一号培养基中的碳源,在其他条件不变的情况下对HY026进行发酵培养,测定各发酵液的代谢物产量和群体感应抑制活性。结果(图 2)显示,以1%淀粉、2%淀粉、2%玉米粉以及1%麦芽糖为碳源时,该菌代谢产物质量较高,在7 mg以上; 以玉米粉为碳源时,该菌株的群体感应抑制活性显著高于其他处理,其对紫色杆菌产紫色素的抑菌圈直径超过20 mm。综合菌株发酵液代谢物产量以及群体感应抑制活性,确定2%玉米粉为HY026的最佳碳源。
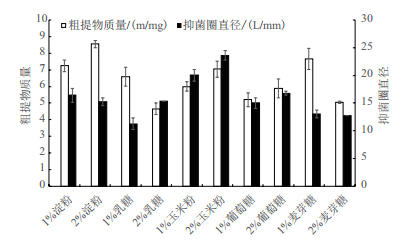
|
| 图 2 不同碳源对HY026代谢物产量及群体感应抑制活性的影响 |
选择硝酸钾、黄豆粉、胰蛋白胨、酵母粉以及硫酸铵为氮源,分别以1‰和5‰的浓度替代高氏一号培养基中的氮源,在其他条件不变的情况下对HY026进行发酵培养,测定各处理的代谢物产量和群体感应抑制活性。结果(图 3)显示,以5‰黄豆粉和5‰胰蛋白胨为氮源时,该菌代谢物产量明显高于其他处理,在6.5 mg以上; 以5‰黄豆粉和5‰(NH4)2SO4为氮源时,该菌株的群体感应抑制活性相对较高,其对紫色杆菌产紫色素的抑制圈直径分别为15.50 mm和14.85 mm。综合菌株发酵液代谢物产量以及群体感应抑制活性,确定5‰黄豆粉为HY026的最佳氮源。
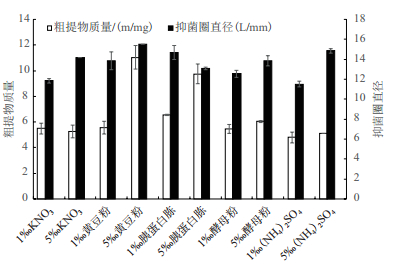
|
| 图 3 不同氮源对海洋短小链霉菌粗提物的影响 |
对选择出的最佳碳源和氮源以及培养基中含量较高的海盐和磷酸氢二钾这4个因素进行正交实验研究,将HY026按各处理条件进行发酵培养、代谢物提取和群体感应抑制活性测试,根据各处理的代谢物质量、群体感应抑制活性的数据分析HY026的最佳培养基配方。
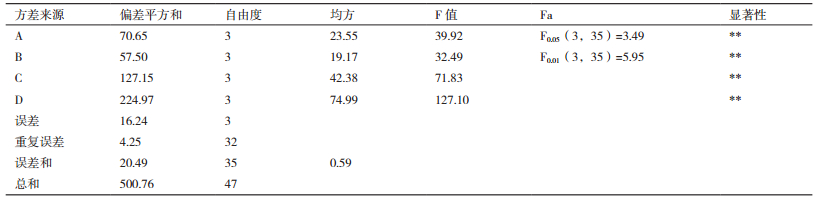
以不同培养基发酵所得的各代谢物对紫色杆菌产紫色素的抑制圈直径为指标,通过极差分析计算并比较各因素的K值和R值,结果(表 2)表明,四因素玉米粉、黄豆粉、盐度、磷酸氢二钾对菌株的群体感应抑制活性的影响作用大小及各因素最优化水平依次为:磷酸氢二钾(4)>盐度(3)>玉米粉(2)>黄豆粉(2)。通过方差分析计算各因素的F值,与查表所得的F0.05、F0.01值进行对比发现,培养基中磷酸氢二钾、盐度、玉米粉和黄豆粉对菌株的群体感应抑制活性的影响均为极显著(表 3),F值的大小顺序也与极差分析的结果一致。因此,仅从活性考虑,菌株HY026的最佳培养基配方(g/L)为磷酸氢二钾1.0,盐度34.0,玉米粉20.0,黄豆粉5.0。
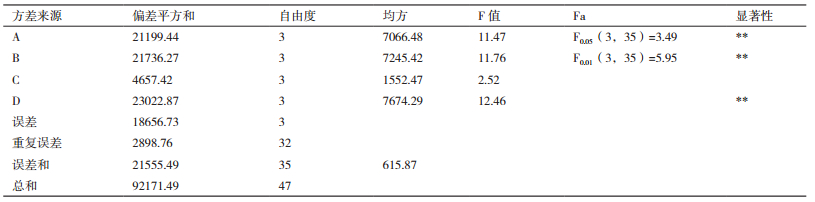
由于在活性物质分离时,代谢物的产量也很重要,抗群体感应活性和代谢物产量也需同时进行考量,因此,将各处理所得的粗提物质量与抑制圈直径相乘,再以所得的值为指标进行极差分析,计算各因素的K'值和R'值。结果(表 4)显示,四因素对菌株的影响作用大小及各因素的最优化水平依次为:磷酸氢二钾(4)>黄豆粉(2)>玉米粉(1)>盐度(3)。与仅考虑活性相比,影响因素的排序发生了变化,黄豆粉的影响变大而盐度的影响变小,玉米粉的最优化水平也有所变动。通过方差分析计算各因素F值并与查表结果相比,发现磷酸氢二钾、黄豆粉、玉米粉的影响仍为极显著,盐度的影响为不显著,与极差分析的结果一致。因此,同时考虑活性和代谢物产量,菌株HY026的最佳培养基配方为磷酸氢二钾1.0 g/L,黄豆粉5.0 g/L,玉米粉10.0 g/L,盐度34.0 g/L。
将正交实验所得的两种优化条件(优化1仅考虑活性,优化2同时考虑活性和代谢物产量)对菌株HY026进行培养,并以原高氏一号培养基为对照,比较3种条件下所得的粗提物的质量与抑制圈直径。
结果(图 4)显示,优化1所得粗提物的质量及抑制圈直径分别为24.24 mg和17.33 mm,优化2所得粗提物的质量及抑制圈直径分别为25.62 mg和16.90 mm,而优化前的高氏一号培养基培养HY026所得粗提物质量、抑制圈直径分别为5.14 mg和14.20 mm。与优化前相比,优化1所得的粗提物质量和群体感应抑制活性分别提高了372%和22%;优化2所得的粗提物质量和群体感应抑制活性分别提高了398%和19%。
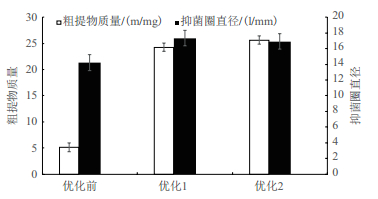
|
| 图 4 优化前后粗提物质量及抑制圈直径比较 |
通过对萃取废液、菌体浸液及粗提物的群体感应抑制活性研究,发现萃取废液及菌体浸液均无群体感应抑制活性,仅粗提物具有较大的抑制圈直径,表明活性代谢产物为胞外产物,本实验中所采用的代谢物萃取方法可以很好地将活性物质从发酵液中萃取出来。在滤纸片实验的操作过程中,将粗提物的溶液移加至滤纸片上时,若滴加速度过快,会有部分粗提物透过滤纸片或从滤纸片的边缘溢出,所测试出的抑制圈会比实际要小,因此,HY026的粗提物群体感应抑制活性应稍大于测试值。
通过单因子试验发现可溶性淀粉和玉米粉是HY026的良好碳源,黄豆粉和胰蛋白胨是HY026的优良氮源。氮源是构成生物体的蛋白质、核酸及其他氮素化合物的主要材料[14],而有机氮源对菌株的生长及代谢产物的产生具有重要的作用。碳源作为微生物生长中的必须营养物质[15],则更多地影响该菌株的群体感应活性(即活性物质在总代谢物中的占比)。夏觅真等[16]在对一株土壤放线菌FX05的发酵条件优化研究中发现以1%玉米粉为碳源时,FX05的代谢产物抑制绿脓杆菌的活性最高。周慧茹[17]在对抗肿瘤活性菌的培养优化及活性物质研究中发现,高浓度的玉米粉不仅能使菌体生长旺盛,而且对菌株的代谢活动更有利。肖怀东等[18]在对海洋放线菌JMC06001发酵培养基优化的研究中发现将蛋白胨和大豆粉组合时获得的粗提物对藤黄八叠球菌(Sarcina lutea)和金黄色葡萄球菌(Staphylococcus aureus)有较强的抑制效果。
通过正交试验发现,就菌株的抗群体感应活性而言,磷酸氢二钾和盐度影响较大,赵媛等[19]在对叶红景天内生菌抗病菌株筛选及培养条件优化研究中发现,磷酸氢二钾对抑菌活性物质的产生有较高的促进作用。许洁[20]在抗群体感应海洋放线菌的分离筛选与活性物质研究中发现,盐度的改变对菌株的活性有较大的影响。综合代谢物产量和活性两者因素发现,碳氮比降低,活性物质的产量略有上升,但活性却略微下降。就两种优化条件下发酵所得的提取物的产量和群体感应抑制活性来看,两者的优化效率没有明显差异,都是培养菌株HY026的良好的发酵培养基。但优化1中用到的玉米粉的含量高于优化2,考虑到经济成本,优化2中的培养基配方为菌株S. parvulus HY026的最佳优化条件。
4 结论本文对分离自连云港海域的一株海洋微小链霉菌HY026进行了群体感应抑制活性的测试和培养条件的优化,通过滤纸片法确定S. parvulus HY026具有较高的群体感应抑制活性,在单因子实验中,确定玉米粉为最佳碳源、黄豆粉为最佳氮源,通过正交实验,确定最佳的培养基配方为:磷酸氢二钾1.0 g/L,盐度34.0 g/L,玉米粉10.0 g/L,黄豆粉5.0 g/L。本研究为进一步大批量发酵获取S. parvulus HY026的粗提物和活性物质的分离纯化提供基础。
| [1] |
Galloway WR, Hodgkinson JT, Bowden SD, et al. Quorum sensing in Gram-negative bacteria:small-molecule modulation of AHL and AI-2 quorum sensing pathways[J]. Chemical Reviews, 2011, 111(1): 28-67. DOI:10.1021/cr100109t |
| [2] |
李宪臻, 栾娈. 群体感应效应的抑制及在抗微生物感染中的应用[J]. 大连工业大学学报, 2008, 27(3): 197-200. DOI:10.3969/j.issn.1674-1404.2008.03.002 |
| [3] |
郝富智, 郭继强, 李宪臻. 群体感应抑制剂的筛选及其在微生物病害防治中的应用[J]. 微生物学杂志, 2010, 30(2): 76-79. DOI:10.3969/j.issn.1005-7021.2010.02.016 |
| [4] |
穆永其, 曾红, 陈伟. 抑制紫色素杆菌12472群感效应放线菌的筛选[J]. 西北农业学报, 2018, 27(10): 1537-1540. DOI:10.7606/j.issn.1004-1389.2018.10.018 |
| [5] |
Weng L, Zhang Y, Meng H, et al. Screening and isolating quorum sensing inhibitor from bacteria[J]. African Journal of Microbiology Research, 2010, 6(5): 927-936. |
| [6] |
Borges A, Serra S, Abreu AC, et al. Evaluation of the effects of selected phytochemicals on quorum sensing inhibition and in vitro cytotoxicity[J]. Biofouling, 2014, 30(2): 183-195. DOI:10.1080/08927014.2013.852542 |
| [7] |
Ta C, Freundorfer M, Mah TF, et al. Inhibition of bacterial quorum sensing and biofilm formation by extracts of neotropical rainforest plants[J]. Planta Medica, 2014, 80(4): 343-350. DOI:10.1055/s-0033-1360337 |
| [8] |
Ni N, Li M, Wang J, et al. Inhibitors and antagonists of bacterial quorum sensing[J]. Medicinal Research Reviews, 2009, 29(1): 65-124. |
| [9] |
刘志恒. 放线菌—微生物药物的重要资源[J]. 微生物学通报, 2005, 32(6): 143-145. DOI:10.3969/j.issn.0253-2654.2005.06.030 |
| [10] |
Subramani R, Aalbersberg W. Marine actinomycetes:An ongoing source of novel bioactive metabolites[J]. Microbiological Research, 2012, 167(10): 571-580. DOI:10.1016/j.micres.2012.06.005 |
| [11] |
Manivasagan P, Kang K, Sivakumar K, et al. Marine actinobacteria:An important source of bioactive natural products[J]. Environ-mental Toxicology and Pharmacology, 2014, 38(1): 172-188. DOI:10.1016/j.etap.2014.05.014 |
| [12] |
刘颖, 王梅梅, 侯志红, 等. 具有群体感应抑制活性海洋放线菌的筛选与鉴定[J]. 生物技术世界, 2015(9): 10-11. |
| [13] |
Miao L, Xu J, Yao Z, et al. The anti-quorum sensing activity and bioactive substance of a marine derived Streptomyces[J]. Biote-chnology & Biotechnological Equipment, 2017, 31(5): 1-9. |
| [14] |
陈喆, 王兆守, 方柏山, 等. 产二羟基丙酮的海洋菌筛选与发酵条件的优化[J]. 食品与发酵科技, 2011, 47(6): 15-21. DOI:10.3969/j.issn.1674-506X.2011.06.004 |
| [15] |
刘志恒. 现代微生物学[M]. 北京: 科学出版社, 2002.
|
| [16] |
夏觅真, 蒋颂, 罗薇薇, 等. 土壤放线菌FX05发酵培养基及发酵条件的优化[J]. 微生物学杂志, 2009, 29(4): 49-52. DOI:10.3969/j.issn.1005-7021.2009.04.011 |
| [17] |
周惠茹.抗肿瘤活性菌的培养优化及活性物质研究[D].扬州: 扬州大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-11117-1014355499.htm
|
| [18] |
肖怀东, 张晓蓉, 刘祝祥, 等. 海洋放线菌JMC06001发酵培养基优化及抑菌物质性质的初步研究[J]. 中国海洋药物杂志, 2007, 26(4): 32-36. |
| [19] |
赵媛, 云梅, 杨国柱, 等. 对叶红景天内生菌抗病菌株筛选及培养条件优化[J]. 江苏农业科学, 2018, 46(17): 102-105. |
| [20] |
许洁.抗群体感应活性海洋放线菌的分离筛选与活性物质研究[D].扬州: 扬州大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-11117-1018139650.htm
|