磷是除氮外限制植物生长的主要营养元素, 在能量代谢、光合作用、营养物质转运和遗传特性中起着至关重要的作用[1-2]。土壤是植物吸收磷的主要库源, 但绝大部分以Ca3(PO4)2、CaHPO4、FePO4和AlPO4等难溶性磷存在, 难以被植物吸收利用[3]。我国约74%的耕地土壤缺磷, 农业生产主要以施用化学磷肥供给有效磷, 而施入土壤的磷肥除小部分被作物吸收外, 75%-90%与土壤中Ca2+、Fe3+、Al3+等阳离子反应沉积在土壤中, 导致土壤磷素不断积累, 而有效磷缺乏, 这不仅会造成有限的磷矿资源大量浪费, 而且还会加剧农业面源污染问题[4-6]。根据农业部"一控两减三基本"的要求, 如何有效利用土壤中固定的难溶性磷, 提高磷肥的利用率, 从而减少磷化肥的施用量, 对解决土壤中磷的供需矛盾具有重要意义。
土壤微生物是土壤养分循环转化的动力, 解磷菌能够通过分泌有机酸、无机酸、嗜铁素、H2S、腐殖质、磷酸酶及胞外多糖等物质, 或NH4+同化作用将土壤中无效磷转化为植物可利用的有效磷, 可提高磷肥利用率、改善土壤结构和促进作物生长[7-10]。目前已发现的解磷细菌主要有无色杆菌属、气杆菌属、芽孢杆菌属、产碱杆菌属、沙雷菌属、黄单胞菌属、克雷伯菌属、气单胞菌属和肠杆菌属等[11-12]。然而, 解磷菌施用于土壤效果受到菌株定殖竞争能力和环境条件影响, 尤其是石灰性盐化土壤, 其固定的难溶性磷酸盐主要以磷酸钙的形态存在, 因此, 需筛选适应新疆盐碱土环境的具有溶磷特性的微生物。此外, 解磷菌的数量是其前期定殖和竞争的基础, 新疆主要采用滴管、喷灌等方式, 一般肥料随水进入作物根区, 为解磷菌以发酵液形式进入土壤奠定了基础, 也便于其在作物根部定殖、生长和溶磷。基于此, 以盐碱土中分离纯化得到一株高效解磷菌PS-3为研究对象, 采用单因素和正交试验, 研究菌株PS-3的发酵条件, 考察碳源、氮源、pH、温度、盐度和接种量对菌株PS-3溶解磷酸三钙的影响, 为新疆盐碱土磷素的有效性释放和合理利用提供理论依据。
1 材料与方法 1.1 材料供试菌株:PS-3为本实验室从新疆盐碱土中筛选获得。
LB培养基:酵母提取物5 g, 蛋白胨10 g, NaCl 10 g, 蒸馏水1 000 mL, pH 7.0。
国际植物研究所磷酸盐生长培养基(National Botanical Research Institute’s phosphate growth medium, NBRIP)[13]:葡萄糖10 g, Ca3(PO)2 5 g, MgCl2·6H2O 5 g, MgSO4·7H2O 0.25 g, KCl 0.2 g, (NH4)2SO4 0.1 g, 蒸馏水1 000 mL, pH 7.0。
1.2 方法 1.2.1 菌株PS-3发酵条件的研究将菌株PS-3接入LB培养基中培养22 h, 以1%的接种量投加至新鲜LB培养基, 分别调节体系的温度(15-45℃)、初始pH(4-10)和盐浓度(0-7%), 同时以不接菌的LB培养基为对照, 每个处理重复3次, 分别置于120 r/min振荡培养, 测定发酵液的OD600。
1.2.2 菌株PS-3溶磷条件的优化 1.2.2.1 碳源和氮源的影响分别以葡萄糖、蔗糖、麦芽糖、果糖、乳糖为NBRIP中唯一碳源(1%), 其他培养基成分不变, 按2%的接种量接种菌株PS-3, 于35℃, 120 r/min振荡培养3 d, 以不接菌的为对照, 每个处理重复3次, 10 000 r/min离心10 min取上清液, 采用钼锑抗比色法[14]测定有效磷含量, 筛选出最适碳源后进行浓度优化(0.5%-5%)。在此基础上, 以硝酸钠、尿素、硝酸铵及氯化铵为氮源等量替换硫酸铵, 研究不同氮源对菌株PS-3溶磷的影响, 并优化氮源添加量(0.005%-0.05%)。
1.2.2.2 环境因素对菌株PS-3溶磷的影响将发酵培养22 h的菌株PS-3制成菌悬液, 按2%的接种量投加至优化的NBRIP中, 分别调节体系的温度(20、25、30、35和40℃)、初始pH(5、6、7、8和9)和盐浓度(2 g/L、5 g/L、10 g/L、15 g/L、20 g/L、30 g/L和50 g/L), 在120 r/min培养7 d, 同时以不接菌的为对照, 每个处理3次重复, 以钼锑抗比色法测定有效磷含量。
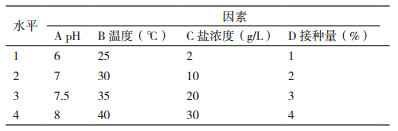
1.2.2.3 正交试验采用L16(44)设计正交试验进一步优化菌株PS-3的溶磷能力, 以不接菌的为对照, 每个处理重复3次, 试验设计见表 1。
试验数据采用SPSS19.0进行统计分析和显著性检验。
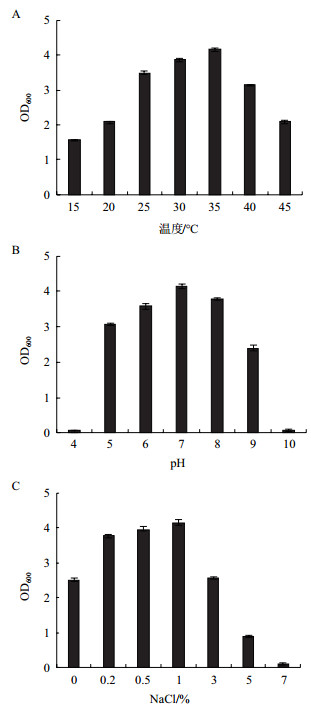
2 结果 2.1 菌株PS-3发酵条件的研究通过摇瓶发酵试验, 考察温度、pH和盐浓度对菌株生长的影响, 结果见图 1。由图 1-A可知, 随着温度的升高, 菌株PS-3的OD600值呈现先增加后降低的现象, 在15-45℃范围内均能生长, 35℃为最适生长温度, 而当温度低于25℃或高于40℃时, 菌株生长缓慢, 数量显著下降(P < 0.05), 这可能是由于环境温度过高时, 会使微生物蛋白质失活死亡, 而温度较低时, 酶的活性降低, 影响微生物的生长繁殖。菌株PS-3对酸碱的耐受性较好, 在pH值5.0-9.0的范围内均能生长, 最适pH值为7, 而当pH低于6或高于8时, 菌株PS-3的生长才会受到明显抑制(图 1-B)。
|
| 图 1 菌株PS-3的生长特性 |
渗透压会影响微生物的生长, 结果见图 1-C。随着NaCl浓度增加, 菌株PS-3的OD600值呈现先升高后降低的趋势, 且差异显著(P < 0.05)。菌株PS-3最适生长盐浓度为1%, 在盐浓度为0-5%范围内均能生长, 这可能与菌株PS-3从盐碱土中分离有关, 而当盐浓度达到7%时基本不能生长。综上所述, 菌株PS-3的较适发酵条件为温度35℃、pH 7、盐浓度1%。
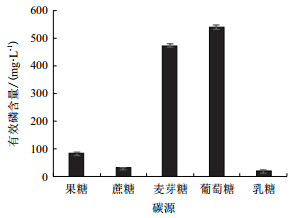
2.2 菌株PS-3溶磷条件的优化 2.2.1 碳源对菌株PS-3溶磷的影响碳源对菌株PS-3溶磷效果的影响, 结果见图 2。由图可知, 不同碳源对菌株PS-3溶解磷酸三钙的能力有差异, 溶液中有效磷含量大小依次为葡萄糖>麦芽糖>果糖>蔗糖>乳糖。以葡萄糖和麦芽糖为碳源时, 溶液中有效磷含量在470 mg/L以上, 显著高于果糖、蔗糖、乳糖(P < 0.05), 其中, 葡萄糖为碳源时, 菌株PS-3溶磷能力最强, 溶液中有效磷含量可达539.19 mg/L, 而当碳源为乳糖时, 菌株PS-3溶磷效果最差, 有效磷含量仅仅为20.50 mg/L, 可能是由于乳糖的代谢途径更为复杂, 菌株PS-3不能很好地利用乳糖。
|
| 图 2 碳源对菌株PS-3溶磷的影响 |
在此基础上, 以葡萄糖作为碳源, 考察葡萄糖浓度对菌株PS-3溶磷效果的影响, 结果如图 3所示。由图可以看出, 随着葡萄糖浓度增加, 溶液中有效磷浓度呈现先增加后降低的趋势, 且差异显著(P < 0.05), 菌株PS-3溶磷最适的葡萄糖浓度为2%。

|
| 图 3 葡萄糖浓度对菌株PS-3溶磷的影响 |
由图 4可看出, 菌株PS-3以硝酸铵为氮源时, 有效磷含量为706.67 mg/L; 以氯化铵、硫酸铵和硝酸钠为氮源时, 有效磷含量均超过648 mg/L, 但无显著差异(P > 0.05);以尿素为氮源时, 有效磷含量最低; 菌株PS-3对氮源的利用顺序依次为硝酸铵 > 硝酸钠 > 氯化铵 > 硫酸铵 > 尿素, 这表明该菌株以硝态氮为氮源时较铵态氮对磷有更好的溶解能力, 这可能与菌株PS-3代谢途径有关。
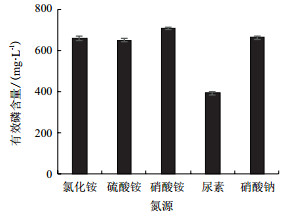
|
| 图 4 氮源对菌株PS-3溶磷的影响 |
在优化碳、氮源的基础上, 考察硝酸铵浓度对菌株PS-3溶磷效果的影响, 结果见图 5。由图可知, 随着硝酸铵浓度增加, 溶液中有效磷含量呈现先增加后降低的趋势, 当其浓度达到0.01%时, 溶液中有效磷含量最高, 而硝酸铵继续增加时, 溶液中有效磷含量开始下降, 且差异不显著(P > 0.05)。
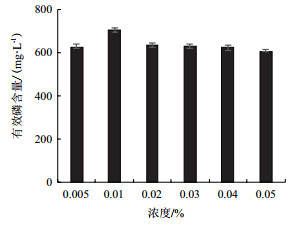
|
| 图 5 硝酸铵浓度对菌株PS-3溶磷的影响 |
由图 6可以看出, 温度对菌株PS-3溶解磷酸三钙的影响不明显, 在20-40℃范围内均具有良好的溶磷能力, 当温度从20℃上升至35℃时, 菌株PS-3对磷的溶解能力增加了11.86%, 在温度达到35℃后, 菌株PS-3溶磷能力逐渐降低, 但差异不显著(P > 0.05), 这表明菌株PS-3具有一定的耐温性。

|
| 图 6 温度对菌株PS-3溶磷的影响 |
由图 7可知, 菌株PS-3在pH 5-9的范围内均能溶解磷酸三钙, 具有较强的适应能力, 尤其是在pH值6-8的环境中, 溶液中有效磷含量均超过750 mg/L; 而pH高于8时, 溶液中有效磷含量显著降低(P < 0.05), 可能是由于体系中碱性较强, 溶磷菌分泌的有机酸量有限, 影响了溶磷效果。

|
| 图 7 初始pH值对菌株PS-3溶磷的影响 |
随着盐浓度上升, 溶液中有效磷含量呈现先增加后降低的趋势(图 8)。菌株PS-3在NaCl浓度为0-5%范围内均能溶磷, 盐浓度为0.2%时, 溶磷量达到最高, 含盐量在2%以内基本不影响菌株的溶磷能力, 能够适应新疆盐渍化土壤环境; 而盐浓度超过3%时, 溶液中有效磷含量显著下降(P < 0.05), 菌株PS-3溶磷能力受到了明显的抑制。

|
| 图 8 盐浓度对菌株PS-3溶磷的影响 |
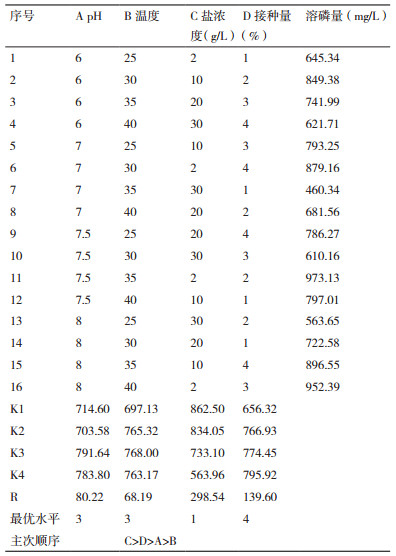
对菌株PS-3进行4因素4水平正交试验, 结果见表 2。由K值和极差R大小可知, 4个因素对菌株PS-3溶磷效果的影响主次顺序为盐浓度 > 接种量 > pH > 温度。正交试验初步得到的最优溶磷条件为pH 7.5、温度35℃、盐浓度2 g/L, 接种量4%。在最优溶磷条件下, 验证实验结果表明该菌株在7 d的溶磷量可达100 2.95 mg/L。
在土壤磷循环过程中, 解磷微生物起着重要的作用, 它可以将土壤中的难溶性磷转化为植物能够吸收利用的有效磷, 提高磷肥的利用率、改良土壤结构和提高作物产量[15-18]。解磷菌自身特性和环境因素会影响其溶磷效果。本研究中筛选的解磷菌PS-3来自于新疆盐碱地, 具有一定的耐盐胁迫能力, 在盐浓度为5%时仍可生长, 其对磷酸三钙的溶磷量可达127.61-1 002.95 mg/L。江红梅等[19]从内蒙古盐碱地中筛选得到的解磷菌M1可耐受10% NaCl。向文良等[20]从四川盐井分离的中度嗜盐菌QW1011可在15% NaCl中生长, 其溶磷能力可达56.76-71.34 mg/L。胡山等[21]从河西走廊盐碱地分离的解磷菌Y3-35也具有一定的耐盐性, 在盐浓度为0.25%时溶磷量可高达723.34 mg/L, 这说明了盐碱土中的解磷微生物具有一定的耐盐能力。与上述耐盐解磷菌相比, 本研究中的菌株PS-3具有较强的溶磷能力。
研究表明, 培养基中碳氮源会影响解磷菌的生长, 并通过改变其产生的有机酸类型和浓度影响溶磷效果[22-23]。卫星[24]等研究发现, 以葡萄糖为碳源、硫酸铵为氮源时, 巨大芽孢杆菌NCT-2的溶磷量可达93.34 mg/L; 黄达明等[25]的洋葱伯克霍尔德氏菌P0417以葡萄糖、草酸铵为碳氮源时, 其溶磷量可达791.84 mg/L; Jain等[23]分离的溶磷菌S29优先利用乳糖和硫酸铵, 其对磷酸三钙的溶解量高达1 110 mg/L。本研究中的菌株PS-3在不同碳氮源条件下的溶磷量也存在差异, 当葡萄糖为碳源、硝酸铵为氮源时, 该菌株7 d优化的溶磷量可达到1 002.95 mg/L, 这与李海云等[26]的研究结果一致。从新疆盐碱土中分离出具有一定耐盐解磷能力的菌株, 这为新疆盐碱土磷素的有效性释放和合理利用提供理论依据, 对区域农业的可持续发展具有重要意义。后续研究中, 将对解磷菌PS-3的解磷机理及其在土壤中的定殖能力、溶磷效果等方面做进一步研究。
4 结论菌株PS-3具有一定的耐酸碱、温度和盐度能力, 在pH 5-9、15-45℃、NaCl浓度0-5%范围内均可生长。菌株PS-3的较适发酵条件为温度35℃、pH 7, 盐浓度1%。
不同碳源和氮源会影响菌株PS-3的溶磷效果, 其对碳源的利用顺序依次为葡萄糖>麦芽糖>果糖>蔗糖>乳糖, 对氮源的利用顺序依次为硝酸铵 > 硝酸钠 > 氯化铵 > 硫酸铵 > 尿素。菌株PS-3在pH 5-9, 20-40℃, NaCl浓度0-5%范围内对磷酸三钙有一定的溶解能力。
通过单因素和正交试验对菌株PS-3的溶磷条件进行了优化, 获得最适条件为2%葡萄糖、0.01%硝酸铵、温度35℃、初始pH 7.5、盐浓度2 g/L、接种量4%, 在此条件下, 其对磷酸三钙的溶解量可达1 002.95 mg/L。
| [1] |
Gyaneshwar P, Kumar GN, Parekh LJ, et al. Role of soil microorganisms in improving P nutrition of plants[J]. Plant & Soil, 2003, 245(1): 83-93. |
| [2] |
Srinivasan R, Alagawadi AR, Yandigeri MS, et al. Characterization of phosphate-solubilizing microorganisms from salt-affected soils of India and their effect on growth of sorghum plants[Sorghum bicolor(L.)Moench][J]. Annals of Microbiology, 2012, 62(1): 93-105. DOI:10.1007/s13213-011-0233-6 |
| [3] |
Saurabh Jyoti S, Satinder Kaur B, Yann LB, et al. Potential application of biohydrogen production liquid waste as phosphate solubilizing agent-a study using soybean Plants[J]. Appl Biochem Biotechnol, 2016, 178: 865-875. DOI:10.1007/s12010-015-1914-6 |
| [4] |
鲁如坤, 时正元, 顾益初. 土壤积累态磷研究II.一次大量施磷的产量效应[J]. 土壤, 1995, 27(6): 286-289. |
| [5] |
Stevenson FJ, Cole MA. Cycles of soils:carbon, nitrogen, phosphorus, sulfur, micronutrients[M]. Wiley: Quarterly Review of Biology, 1999.
|
| [6] |
银婷婷, 王敬敬, 柳影, 等. 高效解磷菌的筛选及其促生机制的初步研究[J]. 生物技术通报, 2015, 31(12): 234-242. |
| [7] |
Swaby RJ, Sperber J. Phosphate dissolving micro-organisms in the rhizosphere of legumes[J]. Nutrition of the Legumes, 1958, 289-294. |
| [8] |
Ochoaloza FJ, Artiola JF, Maier RM. Stability constants for the complexation of various metals with a rhamnolipid biosurfactant[J]. Journal of Environmental Quality, 2001, 30(2): 479. DOI:10.2134/jeq2001.302479x |
| [9] |
Yi YHW, Ge Y. Exopolysaccharide:a novel important factor in the microbial dissolution of tricalcium phosphate[J]. World J Microbiol Biotechnol, 2008, 24(7): 1059-1065. DOI:10.1007/s11274-007-9575-4 |
| [10] |
赵小蓉, 林启美. 微生物解磷的研究进展[J]. 中国土壤与肥料, 2001(3): 7-11. DOI:10.3969/j.issn.1673-6257.2001.03.002 |
| [11] |
Chen YP, Rekha PD, Arun AB, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006, 34(1): 33-41. DOI:10.1016/j.apsoil.2005.12.002 |
| [12] |
Kundu BS, Nehra K, Yadav R, et al. Biodiversity of phosphate solubilizing bacteria in rhizosphere of chickpea, mustard and wheat grown in different regions of Haryana[J]. Indian Journal of Microbiology, 2009, 49(2): 120-127. DOI:10.1007/s12088-009-0016-y |
| [13] |
Nautiyal CS. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. Fems Microbiology Letters, 1999, 170(1): 265-270. DOI:10.1111/fml.1999.170.issue-1 |
| [14] |
鲍士旦. 土壤农化分析[J]. 北京:中国农业出版社, 2000. |
| [15] |
Bianco C, Defez R. Improvement of phosphate solubilization and Medicago plant yield by an indole-3-acetic acid-overproducing strain of Sinorhizobium meliloti[J]. Applied & Environmental Microbiology, 2010, 76(14): 4626. |
| [16] |
Mehta P, Walia A, Chauhan A, et al. Plant growth promoting traits of phosphate-solubilizing rhizobacteria isolated from apple trees in Trans Himalayan region of Himachal Pradesh[J]. Archives of Microbiology, 2013, 195(5): 357-369. DOI:10.1007/s00203-013-0881-y |
| [17] |
Bhagwanjee S, Scribante J, Paruk F. Application of potential phosphate-solubilizing bacteria and organic acids on phosphate solubilization from phosphate rock in aerobic rice[J]. The Scientific World Journal, 2013, (2013-10-8), 2013, 2013(4): 272409.
|
| [18] |
Khan MS, Zaidi A, Wani PA. Role of phosphate-solubilizing microorganisms in sustainable agriculture-A review[J]. Agronomy for Sustainable Development, 2007, 27(1): 29-43. DOI:10.1051/agro:2006011 |
| [19] |
江红梅, 殷中伟, 史发超, 等. 一株耐盐日本曲霉的筛选及其溶磷促生作用[J]. 微生物学报, 2018, 58(5): 862-881. |
| [20] |
向文良, 冯玮, 郭建华, 等. 一株解磷中度嗜盐菌的分离鉴定及解磷特性分析[J]. 微生物学通报, 2009, 36(3): 320-327. |
| [21] |
胡山, 牛世全, 龙洋, 等. 河西走廊盐碱土壤中一株高效溶磷菌的鉴定及条件优化[J]. 微生物学通报, 2017, 44(2): 358-365. |
| [22] |
Ahuja A, Ghosh SB, D'Souza SF. Isolation of a starch utilizing, phosphate solubilizing fungus on buffered medium and its characterization[J]. Bioresource Technology, 2007, 98(17): 3408-3411. DOI:10.1016/j.biortech.2006.10.041 |
| [23] |
Jain R, Saxena J, Sharma V. Effect of phosphate-solubilizing fungi Aspergillus awamori S29 on mungbean(Vigna radiata cv. RMG 492)growth[J]. Folia Microbiologica, 2012, 57(6): 533-541. DOI:10.1007/s12223-012-0167-9 |
| [24] |
卫星, 徐鲁荣, 张丹, 等. 一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J]. 环境科学学报, 2015, 35(7): 2052-2058. |
| [25] |
黄达明, 李倩, 管国强, 等. 一株解磷细菌的筛选、鉴定及其溶磷培养条件的优化[J]. 生物技术通报, 2015, 31(2): 173-178. |
| [26] |
李海云, 牛世全, 孔维宝, 等. 猪粪堆肥中一株溶磷菌的筛选鉴定及溶磷能力初步测定[J]. 环境科学学报, 2015, 35(5): 1464-1470. |