L-异亮氨酸, 别名L-异白氨酸, 是人体八种必需氨基酸之一。1901年, Fischer从蛋白水解液中发现L-异亮氨酸, 是对于异亮氨酸最早的报道[1]。L-异亮氨酸广泛应用于食品、饲料、化妆品与医药行业[2]。目前, 国内外采用微生物发酵法生产L-异亮氨酸, 然而生产菌株存在产酸率低, 杂酸较多等问题。因此, 选育一株产酸率高, 杂酸含量低的L-异亮氨酸产生菌对工业化生产L-异亮氨酸具有重要意义。
目前应用于工业化生产的菌株主要是通过传统诱变获得, Yoshinaga[3]等通过选育S-2氨基乙基-L-半胱氨酸抗性(AECr)、α-氨基-β-羟基戊酸抗性(AHVr)、乙硫氨酸抗性(Ethr)的多重抗性菌株, 发酵过程中流加硫酸铵和醋酸混合液, 可产L-异亮氨酸37.4 g/L。Ikeda等[4]以苏氨酸产生菌FAB-3-1为出发菌株选育Ethr突变株, 获得突变株No.14083, 流加乙酸发酵, 可产L-异亮氨酸33.5 g/L。谢飞等[5]以谷氨酸棒状杆菌为出发菌株, 利用低能氮离子束注入对其进行多次诱变, 结合异亮氨酸氧肟酸盐(IleHx)等氨基酸结构类似物定向筛选, 得到一株稳定的高产L-异亮氨酸菌株, 摇瓶培养72 h产酸可达21-22 g/L。陈宁[6]等以黄色短杆菌为出发菌株, 诱变筛选出一株具有α-氨基丁酸(α-AB)抗性、蛋氨酸缺陷型(Met-)、AECr、Ethr菌株TC-1, 10 L发酵罐84 h可产酸25.0 g/L。
随着生物技术的发展成熟, 分子手段也被应用于菌中选育, 但是目前诱变育种仍是工业菌种选育最为有效的手段。常压室温等离子体生物诱变体系(Atmospheric and room temperature plasma, ARTP)作为一种新兴的高效生物突变手段, 具有放电均匀、活性粒子浓度高、化学活性物种可调控性好、操作简单、安全性高、环境友好、突变速度快、突变率高、突变多样性大等特点[7], 被广泛应用于菌中选育。本文前期采用硫酸二乙酯对菌株进行常规化学诱变处理, 后期结合了更加安全和更加稳定的ARTP对菌种进行逐级诱变, 获得一株2-噻唑丙氨酸(2-TA)和磺胺胍(Sulfaguanidine, SG)高抗性和在琥珀酸平板上能快速生长的突变菌株B. flavum TA-6。随后, 为达到诱变后菌株最佳产酸水平, 本实验采用响应面法对该突变菌株培养基组分进行了进一步优化控制。
1 材料与方法 1.1 材料 1.1.1 菌株菌株Brevibacterium flavum I-12, 由本实验室提供, 保藏于-80℃冰箱甘油管中。
1.1.2 主要试剂和仪器琥珀酸钠, 硫酸二乙酯, 硫代硫酸钠, 国药集团(上海)有限公司; 2-噻唑丙氨酸(2-TA), 磺胺胍, 德国Sigma公司。
HYL-B全温摇瓶柜, 太仓市强乐实验有限责任公司; 常压室温等离子体生物诱变系统, 无锡源清天木生物科技有限公司; ST16型离心机, 美国赛默飞世尔科技有限公司; 721N可见分光光度计, 上海仪电分析仪器有限公司; 生物传感分析仪, 山东省科学院生物研究所。
1.1.3 培养基及培养条件完全培养基(g/L):葡萄糖5.0, NaCl 5.0, 蛋白胨10.0, 牛肉浸膏10.0, 琼脂20.0, pH 7.0。
珀酸培养基(SAM; g/L):琥珀酸钠50.0, (NH4)2SO4 3.0, 尿素1.5, KH2PO4 1.0, K2HPO4 3.0, MgSO4·7H2O 0.1, MnSO4·4H2O 0.01, FeSO4·7H2O 0.01, 硫胺素100 µg/L, 生物素30 µg/L, 琼脂20.0, pH 7.0。
种子培养基(g/L):葡萄糖25.0, (NH4)2SO4(工业级)5.0, 玉米浆40.0, KH2PO4 1.0, MgSO4·7H2O 0.5, CaCO3 10.0, pH 7.5。
发酵培养基(g/L):葡萄糖130.0, (NH4)2SO4(工业级)30.0, 玉米浆12.0, KH2PO4 1.0, MgSO4·7H2O 0.05, 生物素50 µg/L, CaCO3 30.0, pH 7.5。
完全培养基、琥珀酸培养基和种子培养基, 0.1 MPa条件下灭菌20 min; 发酵培养基0.07 Mpa条件下灭菌10 min。
1.2 方法 1.2.1 诱变方法 1.2.1.1 硫酸二乙酯诱变刮取3-5环菌于装有玻璃珠和10 mL生理盐水的小三角瓶中, 加入20 µL硫酸二乙酯和1 mL无水乙醇振荡10 min, 加入1 mL 25%硫代硫酸钠终止反应, 6 000 r/min离心后生理盐水洗涤两次, 重悬菌体, 涂布于筛选培养基, 倒置、30℃培养2-3 d, 挑选抗性菌株。DES属于烷化剂, 主要原理是烷化剂的活性烷基可以转移到其他分子中电子密度高的地方去, 并能够轻而易举取代DNA分子中活泼的氢原子, 使得DNA分子上的一个或多个碱基及磷酸部分被烷基化, 进而改变DNA分子结构, 使其碱基互补配对时发生错配而造成突变[8]。结合相关文献[9-10], 致死率在90%左右正突变率较高。
1.2.1.2 ARTP诱变首先取培养至对数生长期的菌液, 离心后用生理盐水重悬菌体, 控制OD562=0.5-0.6, 取10 µL菌悬液均匀涂到无菌的载片上, 然后用ARTP进行处理, 通过处理时间控制致死率。诱变结束后将载片放入盛有1 mL无菌生理盐水的EP管中, 于振荡器上震荡1 min, 使诱变后的菌体充分洗脱下来, 然后稀释合适倍数, 涂布于相应抗性平板挑选抗性菌落。ARTP诱变条件:射频功率100 W, 载气流量10 SLM, 处理距离2 mm, 处理时间20-160 s。根据相关文献[11-13], 离子束处理致死率在90%时可获得较高正突变率。
1.2.2 高产菌筛选方法 1.2.2.1 平板初筛分别取诱变后的菌液200 µL涂布于SAM培养基、2-TA和SG抗性平板, 恒温30℃、倒置培养2-3 d, 挑选生长快速、单菌落较大的菌株转接于完全培养基培养1-2 d, 进行摇瓶初筛。
1.2.2.2 摇瓶初筛将抗性平板挑出的菌株接种于发酵培养基, 摇床30℃、100 r/min培养72 h, 取静置后的发酵上清液测定产量, 初步筛选L-异亮氨酸高产菌。
1.2.2.3 摇瓶复筛将摇瓶初筛筛选出的高产菌平板活化后接种于种子培养基, 摇床30℃、100 r/min培养16-18 h后, 转接于发酵培养基(每株3个平行), 摇床30℃、100 r/min培养72 h, 取静置后的上清发酵液, 用高效液相色谱精确测定L-异亮氨酸产量及杂酸产量, 将高产菌编号并用甘油管保存, 作为下一步诱变的出发菌株。
1.2.3 分析方法 1.2.3.1 菌体浓度测定取发酵液200 µL, 用0.25 mol/L的稀盐酸稀释26倍, 测定562 nm处吸光度值。
1.2.3.2 致死率致死率(%)=(对照组活菌数-诱变组活菌数)×100% /对照组活菌数
1.2.3.3 葡萄糖含量的测定发酵液稀释100倍, 离心去除菌体和碳酸钙后, 利用SBA-40E生物传感分析仪测定发酵液中葡萄糖含量, 每次进液量为25 µL。
1.2.3.4 L-异亮氨酸的测定高效液相色谱法[14, 15]:高效液相色谱法:取800 µL发酵液, 8 000 r/min离心3 min去除菌体, 经孔径0.22 μm的滤膜过滤所得滤液, 用高效液相色谱Agilent 1200分析测定其中L-异亮氨酸含量。色谱柱:Agilent ZORBAX Eclipse AAA; 检测器:DAD检测器; 流动相:流动相A, 5 mL/L四氢呋喃, 5 g/L无水乙酸钠, 200 µg/L三乙胺, 冰醋酸调pH至7.2;流动相B, 25 g/L无水乙酸钠:甲醇:乙腈=1:2:2;色谱条件:柱温40℃, 流速1.0 mL/min, 进样体积10.0 µL, 波长338 nm。
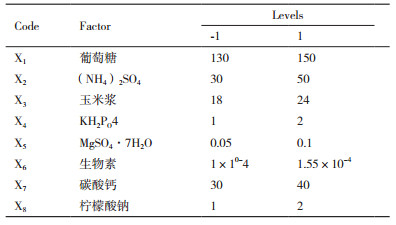
1.2.4 响应面法优化L-异亮氨酸发酵培养基 1.2.4.1 lackett-Burman实验设计P据马雷等[16]文献报道, 发酵过程中添加柠檬酸钠可有效减少副产物的生成, 所以在单因素实验的基础上, 选取原始培养基中的7个组分以及柠檬酸钠共8个组分进行PB试验设计。通过N=12的Plackett-Burman设计, 将L-异亮氨酸发酵培养基8个组分对L-异亮氨酸生产影响的显著性进行了考察, 共12组实验, 每组3个平行, 重复试验4次, 具体实验设计见表 1。
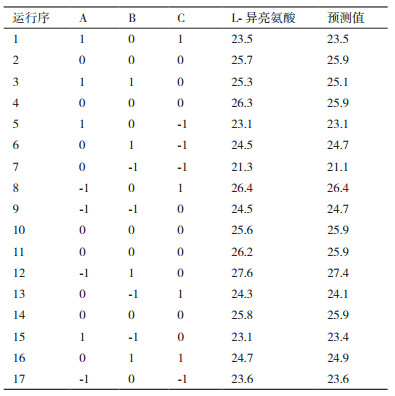
在Plackett-Burman试验结果的基础上, 选择葡萄糖、(NH4)2SO4、KH2PO4这3个对L-异亮氨酸产量有显著影响的因素做出3因素3水平的响应面设计, 实验因素水平选择见表 2, 具体实验设计见表 5, 共17组实验组, 其中包括5组中心点实验, 每组3个平行, 重复试验4次。其它培养基组分浓度与Plackett-Burman试验设计第5组中培养基添加量保持一致。
根据方法1.2.1.1对出发菌株进行诱变, 以DES浓度为变量, 测定DES诱变致死曲线, 如图 1所示, DES浓度为2.0 mL/L时, 致死率为88.65%, 浓度达到2.5 mL/L时, 菌体致死率接近百分之百。致死率在90%左右正突变率较高, 故本实验选择2.0 mL/L DES进行化学诱变。

|
| 图 1 DES诱变致死曲线 |
ARTP对微生物作用的主要因子为高浓度的中性活性粒子。而且相对于其他传统诱变技术, ARTP诱变育种技术的显著特点是:操作简便、设备简单、条件温和、安全性高、诱变快速、突变率高、突变库容大。
根据方法1.2.1.2对原始菌株进行ARTP诱变, 以离子束处理时间为变量, 测定ARTP诱变致死曲线, 如图 2所示。在照射时间为100 s时, 致死率达到94.35%, 120 s时菌体基本全部死亡, 离子束处理致死率在90%可获得较高正突变率。故本实验确定最佳诱变时间为100 s。

|
| 图 2 ARTP诱变致死曲线 |
经过一系列复合诱变及抗性筛选, 最终得到一株L-异亮氨酸产量达到26.2 g/L高产突变株B. flavum TA-6, 比出发菌株提高了44.75%, 其选育谱系如图 3所示。其筛选机理为:琥珀酸培养基筛选磷酸烯醇式丙酮酸羧化酶高酶活突变株, 增强CO2固定能力, 增加天冬氨酸合成。2-TA是L-亮氨酸和L-缬氨酸的结构类似物, 筛选2-TA抗性菌株, 可以解除乙酰羟基酸合酶受到的反馈抑制和阻遏。此外, 选育SG抗性解除了天冬氨酸对磷酸烯醇式丙酮酸羧化酶的反馈抑制, 使代谢更加流畅。

|
| 图 3 B. flavum TA-6选育谱系 |
诱变育种是选育高产菌株较为有效的方法, 但也存在突变体遗传不稳定的问题, 所以对高产菌进行连续传代培养, 检验突变株的遗传稳定性也十分必要。为检验B. flavum TA-6的遗传稳定性, 对其进行7代连续发酵实验, 结果(图 4)表明B. flavum TA-6具有较高的遗传稳定性。
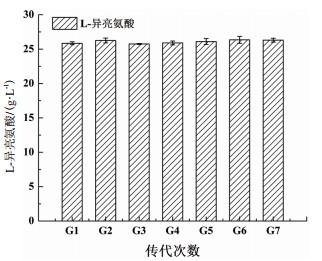
|
| 图 4 突变株TA-6遗传稳定性 |
为了对比诱变前后L-异亮氨酸及主要杂酸产量变化, 对摇瓶发酵过程中主要氨基酸的产量变化进行了监测, 发酵72 h(测定至78 h), 每6 h取样一次。结果(图 5)显示, 突变菌株B. flavum TA-6产酸由突变前18.1 ± 0.5 g/L提高至26.2 ± 0.5 g/L, 提高了44.75%, 主要的杂酸L-亮氨酸由2.10 ± 0.15 g/L下降为1.02 ± 0.06 g/L, L-缬氨酸由4.62 ± 0.30 g/L下降至2.42 ± 0.04 g/L。
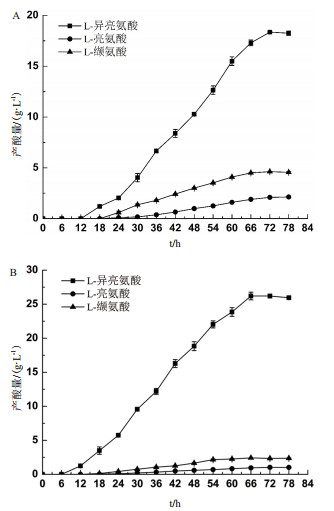
|
| 图 5 摇瓶发酵过程产酸曲线 A :出发菌株 B. flavum I-12 ;B :突变菌株 B. flavum TA-6 |
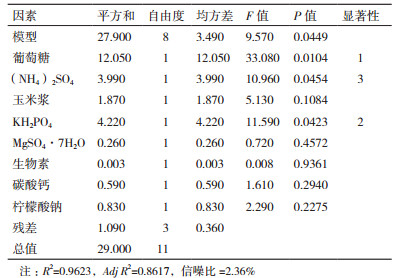
在发酵培养基优化及发酵条件优化方面, 响应面法被广泛应用, 而且效果较为显著。对本实验而言, 一方面是因为菌株发生了突变, 原始培养基可能并不是最合适的产酸培养基, 所以对原始培养基进行重新优化是很有必要的。另一方面, 发酵过程中添加柠檬酸钠可有效减少副产物的生成, 提高L-异亮氨酸生物合成途径的代谢流量。所以在单因素实验的基础上, 选取原始培养基中的7个组分以及柠檬酸钠共8个组分进行PB试验设计。初步筛选出对于L-异亮氨酸产量有显著影响的因素, 具体的实验结果见表 3。
通过Design expert 8.0.6软件对实验数据进行处理, 方差分析结果如表 4所示。由表可知主效应P值为0.044 9, 小于0.05表明Plackett-Burman实验设计的因素所选取水平对L-异亮氨酸产量影响显著, 同时决定系数R2为0.9623%, 说明回归模型有效, 实验设计合理, 结果可靠。因素所对应的P值越小, 说明该因素对异亮氨酸产量影响越大, 各因素对异亮氨酸产量影响大小排序为葡萄糖(P=0.010 4) > KH2PO4(P=0.042 3) > (NH4)2SO4(P=0.045 4) > 玉米浆(P=0.108 4) > 柠檬酸钠(P=0.227 5) > 碳酸钙(P=0.294 0) > MgSO4·7H2O(P=0.457 2) > 生物素(P=0.936 1)。因此, 选取葡萄糖、KH2PO4、(NH4)2SO4为L-异亮氨酸产量的主要影响因素。
基于上述结果, 在后续的实验设计中, 将围绕葡萄糖、KH2PO4、(NH4)2SO4三个因素进行重点考察, 优化出其最佳添加水平。此外, 基于单因素实验优化结果可知, 其他因素最佳添加水平如下(g/L):玉米浆18.0, MgSO4·7H2O 0.1, 柠檬酸钠1.0, 碳酸钙30.0, 生物素1.5×10-4。
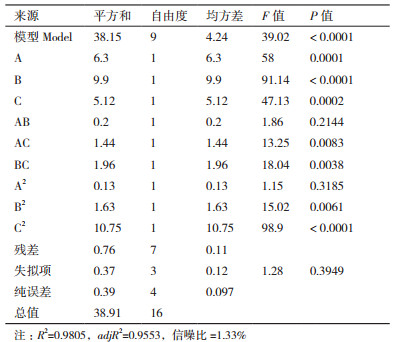
Box-Behnken的实验设计和结果见表 5, 采用Design-Expert软件对实验数据进行多元回归拟合, 根据分析结果, 整理可得L-异亮氨酸产量对葡萄糖、(NH4)2SO4、K2HPO43个因素的二次回归方程:Y=25.92-0.89A+1.11B+0.80C-0.23AB-0.60AC-0.70BC-0.17A2-0.62B2-1.6C2。回归方程的方差分析和模型显著性分析的结果, 如表 6所示。
由表 6可知, 模型P值小于0.001, 表明本实验所选用的二次多项模型显著, 试验方法合理, 实验结果可靠。Adeq Precision的值应大于4, 本实验等于24.77, 说明这个模型有足够分辨力, 能合适地反映实验结果; 变异系数(C.V.值1.33)低于10, 说明实验有良好的稳定性; 模型的相关系数R2=0.980 5, 说明响应值的变化有98.05%来源于所选因素, 仅有约1.85%的响应值总变异不能由此模型进行解释, 未知因素对实验结果的干扰较小; 预测相关系数R2值(Pred R-Squared 0.831 2)与调整相关系数R2值(Adj R-Squared 0.955 3)相比是合理一致的, 这意味着该回归模型对因素与响应值之间的关系做了很好的解释。此外, 模型一次项A、B、C和二次项C2差异极显著, 且一次项显著程度B > A > C, 说明L-异亮氨酸发酵需要更多的氮源。交互项AC、BC和二次项B2差异显著, 说明所选因素对L-异亮氨酸的产量影响存在更为复杂的交互关系, 而不仅仅是简单的线性关系。综上表明模型的拟合程度很好, 误差较小, 可信度高, 此模型可以用来优化L-异亮氨酸最适的培养基组成。
对二次方程求解, 得出优化后的培养基组成(g/L):葡萄糖140.0, 硫酸铵39.44, 玉米浆18.0, K2HPO4 1.12, MgSO4·7H2O 0.1, 柠檬酸钠1.0, 碳酸钙30.0, 生物素1.5×10-4。
2.4.3 验证试验利用Design-Expert软件分析得到的L-异亮氨酸最佳发酵培养基(g/L):葡萄糖140.0, 硫酸铵39.44, 玉米浆18.0, K2HPO4 1.12, MgSO4·7H2O 0.1, 柠檬酸钠1.0, 碳酸钙30.0, 生物素1.5×10-4(图 6)。以其为标准配制培养基, 其他条件保持稳定, 进行摇瓶发酵实验验证此模型的准确性。实验结果测得L-异亮氨酸的产量为27.8 g/L, 比优化前提高了6.1%, 与理论预测值接近, 证明了该模型对于L-异亮氨酸产量预测的准确性。

|
| 图 6 葡萄糖、硫酸铵和KH2PO4交互影响L-异亮氨酸产量的响应面图 |
本实验主要通过化学诱变结合常压室温等离子体生物诱变体系, 逐级诱变选育L-异亮氨酸高产菌。经过一系列诱变和筛选, 成功选育出一株在40 g/L的2-TA和5 g/L的SG, 且以琥珀酸为唯一碳源的培养基上快速生长突变株B.flavum TA-6, 该菌株摇瓶发酵情况下产酸水平达26.2 g/L, 比诱变前提高了44.75%。此外, 该菌株分泌的3种主要的副产物L-丙氨酸、L-缬氨酸和L-亮氨酸的积累量明显减少, 其中L-缬氨酸和L-亮氨酸减少的更为显著。遗传稳定性实验表明, 诱变选育出的L-异亮氨酸高产菌B. flavum TA-6具有良好的遗传稳定性, 可以用于工业化生产。最后, 在单因素的基础上, 利用响应面法对B. flavum TA-6发酵培养基进了进一步优化控制, 得出最佳培养及配方为(g/L):葡萄糖140.0, 硫酸铵39.44, 玉米浆18.0, K2HPO4 1.12, MgSO4·7H2O 0.1, 柠檬酸钠1.0, 碳酸钙30.0, 生物素1.5×10-4。在该优化条件下, B. flavum TA-6最终L-异亮氨酸产量达27.8 g/L, 比优化前提高了6.1%。除了以上3个主要影响因素, 根据单因素实验结果, 生物素也比优化前添加的更多, 其原因是生物素是丙酮酸羧化酶的辅酶, 生物素含量高有利于丙酮酸的羧化反应, 有利于增加天冬氨酸族氨基酸产量[5]。此外, 选育SG抗性解除了天冬氨酸对磷酸烯醇式丙酮酸羧化酶的反馈抑制, 不仅使代谢更加流畅。SG还是四氢叶酸的抗代谢物, 而四氢叶酸是叶酸的衍生物, 它是一碳化合物的载体, 以辅酶的形式参与蛋白质和核酸代谢过程, 对甲基的转移、甲酸基和甲醛基的利用起重要作用[6]。
在基因工程育种方面, Guillouet等[17]在谷氨酸棒杆菌中过表达对反馈不敏感高丝氨酸脱氢酶(homdr)、高丝氨酸激酶(thrB)和分解代谢苏氨酸脱水酶(tdcB), 改造后的菌株可产L-异亮氨酸8.8 g/L。Sahm等[18]通过在L-赖氨酸高产菌中扩增对反馈抑制不敏感的高丝氨酸脱氢酶和高丝氨酸激酶使得碳流从中间体L-天冬氨酸半醛转向高丝氨酸, 并过表达反馈抑制不敏感的苏氨酸脱水酶, 分批发酵可产L-异亮氨酸30 g/L。国内研究人员在代谢工程选育L-异亮氨酸高产菌方面的研究也有较好的进展, 如Yin和王小元等[19]在L-异亮氨酸高产菌中串联表达TDFbr和AHASFbr基因, 发酵可产L-异亮氨酸30.7 g/L; 徐庆阳等[20]通过将hom基因与表达载体pXMJ19连接构建出重组质粒pXMJ19-hom, 再转入C. glutamicum YILW构建C. glutamicum YILW(pXMJ19-hom), 5 L罐可产L-异亮氨酸36.5 g/L, 是目前产量较高的报道。需要指出的是, 利用分子改造选育的高产菌也存在一定局限性, 如需要添加抗生素来防止质粒丢失, 不仅增加了发酵成本, 而且容易造成抗生素污染影响正常发酵[21]。
对于突变株B.flavum TA-6产酸提高的具体原因目前还不清楚, 还需对关键酶基因如ilvBN和ppc进行进一步分析才能得出结论。此外, 摇瓶条件下的溶氧、pH调控水平有限, 且过高糖浓度也会影响菌体生长, 因此, 需要在分批发酵过程中进一步优化控制发酵工艺, 提高L-异亮氨酸产量。
4 结论通过传统化学诱变结合ARTP生物诱变体系, 成功选育出一株杂酸降低的L-异亮氨酸高产菌B.flavum TA-6。该菌株可在40 g/L的2-TA和5 g/L的磺胺胍, 且以琥珀酸为唯一碳源的培养基上快速生长, 在摇瓶发酵过程中L-异亮氨酸产量达26.2±0.5 g/L, 比出发菌株提高了44.75%, 而副产物L-缬氨酸和L-亮氨酸积累量明显降低。经响应面法优化发酵条件后, 突变株产酸可达27.8±0.5 g/L, 比优化前提高了6.1%。综上所述, 菌株B.flavum TA-6具有潜在工业化生产L-异亮氨酸的应用价值。
| [1] |
Voet D, Voet JG, Pratt CW. Fundamentals of biochemistry[J]. Fundamentals of Biochemistry, 2008, 15(2): 1452. |
| [2] |
Yamamoto K, Tsuchisaka A, Yukawa H. Branched-chain amino acids[J]. Methods in Enzymology, 2016, 166(7): 1. |
| [3] |
Yoshinaga F, Kubota K, Jujita I, et al. Method of producing L-isoleucine by fermentation: US, 3767529 A[P]. 1973.
|
| [4] |
Ikeda S, Fujita I, Yoshinaga F. Screening of L-isoleucine producers among ethionnine resistant mutants of L-threonine producing bacteria[J]. Agric Bid Chem, 1976(40): 511-516. |
| [5] |
谢飞, 崔国英, 王翀, 等. L-异亮氨酸高产菌种的选育研究[J]. 中国酿造, 2014, 33(11): 98-100. DOI:10.11882/j.issn.0254-5071.2014.11.022 |
| [6] |
陈宁. 氨基酸工艺学[M]. 北京: 中国轻工业出版社, 2011.
|
| [7] |
张雪, 张晓菲, 王立言, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7): 2676-2684. DOI:10.3969/j.issn.0438-1157.2014.07.027 |
| [8] |
诸葛健, 李华钟, 王正祥. 微生物遗传育种学[M]. 北京: 化学工业出版社, 2009.
|
| [9] |
刘俊梅, 王庆, 等. 紫外线和硫酸二乙酯复合诱变选育PHB高产菌株[J]. 微生物学通报, 2016, 43(10): 2242-2248. |
| [10] |
秦海斌. L-谷氨酸产生菌选育、发酵条件研究及其代谢流分析[D].无锡: 江南大学, 2009.
|
| [11] |
程功, 徐建中, 郭燕风, 等. 常压室温等离子体诱变选育L-精氨酸生产菌及发酵条件优化[J]. 微生物学通报, 2016, 43(2): 360-369. |
| [12] |
周扬, 薛正莲, 夏俊, 等. 常压室温等离子体(ARTP)诱变及高通量筛选那西肽高产菌株[J]. 工业微生物, 2015(2): 7-12. DOI:10.3969/j.issn.1001-6678.2015.02.002 |
| [13] |
袁军, 赵犇, 孙梦玉, 等. 常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J]. 生物技术通报, 2015, 31(10): 199-204. |
| [14] |
Henderson JW, Ricker RD, Bidlingmeyer BA, et al. Rapid, accurate, sensitive, and reproducible HPLC analysis of amino acids[S]. Agilent Application Note 5980-1193EN: 1-10, 2006.
|
| [15] |
唐艳, 李晶, 吴涛. L-异亮氨酸高效液相色谱检测方法的研究[J]. 发酵科技通讯, 2017, 46(4): 220-223. |
| [16] |
马雷, 程立坤, 等. 柠檬酸钠对L-异亮氨酸发酵及代谢流量分布的影响[J]. 天津科技大学学报, 2010, 25(3): 14-18. DOI:10.3969/j.issn.1672-6510.2010.03.004 |
| [17] |
Guillouet S, Rodal AA, An GH, et al. Metabolic redirection of carb-on flow toward isoleucine by expressing a catabolic threonine dehy-dratase in a threonine-overproducing Corynebacterium glutamicum[J]. Appl Microbiol Biotechnol, 2001, 57(5-6): 667-673. DOI:10.1007/s00253-001-0829-z |
| [18] |
Sahm H, Eggeling L, Morbach S, et al. Construction of L-isoleucine overproducing strains of Corynebacterium glutamicum[J]. Naturwissenschaften, 1999, 86(1): 33-38. DOI:10.1007/s001140050565 |
| [19] |
Yin LH, Hu XQ, Xu DQ, et al. Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum[J]. Metabolic Engineering, 2012, 14(5): 542. DOI:10.1016/j.ymben.2012.06.002 |
| [20] |
徐庆阳, 孙家凯, 等. 过表达hom基因对谷氨酸棒杆菌发酵L-异亮氨酸的影响[J]. 天津科技大学学报, 2012(5): 1-6. |
| [21] |
程功, 徐建中, 张伟国. L-精氨酸生物合成机制及其代谢工程育种研究进展[J]. 微生物学通报, 2016, 43(6): 1379-1387. |