固定化微生物具有微生物密度高, 反应迅速, 微生物流失少, 产物易分离及反应过程中易控制的特点, 是一种高效低耗, 远转管理容易和具有应用前途的新技术[1]。近年来, 固定化生物在废水领域的应用非常活跃。Chulhwan等[2]利用海藻酸钠包埋固定Funalia trigii细胞, 用于对染料酸性黑52的脱色研究, 实验结果表明, 4%(W/V)的海藻酸钠与8 g菌丝体为最佳固定化条件。在连续5个循环里, 固定化Funalia trigii细胞的脱色率能达到93.8%, 而游离的Funalia trigii细胞的脱色率仅为88%。
目前, 细胞固定化, 通常只能固定一种微生物, 因此在其处理成分复杂的污水体系时效果并不明显, 难以达到净化水质, 去除或降解污水中的悬浮物质的目的。菌丝球因为表面布满网状空隙, 具有多孔的结构特征以及表面积大的特点, 将菌丝球作为一种新型的固定化载体应用于污水处理中有广泛的应用前景[3]。Roble等[4]以曲霉Y3形成的菌丝球固定化反硝化细菌, 并将其用于含氮废水处理, 实验结果表明, 固定后的反硝化细菌在菌丝球上生长良好, 粘附牢固, 而且对硝酸盐的去除率达到83.04%。
本研究从原始森林土壤中分离得到一株霉菌, 编号为L-3。并对该菌株L-3进行了鉴定, 结合形态学特征, rDNA ITS序列分析初步鉴定为Aspergillus fumigatus L-3, 通过构建系统发育树得出亲缘关系。将该菌株制备成固定化混菌菌丝球、菌丝饼、木质素降解酶液和发酵混合液对刚果红染料液进行处理并测定了染料污水的毒性, 旨为后续的染料废水的处理提供参考依据。
1 材料与方法 1.1 材料 1.1.1 菌株菌株L-3来自甘肃兰州兴隆山原始森林土壤, 由实验室保藏。地衣芽孢杆菌由实验室保藏。
1.1.2 培养基PDA培养基:马铃薯200g/L, 葡萄糖20 g/L, 琼脂20 g/L, pH自然, 用蒸馏水定容至1 L; 富集培养基:碱木质素1 g, (NH4)SO42 g, K2HPO41 g, MgSO4 0.2 g, CaCl2 0.1g, FeSO4 0.05 g, MnSO4 0.02 g, KH2PO4 1 g, 蒸馏水1 L; 菌丝球制备培养基(产酶培养基):NH4Cl 2g/L, KH2PO4 2 g/L, MgSO4·7H2O 0.5 g/L, 蔗糖10 g/L, 加蒸馏水配成1 000 mL, pH值自然[5]; 愈创木酚培养基:葡萄糖20 g, 蛋白胨20 g, 琼脂20 g, 愈创木酚0.1 g, 定容至1 L; 刚果红染料废水:100 mg刚果红溶解于1 L的蒸馏水。以上所有培养基均在115℃灭菌20 min。
1.2 方法 1.2.1 菌株的分离、纯化与保存首先将富集培养液过滤后取上清液1 mL以10倍梯度将其稀释成10-1-10-8的稀释液, 然后取10-8稀释液200 μL用灭菌后的涂布棒涂布于愈创木酚平板上, 倒置放于30℃的恒温霉菌培养箱中进行培养, 待愈创木酚平板上菌落周围变色后, 用接种环挑取少量具有变色圈的菌丝在PDA平板上划线分离, 反复5次以上获得单菌落。将获得的单菌落挑取少量菌丝在PDA斜面培养基上划线, 待长出菌落后保存于4℃冰箱。
1.2.2 菌体的形态学观察将获得的真菌单菌落在PDA平板上恒温培养, 待长出菌落后, 挑取少量菌丝于载玻片上, 用0.5%的品红溶液简单染色, 加盖玻片后用光学显微镜进行显微观察。
1.2.3 rDNAITS序列及进化树的构建菌株采用ITS基因序列分析并对降解菌进行序列鉴定。PCR采用的引物[6]为ITS1:5′-TCCG TAGG TGAA CCTG CGG-3′;ITS4:5′-TCCT CCGC TTAT TGAT ATGC-3′。PCR的反应体系为50 μL, 所用程序为94℃预热变性5 min, 94℃变性1 min, 60℃退火1 min, 72℃延伸1 min 15 s, 共进行35次循环, 然后以72℃延伸10 min循环最后一次结束。4℃保存备用。再送至北京华大基因完成测序工作, 将测序结果与GenBank数据库中的基因序列进行BlAST序列比对, 并用MEGA 7.0软件(Neighbor-Joining法)构建系统发育树。菌株形态及生理化特性鉴定参照文献[7]。
1.2.4 混菌菌丝饼、发酵液和粗酶液的制备取霉菌L-3种子液1 mL, 地衣芽孢杆菌种子液3 mL接种于菌丝球制备培养基中, 放置于30℃, 160 r/min的恒温振荡器中培养3 d。收集培养液过滤即可得菌丝球, 用蒸馏水反复洗涤多次, 4℃保存备用。
菌丝饼:将100 mL含有菌丝球的混合液加入砂芯漏斗中, 并连接循环水式真空泵进行减压过滤20 s, 即可得到菌丝饼。将菌丝饼放入水中, 轻轻振荡, 即可恢复成菌丝球。
发酵混合液:既含有菌丝球又含有发酵液的混合液。
粗酶液:将发酵混合液在6 000 r/min离心5 min, 取上清液为粗酶液。漆酶酶活力的测定[8]:向反应体系中加入2 mL乙酸-乙酸钠缓冲溶液(200 mmol/L, pH5)、0.5 mLABTS溶液(0.5 mmol/L)和0.5 mL的粗酶液, 在28℃下反应10 min, 于420 nm测定吸光度的变化值。
1个酶活单位(U)定义为:每min将1 μmolABTS转化为ABTS自由基的需酶量。每个样品平行操作3次, 然后取平均值。
1.2.5 染料处理性能的研究将发酵混合液, 粗酶液分别取10 g放入100 mg/L的刚果红染料废水中, 置于30℃, 160 r/min的摇床培养12 h。将100 mg/L的刚果红染料废水倒入抽滤泵所制成的菌丝饼进行染料废水的吸附与降解, 将以上所有处理后废水取一定量在6 000 r/min, 离心5 min后取上清液在457 nm测定其吸光度值。以刚果红染料液作基准线, 绘制出标准工作曲线。降解率计算公式[9]如下:
R=(p0-pt)/p0×100%
式中P0为反应前染料质量浓度值(mg/L), Pt为脱色时间t后染料质量的浓度值。
1.2.6 毒性实验染料废水的毒性由烟曲霉在PDA平板上的的抑制率来评估, 生物处理染料溶液为实验组, 无染料的蒸馏水为对照组, 来制备PDA平板。PDA平板进行点接种真菌烟曲霉, 倒置平板于30℃培养箱培养4 d, 测定其生长均一的3个菌落直径取平均值。抑制率是以实验组与对照组菌落直径比降低的百分比来衡量。
2 结果 2.1 土壤霉菌的筛选利用愈创木酚平板筛选出10株透明圈比较明显的菌株, 其中透明圈最大的菌株编号为L-3, 其菌落在PDA平板上生长速度快, 2-3 d菌落可达到3-4 cm, 初期菌落呈白色绒毛状, 后期呈烟绿色。进一步在愈创木酚平板上比较其透明圈直径, 在产酶培养基验证其产酶能力, 实验结果如表 1所示。菌株的变色圈直径跟产漆酶的能力是正比的, 其中菌株L-3的变色圈直径最大且产漆酶能力最高。
d菌落直径达3-4 cm, 开始菌落呈白色绒毛样, 培养后期菌落逐渐成为烟绿色(图 1-A)。菌丝无横隔, 不产生菌核, 菌丝直径4-7 μm, 顶囊烧瓶型, 头部直径30-35 μm, 小梗生于顶囊中上部, 单层, 小梗长7-8 μm, 分生孢子近似球形, 大小不均一, 直径3-4 μm, 孢子颜色浅绿色至灰绿色。(图 1-B)

|
| 图 1 霉菌L-3的菌落形态(A)与菌丝结构(B) |
由测序结果可知, 以该菌株的总DNA为模板, 通过PCR获得ITS基因片段, 测序后将数据提交至GenBank数据库进行BlAST比对, 发现该菌株与烟曲霉SCAU062的基因一致性为99%。如图 2所示, 基于ITS基因序列建立的系统发育树也呈现出稳定的亲缘关系。结合该菌株的形态特征, ITS基因序列同源性比对及系统发育树分析, 表明该菌株为曲霉属(Aspergillus)烟曲霉(Aspergillus fumigatus)。将菌株初步鉴定为烟曲霉Aspergillus fumigatusl-3(GenBank登录号为MG183670)。

|
| 图 2 基于ITS的L-3菌株的系统发育树 |
根据标准曲线计算出降解质量浓度并计算降解率, 由图 3可以看出, 混合发酵液对刚果红染料废水的处理中, 在第2小时时降解率仅有25%左右, 随着时间降解率逐渐增大, 在16 h时达到最大为88%, 最后趋于稳定不变。

|
| 图 3 混合发酵液对染料废水的处理结果 |
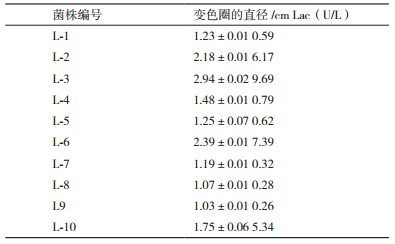
以酶活为9.69 U/L的粗漆酶液处理100 mg/L的刚果红染料废水, 每隔2 h测定其降解率。由图 4可以看出, 在第2小时时粗酶液对刚果红染料废水的降解率为26%左右, 降解率随着时间逐渐增加, 在12 h达到最高为74%, 最后趋于稳定不变。
|
| 图 4 粗漆酶液对染料的处理结果 |
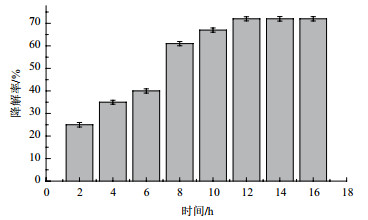
通过减压过滤的方法得到菌丝饼之后, 除去抽滤瓶中的液体, 然后直接将配置好的刚果红溶液倒入砂芯漏斗中, 进行第2次抽滤, 20 s, 随后对抽滤瓶中的脱色液进行吸光度值测定。根据标准曲线计算降解质量浓度得出降解率。由图 5可以看出, 用100 mL(100 mg/L)刚果红染料废水通过菌丝饼的时间仅为20 s, 脱色率就可以高达91%, 其处理染料废水的效果是明显的。其中酸性及中性条件有利于菌丝饼对刚果红染料废水的处理, 碱性条件下对脱色率有抑制作用。
|
| 图 5 菌丝饼对不同pH的染料废水的处理 |
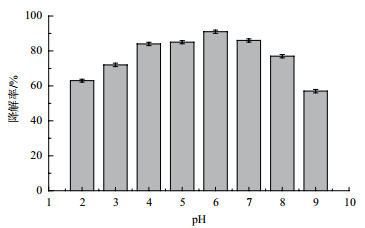
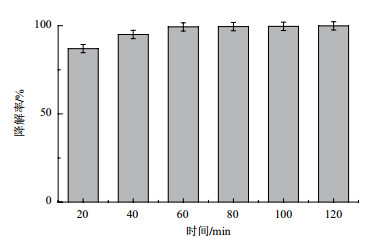
将10 g湿菌丝球放入100 mL刚果红染料废水(100 mg/L)中, 置于30℃, 160 r/min的恒温摇床培养, 每隔20 min取样测定其降解率。由图 6所示, 在20 min时, 菌丝球对刚果红染料废水的处理已经达到87%, 60 min时, 降解率达到99.3%, 120 min为99.9%, 基本达到处理染料污水的标准。
|
| 图 6 菌丝球对染料污水的处理 |
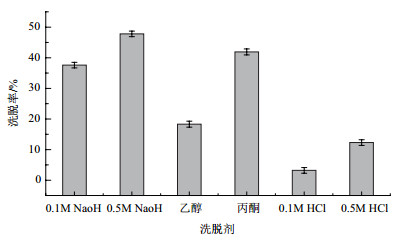
不同洗脱剂对刚果红废水的洗脱效果如图 7所示, 0.1 mol/L NaOH对染料废水的脱色率37.6%, 0.5 mol/L NaOH对染料废水的脱色率47.9%, 说明随着碱浓度的增加对染料洗脱效果更明显。0.1 mol/L HCl对染料废水的处理仅为3.2%, 0.5 mol/L HCl对染料废水的处理为8.3%, 说明烟曲霉菌固定化丝球在酸性溶液中有较好的活性, 所以酸性洗脱剂对染料废水的处理效果并不明显。有机溶剂对刚果红染料废水的处理跟碱性溶液的效果一样, 丙酮对染料废水的处理可以达到41.9%, 乙醇对染料废水的处理仅为18.3%。这是由于碱性溶液跟有机溶剂对细胞壁和细胞膜上的脂溶性结构造成一定程度的破坏, 导致已吸附的染料因为细胞壁结构的破坏而释放。简言之, 5种溶剂对菌丝饼的洗脱率都超过50%, 说明部分染料颗粒已经被菌丝吸附并降解。
|
| 图 7 不同洗脱剂对吸附后菌丝饼的洗脱 |
染料废水的毒性影响水生动植物的生长甚至是灭绝, 所以通过微生物对毒性的抑制来减少对水生动植物的伤害。毒性试验结果表明, 与对照组相比, 菌丝球、菌丝饼、发酵混合液和粗酶液对真菌烟曲霉的去毒率分别是78%、72%、23%和35%。结果表明, 烟曲霉菌丝对选定微生物有一定的去毒性, 尤其是菌丝球对选定微生物的去毒率最高。因为菌丝球在培养过程中有足够的时间进行生物代谢而菌丝饼仅有20 s代谢时间。发酵混合液与粗酶液对选定微生物的去毒性也有一定的作用, 但相对来说较低。
3 讨论利用丝状真菌处理废水是一种低成本, 高效, 绿色的污水处理方法。针对某种特定的污染物, 有些细菌的降解能力比真菌更有效, 并且细菌可以直接固定在真菌菌丝球上形成真菌-细菌混合体系[10]。该体系具备生物降解和生物吸附功能, 如具备苯胺降解能力醋酸不动杆菌JH-9和其他COD高效降解菌固定在黑曲霉Y3菌丝球上即可制备成多功能菌丝球, 可高效去除苯胺[11]。鞘氨醇单胞菌QYY具有良好的偶氮还原性, 而青霉菌QQ则具有染料吸附能力, 因此两者的组合可以起到吸附降解的作用[12]。
而黄孢原毛平革菌可用于多环芳烃的吸附和降解, 在其菌丝球中接入野生土壤微生物, 它对芳烃的去除起到了很明显的作用。因为漆酶可以通过催化共价键(C-C, C-O, C-N)的形成, 使底物分子偶联, 有时还伴随着脱甲基和脱卤素的作用[13-14]。因此, 漆酶对一些有机农药, 食品加工废水, 染料废水也有一定的降解能力。而工业废水体系十分复杂, 靠单一的真菌难以彻底降解污水废物, 不同的真菌对不同的工业废水处理能力不同, 因此可以将几种真菌固定在一起对工业废水进行处理[15]。
如果某种微生物能使愈创木酚的平板产生变色反应, 则这种微生物具有降解木质素的能力。当变色圈在菌丝圈的外圈形成时, 该菌株能够降解木质素, 反之则优先降解纤维素。根据这一结论, 本实验在产生变色反应的平板中挑选变色圈在菌丝圈外圈形成的菌株[16-18]。
本研究中采用可降解刚果红的地衣芽孢杆菌与可吸附染料的烟曲霉形成固定化菌丝球, 采用4种不同的状态对刚果红染料进行处理。混合发酵液对染料废水的处理在16 h降解率达到最高为88%, 粗酶液在12 h达到最高为74%。菌丝饼仅用20 s的时间降解率可达91%, 而菌丝球在1 h降解率高达99%。陆涛等[19]将海洋黑曲霉菌丝球制成菌丝饼对(50 mg/L)的刚果红溶液进行处理, 只需20 s降解率就可达到97.5%。王明霞等[20]研究了淡紫拟青霉菌丝球对刚果红染料的脱色处理, 结果表明菌丝球主要是通过吸附作用去除染料, 吸附过程中染料通过菌丝表面也透过细胞膜进入细胞内。
在染料毒性实验中, 本研究4种不同状态下菌丝对染料都有一定的去毒能力。在早期研究中Apohan等[21]也报道了该真菌的去毒能力。Birhanli和Yesilada等[22]研究了菌丝球在处理纺织染料废水的去毒性, 结果表明菌丝球不但有很高的脱色能力也有很高的去毒能力。
4 结论通过愈创木酚平板筛选出一株具有降解刚果红染料的真菌, 并与地衣芽孢杆菌形成固定化菌丝球对刚果红染料废水进行处理以及染料废水的毒性测定。结果表明, 菌丝球对刚果红染料废水的处理效果最明显, 菌丝饼次之, 但菌丝球所用时间较长。而发酵混合液与粗酶液也有一定的降解能力, 但效果较前者并不显著。毒性结果表明, 固定化菌丝球对刚果红染料废水不但有很高的降解能力也有一定的去毒能力。
| [1] |
Sanchez OJ, Cardona CA. Trends in biotechnological production of fuel ethanol from different feedstock[J]. Bioresource Tecnology, 2008, 99: 5270-5295. DOI:10.1016/j.biortech.2007.11.013 |
| [2] |
Park C, Lee B. Decolorization of acid black 52 by fungal immobilization[J]. Enzyme Microb Technol, 2006, 39: 371-374. DOI:10.1016/j.enzmictec.2005.11.045 |
| [3] |
Binupriya AR, Sathishkumar M, Swaminathan K. Comparative studies on removel of Congo red by native and modified mycelial pellets of Trametes versicolor in various reactor modes[J]. Bioresource Technology, 2008, 99: 1080-1088. DOI:10.1016/j.biortech.2007.02.022 |
| [4] |
Roble N, Ogbonna J, Tanaka H. A novel circulating loop bioreactor with cells immobilized in Loofa sponge for the bioconversation of raw cassava starch to ethanol[J]. Appl Microbiol Biotechnol, 2003, 60: 671-678. DOI:10.1007/s00253-002-1119-0 |
| [5] |
陈慧英.由高产木质纤维素酶的海洋微生物组成的双菌种固定化体系的构建及应用[D].杭州: 浙江大学, 2014.
|
| [6] |
叶光斌, 罗惠波, 杨晓东, 等. 浓香型大曲中黑曲霉的分离鉴定及其安全性初步研究[J]. 酿酒科技, 2013(10): 20-23. |
| [7] |
Jin CX, Yu N. Laccase production optimization by response surface methodology with Aspergillus fumigatus AF1 in unique inexpensive medium and decolorization of different dyes with the crude enzyme or fungal pellets[J]. J Hazard Mater, 2013, 262(1): 512-517. |
| [8] |
宋贤冲, 张照远, 刘媛, 等. 广西南宁纤维板霉变微生物的分离及鉴定[J]. 林业工程学报, 2016, 1(1): 78-82. |
| [9] |
傅恺.真菌漆酶高产菌株的发酵产酶及酶促降解有机染料的动力学研究[D].广州: 华南理工大学, 2013.
|
| [10] |
高敏.生物质载体菌丝球的形成机制及其脱色性能研究[D].哈尔滨: 哈尔滨工业大学, 2006.
|
| [11] |
Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes[J]. Biotechnology Advances, 2004, 22: 189-259. DOI:10.1016/j.biotechadv.2003.09.005 |
| [12] |
Kim YM, Kim JH. Formation and dispersion of mycelial pellets of Streptomyces coelicolor A3(2)[J]. J Microbiol, 2004, 42: 64-67. |
| [13] |
Abadulla E, Tzanov T, Costa S, et al. Decolorization and detoxificat-ion of textile dyes with a laccase from Trametes hirsute[J]. Applied and Environment Microbiology, 2000, 66: 3357-3362. DOI:10.1128/AEM.66.8.3357-3362.2000 |
| [14] |
Duran N, Rosa MA. Application of laccases and tyrosinases immobilized on different supports:a revie[J]. Enzyme Microb Technol, 2002, 31: 907-931. DOI:10.1016/S0141-0229(02)00214-4 |
| [15] |
Torres J, Svistunenko D, Kaelsson B. Fast reduction of a copper center in laccase by nitric oxide and formation of a peroxide intermediate[J]. J Am Chem Soc, 2002, 124: 963-967. DOI:10.1021/ja016107j |
| [16] |
Pozdnyakova NN, Rodakiewicz-Nowak J, Turkovskaya OV. Oxidative degradation of polyaromatic hydrocarbons catalyzed by blue laccase from pleurotus ostreatus D1 in the presence of synthetic meditors[J]. Enzyme Microb Technol, 2006, 39: 1242-1249. DOI:10.1016/j.enzmictec.2006.03.009 |
| [17] |
殷中伟.秸秆纤维素高效降解菌株的筛选及对秸秆降解效果初步研究[D].北京: 中国农业科学院, 2010.
|
| [18] |
Corso CR, Maganha AC. Bioremediation of dyes in textile effluents by Aspergillus oryzae[J]. Microb Ecol, 2009, 57: 384-390. DOI:10.1007/s00248-008-9459-7 |
| [19] |
陆涛.海洋黑曲霉菌丝球的形成机理及其对含染料废水的脱色作用[D].杭州: 浙江大学, 2016.
|
| [20] |
王明霞.海洋微紫青霉菌丝球的制备及其对染料吸附性能的研究[D].杭州: 浙江大学, 2014.
|
| [21] |
Apohen E. Yesilada O.. Role of white rot fungus Funalia trogii in detoxification of texitile dyes[J]. J Basic Microbiol, 2005, 45: 99-105. DOI:10.1002/(ISSN)1521-4028 |
| [22] |
Birhanli E, Yesilada O. Increased production of laccase by pellets of Funalia trogii ATCC 200800 and Trametes vericolor ATCC 200801[J]. Enzyme Microb Technol, 2006, 39: 1286-1293. DOI:10.1016/j.enzmictec.2006.03.015 |