2. 云南师范大学马铃薯科学研究院,昆明 650500
2. Joint Academy of Potato Science, Yunnan Normal University, Kunming 650500
植物泛素-蛋白酶体系统(Ubiquitin-proteasome pathway,UPP)广泛存在于真核细胞中,在植物的生长发育、形态形成及抗逆反应等过程中扮演着重要角色[1-2]。泛素-蛋白酶体系统主要由E1泛素激活酶、E2泛素结合酶、E3泛素蛋白连接酶、蛋白酶体和去泛素化酶组成。通过3种酶先后与靶蛋白结合形成1条多泛素链,将底物蛋白泛素化后,使靶蛋白被26S蛋白酶识别并降解,从而实现对多种代谢过程的调节。其中,E2泛素结合酶是泛素-蛋白酶体系统中的重要组成部分,对蛋白泛素化修饰起关键作用[3]。由致病疫霉菌(Phytophthora infestans(Mont.)de Bary)引起的马铃薯晚疫病严重威胁着全球马铃薯生产安全,严重时导致马铃薯大幅度减产[4]。
Ni等[5]研究发现E3泛素连接酶基因StRFP1受P. infestans、SA、MeJA等诱导表达,在马铃薯抗晚疫病反应中起正向调控作用。稳定超量表达StRFP1增强马铃薯的抗病性,而抑制StRFP1表达促使马铃薯更感病。同样,抑制E3泛素连接酶基因StPUB17表达导致马铃薯抗病性减弱和对盐胁迫更敏感[6]。He等[7]研究证实了马铃薯StPUB17定位于细胞核中,正向调控马铃薯的抗病免疫反应。此外,E3泛素连接酶基因CMPG1也在调控植物免疫方面同样发挥重要作用。CMPG1的沉默大大减弱了抗病基因Cf-9、Cf-4、Pto及P. infestans病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)基因INF1等介导抗病信号传导[8]。另外,E3泛素连接酶基因也可以作为负调控因子参与植物抗病信号传导。如E3泛素连接酶基因POB1负调控植物基础免疫和细胞死亡反应。沉默POB1能够抑制P. infestans的扩展,增强植物对晚疫病的抗性;而瞬时超量表达POB1则促进P. infestans的侵染,且能够抑制Cf4/Avr4介导的细胞死亡[9]。以上研究表明,E3泛素连接酶对植物抗病免疫系统起着重要作用。
有关E2泛素结合酶在植物抗病免疫反应中功能的报道则很少,且相关研究多集中在E2泛素结合酶基因受病原菌诱导表达方面,缺少实质的基因功能研究。如Li等[10]利用cDNA-AFLP法在马铃薯中筛选出一个EST序列受β-氨基丁酸(β-aminobutyric acid,BABA)诱导表达,经与NCBI数据库比对发现该EST对应基因为泛素结合酶基因E2-17(GenBank:XM_015307154.1,StUBC17)。刘炎霖等[11]从水茄(Solanum torvum)中克隆得到一个756 bp的泛素结合酶基因(StUBCc),RT-PCR表明StUBCc受黄萎病菌诱导表达。刘鑫等[12]通过生物信息学、RNA-seq和qRT-PCR的方法,分析了水稻泛素结合酶基因家族的特征及其表达模式,发现有超过50%水稻泛素结合酶基因受稻瘟病菌诱导表达。
为了研究E2泛素结合酶是否对马铃薯抗病反应发挥作用,本研究在BABA诱导基础上,从马铃薯栽培种“合作88”(“C88”)中克隆得到E2泛素结合酶基因StUBC17的全长序列并对其进行生物信息学分析。利用病毒诱导的基因沉默技术(Virus-induced gene silencing,VIGS)在本氏烟(Nicotiana benthamiana)上构建了NbUBC(StUBC17同源基因)基因沉默植株,并对其进行晚疫病抗性鉴定。此外,利用农杆菌介导基因瞬时表达技术,在NbUBC沉默植株上共表达马铃薯抗病基因和相应无毒基因及晚疫病菌PAMP基因INF1,为深入研究StUBC17调控马铃薯抗病性的作用机理奠定基础。
1 材料与方法 1.1 材料马铃薯栽培种“合作88”(“C88”)为云南师范大学马铃薯科学研究院保存。“C88”无菌试管苗在含有4%蔗糖的MS培养基中繁殖,待试管苗生长30 d时将其移栽于温室塑料钵(20 cm×20 cm)中生长,浇水、施肥等按日常管理。将生长两个月健康无机械损伤的叶片用于P. infestans接种。
本氏烟为云南师范大学马铃薯科学研究院保存,种植于恒温生长室内。幼苗移栽后于22℃ 16 h光照/8 h黑暗条件下生长28-35 d,然后进行VIGS沉默和农杆菌注射瞬时共表达试验。
P. infestans生理小种88069(1.3.4.7)和HB09-14-2(1.2.3.4.5.6.7. 9.10.11)由华中农业大学马铃薯实验室馈赠。合作88对P. infestans生理小种88069表现抗病过敏反应,对生理小种HB09-14-2表现感病。菌株繁殖和保存采用黑麦培养基[13]。
1.2 方法 1.2.1 DNA和RNA的提取采用植物基因组DNA提取试剂盒(货号DP305,天根天根生化科技有限公司)提取接种P. infestans后的烟草叶片的DNA,具体步骤见试剂盒说明书。采用Trizol-RNA提取试剂盒(货号DP432,天根天根生化科技有限公司)提取马铃薯叶片总RNA,具体步骤见说明书。提取的RNA于-70℃保存备用。
1.2.2 StUBC17的克隆及序列分析将前人公布的差异表达片段TDF8-11-2(GenBank:EL732271)序列在NCBI网站和茄科基因组数据库(http://solanaceae.plantbiology.msu.edu/index.shtml)上进行BlAST比对,发现TDF8-11-2与马铃薯泛素结合酶E2-17基因(StUBC17)序列相似率高达87%。初步判断该序列表达标签对应基因为StUBC17。根据StUBC17全长序列设计引物(表 1),以“C88”的cDNA为模板,采用Pfu高保真PCR聚合酶(货号:P501,南京诺唯赞生物科技有限公司)进行PCR扩增。扩增产物经1.2%琼脂糖凝胶电泳检测,回收,并与pEASY-T1克隆载体(货号:CT101,北京全式金生物技术有限公司)连接,测序。
采用在线软件HMMER分析蛋白结构域,用Protparam分析蛋白等电点和分子量,用DANMAN软件对StUBC17和其他同源蛋白的氨基酸序列进行比对。
1.2.3 StUBC17在P. infestans诱导下的表达分析马铃薯C88试管苗继代培养1个月后移栽至温室,待其生长50 d左右用于P. infestans生理小种(88069和HB09-14-2)接种。提取经P. infestans处理和无菌水处理(对照)4个不同时间点(0、24、36和72 h)的叶片的总RNA并反转录合成cDNA。每个处理时间点取2片叶片,3次生物学重复。以cDNA为模板,StEF1(GenBank:AB061263)为内参基因,qRT-PCR分析StUBC17受P. infestans诱导表达特性。相关引物见表 1,反应体系参照KAPA SYBR®快速定量PCR试剂盒(货号:KK4601,Kappa Bioscience AS)说明:2×qRT-PCR mix 5 μL、H2O 2.4 μL、左右引物(10 μmol/L)各0.2 μL、50×Rox 0.2 μL和模板2 μL。于ABI StepOnePlus实时荧光定量PCR系统上进行反应,反应程序:95℃ 3 min;95℃ 10 s,58℃ 30 s,40个循环。采用2-ΔΔCt法计算基因相对表达量。
1.2.4 VIGS载体构建及基因沉默效率分析用于构建VIGS体系的pTRV2(GenBank:AF406991.1)、含烟草脆裂病毒RNA1片段的pTRV1(GenBank:AF406990.1)及携带八氢番茄红素脱氢酶基因(phytoenedesaturae,PDS)的病毒载体由华中农业大学马铃薯实验室惠赠。将StUBC17序列经BlAST比对获得本氏烟中的同源基因NbUBC(GenBank:KR296788.1),再以NbUBC序列设计VIGS载体引物(表 1)。
采用LA酶(货号:RR02MA,宝日医生物技术有限公司)从本氏烟cDNA中PCR扩增NbUBC的3'端片段,用EcoRⅠ和BamHⅠ限制性内切酶酶切扩增片段和TRV2载体,回收后分别连接、转化大肠杆菌DH5α。得到的转化子用TRV载体通用引物(表 1)进行PCR检测,筛选成功插入目的片段的阳性克隆并测序。利用电转化法将测序正确的质粒转化到农杆菌GV3101菌株中。阴性对照为重组载体携带外源GFP片段,即TRV-GFP;阳性对照为重组载体携带的PDS片段,即TRV-PDS。
选取3-4叶龄的本氏烟,阴性对照(TRV-GFP)、阳性对照(TRV-PDS)和目标基因(TRV-NbUBC)沉默植株各4株,待阳性对照(TRV-PDS)植株新长出的叶片出现漂白现象时(约25 d),取对照植株(TRV-GFP)和沉默植株(TRV-NbUBC)顶叶以下第3-第4片叶片,3次生物学重复。分别提取叶片总RNA进行qRT-PCR检测,以NbEF1(GenBank:AY206004)为内参基因。用Excel软件对NbUBC表达量进行t检验(两尾检验),分析差异显著性(**P < 0.01)。
1.2.5 农杆菌介导的基因瞬时表达分析采用Wang等[14]方法,将含有马铃薯抗病基因(R3a、R3b和Rx)、无毒基因(AVR3a、AVR3b和CP)及INF1的农杆菌在LB平板培养基上活化,28℃培养2 d。挑取单克隆接入1 mL LB液体培养基(含50 µg/L Kan和25 µg/L Rif),28℃,200 r/min,培养过夜。取500 µL菌液加入5 mL含相应抗生素YEB培养液中,另加0.5 µL的200 µmol/L乙酰丁香酮(Acetosyringone,AS),28℃,200 r/min,培养过夜。4 000 r/min离心10 min,收集农杆菌沉淀,并加入MMA buffer(10 µmol/L MES,10 µmol/L MgCl2和200 µmol/L AS,pH 5.6),调整农杆菌悬浮液的OD600值约为0.4。
将含马铃薯抗病基因-无毒基因组合(R3a+AVR3a、R3b+AVR3b和Rx+CP)及INF1的农杆菌悬液分别注射3株对照植株(TRV-GFP)和3株基因沉默植株(TRV-NbUBC)顶叶以下第3至第5片叶片,每株注射3片叶片,3次生物学重复。GFP为阴性对照,5 d后观察HR反应。含马铃薯抗病基因-无毒基因组合(R3a+AVR3a、R3b+AVR3b和Rx+CP)及晚疫病菌PAMP基因INF1的质粒由华中农业大学马铃薯实验室馈赠。
1.2.6 晚疫病菌接种、病斑面积及菌丝生物量统计参照Vleeshouwers等[13]方法对马铃薯C88和本氏烟进行离体叶片接种。将P. infestans的孢子囊浓度调至约5×104个/mL,4℃下放置2-3 h后用于接种。每片叶片主脉两侧各接种10 µL孢子悬浮液,塑料薄膜密封接种盘,相对湿度95%,温度20℃。
每次接种本氏烟,阴性对照(TRV-GFP)和沉默植株(TRV-NbUBC)各4株,每株分别取顶叶以下第3、第4片叶片用于P. infestans接种,3次生物学重复。接种5 d后,用游标卡尺测量病斑的长和宽,病斑面积= 1/4×π×长×宽。用Microsoft Excel软件对病斑面积进行t检验(两尾检验),分析差异显著性(**P < 0.01)。
参照llorente等[15]方法对P. infestans生物量进行统计。提取P. infestans(88069)接种阴性对照(TRV-GFP)和沉默植株(TRV-NbUBC)2个不同时间点(0和120 h)的叶片总DNA,每个时间点混合取样(4片叶片),3次生物学重复。以接种后0和120 h的叶片DNA为模板,P. infestans特异基因PiO8和本氏烟内参基因NbEF-1a用于qRT-PCR检测,引物见表 1。用Microsoft Excel软件对P. infestans生物量进行t检验(两尾检验),分析差异显著性(**P < 0.01)。
1.2.7 台盼蓝染色为了更清晰观察接种P. infestans叶片的发病表型,用台盼蓝对发病细胞进行染色。参照Wang等[14]的方法,将接种6 d后的本氏烟叶片浸泡在台盼蓝染液(以100 mL为例:25 mL水饱和酚、25 mL甘油、25 mL乳酸、25 mL水和25 mg台盼蓝)中,浸泡36 h后,用95%乙醇煮沸2 min进行脱色,然后放在50%甘油中保存,自然光照下拍照。
2 结果 2.1 StUBC17的克隆和序列分析基因序列分析表明,克隆得到的StUBC17与NCBI数据库公布的E2-17泛素结合酶(GenBank:XM_015307154.1)基因的序列完全相同。StUBC17编码序列全长为447 bp,编码多肽含有148个氨基酸。StUBC17蛋白预测分子量为16.52 kD,理论等电点为7.72。蛋白功能域分析表明,第5-142位氨基酸区间为泛素结合功能域(图 1-A)。
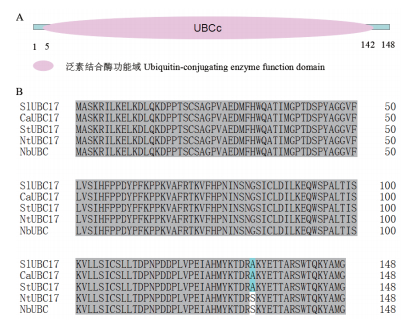
|
| 图 1 马铃薯StUBC17蛋白结构域(A)及与其同源蛋白氨基酸序列比对(B)分析 |
将StUBC17蛋白序列在NCBI数据库中进行BlAST比对(图 1-B),发现StUBC17在番茄(SLUBC17,XM_019214130.2)、辣椒(CaUBC17,XM_016720-450.1)、烟草(NtUBC17,XM_016606733.1)和本氏烟(NbUBC,KR296788.1)中均有同源蛋白,相似性分别为100%、100%、99.32%和99.32%。通过DNAMAN软件对StUBC17及其同源蛋白进行氨基酸序列比对,结果表明,不同泛素结合酶间的泛素结合功能域高度保守。
2.2 StUBC17的表达特性分析对不同接种时间点StUBC17的qRT-PCR分析结果(图 2)表明,在88069和HB09-14-2接种24 h时,StUBC17均上调表达。而在接种后48和72 h,与对照相比,接种88069的C88叶片中StUBC17表达水平无显著变化;接种HB09-14-2的“C88”叶片中StUBC17表达水平虽有所下调,但仍高于对照。

|
| 图 2 荧光定量PCR分析马铃薯StUBC17的表达模式 |
检测对照和基因沉默植株中NbUBC的表达量,结果(图 3-A)显示,该基因的mRNA水平均出现不同程度的下降。
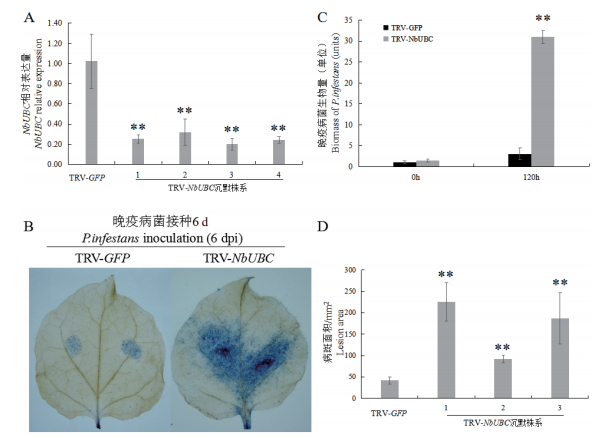
|
| 图 3 沉默植株的NbUBC的相对表达量及抗性鉴定 **:表示差异达到极显著水平 |
接种P. infestans(88069)5 d后,发现对照植株叶片发病较轻且叶片病斑面积明显较NbUBC沉默植株小(图 3-B,D)。另外,通过qRT-PCR检测发现,NbUBC沉默植株上的P. infestans生物量明显高于对照植株(图 3-C)。结果表明,沉默NbUBC降低了本氏烟对P. infestans的抵抗能力。
2.5 沉默NbUBC不影响R3a-AVR3a、R3b-AVR3b、Rx-CP及INF1介导的HR反应基因沉默25 d后,分别在对照植株(TRV-GFP)和基因沉默植株(TRV-NbUBC)顶叶以下第3至第5片叶片中瞬时表达R3a-AVR3a、R3b-AVR3b、Rx-CP及INF1。表达5 d后,除阴性对照(瞬时表达GFP)外,叶片注射点均呈现HR反应(图 4)。说明沉默NbUBC没有影响R3a-AVR3a、R3b-AVR3b、Rx-CP及INF1诱发的HR反应。
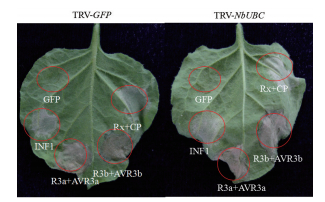
|
| 图 4 沉默NbUBC不影响基因对基因的识别 |
BABA能够在马铃薯上诱导产生抗病性[16],表明BABA具有在植物诱导抗病方面具有重要利用价值。在前人研究的基础上,本研究克隆了一个BABA早期诱导表达E2泛素连接酶基因StUBC17,并对其受P. infestans诱导表达特性和对晚疫病抗性反应中的功能进行了初探。
绝大多数植物防御反应都涉及到泛素-蛋白酶体系统[17]。E2泛素结合酶是泛素-蛋白酶体系统中的重要组成部分,对泛素化修饰的特异性和精确时空性起关键作用[3]。研究表明,E2泛素结合酶广泛参与植物对逆境胁迫的响应途径。如水稻48个E2泛素结合酶基因中,3个基因受干旱和盐胁迫诱导上调表达,7个基因受干旱和盐胁迫诱导下调表达,12个基因受植物激素6-BA和ABA诱导表达[18]。玉米75个E2泛素结合酶基因中,35个基因受盐胁迫诱导表达,22个基因受PEG600诱导表达[19]。在拟南芥中超量表达大豆泛素结合酶GmUBC2基因,可以增强拟南芥耐寒和耐盐性[20]。决登伟等[21]发现玉米泛素结合酶基因ZmUBC-76在盐胁迫和干旱胁迫处理下,表达量下调。与这些报道类似,本研究证明马铃薯泛素结合酶StUBC17可以被生物胁迫因子P. infestans诱导表达。
由于VIGS技术[22]在马铃薯上尚不成熟,而马铃薯和本氏烟同为茄科作物,基因组高度保守,且VIGS技术在本氏烟中较成熟。为了快速、高通量鉴定目标基因对马铃薯抗晚疫病是否有贡献,研究者大多先在本氏烟上利用VIGS技术对目标基因进行功能分析[23-24]。本研究利用VIGS技术初步鉴定NbUBC(StUBC17同源基因)对植物防御P. infestans有一定作用。沉默NbUBC后,沉默植株的抗病性明显减弱。另外,在NbUBC沉默植株上瞬时表达马铃薯抗病基因-无毒基因组合(R3a+AVR3a、R3b+AVR3b和Rx+CP)及晚疫病菌PAMP基因INF1,结果发现抗病基因-无毒基因组合及INF1激发的HR反应并没有被干扰。说明E2泛素结合酶基因NbUBC并不影响R3a、R3b、Rx及INF1介导的HR反应。至于NbUBC是否影响其他抗病基因介导的HR反应有待进一步研究。
4 结论从马铃薯中克隆获得泛素结合酶基因StUBC17,其受P. infestans诱导表达。该基因编码蛋白及其同源蛋白间的泛素结合酶功能域高度保守。在本氏烟上沉默StUBC17同源基因导致植株抗病性下降,且沉默该基因并不影响马铃薯抗病蛋白-无毒蛋白(R3a+AVR3a、R3b+AVR3b和Rx+CP)及晚疫病菌INF1介导的HR反应。
| [1] |
Hershko A. The ubiquitin system for protein degradation and some of its roles in the control of the cell division cycle[J]. Cell Death and Differentiation, 2005, 12(9): 1191-1197. DOI:10.1038/sj.cdd.4401702 |
| [2] |
王金利, 史胜青, 贾利强, 等. 植物泛素结合酶E2功能研究进展[J]. 生物技术通报, 2010(4): 7-10. |
| [3] |
Mukhopadhyay D, Riezman H. Proteasome-independent functions of ubiquitin in endocytosis and signaling[J]. Science, 2007, 135: 201-205. |
| [4] |
谢从华. 马铃薯产业的现状与发展[J]. 华中农业大学学报:社会科学版, 2012(1): 1-4. |
| [5] |
Ni X, Tian Z, Liu J, et al. Cloning and molecular characterization of the potato RING finger protein gene StRFP1 and its function in potato broad-spectrum resistance against Phytophthora infestans[J]. J Plant Physiol, 2010, 167(6): 488-496. DOI:10.1016/j.jplph.2009.10.019 |
| [6] |
Ni X, Tian Z, Liu J, et al. StPUB17, a novel potato UND/PUB/ARM repeat type gene, is associated with late blight resistance and NaCl stress[J]. Plant Science, 2010, 178(2): 158-169. DOI:10.1016/j.plantsci.2009.12.002 |
| [7] |
He Q, Mclellan H, et al. U-box E3 ubiquitin ligase PUB17 acts in the nucleus to promote specific immune pathways triggered by Phytophthora infestans[J]. J Exp Bot, 2015, 66(11): 3189-3199. DOI:10.1093/jxb/erv128 |
| [8] |
Gilroy EM, Taylor RM, Hein I, et al. CMPG1-dependent cell death follows perception of diverse pathogen elicitors at the host plasma membrane and is suppressed by Phytophthora infestans RXLR effector AVR3a[J]. New Phytologist, 2011, 190(3): 653-666. DOI:10.1111/nph.2011.190.issue-3 |
| [9] |
Orosa B, He Q, et al. BTB-BACK domain protein POB1 suppresses immune cell death by targeting ubiquitin E3 ligase PUB17 for degradation[J]. PLoS Genet, 2017, 13(1): e1006540. DOI:10.1371/journal.pgen.1006540 |
| [10] |
Li Y, Tian Z, Liu J, et al. Comparative cDNA-AFLP analysis reveals that Dl-beta-amino-butyric acid induces resistance through early activation of the host-defense genes in potato[J]. Physiologia Plantarum, 2009, 136(1): 19-29. |
| [11] |
刘炎霖, 陈钰辉, 刘富中, 等. 水茄泛素结合酶E2基因StUBCc的克隆及黄萎病菌诱导表达分析[J]. 园艺学报, 2015, 42(6): 1185-1194. |
| [12] |
刘鑫, 张恒, 等. 水稻泛素结合酶基因家族的生物信息学与表达分析[J]. 中国水稻科学, 2016, 30(3): 223-231. |
| [13] |
Vleeshouwers VGAA, Dooijeweert WV, Keizer LCP, et al. A Laboratory assay for Phytophthora infestansresistance[J]. European Journal of Plant Pathology, 1999, 105: 241-250. DOI:10.1023/A:1008710700363 |
| [14] |
Wang H, Sun C, Jiang R, et al. The dihydrolipoyl acyltransferase gene BCE2 participates in basal resistance against Phytophthora infestans in potato and Nicotiana benthamiana[J]. J Plant Physiol, 2014, 171(11): 907-914. DOI:10.1016/j.jplph.2014.02.011 |
| [15] |
llorente B, Bravo-Almonacid F, et al. A quantitative real-time PCR method for in planta monitoring of Phytophthora infestans growth[J]. Lett Appl Microbiol, 2010, 51(6): 603-610. DOI:10.1111/lam.2010.51.issue-6 |
| [16] |
Liljeroth E, Bengtsson T, Wiik L, et al. Induced resistance in potato to Phytphthora infestans-effects of BABA in greenhouse and field tests with different potato varieties[J]. European Journal of Plant Pathology, 2010, 127(2): 171-183. DOI:10.1007/s10658-010-9582-4 |
| [17] |
Dielen AS, Badaoui S, et al. The ubiquitin/26S proteasome system in plant-pathogen interactions: A never-ending hide-and-seek game[J]. Mol Plant Pathol, 2010, 11(2): 293-308. DOI:10.1111/mpp.2010.11.issue-2 |
| [18] |
E Z, Zhang Y, Li T, et al. Characterization of the ubiquitin-conjugating enzyme gene family in rice and evaluation of expression profiles under abiotic stresses and hormone treatments[J]. PLoS One, 2015, 10(4): e0122621. DOI:10.1371/journal.pone.0122621 |
| [19] |
Jue D, Sang X, et al. Genome-wide ddentification, phylogenetic and expression analyses of the ubiquitin-conjugating enzyme gene family in maize[J]. PLoS One, 2015, 10(11): e0143488. DOI:10.1371/journal.pone.0143488 |
| [20] |
Zhou GA, Chang RZ, Qiu LJ. Overexpression of soybean ubiquitin-conjugating enzyme gene GmUBC2 confers enhanced drought and salt tolerance through modulating abiotic stress-responsive gene expression in Arabidopsis[J]. Plant Mol Biol, 2010, 72(4-5): 357-367. DOI:10.1007/s11103-009-9575-x |
| [21] |
决登伟, 桑雪莲, 舒波, 等. 玉米泛素结合酶基因ZmUBC_76的功能分析[J]. 热带作物学报, 2017, 38(8): 1507-1511. DOI:10.3969/j.issn.1000-2561.2017.08.021 |
| [22] |
崔艳红, 贾芝琪, 等. 利用VIGS技术研究马铃薯抗晚疫病基因R3a和RB的信号传导[J]. 园艺学报, 2009, 36(7): 997-1004. DOI:10.3321/j.issn:0513-353X.2009.07.009 |
| [23] |
李亚军, 等. 利用病毒诱导的基因沉默(VIGS)技术快速鉴定两个马铃薯晚疫病抗性相关EST片段EL732276和EL732318的功能[J]. 农业生物技术学报, 2012, 20(1): 16-22. DOI:10.3969/j.issn.1674-7968.2012.01.003 |
| [24] |
He Q, Naqvi S, Mclellan H, et al. Plant pathogen effector utilizes host susceptibility factor NRL1 to degrade the immune regulator SWAP70[J]. Proc Natl Acad Sci USA, 2018, 115(33): E7834-E7843. DOI:10.1073/pnas.1808585115 |





