2. 中国林业科学研究院天津林业科学研究所,天津 300457
2. Tianjin Institute of Forestry Science, Chinese Academy of Forestry, Tianjin 300457
目前,除了南极洲等极少数地区待查外,全世界大部分地区都有各种类型的盐渍土分布,据不完全统计,全世界盐渍土面积为9.543 8×108 hm2,并呈现出逐年递增的趋势,全世界每年约有1.0×106-1.5×106 hm2的土地成为盐渍土,盐渍土已成为限制农林业发展的主要因素之一[1-2]。盐胁迫对植株的影响体现在植物生长发育的各个阶段,在盐胁迫条件下,植物种子细胞内水势降低,造成种子生理性吸水困难。同时,类囊体膜结构发生变化,碳同化减少,影响光合作用[3-4]。此外,盐胁迫下,活性氧代谢紊乱,影响蛋白质合成。与此同时,植物为了抵御盐胁迫会合成各类有机物质造成耗能增加,最终导致植物生长缓慢[5]。我国盐渍土约为9 913×104 hm2,分布范围广、盐分类型多样、生态修复极为困难,且近半个世纪以来,由于不合理的灌溉而引起的次生盐渍化问题已经成为我国农业发展的重要阻碍因子,如内蒙古河套灌区、宁夏银川灌区等均有灌溉不当而引起次生盐碱化发生[6]。
如何开发利用盐碱土,破解盐碱地区植被更新困难及农作物减产等难题,已迫在眉睫。科技人员研究发现,在盐碱地区长期的植物演化过程中,演化出一种特殊的植物类型——盐生植物,它能够在离子浓度为200 mmol/L以上的生境中完成其生活史[6]。盐碱地区生态修复的第一步就是如何使植物完成其生活史,而生活史的起始阶段就是种子萌发期,它直接影响着后期的成活率、结实率以及物种的分布和丰度。萌发率的降低是非盐生植物在盐碱地实现种群延续的主要限制因素,故盐碱地上的非盐生植物多以人工移植为主、且类型单一,但是盐生植物却可以在盐碱地上顺利度过种子萌发、完成自然更新和种群延续[7-8]。因此,以盐生植物为材料,解析盐生树种种子萌发期对于盐胁迫的生理生化响应特征,阐释耐盐机理、确定耐盐阈值对于理解植物种子萌发过程中的耐盐机制、筛选种子萌发阶段的耐盐基因、提高植物种子萌发期耐盐性,攻克盐碱地植物天然更新障碍具有重要理论意义和现实价值。
红砂(Reaumuria soongorica)是柽柳科盐生植物(泌盐植物),高15-25 cm,主要分布在我国西北部、内蒙古及东北西部盐土荒漠、半荒漠沙地等具有不同程度的盐渍化土壤中,红砂一般可通过盐腺将盐分排出体外,以减少盐分危害。
目前,国内外关于红砂的研究主要集中在种子萌发的影响因素、外界因素对红砂生长、分布的影响等方面[9-14]。朱恭等[15]发现,种子萌发的最低渗透阈值为-1.8 Mpa,土壤含水量在3%以上,黑暗条件下有利于红砂种子的萌发,种子萌发的适宜温度一般为15-25℃。牛宋芳等[16]发现经赤霉素处理的红砂种子萌发率可高达78%。在有关盐碱逆境条件下红砂种子萌发研究方面,陈金元等[17]认为,混合盐碱胁迫对于红砂种子的萌发及萌发后幼苗生长均有抑制作用。高茜等[18]研究了2种不同盐对红砂种子吸胀过程中生理特性的影响及对种子的伤害程度发现,CaCl2的伤害大于NaCl。周航宇等[19]发现在高盐条件下,红砂能够吸收大量Na+并将其绝大部分通过盐腺排出体外或积累在地上部中,从而减轻Na+毒害。而在红砂分子研究层面,Du等[20]研究发现,从长叶红砂中克隆出的转录因子RtWRKY1可在拟南芥中进行转化,且过表达植株中RtWRKY1主要通过调控抗氧化系统、离子转运系统等提高拟南芥的耐盐性。刘丹等[21]发现在干旱和UV-B双重胁迫下,红砂中产生了356个上调和248个下调的差异表达基因,且这些基因多在固碳作用等生物过程中显著富集。
当前,关于盐碱胁迫下红砂的研究多集中在萌发后生长阶段,聚焦萌发期的研究多停留在生长形态水平,而关于萌发期生理生化指标的研究及萌发期耐盐阈值和萌发后生长阈值的计算等鲜有报道。本研究以泌盐植物红砂为材料,探究盐胁迫对红砂种子萌发及萌发后生长和生理生化指标的影响,确定红砂萌发耐盐阈值及最适盐浓度、萌发后生长耐盐阈值及最适盐浓度,旨为解析红砂萌发期耐盐机制及后续研究提供数据支撑。
1 材料与方法 1.1 材料供试红砂种子于2017年9月收集于内蒙古巴彦淖尔市乌拉特中旗甘其毛都镇S212省道南侧(N:42°09'56.69″,E:107°43'21.95″),种子采集完成后,去杂、晾晒、置于室温下干燥保存,红砂种子千粒重为(1.137±0.121)g。
1.2 方法 1.2.1 实验设计红砂种子萌发实验于培养箱中进行。实验采取NaCl胁迫处理,共设置7个浓度梯度(CK、50、100、150、200、300和400 mmol/L),每个处理3次重复。随机选取颗粒饱满、大小均匀、无破损的红砂种子,经75%酒精消毒1 min后,用蒸馏水冲洗3-5次,吸水纸吸干水分备用,加入7 mL处理液置于垫有两层滤纸的培养皿上,每皿放20粒种子,随后,将添加处理液的培养皿置于培养箱中,在黑暗条件下设置温度为25℃,相对湿度为55%进行培养。每天定时称重补水以维持盐溶液浓度的相对稳定,并以胚根明显突破种皮1 mm左右为发芽标准,每天统计发芽数,试验持续14 d。
1.2.2 生长指标的测定萌发率:正常发芽的种子数/供试种子总数×100%;相对萌发率:(处理种子发芽率/对照种子发芽率)×100%;萌发势:发芽种子数达到高峰时正常发芽种子总数与供试种子总数的百分比;相对萌发势:(处理种子发芽势/对照种子发芽势)×100%;相对盐害率:(对照发芽率-盐处理发芽率)/对照发芽率×100%;发芽指数=∑Gt/Dt,[Gt为不同时间(d)的发芽量,Dt为相应的发芽试验天数];活力指数(VI)=S×GI[S:平均根长(mm),GI:萌发势];株高和根长:在胁迫14 d后,每个重复取3棵测株高与根长,以3个重复的平均值作为株高和根长;地上鲜重:胁迫14 d后,每个重复随机选取5株植株,除去根部、称重记录;地下鲜重:胁迫14 d后,每个重复随机选取5株植株,保留根部、称重记录。
1.2.3 生理生化指标的测定分别采用硫代巴比妥酸法、茚三酮染色法、创木酚染色法和氮蓝四唑光还原法测定丙二醛含量(Malondialdehyde,MDA)、脯氨酸含量(Proline,Pro)、过氧化物酶含量(Peroxidase,POD)和超氧化物歧化酶含量(Supero-xide dismutase,SOD)[22],每个处理测5次,取均值。
1.2.4 数据处理采用Excel 2007进行数据整理、作图,用SPSS17.0中的One-way ANOVA进行不同盐浓度下待测指标间的差异性检验,LSD多重比较。耐盐阈值的确定以NaCl浓度为自变量,相对萌发率、植株全长为因变量,以相对萌发率及植株全长下降到对照的50%为标准,拟合回归方程,分别确定萌发耐盐阈值及萌发后生长耐盐阈值(所有数据的处理均做标准误差分析)。
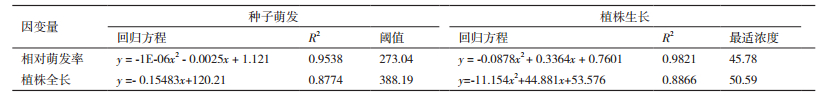
2 结果 2.1 NaCl胁迫对红砂种子萌发的影响运用不同浓度的NaCl对红砂种子进行萌发实验(图 1和表 1),与对照相比,适当低浓度(50 mmol/L)NaCl处理后,红砂种子的萌发数增加,相对萌发率升高且大于100%(P > 0.05),相对盐害率下降为负,萌发势、相对萌发势、萌发指数和活力指数增加。但是,随着盐浓度的升高,红砂种子的萌发时间相比CK滞后2-7 d,且萌发率、发芽指数、活力指数显著降低(P < 0.05),相对盐害率显著增加,萌发势下降。当NaCl浓度达到400 mmol/L的时候,红砂种子在处理时间内已经不能萌发,相对盐害率达到了100%。
|
| 图 1 不同浓度NaCl处理下红砂种子萌发率 |
为了探究胁迫下不能萌发的种子是否具有活力,分别将400 mmol/L NaCl处理15、25和35 d的种子进行复萌处理,处理时间仍为14 d,以复萌处理的第1天开始记录。结果发现,复萌处理后,红砂种子快速萌发,且萌发集中。复萌第1天的相对萌发率达105%,胁迫处理15、25和35 d的种子复萌情况相当,差异性不大,这符合自然条件下,红砂种子在雨后快速、集中萌发的特征。
整体来看,红砂种子的萌发具有以下特点:(1)条件适宜时,快速集中萌发,萌发速率先升高后降低;适当低浓度盐促进萌发,高浓度盐抑制萌发;(2)红砂种子处理12 d左右,红砂萌发达到稳定,此时间点可作为验证红砂种子是否能够萌发的相对时间点;(3)胁迫条件下不能萌发的种子仍保持活性,可在条件适宜时快速集中萌发,以维持物种延续。
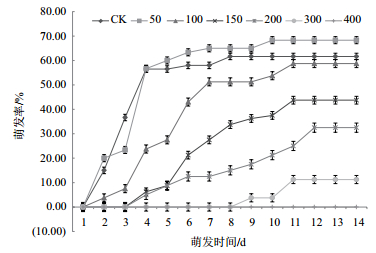
2.2 NaCl胁迫对红砂生长的影响为探究盐胁迫对红砂萌发及后期幼苗生长的影响,以萌发后期红砂幼苗的根长和苗高作为指标(图 2-图 4),当盐浓度为50 mmol/L时,根长增加13.55%;当NaCl浓度大于50 mmol/L时,其长度相比CK显著降低(P < 0.05);当NaCl浓度为300 mmol/L时,根长降低69.77%;当NaCl浓度为50 mmol/L时,株高增加36.37%;当NaCl浓度增加时,株高相比CK降低;当盐浓度为300 mmol/L时,株高相比对照降低51.05%,差异性显著(P < 0.05)。当盐浓度为50 mmol/L时,地上鲜重和地下鲜重相比CK分别3.54%和4.31%,但增加不显著(P > 0.05),随着浓度增加,地上和地下鲜重较CK显著下降。

|
| 图 2 不同浓度NaCl处理下红砂根长株高变化情况 不同字母表示同一指标在不同浓度NaCl的处理下,在0.05水平差异显著。下同 |
|
| 图 3 不同浓度NaCl处理下红砂地上和地下鲜重 |
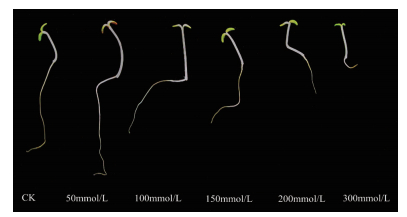
|
| 图 4 红砂经400 mmol/L NaCl处理14 d后的生长表型图 因400 mmol/L NaCl处理的红砂试验期内尚未萌发,故无法获得生长表型图 |
整体来看,盐浓度为50 mmol/L时,根长、株高相比CK显著增加,但地上和地下鲜重增加不明显;随着盐浓度的增加,根长、株高和鲜重下降显著,但根长变化更为明显,下降幅度更大。
2.3 NaCl胁迫对红砂萌发期生理生化指标的影响 2.3.1 NaCl胁迫对红砂中MDA、Pro含量的影响由图 5可知,随着NaCl浓度增加,红砂植株内的MDA含量较对照分别增加31.05%、164.03%、244.09%、282.12%和389.21%(P < 0.05),MDA的增加将会影响损伤细胞膜结构,影响膜渗透性,同时积累活性氧。
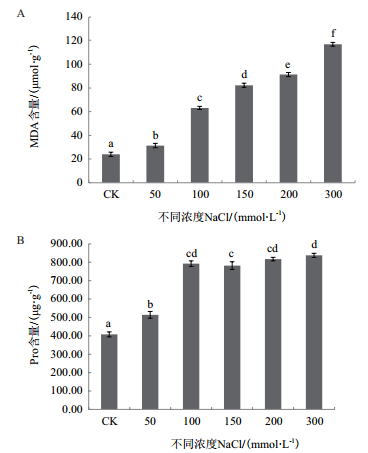
|
| 图 5 不同浓度NaCl处理下红砂中的MDA和Pro含量变化 |
结果发现,在MDA增加的同时,作为渗透调节物质的Pro含量也显著增加,与CK相比,不同NaCl浓度下的Pro含量分别增加25.95%、94.22%、91.59%、100.18%和105.22%,且差异性显著(P < 0.05),但100、150、200和300 mmol/L NaCl浓度下的Pro含量差异不大(P > 0.05)。
2.3.2 NaCl胁迫对红砂中酶活性的影响由图 6可知,随着NaCl浓度的增加,SOD的活性逐渐增强,与CK相比,不同浓度所对应的SOD活性分别增加237.23%、315.05%、631.35%、716.69%和699.58%,且增加显著(P < 0.05),但是50和100 mmol/L之间、0和300 mmol/L之间的SOD活性差异不显著。

|
| 图 6 不同浓度NaCl处理下红砂中的SOD和POD活性变化 |
NaCl浓度增加的同时,POD的活性也整体呈现出增强趋势,与CK相比,除了50 mmol/L外,其余浓度所对应的POD活性分别增加28.47%、52.18%、74.02%和81.41%,且增加显著(P < 0.05),但NaCl浓度为200和300 mmol/L所对应的POD活性差异不大,且NaCl浓度为50 mmol/L时,POD活性略有下降。
2.4 NaCl胁迫下红砂萌发过程中耐盐阈值的确定分别以红砂相对萌发率降为CK的50%时所对应的盐浓度为萌发耐盐阈值,植株全长降为对照的50%时所对应的盐浓度为萌发后生长耐盐阈值。
以NaCl浓度为自变量(x),以处理14 d后不同浓度下红砂的相对萌发率、植株全长为因变量(y)建立回归方程(表 2),发现红砂萌发耐盐阈值浓度为273.04 mmol/L,生长耐盐阈值为388.19 mmol/L,且拟合出的方程相关性较好。
与此同时,由于低浓度对于红砂的萌发有一定的促进作用,分别以红砂相对萌发率、植株全长为因变量y,NaCl浓度为自变量x,拟合出最适萌发曲线,经计算红砂的最适萌发盐浓度为45.78 mmol/L、最适生长盐浓度为50.59 mmol/L。生长耐盐阈值浓度明显高于萌发耐盐阈值浓度,最适萌发浓度和最适生长浓度差异性不大。
3 讨论盐分是土壤组分的重要组成部分,对于植物的生长发育起着重要的作用,但过量的盐分会导致植物种子萌发率降低、光合作用下降、活性氧代谢紊乱、蛋白质合成受阻等,最终造成植物生长发育迟缓[3-5]。本研究表明,低浓度的NaCl溶液处理,促进红砂种子萌发,且萌发后的植株全长、根长、苗高较CK显著增加,这种现象的出现可能是低浓度NaCl溶液促进细胞膜的渗透调节,或者是红砂对低浓度盐的一种适应机制,通过加速生长降低盐浓度。
随着NaCl溶液浓度的增加,红砂的萌发时间滞后、相对盐害率增加,相对萌发率、发芽指数、活力指数下降,植株全长、根长、苗高降低显著,但根长的变化更为明显,推测盐胁迫主要影响红砂根系建成与延长,影响水分吸收和养分供应;当盐浓度为400 mmol/L时,红砂不能萌发,但复萌处理发现,这些胁迫后的种子萌发迅速、集中,且胁迫35 d红砂种子仍然具有萌发活力。这说明红砂可以长时间忍受盐碱环境,在盐碱环境下,种子内部进行响应调节,以维持低耗、最佳萌发状态(推测应为种子萌发的第Ⅱ阶段),待条件适宜时,快速集中萌发。因此,在复萌阶段,可将胁迫后待复萌种子进行生理生化指标分析,或者将待复萌的种子进行萌发期耐盐基因筛选,以确定盐生植物逆境条件下的“保活”机制。
通过拟合曲线分别确定了红砂萌发期、生长期的耐盐阈值及最适盐浓度。从结果来看,红砂萌发期的耐盐阈值为273.04 mmol/L,萌发后生长耐盐阈值为388.19 mmol/L,最适萌发盐浓度为45.78 mmol/L,最适生长盐浓度为50.59 mmol/L,萌发后生长耐盐阈值明显高于萌发耐盐阈值,但最适生长和最适萌发盐浓度差异性不大,这印证了低浓度盐对盐生植物的萌发和生长具有促进作用,也说明种子萌发阶段是盐生植物逆境条件下成活的关键阶段,在这一阶段,抗逆性最弱,对盐胁迫比较敏感,种子萌发成功后对盐环境适应性较强,可适应较高浓度的胁迫。萌发阈值及生长阈值的确定,为盐生植物研究提供了不同发育层面的数据支撑。
当植株受到盐胁迫时,植物体内活性氧代谢紊乱,MDA积累,细胞膜脂过氧化,细胞膜渗透性增大,细胞水分运输失衡,同时Pro积累,起到渗透调节作用。本研究表明,随着盐浓度的增加,红砂植株内MDA、Pro含量较对照显著增加,但100、150、200和300 mmol/L之间Pro含量差异不大(P > 0.05),可能是过高的盐浓度导致植株仅依靠Pro不能进行有效的细胞膜渗透性调节,须有其他物质参与,共同响应并调节盐胁迫下植株的各个过程。
植物在逆境下会积累MDA、活性氧(Reactive oxygen species,ROS)和自由基,导致膜脂过氧化、损伤大分子生命物质,进而导致生理生化紊乱。为了减少胁迫危害,植株内的SOD催化超氧化物的歧化反应,生成过氧化氢(H2O2)和氧气(O2),但H2O2的积累对植株不利,需要POD将SOD歧化反应产生的H2O2分解[23-24]。结果表明,随着盐浓度的增加,SOD、POD的活性逐渐显著增强,但200和300 mmol/L所对应的POD活性差异不大,推测原因为:盐浓度过高,积累的较多的MDA,细胞膜渗透性发生了较大变化,MDA的积累激活SOD、POD相关信号通路,增加SOD、POD酶活性,加速歧化反应的进行,但SOD、POD相关信号通路对于MDA的响应存在一定的浓度区间。当MDA含量过低时,胁迫尚未造成直接影响,植株可通过自身渗透物质Pro进行调节,不激活酶活信号通路;当MDA浓度过高,超出植株自身调节范围时不能激活相关信号通路,或是能激活相关信号通路进行调节,但歧化反应的发生需要消耗能量,种子内的储存的物质有限,仅能维持一定程度内的歧化反应,最终导致植株胁迫致死或胁迫假休眠(非盐生植物种子胁迫致死,盐生植物种子胁迫假休眠)。因此,探究与胁迫响应相关酶联信号通路和胁迫下盐生植物种子保活机制尤为必要。
综上所述,盐浓度的增加,会导致红砂种子萌发受阻,萌发时间滞后;萌发后生长受到抑制,且受抑制明显;拟合方程发现种子萌发后生长耐盐阈值显著高于萌发耐盐阈值,同时MDA、Pro积累,POD、SOD活性增加。这说明萌发期是红砂完成生活是的关键时期,这一时期受到胁迫在一定程度内可通过提高POD、SOD活性清除MDA,增加Pro含量减少胁迫危害,维持正常的生理代谢。但这些指标的变化仅能帮助确定红砂萌发期对盐碱逆境的生理响应,并不能完全解析盐生植物红砂萌发期的耐盐机制。因此,应进一步以这些生长生理指标为基础,分别以阈值浓度和最适浓度做红砂萌发期差异基因分析,开展盐生植物种子复萌及胁迫后种子保活机制研究,这将为深入研究胁迫下盐生植物种子萌发期信号通路、耐盐机制奠定基础,也将为通过分子育种解决盐碱地区植被更新困难奠定理论基础和提供基因资源。
4 结论适当低浓度NaCl促进红砂萌发及萌发后生长,反之则抑制,且萌发期耐盐性较萌发后生长阶段更为敏感,在生长阶段,高浓度NaCl对红砂根长的抑制作用更为明显。红砂可在胁迫环境下长期保持萌发活力,待萌发条件适宜时,可快速集中大量萌发;红砂通过提高Pro含量维持渗透势,增加POD和SOD活性清除MDA以维持正常的生理代谢。
| [1] |
Kovda VA. Loss of productive land due to salinization[J]. Ambiology, 1983, 12(2): 91-93. |
| [2] |
王遵亲. 中国盐渍土[M]. 北京: 科学出版社, 1993.
|
| [3] |
Zhu JK. Abiotic stress signaling and response in plants[J]. Cell, 2016, 167(2): 313-324. DOI:10.1016/j.cell.2016.08.029 |
| [4] |
张娟, 姜闯道, 平吉成. 盐胁迫对植物光合作用影响的研究进展[J]. 农业科学研究, 2008, 29(3): 74-80. DOI:10.3969/j.issn.1673-0747.2008.03.020 |
| [5] |
韩志平, 张海霞, 周凤. 盐胁迫对植物的影响及植物对盐胁迫的适应性[J]. 山西大同大学学报:自然科学版, 2015, 31(3): 59-62. |
| [6] |
赵可夫, 李法曾, 张福锁. 中国盐生植物[M]. 北京: 科学出版社, 2013: 611-613.
|
| [7] |
Bu HY, Chen XL, Wang Y, et al. Germination time, other plant traits and phylogeny in an alpine meadow on the eastern Qinghai-Tibet plateau[J]. Community Ecology, 2007, 8(2): 221-227. DOI:10.1556/ComEc.8.2007.2.8 |
| [8] |
刘会良, 宋明方, 段士民, 等. 古尔班通古特沙漠及周缘52种植物种子的萌发特性与生态意义[J]. 生态学报, 2011, 31(15): 4308-4317. |
| [9] |
白蕾, 单立山, 李毅, 等. 降雨格局变化对红砂幼苗根系生长和生物量分配的影响[J]. 西北植物学报, 2017, 37(1): 163-170. |
| [10] |
刘瑞香, 马迎梅, 刘冰, 等. 额济纳荒漠红砂(Reaumuria soongorica)根系分布与土壤环境关系的研究[J]. 干旱区资源与环境, 2018(6): 149-154. |
| [11] |
姬江莉, 种培芳, 李毅, 等. 红砂对CO2浓度升高及降水变化的生理生长响应[J]. 西北植物学报, 2017, 37(5): 923-932. |
| [12] |
薛焱, 王迎春. 光照、温度和盐分对长叶红砂种子萌发的影响[J]. 植物生理学报, 2007, 43(4): 708-710. |
| [13] |
曾彦军, 王彦荣, 张宝林, 等. 红砂和猫头刺种子萌发生态适应性的研究[J]. 草业学报, 2000, 9(3): 36-42. DOI:10.3321/j.issn:1004-5759.2000.03.006 |
| [14] |
张勇, 薛林贵, 高天鹏, 等. 荒漠植物种子萌发研究进展[J]. 中国沙漠, 2005, 25(1): 106-112. DOI:10.3321/j.issn:1000-694X.2005.01.018 |
| [15] |
朱恭, 李正平, 王万鹏, 等. 红砂属植物研究进展[J]. 甘肃林业科技, 2004, 29(3): 1-6. DOI:10.3969/j.issn.1006-0960.2004.03.001 |
| [16] |
牛宋芳, 王利娟, 刘秉儒. 赤霉素对盐胁迫下红砂种子萌发的影响[J]. 草业学报, 2017, 26(6): 89-97. |
| [17] |
陈金元, 陈学林, 满吉琳, 等. 混合盐碱胁迫对红砂种子萌发的影响[J]. 西北农林科技大学学报:自然科学版, 2016, 44(5): 113-119. |
| [18] |
高茜, 李毅, 苏世平, 等. 盐胁迫对红砂(Reaumuria soongorica)种子吸胀过程中生理特性的影响[J]. 中国沙漠, 2014, 34(1): 83-87. |
| [19] |
周航宇, 包爱科, 杜宝强, 等. 荒漠植物红砂响应高浓度NaCl的生理机制[J]. 草业科学, 2012, 29(1): 71-75. |
| [20] |
Du C, Zhao PP, Zhang HR, et al. The Reaumuria trigyna transcription factor RtWRKY1 confers tolerance to salt stress in transgenic Arabidopsis[J]. J Plant Physiol, 2017, 215: 48-58. DOI:10.1016/j.jplph.2017.05.002 |
| [21] |
刘丹, 刘玉冰, 张雯莉. 红砂(Reaumuria soongorica)响应干旱和UV-B辐射双重胁迫的基因转录表达[J]. 中国沙漠, 2017, 37(4): 705-713. |
| [22] |
王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015.
|
| [23] |
Tian G, Li H, Qiu W. Advances on research of plant peroxidases[J]. Journal of Wuhan Botanical Research, 2001, 19(4): 332-344. |
| [24] |
Wei X, Yin Y, Lu Z, et al. Effects of NaCl stress on growth and physiological indexes of five greening plant seedlings and comprehensive evaluation of their salt tolerance[J]. Journal of Plant Resources & Environment, 2011, 20(2): 35-42. |