外泌体是一种细胞内多泡小体与细胞膜融合后以外分泌的形式释放到细胞外的一种囊泡, 具有脂质双分子层结构, 直径一般为30-150 nm, 与其他微泡共同组成细胞外囊泡[1]。近几年来的研究表明外泌体具有功能活性并可进行细胞间的信息传递, 并且在抗原传递、蛋白及RNA转运、血管介导新生、肿瘤细胞发生发展等过程中发挥着重要作用[2-4]。此外, 由于外泌体具有体积小、易穿透生物膜、免疫原性低等优点, 可以作为药物的良好载体[5]。而且肿瘤细胞的外泌体中含有大量与肿瘤相关的mRNA、miRNA、rRNA、DNA及特异性蛋白质[4], 因此在癌症发生机制及癌症的早期检测中具有重要的研究和应用价值。例如, Tanaka等[6]研究表明miRNA水平与肿瘤生长进展以及侵袭性密切有关, Kalluri和Taylor等[7-8]发现癌症患者中的病变器官和其中的异常细胞会比正常细胞产生更多的外泌体。
尽管外泌体在血液、尿液、乳液和唾液等体液中含量丰富[9], 但是体液中其他种类的细胞外囊泡及生物分子往往会对其研究结果产生干扰, 因此对外泌体的分离和纯化是基于外泌体的疾病检测及相关研究的重要环节。然而, 外泌体具有尺寸小、密度低以及生物流体性复杂等特点, 这对外泌体的分离和纯化提出了重大的挑战。近几年来, 围绕癌症等疾病的研究及诊断应用, 已有大量针对外泌体分离和纯化的方法技术研究。本文首先简要介绍传统的外泌体分离方法如离心法和过滤法等, 然后重点介绍近年来利用声流特性、流体动力学特性以及介电泳特性等基于微流控技术的外泌体分离方法。本文通过归纳比较当前已有的外泌体分离纯化方法, 旨在为要开展外泌体研究的研究人员提供参考, 推进外泌体在相关疾病检测及其他生物医学应用方面的研究进展。
1 传统的外泌体分离方法传统的外泌体分离的方法, 较为常用的有基于离心、过滤、免疫磁珠以及聚合物沉淀的方法。
超速离心法是目前传统外泌体分离技术中应用最广泛的方法。其原理主要是基于相对离心力的不同依次去除血液中的细胞、细胞碎片和大分子蛋白质等物质, 最后分离纯化得到外泌体。基于超速离心法的原理, 大量改进的外泌体分泌方法被相继报道。例如, 邢宇洋等[10]采用多步差速离心的方法分离了乳腺癌MDA-MB-231细胞的外泌体, 并从形态学、蛋白标记物和miRNA等方面对其进行了鉴定, 进一步证实了多步差速离心方法是一种简单有效的外泌体提取方法。陈加贵等[11]采用改良的超速离心法实现了肝癌细胞外泌体的分离和纯化, 首先收集使用无血清培养基培养肝癌SMMC-7721细胞的上清液, 然后在3 kg下离心去除细胞和细胞碎片, 然后依次在110 kg下离心3次获得外泌体。这种改良后的超速离心方法能提取到一定纯度的外泌体, 并且能够排除来自细胞培养血清所含的外泌体的干扰。为了进一步改善超速离心法分离外泌体的纯度, 研究者提出了利用蔗糖密度梯度的外泌体离心法, 这种方法是将样本和蔗糖梯度材料一起超速离心, 使样品中不同组分沉降到各自的等密度区域, 从而实现外泌体的分离[12]。
尽管超速离心法在外泌体的分离中得到了广泛的应用, 但其对离心速度的苛刻要求以及较低的分离产量制约了其发展, 为此相关学者提出了基于过滤的分离方法, 如旋转超滤技术。旋转超滤技术分离外泌体的原理是利用超滤膜孔径的大小对不同相对分子质量的物质进行分离。胡国文等[13]采用了一种利用旋转超滤技术从骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)培养上清液中分离外泌体的方法。首先收集骨髓间充质干细胞的培养上清液, 在低速离心下去除残余的细胞, 然后用0.22 μm的过滤器去除细胞碎片, 最后采用旋转超滤技术成功分离外泌体。相对于超速离心法所需要的大于100 kg的离心力, 这种方法仅需要517.125 kPa的压力, 可有效减少离心力对外泌体的损坏, 并且可以提高外泌体的分离产量。然而, 该方法中的缺点为过滤膜孔径会对分离结果产生影响, Liu等[14]就发现使用30 nm和50 nm孔径分离得到的外泌体内含蛋白质并不完全相同, 这可能会导致后续的外泌体蛋白质分析和检测结果产生差异。
外泌体表面含有CD9、CD63、CD81等特异性蛋白, 因此可以利用这些特异性表面蛋白实现外泌体的分离和收集。免疫磁珠法就是一种通过抗体结合磁珠实现特异性捕获外泌体的方法[15], 该方法不仅可以增加外泌体的分离纯度, 还可以通过结合流式细胞术、蛋白质免疫印迹以及电子显微镜等方法对收集的外泌体进行分析。
另外, 聚合物沉淀的方法也被用于分离外泌体。聚合物沉淀法是利用聚合物作为沉淀剂从生物样本中分离沉降出外泌体, 如基于聚乙二醇的沉淀方法的原理就是含水的聚乙二醇可以包裹外泌体形成外泌体聚合物, 进而在低速离心中就可以轻松分离。Weng等[16]根据这个原理从海拉细胞培养上清液中分离出外泌体, 并且研究了聚乙二醇的分子量MW和浓度对外泌体分离效果的影响。类似的, 可以采用这种方法从血液、尿液、唾液等生物样本中分离和纯化外泌体。但是, 这种方法提取的外泌体可能会受到聚合物和一些蛋白质的污染, 从而对后续的功能性分析产生影响。
2 基于微流控技术的分离方法虽然传统的外泌体分离方法比较常用, 但是存在所需样本量大、可能损伤外泌体以及回收率低等缺点。近年来, 随着微纳米制造工艺的发展, 微流控技术被广泛应用于各种微粒分离及检测过程。基于微流控技术的分离检测具有所需样本小、检测速度快及检测成本低等优点, 因此一些研究人员在微流控技术的基础上结合声波、介电电泳、微流体黏弹性以及其他物理特性成功发展了多种新颖的外泌体分离方法。
2.1 声流体技术分离外泌体研究人员将微流控技术和声学巧妙地结合形成声流体(Acoustofluidics), 可有效实现细胞等微粒的分选和操纵, 其原理是不同尺寸的微粒在微流控声场中会受到差异化大小的声辐射力和粘滞力[17-19]。其中, 粘滞力与微粒的半径成正比, 而声辐射力与微粒的体积成正比。如图 1-A-B所示, 对于尺寸较大的微粒, 声辐射力起主导作用, 微粒向声波节点移动; 而尺寸较小的粒子, 黏滞力抵消了大部分的声辐射力, 微粒侧向运动微弱。在声辐射力和黏滞力的综合作用下, 尺寸不同的微粒会移向不同的出口, 进而实现微粒的分离。虽然声流体技术在细胞操纵和分离中得到了广泛的应用, 但最初的声流体器件只适合两种目标物的分离, 因此很难从成分复杂血液中分离出外泌体。针对这种不足, Wu等[20]开发了一种新型的声流体器件, 可从全血样品中以免标记、无接触的方式快速有效地分离出外泌体。该器件及分离过程如图 1-C所示, 整体分为微细胞去除模块和外泌体分离模块。首先, 在微细胞去除模块中利用较低频率(19.6 MHz)声波去除血液中尺寸较大的红细胞、白细胞以及血小板等; 然后在外泌体分离模块中采用较高频率(39.4 MHz)的声波将外泌体与细胞外囊泡亚组成分(凋亡小体、较大的细胞外囊泡等)进行分离, 并在通道的指定出口对外泌体进行收集。Lee等[21]也展示了一种基于声波纳米过滤系统的细胞外囊泡分离方法, 该方法是根据细胞外囊泡和其他成分存在大小和密度差异, 进而可以利用超声驻波将纳米尺度的囊泡(< 200 nm)从细胞培养液和红细胞产物中分离出来。
基于声流体的外泌体分离方法具有获得的外泌体生物特性好、纯度(~98%)和回收率(~82%)比较理想、所需样本量少的优点, 是一种较为新颖的分离方法。但是其分离原理是根据对象尺寸和声阻抗特性实现的, 因此不可避免地会受到血浆中与外泌体尺寸和声阻抗特性类似成分的干扰。
2.2 介电泳技术分离外泌体在置于溶液中的微电极上施加交流电压, 常常会在电极表面产生电渗流、介电泳和电热流等电液动力现象, 并且这些电液动力现象可以通过控制交流电压的频率和幅值进行灵活控制, 因此被广泛用于微流体的混合、微纳颗粒的操控等应用[22-24]。其中, 交流电渗适合用于低电导率溶液的操作, 这是因为当溶液电导率比较高时, 在电极表面形成的双电层厚度非常小, 使得交流电渗的作用减弱[25], 难以实现从细胞培养液或血清中分离外泌体。介电泳(Dielectrophoretic, DEP)力是介质粒子在非均匀电场中受到极化并与电场相互作用产生的一种使极化粒子定向移动的力。由于介电泳力的大小与被操纵粒子及溶液介质的介电特性相关, 并且与被操纵粒子的尺寸成比例[26], 要利用介电泳在血液中实现外泌体的分离和纯化, 需要设计特别的电极结构。
Heineck等[27]通过比较平行导线排列和平面阵列, 证实了平面阵列电极模型可以在高电导条件下不受电热流的影响, 这为从细胞培养液或血液等高电导溶液下分离外泌体提供了一种新的思路。Ibsen等[28]设计了一种基于介电泳技术的交流电动微阵列芯片, 能够快速地从未稀释的血液样本中分离并且回收胶质母细胞瘤的外泌体。该芯片的分离原理是根据外泌体与血浆中其他成分具有不同的介电特性, 因此会受到不同的介电泳力, 使得纳米尺度的外泌体被吸引到微电极边缘区域, 即介电泳强场区域, 而细胞及大分子蛋白质则被拉进电极之间的介电泳弱场区域, 从而实现对外泌体的分离。Sonnenberg等[29]采用类似的微阵列电极方法成功从血液中分离出DNA等纳米尺度物质。
采用介电泳技术分离外泌体回收率和纯度高, 而且所需的血浆样本少(30-50 µL), 在很短的时间内(15 min)就能富集到外泌体[28]。但是该方法一个潜在的缺点就是外泌体可能会与电极直接接触产生电化学现象而受到损坏。可以考虑在阵列电极上铺设一层多孔水凝胶层, 避免外泌体与电极直接接触, 发生电化学效应。
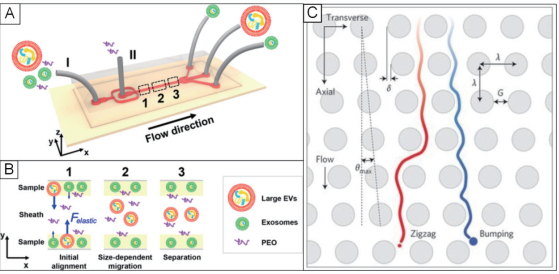
2.3 利用流体动力学特性分离外泌体在黏弹性微流体中, 作用在粒子上的黏弹性力可使其产生移动[30], 并且黏弹性力的大小及其产生的位移与粒子的大小有关, 因此微流体的黏弹性力可以作为一种简单的、无标记的技术用于粒子的操纵和分离。黏弹性微流体的黏弹性力被广泛用于肿瘤细胞、血细胞、细菌、液滴和微球体等微纳物体的操纵和分离[30-33]。相对于声流体、介电泳及磁性等其他技术方法, 利用微流体黏弹性的分离方法可以在不施加额外的场力的条件下对微粒进行精确操纵。尽管微流体黏弹性分离法有诸多优点, 但其并不能在纳米粒子上产生足够大的黏弹性力。针对一般黏弹性微流体不能直接分离外泌体的局限, Liu等[34]提出了利用聚氧化乙烯聚合物(Poly-oxyethylene, PEO)作为介质添加剂来改变流体的黏弹性。聚合物PEO可以增加微流体黏弹性的大小, 从而增加作用在外泌体上的黏弹性力。如图 2-A-B所示, 在分离过程中, 控制入口和鞘流的流速使样本最开始在微通道的两侧, 尺寸较大的细胞外囊泡受到较大的黏弹性力移向通道中央, 较小的外泌体受到的黏弹性力有限, 位移较小, 从而使外泌体和较大的细胞外囊泡移向不同的出口。
利用流体动力学的特性, Wunsch等[35]设计了一种基于横向位移的外泌体分离方法, 如图 2-C。这种方法是通过光刻技术在微通道内制造阵列纳米柱来控制不同尺寸微粒的运动轨迹, 其中阵列纳米微柱间隙为25-235 nm, 最大角度为θmax= 5.7°。在该设计中, 低于临界尺寸的微粒随着层流的流动沿“Z”字型前进, 而大于临界尺寸的微粒则以阵列纳米柱设定的路径前进。通过优化阵列纳米柱的参数, 就可以控制微粒的运动轨迹, 实现外泌体的分离。
相对于其他微流控方法, 利用微流体的流动特性的分离方法不需要施加额外的场力, 分离方便, 且对外泌体的损害小, 为微量样本的外泌体分离和定量分析提供了新的思路。
2.4 其他微流控方法不论是基于离心过滤的传统方法, 还是近年来新兴的微流控分离方法均未在纯度、回收率、生物活性等方面达到完全理想的分离效果。如今, 研究人员越来越重视集成多种分离原理和方法, 以期实现更好的分离效果。Davies等[36]结合微流体和过滤两种方法, 将纳米多孔膜整合到微流控芯片上, 形成微流控过滤系统。相对于常规的过滤方法, 这种装置可以通过改变致孔溶剂与预聚物溶液的比例控制纳米孔的尺寸, 使其适合于外泌体的提取和分离。并且此方法采用电泳驱动过滤, 消除了一些可溶性蛋白的干扰, 从而提高了纯度。另外, Yasui[37]设计了一种基于纳米线的微流控芯片用于收集尿液中的外泌体。该芯片将带正电的纳米线固定在微流控通道的基底上, 实现很高的收集效率。与超速离心法相比, 该方法检测样本小、样本处理时间短, 且提取的miRNA的种类更多。该芯片为基于尿液样本的疾病早期诊断提供了一种新的策略。
基于免疫的方法一直是外泌体分离的一个重要分支, He等[38]开发了一种新的微流控方法, 将磁珠集成在微流控芯片上, 可以对外泌体进行特异性免疫分离和靶向蛋白分析。该免疫磁珠结合微流控技术的方法不仅可以富集捕获到外泌体, 而且可以方便地制备透射电镜表征样品, 从而提高捕获效率以及分析的灵敏度。
除了上述的外泌体分离方法, 也有一些针对特定应用和特殊需求发展而来的分离方法。如Chiu等[39]为了实现单细胞的外泌体的实时检测, 提出了一种单细胞外泌体测定法。该方法设计并制造了一种带网孔的PDMS基底, 并在离心力作用下使每个网孔能够装载单个细胞并培养, 然后利用固定有CD-63抗体的盖玻片对应收集每个网孔内细胞分泌的外泌体。该方法可以在体外环境下定量分析单细胞分泌外泌体的数量, 并研究药物和酸性环境对外泌体分泌量和蛋白质表达的影响。
3 总结尽管近年来外泌体的分离研究取得了长足的进展, 但是每种方法都有其优点和不足。表 1对几种典型的外泌体分离方法在回收率、纯度以及优缺点等方面进行了总结和对比。
基于离心和过滤的方法仍是最常用和有效的方法, 一次性可以获得大量的外泌体, 但不适用于微量以及珍贵样本。通过离心方法提取的外泌体纯度、回收率以及生物活性都会受到离心力、离心时间等一些因素的影响, 而且分离前需要复杂的准备工作, 耗费时间长(2-6 h)[40-42]。多步过滤的方法在前期准备上仍然需要离心处理, 步骤繁琐, 而且需要大量的样本(30-100 mL), 产率反而很低。免疫磁珠分离法的分离效果严重依赖于特异性抗体, 成本高, 且只能分离获得与抗体亲和的外泌体, 造成某些种类的外泌体丢失。
近年来, 微流控技术在外泌体分离中得到广泛的应用。基于微流控技术的分离方法具有分离速率较快, 分离产率和纯度较高, 对样本需求量较少的优点, 与上述传统方法相比更适用于微量样品分析, 有望被广泛应用于未来个人医疗和精准治疗中。然而, 当前基于微流控的外泌体分离方法仍处于实验研究阶段, 还需要进一步发展研究。
随着外泌体分离方法和技术的发展, 外泌体在细胞通信、疾病发生等重要生命活动中的作用及机制会进一步得到揭示, 促进疾病检测及相关治疗方法的发展。
| [1] |
Lobb RJ, Becker M, Wen SW, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J]. J Extracell Vesicles, 2015, 4: 27031. DOI:10.3402/jev.v4.27031 |
| [2] |
Mahaweni NM, Kaijenlambers MEH, Dekkers J, et al. Tumour-derived exosomes as antigen delivery carriers in dendritic cell-based immunotherapy for malignant mesothelioma[J]. J Extracell Vesicles, 2013, 2. DOI:10.3402/jev.v210.22492 |
| [3] |
Buzas EI, Gy Rgy B, Nagy G, et al. Emerging role of extracellular vesicles in inflammatory diseases[J]. Nature Reviews Rheumatology, 2014, 10(6): 356-364. DOI:10.1038/nrrheum.2014.19 |
| [4] |
Gallo A, Tandon M, Alevizos I, et al. The majority of microRNAs detectable in serum and saliva is concentrated in exosomes[J]. PLoS One, 2012, 7(3): e30679. DOI:10.1371/journal.pone.0030679 |
| [5] |
Whiteside TL. Exosomes carrying immunoinhibitory proteins and their role in cancer[J]. Clinical and Experimental Immunology, 2017, 189(3): 259-267. DOI:10.1111/cei.2017.189.issue-3 |
| [6] |
Youhei Tanaka MD, Hidenobu Kamohara MDPhD, et al. Clinical impact of serum exosomal microRNA-21 as a clinical biomarker in human esophageal squamous cell carcinoma[J]. Cancer, 2013, 119(6): 1159-1167. DOI:10.1002/cncr.27895 |
| [7] |
Kalluri R. The biology and function of exosomes in cancer[J]. J Clin Invest, 2016, 126(4): 1208-1215. DOI:10.1172/JCI81135 |
| [8] |
Taylor DD, Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecologic Oncology, 2008, 110(1): 13-21. DOI:10.1016/j.ygyno.2008.04.033 |
| [9] |
Schageman J, Zeringer E, Li M, et al. The complete exosome workflow solution:from isolation to characterization of RNA Cargo[J]. Biomed Res Int, 2013, 2013(8): 253957. |
| [10] |
邢宇洋, 康亚妮, 戚颖. 乳腺癌细胞外泌体的分离与鉴定[J]. 肿瘤, 2013, 33(7): 581-584, 596. |
| [11] |
陈加贵, 邓敬桓, 何敏. 肝癌细胞外泌体的分离与鉴定[J]. 世界华人消化杂志, 2016, 5: 737-743. |
| [12] |
卢婉, 杨人强, 王伶. 外泌体的研究进展[J]. 生命的化学, 2013, 51(4): 438-442. |
| [13] |
胡国文, 李青, 牛鑫. 旋转超滤:一种提取细胞外泌体的新方法[J]. 第二军医大学学报, 2014, 35(6): 598-602. |
| [14] |
Liu F, Vermesh O, Mani V, et al. The Exosome Total Isolation Chip[J]. ACS Nano, 2017, 11(11): 10712-10723. DOI:10.1021/acsnano.7b04878 |
| [15] |
Oksvold MP, Neurauter A, Pedersen KW. Magnetic bead-based isolation of exosomes[J]. Methods in Molecular Biology, 2015, 1218: 465. DOI:10.1007/978-1-4939-1538-5 |
| [16] |
Weng Y, Sui Z, Shan Y, et al. Effective isolation of exosomes with polyethylene glycol from cell culture supernatant for in-depth proteome profiling[J]. Analyst, 2016, 141(15): 4640-4646. DOI:10.1039/C6AN00892E |
| [17] |
Augustsson P, Karlsen JT, Su HW, et al. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping[J]. Nature Communications, 2016, 7: 11556. DOI:10.1038/ncomms11556 |
| [18] |
Ding X, Lin SC, et al. On-chip manipulation of single microparti-cles, cells, and organisms using surface acoustic waves[J]. Proc Natl Acad Sci USA, 2012, 109(28): 11105-11109. DOI:10.1073/pnas.1209288109 |
| [19] |
Ma Z, Zhou Y, Collins DJ, et al. Fluorescence activated cell sorting via a focused traveling surface acoustic beam[J]. Lab Chip, 2017, 17(18): 3176-3185. DOI:10.1039/C7LC00678K |
| [20] |
Wu M, Ouyang Y, Wang Z, et al. Isolation of exosomes from whole blood by integrating acoustics and microfluidics[J]. Proc Natl Acad Sci USA, 2017, 114(40): 201709210. |
| [21] |
Lee K, Shao H, et al. Acoustic purification of extracellular microvesicles[J]. ACS Nano, 2015, 9(3): 2321-2327. DOI:10.1021/nn506538f |
| [22] |
Feng JJ, Krishnamoorthy S, Sundaram S. Numerical analysis of mixing by electrothermal induced flow in microfluidic systems[J]. Biomicrofluidics, 2007, 1(2): 24102. DOI:10.1063/1.2734910 |
| [23] |
方明, 樊磊, 曾一笑. 集成阵列叉指电极介电泳芯片粒子分离[J]. 微纳电子技术, 2016, 53(7): 461-466. |
| [24] |
任玉坤, 敖宏瑞, 顾建忠. 面向微系统的介电泳力微纳粒子操控研究[J]. 物理学报, 2009, 58(11): 7869-7877. DOI:10.7498/aps.58.7869 |
| [25] |
吴玉潘.基于交流电热的微流体混合芯片研究[D].哈尔滨: 哈尔滨工业大学, 2015.
|
| [26] |
Pohl HA. Dielectrophoresis:the behavior of neutral matter in nonuniform electric fields[M]. London: Cambridge University Pr, 1978.
|
| [27] |
Heineck DP, Lewis JM, Heller MJ. Electrokinetic device design and constraints for use in high conductance solutions[J]. Electrophoresis, 2017, 38(11): 1475-1482. DOI:10.1002/elps.v38.11 |
| [28] |
Ibsen SD, Wright J, Lewis JM, et al. Rapid isolation and detection of exosomes and associated biomarkers from plasma[J]. ACS Nano, 2017, 11(7): 6641-6651. DOI:10.1021/acsnano.7b00549 |
| [29] |
Sonnenberg A, Marciniak JY, Krishnan R, et al. Dielectrophoretic isolation of DNA and nanoparticles from blood[J]. Electrophoresis, 2012, 33(16): 2482-2490. DOI:10.1002/elps.201100700 |
| [30] |
Lu X, Xuan X. Continuous microfluidic particle separation via elasto-inertial pinched flow fractionation(eiPFF)[J]. Anal Chem, 2015, 87(12): 6389-6396. DOI:10.1021/acs.analchem.5b01432 |
| [31] |
Chao L, Xue C, Chen X, et al. Size-based separation of particles and cells utilizing viscoelastic effects in straight microchannels[J]. Anal Chem, 2015, 87(12): 6041-6048. DOI:10.1021/acs.analchem.5b00516 |
| [32] |
Yuan D, Zhang J, Sluyter R, et al. Continuous plasma extraction under viscoelastic fluid in a straight channel with asymmetrical expansion-contraction cavity arrays[J]. Lab Chip, 2016, 16(20): 3919-3928. DOI:10.1039/C6LC00843G |
| [33] |
Zhang J, Yan S, Yuan D, et al. A novel viscoelastic-based ferrofluid for continuous sheathless microfluidic separation of nonmagnetic microparticles[J]. Lab Chip, 2016, 16(20): 3947-3956. DOI:10.1039/C6LC01007E |
| [34] |
Liu C, Guo J, Tian F, et al. Field-free isolation of exosomes from extracellular vesicles by microfluidic viscoelastic flows[J]. ACS Nano, 2017, 11(7): 6968-6976. DOI:10.1021/acsnano.7b02277 |
| [35] |
Wunsch BH, Smith JT, Gifford SM, et al. Nanoscale Lateral displacement arrays for the separation of exosomes and colloids down to 20 nm[J]. Nat Nanotechnol, 2016, 11(11): 936. DOI:10.1038/nnano.2016.134 |
| [36] |
Davies RT, Kim J, Jang SC, et al. Microfluidic filtration system to isolate extracellular vesicles from blood[J]. Lab Chip, 2012, 12(24): 5202-5210. DOI:10.1039/c2lc41006k |
| [37] |
Yasui T, Yanagida T, Ito S, et al. Unveiling massive numbers of cancer-related urinary-microRNA candidates via nanowires[J]. Science Advances, 2017, 3(12): e1701133. DOI:10.1126/sciadv.1701133 |
| [38] |
He M, Crow J, Roth M, et al. Integrated immunoisolation and protein analysis of circulating exosomes using microfluidic technology[J]. Lab Chip, 2014, 14(19): 3773-3780. DOI:10.1039/C4LC00662C |
| [39] |
Chiu YJ, Cai W, Shih YR, et al. A single-cell assay for time Lapse studies of exosome secretion and cell behaviors[J]. Small, 2016, 12(27): 3658-3666. DOI:10.1002/smll.v12.27 |
| [40] |
Deun JV, Mestdagh P, Sormunen R, et al. The impact of disparate isolation methods for extracellular vesicles on downstream RNA profiling[J]. J Extracell Vesicles, 2014, 3(1): 24858. DOI:10.3402/jev.v3.24858 |
| [41] |
Linares R, Tan S, Gounou C, et al. High-speed centrifugation induces aggregation of extracellular vesicles[J]. J Extracell Vesicles, 2015, 4(1): 29509. DOI:10.3402/jev.v4.29509 |
| [42] |
Yang F, Liao X, Tian Y, et al. Exosome separation using microfluidic systems:size-based, immunoaffinity-based and dynamic methodologies[J]. Biotechnol J, 2017, 12(4): 160069. |