小肽可作为植物生长发育与逆境适应性等细胞活动的调控信号,赋予植物适应复杂多变环境的能力[1]。快速碱化因子(Rapid alkalinization factor,RALF)首先在烟草中发现并被鉴定为一类5kD左右的小肽分子[2]。部分RALF可使细胞外围环境快速发生碱化反应[3-4]。在模式植物拟南芥、水稻、杨树和玉米等生物体内,针对RALF同源基因的克隆与功能分析显示,RALF在主根中都抑制细胞生长,并提出RALF主要是通过使细胞壁碱化,从而抑制细胞生长[5]。RALF蛋白前体通常具有80-120 aa[2, 6]。通过某种蛋白酶,如S1P蛋白酶[7],切割获得RALF成熟多肽(约50 aa),成熟RALF小肽富含半胱氨酸,并在N末端存在一段保守的-YISY序列,推测其对于识别RALF对应的受体蛋白起重要作用,若将这段序列中的异亮氨酸突变成丙氨酸,则显著抑制RALF功能[8-9]。在拟南芥中,至少具有35个组织特异性表达的RALF成员[10]。RALF4和RALF19在花粉管中高表达,RALF4/19能抑制花粉管的破裂[11-12],但RALF4对根长和下胚轴并没有抑制作用[4]。这些结果暗示,RALF不同成员的功能可能具有组织特异性和多样性。
受体激酶FERONIA(FER)是RALF1信号分子的受体。RALF1与位于细胞膜表面的FER受体激酶结合并促进FER的磷酸化,抑制氢泵AHA2的活性,导致细胞壁碱化,从而抑制主根的生长[13]。本课题组的工作进一步发现FER通过与受体激酶RIPK相互作用响应RALF1信号,并抑制主根细胞生长[14]。同时,RALF1-FER/RIPK信号通路也在逆境响应中发挥重要作用。课题组前期研究发现FER能够抑制逆境激素脱落酸(Abscisic acid,ABA)的响应,并介导RALF1与ABA在主根生长调节中的交叉会话[15]。在生物免疫方面,以丝裂原活化蛋白激酶(MAPK)磷酸化分析及活性氧迸发(Reactive oxygen species,ROS)作为检测指标[16-19]。RALF23作为配体小分子,与受体FER相互作用,抑制免疫方面相关的受体复合物(EFR/BAK1/FLS2)的形成,负调控免疫信号的应答。在拟南芥中,过表达RALF23可以抑制flg22诱导的ROS产生,并且对Pto DC3000(Pseudomonas syringae pv. tomato DC3000)的敏感性增加,相反,其突变体可以促进flg22诱导的ROS的产生,并且对Pto DC3000的敏感性降低[10],以上研究表明RALF23作为负调节因子,通过FER参与到由病原体分子模式引起的植物细胞免疫。综上可知,RALF的活性分析具有以下几类主要测定指标:(1)对根长等组织细胞生长的影响;(2)对flg22诱导的ROS产生和(3)对MAPK磷酸化的影响。
目前的研究结论表明,RALF1作为FER的配体的遗传学证据只在根中成立,多项研究都认为RALF抑制根和叶片组织细胞的生长,而FER在不同组织中对细胞生长起到不同甚至完全相反的作用,比如FER和RALF1都在根中抑制细胞生长,但是FER在叶片中促进细胞生长[20-21],这与RALF1功能相反。为解释以上悖论,目前推测认为不同RALF多肽成员在不同组织存在功能差异,甚至存在完全相反的功能,而这些功能相反的成员在不同的组织中与特异的受体结合,从而在不同组织起到差异甚至相反的遗传学功能。为了验证该推测,本研究克隆并分析了19种RALF小肽,系统性地研究不同RALF对根生长及下胚轴伸长的影响,发现并不是所有RALF都会对下胚轴伸长有抑制作用,RALF10会明显促进下胚轴的伸长。该实验结果表明不同RALF确实存在功能性的差异,甚至出现相反的功能。
1 材料与方法 1.1 材料 1.1.1 主要试剂限制性核酸内切酶BamH 1(货号:00455366)和EcoR Ⅰ(货号:00466339)、高保真酶(货号:P505-d1-AA)、T4 DNA连接酶(货号:00524509)为Thermo Fisher Scientific公司产品。氯化钠(货号:7647-14-5)、蛋白胨(货号:73049-73-7)、酵母粉(货号:8013-01-2)、Tris-碱(货号:77-86-1)、异丙基-β-D-硫代半乳糖苷(IPTG)(货号:367-93-1)、咪唑(货号:288-32-4)、卡那霉素(货号:70560-51-9)以及氨苄霉素(货号:69-52-3)均购于生工生物工程上海(股份)有限公司。载体与菌株:菌株E. coli DH5α,E. coli BL21由本实验室保存,质粒pET-32a由本实验室保存。
1.1.2 主要材料拟南芥Col-0(哥伦比亚背景),将消毒好的Col-0点种于1/2 MS固体培养基上,垂直置于长日照培养箱里(16 h光照,8 h黑暗),温度为22±4℃,4-5 d后取材进行根长处理及下胚轴处理实验,7 d后取材进行MAPK磷酸化分析实验。移苗于营养土中的Col-0在拟南芥生长室生长4-5周后取材进行ROS含量测定实验。
1.2 方法 1.2.1 生物信息学分析从Tair网站上获得(https://www.arabidopsis.org/)RALF多肽氨基酸一级序列。使用带有默认参数的ClustalW软件对成熟的RALF多肽序列进行多序列比对。进化树分析采用邻近-连接方法,使用MEGA7.0软件(参数为1 000 bootstrap和Poisson correction model)对多序列比对后的RALF多肽进行进化树分析。
1.2.2 蛋白表达载体的构建本研究中所选的表达载体为pET-32a,首先利用Primer 5.0软件设计特异性引物,以野生型拟南芥cDNA为模板,进行PCR克隆扩增,获得目的基因片段,设计的引物见表 1。PCR程序为95℃ 3 min;95℃ 15 s,58℃ 15 s,72℃ 40 s,共36个循环;72℃ 5 min,22℃ ∞。然后进行琼脂糖凝胶电泳回收目的条带,以BamH Ⅰ和EcoR Ⅰ为酶切位点,对扩增产物和载体进行双酶切(37℃,2 h)。然后用T4连接酶4℃连接12 h后进行热激转化(42℃,90 s),涂布于含有氨苄霉素(Amp+)抗性的LB固体培养基上,37℃培养12 h,然后挑取单菌落进行菌落PCR检测,挑取阳性菌落进行摇菌(37℃,12 h),提取质粒并测序。
将测序正确的重组质粒经过热激转化至宿主菌BL21中,涂布于含100 mg/mL氨苄霉素的LB固体筛选培养基上,37℃培养12-16 h后,挑取单菌落接种于6 mL含100 mg/mL的氨苄霉素的LB液体培养基中,37℃,220 r/min,活化10 h。次日将活化的菌液按1:100的比例接种于100 mL含100 mg/mL的氨苄霉素的LB液体培养基中,37℃,220 r/min振荡培养2-3 h,至OD600=0.8,加入0.5 mmol/L的IPTG,28℃诱导6 h,离心收集菌体(5 000 r/min,22℃,5 min)。
1.2.4 蛋白纯化将菌体重悬于10 mL裂解缓冲液(50 mmol/L Tris-HCl(pH8),150 mmol/L NaCl,10 mmol/L imidazole,1 mmol/L PMSF),置于冰上,20 kH,5 min,超声破碎,离心(5 000 r/min,4℃,5 min)收集上清,加入500 μL Ni-NTA Agarose,4℃孵育12 h。离心(800 r/min,4℃,1 min)去上清,加入清洗缓冲液(50 mmol/L Tris-HCl,300 mmol/L NaCl,20 mmol/L imidazole),4℃孵育10 min,重复清洗两遍后去上清,加入洗脱缓冲液(50 mmol/L Tris-HCl,250 mmol/L imidazole),4℃孵育1 h。收集上清(800 r/min,4℃,1 min),得到RALF蛋白。取少量纯化重组蛋白,11% SDS-PAGE凝胶电泳,考马斯亮蓝染色观察。
1.2.5 根长抑制及下胚轴抑制实验将拟南芥Col-0种子在75%酒精里消毒1 min,无菌水冲洗两次,然后加入15%的次氯酸钠消毒3 min,无菌水冲洗3次,将消毒好的种子置于4℃,春化2 d。根长抑制实验,将消毒好的种子点种于1/2 MS固体培养基上,放置在22℃长日照培养箱中,使其生长4 d,然后将苗子移放到含有RALF小肽(1 μmol/L)的液体1/2 MS液体培养基中,正常生长3 d后进行根长观察和统计。下胚轴抑制实验,将春化后的种子点种于1/2 MS固体培养基上,使其生长4 d,然后将苗子移放到含有RALF小肽(1 μmol/L)的液体1/2 MS液体培养基中,放在黑暗条件下培养,4 d后进行下胚轴观察和统计(对照组平均值-实验组平均值/对照组平均值)。对照组植物与实验组植物处于相同的生长条件。使用Image J软件分别统计根长及下胚轴数据。
1.2.6 flg22诱导的ROS实验剪取未抽薹的野生型(Col-0)叶片(第七、八片对生叶),将叶片切成直径为0.4×0.4 cm的正方形小块,分别转入每孔含有100 μL双蒸水(pH5.8)的96孔板,用锡箔纸遮盖,避光,过夜反应(8-12 h),消耗因机械损伤引起的ROS,并恢复叶片生理状态。第2天,吸去双蒸水,加入反应液17 μg/mL luminol(Sigma,货号CAS:521-31-3),10 μg/mL HRP(Sigma),0.1 μmol/L flg22(Sigma),1 μmol/L RALF,阳性对照加入flg22,实验组加入flg22及相应的1 μmol/L RALF小肽,然后迅速放入仪器Fluoroskan Ascent FL(Thermo Scientific),检测。
1.2.7 MAPK磷酸化水平分析实验每组称取0.1 g生长了7 d的拟南芥幼苗,置于含有1/2 MS液体培养基的1.5 mL EP管中(实验组含2 μmol/L RALF小肽),置于光照培养箱处理5 min,15 min,30 min,去除反应液进行蛋白提取,蛋白提取试剂为(150 mmol/L NaCl,10 mmol/L MgCl2,50 mmol/L HEPES(pH7.5),10 mmol/L KCl,5 mmol/L EDTA,1% Tritonx-100,10% glycerol,1% PMSF,1% Cocktail),Western检测。用β-actin(CMC,货号:AT0004)检测上样平衡,使用p-MAPK(Cell Signaling,货号:#4370)抗体检测MAPK磷酸化水平。WB灰度值使用image J软件进行测定。
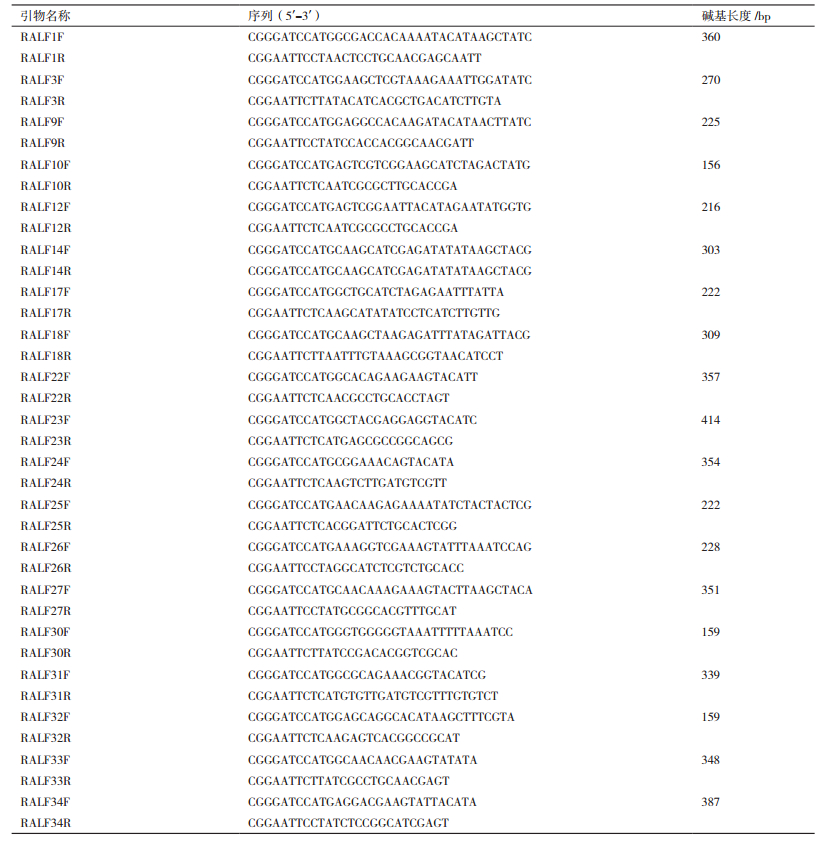
2 结果 2.1 重组His-RALF的纯化在拟南芥中,RALF家族至少含有35个成员,并有着不同的分布与功能,为系统性研究这些RALF的功能,首先根据其蛋白一级结构序列上的相似性,将其分为四大类并分别命名为Ⅰ、Ⅱ、Ⅲ和Ⅳ。
本研究中,我们选择具有代表性的19个RALF进行后续的研究,研究的RALF蛋白当中,以RALF1为代表的第Ⅰ类共8个成员中我们选取其中6个成员进行研究;以RALF34为代表的第Ⅱ类共9个成员中我们选取其中7个成员进行研究;以RALF17为代表的第Ⅲ类共14个成员中我们选取其中3个成员进行研究;以RALF18为代表的第Ⅳ类共4个成员中我们选取其中3个成员进行研究(图 1-A)。
|
| 图 1 RALF家族成员进化分析及蛋白纯化 A:RALF家族进化分析。红色代表第Ⅰ类RALF,共6个,占比例为75%;绿色代表第Ⅱ类RALF,共7个,占比例为78%;橙色代表第Ⅲ类RALF,共3个,占比例为21%;蓝色代表第Ⅳ类RALF,共3个,占比例为75%;B:19个代表性RALF成员的蛋白纯化结果;M:蛋白Marker |
首先对这19个RALF进行目的片段的PCR克隆,亚克隆进入原核蛋白表达载体并转入BL21大肠杆菌中进行原核表达和诱导,纯化并获得原核表达的重组蛋白。通过考马斯亮蓝染色分析,发现RALF目的蛋白是纯化后蛋白的主要成分,分子量与预测大小吻合,表明RALF纯化成功(图 1-B)。
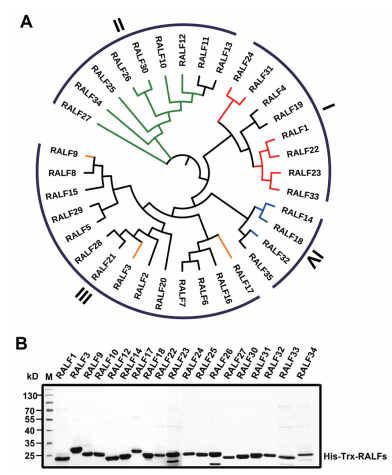
2.2 RALF抑制主根生长实验的分析RALF对主根生长的调控是其活性的主要体现指标之一。已有研究报道发现RALF1处理能够有效的抑制主根的生长,后续的研究发现RALF23同样也能够有效的抑制主根的生长。为了验证除RALF1和RALF23外的其他17种RALF是否都具有抑制根长的作用,我们用1 μmol/L RALF处理拟南芥野生型Col-0(WT)幼苗,发现所有RALF均能不同程度地对根的生长产生抑制(图 2)。从实验结果来看,不同的RALF对根长的抑制效果存在一定的差异,RALF1/23均能对根的生长产生抑制,其抑制率分别为26.42%和18.56%(图 2),该结论与前期研究报道的实验结论一致。
|
| 图 2 RALF对Col-0及fer-4主根生长的抑制 将消毒好的Col-0与fer-4种子点种于1/2 MS固体培养基上,4 d后,将苗子移放到含有RALF小肽(1 μmol/L)的液体1/2 MS液体培养基中,正常生长3 d后进行根长统计。n > 40,数据以平均值±SD表示,统计学方法为one-way ANOVA,*P < 0.05,**P < 0.01,***P < 0.001,ns表示无显著性差异。实验至少重复3次以上,结论一致 |
RALF27对根生长的抑制作用相对于其它RALF最低,只有7.46%的相对抑制率。而RALF34的相对抑制率达到了26.63%,对根的抑制作用最明显。以上实验结果表明,这19种RALF均能对根的生长产生抑制,不同的RALF对根的抑制作用存在一定的差异。
同时,进一步探究在fer-4背景下,不同RALF处理对根生长的抑制作用。fer-4为T-DNA插入到FER胞外域后得到的突变体植株,相比于野生型,其植株矮小,根毛缺失,表皮毛减少,并且结实率显著降低,fer-4突变体根长生长对RALF1和RALF23不敏感。fer-4实验结果表明,在fer-4背景下,RALF对根生长的抑制与WT存在差异。与前期研究的结论一致,RALF1和RALF23在fer-4背景下,和WT相比对根生长的抑制不敏感,RALF1抑制率为9.65%,RALF23抑制率为7.63%(图 2),表明这些RALF对根生长的抑制可能由FER介导。
而RALF34抑制率为25.82%,RALF10抑制率为25.34%,和对照WT的抑制率大体类似,表明这些RALF介导的对根生长的抑制可能由其它受体激酶介导。以上实验结果表明,RALF可能与其特异特定受体蛋白结合介导对主根生长的抑制。
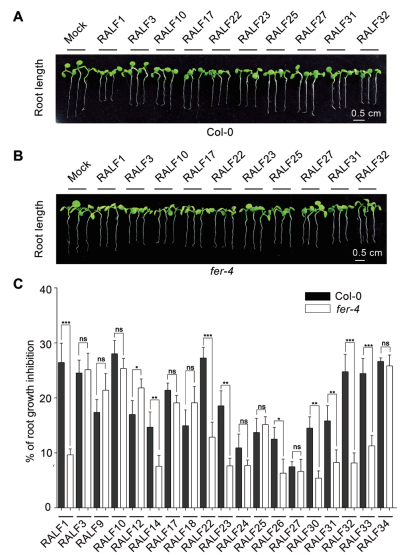
2.3 RALF诱导MAPK磷酸化的分析RALF对丝裂原活化蛋白激酶(MAPK)磷酸化水平的调控是其生物活性的另外一个体现指标。活性氧迸发(ROS burst)和MAPK磷酸化是病原体触发的植物细胞免疫(PTI)引起的两个早期事件。为研究RALF是否也参与到植物细胞免疫的信号通路,我们以MAPK磷酸化变化来验证RALF在植物细胞免疫调节中的作用。前期的研究表明,真菌内分泌的RALF类似小肽可激活MPK3/6的磷酸化。
基于此,本研究分别从每一大类中选取3个RALF进行MAPK磷酸化水平分析实验。实验结果(图 3)表明,RALF9/10/14/18/23/30/32/33/34处理Col-0幼苗5 min后,MPK3/6的磷酸化显著增强,RALF1/3在处理15 min后,MPK3/6的磷酸化显著增强,然而,随着处理时间的增加,MAPK磷酸化显著下降,表明RALF1/3/9/10/14/18/23/30/32/33/34可能参与到了由MAPK介导的植物细胞免疫,这种由RALF1/3/9/10/14/18/23/30/32/33/34参与引起的MAPK磷酸化是一种快速的响应机制。而RALF17对MPK3/6的磷酸化没有显著性的影响(图 3-B)。
|
| 图 3 RALF对MAPK磷酸化的影响 RALF引起Col-0的MAPK磷酸化反应,Col-0幼苗分别用A:RALF1、RALF23、RALF33;B:RALF3、RALF9、RALF17;C:RALF14、RALF18、RALF32和;D:RALF10、RALF30、RALF34处理5 min、15 min、30 min,随后进行MAPK磷酸化检测。每组实验均重复3次,结论一致 |
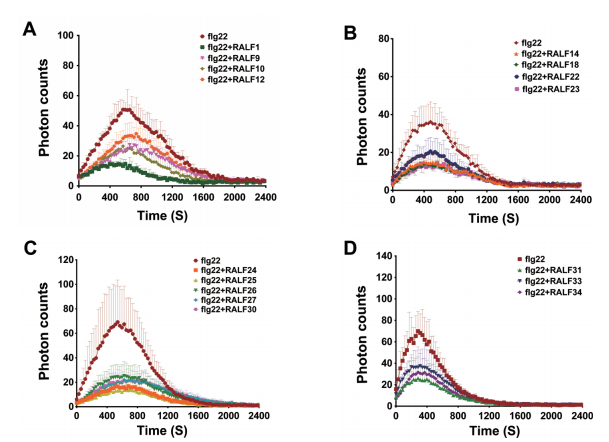
RALF可以通过调节flg22诱导的ROS来调控植物的免疫系统,是RALF活性的一个重要指标。ROS,作为一种第二信使分子,参与到对植物细胞免疫的响应,病原体分子模式诱导植物细胞内ROS的释放。
基于此,本研究想进一步探索不同的RALF对病原体分子模式引起的ROS的释放的影响。在含有flg22的反应体系中添加不同RALF,探索RALF对flg22诱发的ROS释放的影响。实验结果(图 4)表明,分析的16种RALF(RALF1/9/10/12/14/18/22/23/24/25/26/27/30/31/33/34)均不同程度地抑制由flg22诱导的ROS的释放。表明其可能在植物细胞免疫中起负调控作用。
|
| 图 4 RALF调控flg22触发的ROS释放 A-D:Col-0叶片100 nmol/L flg22与0.1 μmol/L RALF共同处理诱发ROS的产生后进行ROS释放量的测定。每组共4个平行,用时约40 min。ROS的释放用平均值±SD表示,统计方法为one-way ANOVA,P < 0.05。每组实验均重复3次,结论一致 |
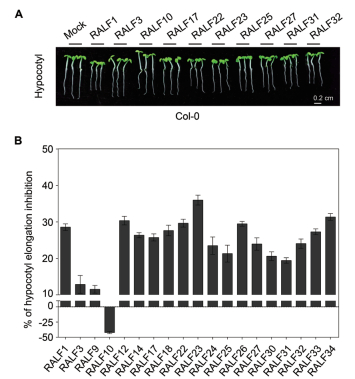
FER突变后,在黑暗生长情况下,下胚轴变短,这暗示RALF可能参与下胚轴细胞的伸长调控过程,但是目前尚未有相关研究报道RALF对下胚轴伸长的作用。基于此,本研究想研究这19个不同的RALF对下胚轴伸长的影响。分别用1 μmol/L不同的RALF处理拟南芥幼苗,置于黑暗培养箱培养4 d后观察实验结果,实验结果(图 5)表明,不同的RALF对下胚轴的抑制存在极大的差异,与对照组相比,RALF3和RALF9的抑制作用相对不明显,抑制率分别为12.86%和11.51%。RALF10则是促进下胚轴的伸长,其促进伸长的百分比为41.99%,其它RALF则均能显著的抑制下胚轴的伸长。
|
| 图 5 RALF对Col-0下胚轴伸长的影响 将消毒好的Col-0种子点种于1/2 MS固体培养基上,放置在22℃长日照培养箱中,使其生长4 d,然后将苗子移放到含有RALF小肽(1 μmol/L)的液体1/2 MS液体培养基中,黑暗生长四天后进行下胚轴统计,n > 40,数据以平均值±SD表示。实验至少重复三次以上,结论一致 |
该实验结果表明,不同的RALF参与对下胚轴伸长抑制存在功能性的差异,大部分的RALF能够显著抑制下胚轴伸长,但也有少部分的RALF则能促进下胚轴的伸长,这暗示不同RALF的功能存在组织差异性。
3 讨论RALF小肽最早从烟草中发现并提取,它可以引起烟草细胞悬浮液的碱化、并可以激活体内的MAPK反应、引起Ca2+流的上升。同时,RALF同源物也从多个物种中被分离出来,如,双子叶植物,单子叶植物,裸子植物等[5]。RALF作为进化保守的多肽分子,以基因家族形式存在,在植物不同器官的表达模式存在差异,这暗示RALF不同成员之间功能可能具有功能特异性,可能影响特定的信号通路。本研究的实验结果发现,不同的RALF对下胚轴细胞的伸长过程起到截然相反的作用,RALF1,23等抑制下胚轴细胞伸长,而RALF10则促进下胚轴细胞伸长。最近的研究发现,RALF 4和RALF19作为BUP1/2和AUX1/2的配体,在维持花粉管的稳定中起着非常重要的作用,当花粉管靠近珠孔时,从雌配子体释放的RALF34与RALF4/19竞争BUP1/2和ANXUR1/2受体而干扰其信号,从而导致花粉管的破裂,释放精细胞完成双受精[12]。这让我们猜想到,FER在不同组织中其功能存在差异是否也涉及类似具有不同功能的RALF成员之间的竞争结合,最终产生截然相反的功能。基于以上的研究,我们有理由猜测FER在不同部位具有相反功能的原因之一可能是由于FER与不同的RALF小肽结合从而引起下游不同的生物学响应。
基于蛋白一级结构序列进行分类的RALF成员在参与到相同的信号响应过程中存在很大差异,这表明,对RALF多肽的生物学功能研究从一级结构层面进行研究的策略还需要调整,如需要更多结构学研究来系统阐述一级序列相似,而功能不同的RALF成员是否具有结构差异性。此外,RALF多肽具有生物学活性需要其从前体肽切割释放出成熟的功能性多肽,而这种从前体肽到成熟肽的加工过程需要特异的蛋白酶的参与和介导,是否存在除了S1P之外的的蛋白酶对不同的RALF前体肽进行切割,从而产生相应的生物学功能,这可能是今后需要关注和研究的方向。为了更为具体的研究不同RALF多肽的生物学功能,建议可以从基因敲除的层面入手,对特定的RALF进行特定的研究,从而从遗传学的角度探明不同RALF的生物学功能。目前我们的工作还不完善,更多更深入的研究还需要开展,同时需要把重点落实到遗传学层面,从而确认不同RALF的生物学功能和生物学意义。此外,关于不同RALF调控不同信号转导的研究也是今后的研究方向和重点。
4 结论本研究以模式生物拟南芥为研究材料,分别克隆出了19个RALF多肽,发现19个RALF均能抑制拟南芥主根的生长;RALF1/3/9/10/14/18/23/30/32/33/34影响MAPK的磷酸化变化;RALF1/9/10/12/14/18/22/23/24/25/26/27/30/31/33/34抑制由flg22引起的ROS的释放。下胚轴伸长抑制实验,发现RALF10促进下胚轴的伸长,推测RALF10可能通过不同于其他RALF的信号通路参与到对下胚轴伸长的调控。
| [1] |
Ryan CA, Pearce G, Scheer J, et al. Polypeptide hormones[J]. The Plant Cell, 2002, 14: S251-S264. DOI:10.1105/tpc.010484 |
| [2] |
Pearce G, Moura DS, Stratmann J, et al. RALF, a 5-kDa ubiquitous polypeptide in plants, arrests root growth and development[J]. Proceedings of the National Academy of Sciences, 2001, 98(22): 12843-12847. DOI:10.1073/pnas.201416998 |
| [3] |
Matos JL, Fiori CS, Silva-Filho MC, et al. A conserved dibasic site is essential for correct processing of the peptide hormone RALF1 in Arabidopsis thaliana[J]. Federation of European Biochemical Societies Letters, 2008, 582(23-24): 3343-3347. DOI:10.1016/j.febslet.2008.08.025 |
| [4] |
Do Canto AM, Ceciliato PHO, Ribeiro B, et al. Biological activity of nine recombinant RALF peptides: implications for their perception and function in Arabidopsis[J]. Plant Physiology and Biochemistry, 2014, 75: 45-54. DOI:10.1016/j.plaphy.2013.12.005 |
| [5] |
Cao J, Shi F. Evolution of the RALF gene family in plants: gene duplication and selection patterns[J]. Evolutionary Bioinformatics, 2012, 8: 271-292. |
| [6] |
Wu JS, Kurten EL, Monshausen G, et al. NaRALF, a peptide signal essential for the regulation of root hair tip apoplastic pH in Nicotiana attenuata, is required for root hair development and plant growth in native soils[J]. The Plant Journal, 2007, 52(5): 877-890. DOI:10.1111/tpj.2007.52.issue-5 |
| [7] |
Srivastava R, Liu JX, Guo H, et al. Regulation and processing of a plant peptide hormone, RALF23, in Arabidopsis[J]. The Plant Journal, 2009, 59(6): 930-939. DOI:10.1111/tpj.2009.59.issue-6 |
| [8] |
Campbell L, Turner SR. A comprehensive analysis of RALF proteins in green plants suggests there are two distinct functional groups[J]. Frontiers in Plant Science, 2017, 8: 37. |
| [9] |
Pearce G, Yamaguchi Y, Munske G, et al. Structure-activity studies of RALF, Rapid Alkalinization Factor, reveal an essential-YISY-motif[J]. Peptides, 2010, 31(11): 1973-1977. DOI:10.1016/j.peptides.2010.08.012 |
| [10] |
The receptor kinase FER is a RALF-regulated scaffold controlling plant immune signaling[J]. Science, 2017, 355(6322): 287-289. http://www.ncbi.nlm.nih.gov/pubmed/28104890
|
| [11] |
Mecchia M A, Santos-Fernandez G, Duss N N, et al. RALF4/19 peptides interact with LRX proteins to control pollen tube growth in Arabidopsis[J]. Science, 2017, 358(6370): 1600-1603. DOI:10.1126/science.aao5467 |
| [12] |
Ge Z, Bergonci T, Zhao Y, et al. Arabidopsis pollen tube integrity and sperm release are regulated by RALF-mediated signaling[J]. Science, 2017, 358(6370): 1596-1600. DOI:10.1126/science.aao3642 |
| [13] |
Haruta M, Sabat G, Stecker K, et al. A peptide hormone and its receptor protein kinase regulate plant cell expansion[J]. Science, 2014, 343(6169): 408-411. DOI:10.1126/science.1244454 |
| [14] |
Du CQ, Li XS, Chen J, et al. Receptor kinase complex transmits RALF peptide signal to inhibit root growth in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 2016, 113(51): E8326-E8334. DOI:10.1073/pnas.1609626113 |
| [15] |
Chen J, Yu F, Liu Y, et al. FERONIA interacts with ABI2-type phosphatases to facilitate signaling cross-talk between abscisic acid and RALF peptide in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 2016, 113(37): E5519-E5527. DOI:10.1073/pnas.1608449113 |
| [16] |
Tang DZ, Wang GX, Zhou JM. Receptor kinases in plant-pathogen interactions: more than pattern recognition[J]. The Plant Cell, 2017, 29(4): 618-637. DOI:10.1105/tpc.16.00891 |
| [17] |
Thynne E, Saur IML, Simbaqueba J, et al. Fungal phytopathogens encode functional homologues of plant rapid alkalinization factor(RALF)peptides[J]. Molecular Plant Pathology, 2017, 18(6): 811-824. DOI:10.1111/mpp.2017.18.issue-6 |
| [18] |
Henzler T, Steudle E. Transport and metabolic degradation of hydrogen peroxide in Chara corallina: model calculations and measurements with the pressure probe suggest transport of H2O2 across water channels[J]. Journal of Experimental Botany, 2000, 51(353): 2053-2066. DOI:10.1093/jexbot/51.353.2053 |
| [19] |
Mori IC, Schroeder JI. Reactive oxygen species activation of plant Ca2+ channels. A signaling mechanism in polar growth, hormone transduction, stress signaling, and hypothetically mechanotransduction[J]. Plant Physiology, 2004, 135(2): 702-708. DOI:10.1104/pp.104.042069 |
| [20] |
Deslauriers SD, Larsen PB. FERONIA is a key modulator of brassinosteroid and ethylene responsiveness in Arabidopsis hypocotyls[J]. Molecular Plant, 2010, 3(3): 626-640. DOI:10.1093/mp/ssq015 |
| [21] |
Duan QH, Kita D, Li C, et al. FERONIA receptor-like kinase regulates RHO GTPase signaling of root hair development[J]. Proceedings of the National Academy of Sciences, 2010, 107(41): 17821-17826. DOI:10.1073/pnas.1005366107 |