人工湿地(Constructed wetland, CW)是将污水、污泥有控制的投配到经人工建造的湿地上, 污水与污泥在沿一定方向流动的过程中, 利用土壤、人工介质、植物、微生物的物理、化学及生物三重协同作用, 对污水、污泥进行处理的一种技术。1987年, Brian Mackney首次提出了“CW”的概念[1], 到了20世纪90年代, 欧美等发达国家已经将这项技术广泛应用于各个领域[2]。CW由植物部分、基质部分、污水部分和微生物部分组成, 植物部分可以吸收富集污水中的污染物, 植物根际的分泌物也可为微生物提供一个良好的生存环境; 基质部分具有良好的透水性, 吸附性和稳定性, 对污水有过滤作用, 同时可以固定植物根际为微生物提供附着场所; 外界各种待处理的污水是污水部分; 微生物部分包括基质中存在的大量好氧微生物、厌氧微生物以及兼性厌氧微生物, 其通过复杂的代谢过程和相互作用降解污水中的污染物。CW通过物理(基质吸附、过滤)-化学(基质内发生的各种氧化还原反应)-生物(微生物降解)三方面相互协同作用对污水进行综合处理[3-4]。由于这项技术在土建安装, 运行, 维护方面成本较低, 污水处理效果明显。近些年来受到越来越多的关注[5]。
近几年, 微生物燃料电池技术(Microbial fuel cell, MFC)也受到广泛的关注。英国植物学家Potter[6]于1911年首次提出MFC的概念。MFC由反应器、阴极、阳极、离子交换膜和外电路构成。产电微生物在阳极富集, 氧化有机底物产生电子并将电子传递到胞外。电子最终汇集到阳极上, 通过外电路传递到阴极。电子与氧气、氢离子在阴极发生还原反应最终生成水, 完成氧化还原反应产生电流。我国在20世纪90年代也开始致力于MFC的研发, 在产电和污水处理方面都取得了很大的进步。
随着CW与MFC的蓬勃发展, 人工湿地型微生物燃料电池耦合系统(Microbial fuel cell coupled constructed wetlands, CW-MFC)也应运而生。印度的Yadav等[7]最早对CW-MFC进行了报导, 他们在垂直流CW中加入了石墨电极, 研究其污水处理效果和产电能力。垂直流CW表层为有氧环境, 底层基质为厌氧环境, 这恰好满足了MFC阴极和阳极所需的环境条件[7]。与此同时, CW的基质和污水中含有大量的微生物, 为MFC提供了充足的微生物来源。CW-MFC作为一种新兴的利用污水产电的技术, 具有广泛地应用前景和开发价值。本文综述了电极材料、水利条件、湿地植物以及微生物等影响因素对CW-MFC污水处理能力和产电能力的影响。分析了这一新兴技术的优点与不足之处, 以及探讨了该技术将来的研究方向, 以期为CW-MFC的实际应用提供理论依据。
1 CW-MFC的污水处理能力 1.1 水力条件对污水处理能力的影响CW-MFC根据不同的水力条件可以分为水平流人工湿地型微生物燃料电池(Horizontal flow-microb-ial fuel cell coupled constructed wetlands, HF-CW-MFC)和垂直流人工湿地型微生物燃料电池(Vertical flow-microbial fuel cell coupled constructed wetlands, VF-CW-MFC)。在Villasenor等[8]构建的可循环HF-CW-MFC中, 利用土壤代替玻璃网作为离子交换膜将阴阳极隔开, 使污水可以在阴阳极之间循环从而获得优秀的COD去除率。Doherty等[9]也利用HF-CW-MFC获得相似的COD去除率。VF-CW-MFC根据进水方式可以分为升流式、降流式和升流-降流式。CW-MFC在升流式的进水条件下可以获得较高的有机物负载率(Organic Loading rate, OLR)[10]和氧化还原梯度(Redox gradient, RG)[11], 所以在CW-MFC的研究中通常选用升流式作为进水方式。Doherty等[9]在研究不同的进水方式对CW-MFC去污能力的影响时发现, 升流-降流式CW-MFC对氨氮去除率高达75%, 但对化学需氧量(Chemical oxygen demand, COD)的去除率只有64%(升流式部分去除率为84%, 降流式部分为51%), 低于上流式CW-MFC(COD去除率为80%)。CW-MFC的污水处理能力同时也受水力停留时间(Hydraulic retention time, HRT)的影响。国内外研究人员在不同HRT下对污水中污染物去除率进行检测, 得到最佳的HRT为2-3 d。Fang等[12]在偶氮染料脱色研究中发现, HRT在为3 d时, 阳极室的脱色率可达到65.7%, HRT为1.5 d时, COD去除率可达到79.2%。Villasenor等[13]在HF-CW-MFC处理养猪废水的研究中发现, 当进水COD为560 mg/L、HRT为3.2 d时, COD去除率可达到90%-95%。
1.2 电极材料对污水处理能力的影响电极是CW-MFC的重要组成部分。电极材料不仅影响CW-MFC的产电能力, 对CW-MFC的污水处理能力也有很大影响。微生物在CW-MFC阳极发生催化反应, 因此阳极材料需要具有耐腐蚀、电导率高及比表面积大等特性。湿地植物需要种植在CW-MFC阴极, 阴极材料需具有优良的固定性。由于CW-MFC主要通过阴阳极对污水进行过滤, 所以电极材料还需具有良好的孔隙率和吸附性, 并且不易堵塞。常见的电极材料包括石墨毡(Graphite felt, GF)、石墨棒(Graphite rod, GR)、碳纤维毡(Carbon fiber felt, CFF)、活性炭颗粒(Active carbon granule, ACG)、泡沫镍(Foamed nickel, FN)、不锈钢网(Stainless steel wire, SSM)等。Wang等[14]选用了CFF、FN、SSM和GR四种电极材料进行实验验证最佳COD去除率与最大输出电压。实验表明, 以CFF和GR作为电极材料, 进水COD为200 mg/L时, 最大COD去除率为52.5%和49.8%。以CFF为电极可达到最大输出电压117 mV。进一步研究发现, 当CW-MFC以ACG-SSM复合电极为电极材料时具有优秀的去污效果。Xu等[15]研究不同比例ACG-SSM复合电极材料对CW-MFC电池性能的影响。当活性炭比例为2%, COD、总氮(TN)、氨氮(NH4-N)的去除率最高, 当活性炭比例提高到10%时, 可达到最大电功率密度87.79 mW/m2。将ACG-SSM复合电极嵌入CW-MFC基质中可以明显提高对有机污染物的去除率[16]。因此, 以复合材料为电极材料将会成为今后的一种发展方向。
1.3 湿地植物对污水处理能力的影响CW-MFC根据湿地植物根际位置可以分为两类, 一类是植物根际在CW-MFC的阴极, 湿地植物进行光合作用释放氧气, 为阴极提供了充足的氧气, 有利于生物阴极的形成[17]。同时湿地植物的根际会分泌一定量的有机物, 消耗一部分阴极用于还原反应的溶解氧, 但整体不会对生物阴极造成消极影响。另一类是植物根际在CW-MFC的阳极, 湿地植物在生长过程中根际会分泌一些有机物, 阳极微生物可以利用这些有机物进行代谢反应和产电。Liu等[18]在研究CW-MFC产甲烷和产电量关系中发现, 当通入的合成污水中葡萄糖浓度为0时, CW-MFC体系仍可以产生少量的甲烷和电流, 说明产电微生物可以利用植物根际分泌的有机物产电。无论湿地植物是在CW-MFC阴极还是阳极, 植物根际都可吸收污水中少量的污染物(如N、P), 同时在一定程度上提高COD去除率。Fang等[19]在有无植物的CW-MFC对染料ABRX3脱色实验中发现, 种植植物的CW-MFC比无植物的CW-MFC的COD消除率高5%左右, 阳极为COD去除和染料污水脱色的主要区域。
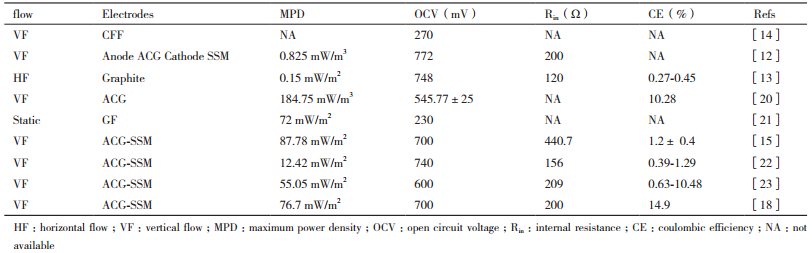
2 CW-MFC的产电能力 2.1 电极材料对CW-MFC产电性能的影响不同的电极材料具有不同的电导率、吸附性、内阻, 这些因素都会对CW-MFC的产电性能产生影响。寻找廉价并且能高效收集电子的电极材料是当下主要任务。钛电极的电导性优于活性炭或石墨电极, 但由于其吸附性差, 不易固定阳极微生物, 所以CW-MFC很少使用金属作为电极材料。ACG-SSM复合电极可利用活性碳的高吸附性固定阳极微生物, 通过外部的SSM传导电子, 使CW-MFC获得较大电能输出。表 1总结了近几年, 不同电极材料对CW-MFC产电性能的影响, 包括最大开路电压、最大功率密度, 内阻、库伦效率。从表 1中可以看出, 在水力条件为VF、电极材料为ACG-SSM和阴极曝气[20]的条件下, CW-MFC可获得较大的功率密度。另一方面, 研究人员将生物工程技术应用于阳极生物膜上来提高电极的电导率[24]。Fu等[25]使用氧化铁(Zhou等[26]使用铁氰化物)改造电池阳极, 提高了CW-MFC的产电效率。利用生物工程技术来改造CW-MFC或MFC电极将会是一个具有发展前景的研究方向。
COD浓度是检测污水时的一个重要指标, 在污水处理过程中具有重要的意义。与此同时, 不同COD浓度的污水也会影响CW-MFC的产电性能。CW-MFC处理的污水一般分为养猪污水、城市污水、染料污水和合成污水等。前三类污水均属于自然条件下生成的污水, 成分复杂, 不易做定量分析。研究人员一般使用合成污水研究COD浓度对CW-MFC产电性能的影响。阳极微生物可以利用污水中的有机物进行呼吸代谢和产电。有机物是产电过程中不可缺少的部分, 但并非含量越高越有利于产电。Corbella等[27]使用不同COD浓度的醋酸盐溶液作为营养物, 研究CW-MFC输出电压的变化情况。当COD浓度为0-500 mg/L时, 电压为101.99±7.42到631.74±7.41 mV, 存在线性关系y=0.0828+1.2E-03x(R2 = 0.9 710);当COD浓度为500-1 000 mg/L时, 电压为631.74±7.41到668.46±0.01 mV, y=0.5997+7E-05x(R2 = 0.924 5)。COD浓度过高时, 多余的有机物会消耗阴极的溶解氧, 同时也会造成阴极区域滋生大量的异养微生物, 限制了电极上反应物与产物之间的相互传递[28]。当COD浓度为500-600 mg/L时, 可达到最佳产电效益。所以当利用过高COD浓度污水进行产电研究时, 应适当稀释污水, 以确保最佳产电效果。
CW-MFC对染料污水具有极佳的处理效果, 脱色率可达到90%以上[9]。污水中染料与有机物比例也会影响CW-MFC的产电性能。Fang等[12]研究发现, 将染料污水中ABRX3(一种偶氮染料)的比例从10%提高到90%, 功率密度从0.455 W/m3下降到0.138 W/m3。由于ABRX3含量增加, 产电微生物可利用的葡萄糖含量降低, 产电量下降。与此同时, 偶氮染料的脱色过程消耗大量电子, 也会导致功率密度下降。
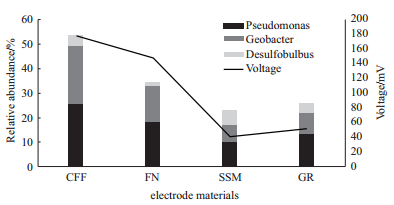
2.3 微生物对CW-MFC产电性能的影响在CW-MFC中, 阳极产电微生物氧化污水中的有机物产生电子并通过电子传递链传递到胞外, 电子通过直接传递或中介体传递的方式传递到电极上产生电流。在该过程中, 产电微生物氧化有机物降低污水的COD浓度, 同时降解污水中其他污染物(NO3-N、NH4-N、PO4-3等)。在降解过程中产生的中间代谢产物又可作为电子传递的中介体或受体[29], 进一步促进产电。微生物在CW-MFC的产电过程中扮演十分重要的角色。本实验团队主要从事MFC、CW-MFC阴阳极微生物多样性研究[30], 通过改善微生物群落结构提高其产电能力和污水处理能力。近几年来研究发现, CW-MFC阴阳极微生物群落结构存在明显的差异。表 2汇总了研究人员利用高通量测序技术对CW-MFC阴阳极产电微生物种类的研究。从表 2中可以看出, 阳极和阴极中存在的已被验证产的电微生物种类相似, 主要为地杆菌属(Geobacter)、脱硫叶菌属(Desulfobulbus)、假单胞菌属(Pseudomona)等, 但阳极产电微生物的丰度却远远高于阴极[31-32]。在门水平上, CW-MFC中产电微生物主要分布在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)。在科水平上, 梭菌科(Clostridiaceae)和疣微菌科(Ruminococcaceae)可以将植物死根中的纤维素降解为脂肪酸作为电子受体, 促进CW-MFC产电[35]。δ变形菌纲(Deltaproteobacteria)地杆菌科(Geobacteraceae)微生物是MFC中常见的产电微生物, 对MFC产电性能有很重要的影响[36]。在属水平上, 地杆菌属(Geobacter)、脱硫叶菌属(Desulfobulbus)、假单胞菌属(Pseudomona)、脱硫弧菌属(Desulfovibrio)等都是CW-MFC中常见的产电微生物。Desulfobulbus在阳极厌氧条件下以乳酸盐和丙酸盐为碳源氧化产生电子[37]。Pseudomona在阴极有氧条件下分泌电子中介体绿脓菌素, 提高电子从胞外传递到电极的能力。另一方面, 许多外界因素(如电极材料、植物种类、COD浓度等)都会影响阳极微生物群落结构, 进而影响产电。图 1为不同电极材料对阳极产电微生物相对丰度及产电影响[14]。从图 1中可以看出, 不同电极材料中产电微生物的相对丰度对产电效率有明显的影响。
氧化还原电位梯度是影响CW-MFC产电性能的重要因素。在CW-MFC中电子从低的氧化还原电位向高的氧化还原电位方向移动形成电流。因此, 阴阳极之间存在的氧化还原电位梯度的大小直接影响其产电性能的好坏。Corbella等[27]研究发现, 传统的连续流CW的表面与底部存在的最大的氧化还原电位梯度为407.4 mV。而未种植植物的CW氧化还原电位梯度为401 mV, 非连续流的CW氧化还原电位梯度则为326.2 mV。由此可见, 种植湿地植物与连续的进水方式都有利于增加CW的氧化还原电位梯度。
在CW-MFC运行过程中, 外部条件改变造成CW-MFC内部氧化还原条件改变进而导致产电性能的改变。这些外部条件除了上文提到的湿地植物和进水方式外, 还包括电极位置和水力条件。电极位置和水力条件改变阴阳极氧化还原电位梯度的根本原因在于改变阴阳极溶解氧含量(Dissolved oxygen, DO)。在Liu等[23]的升流式CW-MFC的研究中, SSM电极放置于水面下2.5 cm处, DO值仅有0.68 mg /L, 平均电流密度为14.65 mA /m2。而将SSM提高到CW-MFC表面时, DO值提高到3.25 mg /L, 平均电流密度提高到29.36 mA /m2。Doherty等[9]研究发现, 升流-降流式的CW-MFC比升流式CW-MFC功率密度提高了70%(0.268 W/m3), 内阻降低了60%(300Ω)。在升流-降流的水力条件下, 阴极部分采用降流式提高了阴极的DO值, 增加阴阳极氧化还原电位梯度, 从而提高产电效率。
3 CW-MFC面临的挑战和发展前景尽管CW-MFC兼具了MFC的产电能力和CW的污水处理能力。但研究表明, CW-MFC实际产生的功率密度总体低于传统MFC。其原因主要包括以下几点:(1)CW-MFC的电极镶嵌在CW内部, 造成电极距离过大和电极有效面积与反应器体积比过小。简单增加电极面积又会造成欧姆电阻增加。同时水位高度与基质材料也会影响内阻[39]。(2)CW-MFC的净能量回收率(Net energy recovery, NER)比传统MFC低, 更比有机物通过氧化还原反应生成H2O和CO2所产生的能量低2个数量级[39]。(3)CW-MFC在去污的同时会产生多种代谢产物, 这些代谢产物也会影响产电。Liu等[22]研究发现, 在CW-MFC运行过程中, 湿地植物会通过根际直接释放或植物释放两种方式释放CH4, 根际直接释放的CH4会消耗系统中的电子, 使产电量下降。(4)微生物对CW-MFC的产电性能有重要的影响。传统MFC可以在一定程度上控制阴阳极的微生物群落结构, 有效优化产电性能。但CW-MFC实质仍是一个CW系统, 内部微生物群落结构无法有效控制, 许多异养非产电微生物会消耗大量能量, 造成CW-MFC产电效率低下。
尽管CW-MFC存在一些不足之处, 但仍具有良好的发展前景。近几年来, 研究人员开始尝试在CW-MFC系统上耦合其他系统来提高产电性能和污水处理能力。Zou等[40]尝试将电解槽(electrolytic cell, EC)和CW-MFC耦合在一起, 提高对甲基红(methyl red, MR)的去除能力和产电能力。实验表明, MR的脱色率高达100%, COD去除率也达到89.3%, 输出电压平均值为0.56V。另一方面, CW-MFC中产电微生物的生理代谢活动会因外部环境的改变而改变, 从而引起输出电压/电流的变化。根据这一原理, CW-MFC也可应用于生物传感器领域。Xu等[28]发现CW-MFC的输出电压与废水中的COD值存在一定的线性关系, 利用这一原理制作CW-MFC生物传感器来检测污水中的COD值。
CW-MFC在污水脱氮、脱色方面也有着优秀的表现。Wang等[33]研制的CW-MFC在中性PH和HRT为24 h的条件下, NO3-N去除率达到80.7%。CW-MFC的脱氮过程主要利用反硝化细菌的反硝化作用。反硝化细菌接收阴极的电子, 将NO3-还原为N2或N20, 去除污水中的硝酸盐[41]。偶氮染料污水是一种常见的工业污水, 其主要成分-N=N-有着牢固的化学键, 不易被打断, 具有抗生物降解的特性。Dos等[42]研究发现-N=N-可以在厌氧条件下作为电子受体被降解。CW-MFC阳极可以为-N=N-的降解提供电子和厌氧条件, 所以CW-MFC对偶氮染料废水有优秀的去除效率。Fang等[12]利用CW-MFC对偶氮染料污水进行处理, 脱色率高达95.6%。
4 展望CW-MFC作为一种可以在处理污水的同时产生电能新兴设备, 具有广阔的发展前景。尽管仍存在诸多问题, 但研究人员仍然不断通过优化电极材料、研制新型反应器、控制进水负荷和改善水力条件等方法来不断改善产电和去污能力。相信通过不断的改进、完善, CW-MFC终将在实际生产中发挥重要的作用, 缓解社会面临的水体污染和能源短缺两大核心问题。另外, 可以利用高通量测序技术检测CW-MFC内微生物群落结构, 有利于我们更好地了解CW-MFC内部微生物的群落结构、代谢途径以及发现更多产电微生物。
| [1] |
Cooper PF, Boon AG.The use of Phragmites for wastewater treatment by the root-zone method: the UK approach[M]//Reddy KR, Smith WH.In Aquatic Plants for Water Treatment and Resource Recovery.Orlando: Magnolia Publishing Inc, 1987: 471-478.
|
| [2] |
Hallberg KB, Johnson DB. Biological manganese removal from acid mine drainage in constructed wetlands and prototype bioreactors[J]. Sci Total Environ, 2005, 338(1-2): 115-124. DOI:10.1016/j.scitotenv.2004.09.011 |
| [3] |
Vymazal J. Constructed wetlands for treatment of industrial wastewaters:a review[J]. Ecological Engineering, 2014, 73: 724-751. DOI:10.1016/j.ecoleng.2014.09.034 |
| [4] |
Wu H, Zhang J, Ngo HH, et al. A review on the sustainability of constructed wetlands for wastewater treatment:design and operation[J]. Bioresource Technology, 2015, 175: 594-601. DOI:10.1016/j.biortech.2014.10.068 |
| [5] |
Ghrabi A, Bousselmi L, Masi F, et al. Constructed wetland as a Low cost and sustainable solution for wastewater treatment adapted to rural settlements:the chorfech wastewater treatment pilot plant[J]. Water Science and Technology, 2011, 63(12): 3006-3012. DOI:10.2166/wst.2011.563 |
| [6] |
Potter MC. Electrical effects accompanying the decomposition of organic compounds[J]. Proceedings of the Royal Society of London, 1911, 84(571): 260-276. DOI:10.1098/rspb.1911.0073 |
| [7] |
Yadav AK, Dash P, Mohanty A, et al. Performance assessment of innovative constructed wetland-microbial fuel cell for electricity production and dye removal[J]. Ecological Engineering, 2012, 47: 126-131. DOI:10.1016/j.ecoleng.2012.06.029 |
| [8] |
Villasenor J, Capilla P, Rodrigo MA, et al. Operation of a horizontal subsurface flow constructed wetland e microbial fuel cell treating wastewater under different organic loading rates[J]. Water Research, 2013, 47: 6731-6738. DOI:10.1016/j.watres.2013.09.005 |
| [9] |
Doherty L, Zhao Y, Zhao X, et al. Nutrient and organics removal from swine slurry with simultaneous electricity generation in an alum sludge-based constructed wetland incorporating microbial fuel cell technology[J]. Chemical Engineering Journal, 2015, 266: 74-81. DOI:10.1016/j.cej.2014.12.063 |
| [10] |
Lee Y, Oa SW. High speed municipal sewage treatment in microbial fuel cell integrated with anaerobic membrane filtration system[J]. Water Science and Technology, 2014, 69(12): 2548-2553. DOI:10.2166/wst.2014.179 |
| [11] |
Mohanakrishna G, Abu-Reesh IM, AL-Raoush RI. Biological anodic oxidation and cathodic reduction reactions for improved bioelectrochemical treatment of petroleum refinery wastewater[J]. Journal of Cleaner Production, 2018, 190: 44-52. DOI:10.1016/j.jclepro.2018.04.141 |
| [12] |
Fang Z, Song HL, Cang N, et al. Electricity production from azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions[J]. Biosens Bioelectron, 2015, 68: 135-141. DOI:10.1016/j.bios.2014.12.047 |
| [13] |
Villasenor J, Capilla P, Rodrigo MA, et al. Operation of a horizontal subsurface flow constructed wetland-microbial fuel cell treating wastewater under different organic loading rates[J]. Water Research, 2013, 47(17): 6731-6738. DOI:10.1016/j.watres.2013.09.005 |
| [14] |
Wang J, Song X, Wang Y, et al. Microbial community structure of different electrode materials in constructed wetland incorporating microbial fuel cell[J]. Bioresource Technology, 2016, 221: 697-702. DOI:10.1016/j.biortech.2016.09.116 |
| [15] |
Xu L, Zhao Y, Doherty L, et al. Promoting the bio-cathode formation of a constructed wetland-microbial fuel cell by using powder activated carbon modified alum sludge in anode chamber[J]. Sci Rep, 2016, 6: 26514. DOI:10.1038/srep26514 |
| [16] |
Dordio AV, Carvalho AJP. Organic xenobiotics removal in constructed wetlands, with emphasis on the importance of the support matrix[J]. J Hazard Mater, 2013, 252: 272-292. |
| [17] |
Chen Z, Huang Y-C, Liang J-H, et al. A novel sediment microbial fuel cell with a biocathode in the rice rhizosphere[J]. Bioresource Technology, 2012, 108: 55-59. DOI:10.1016/j.biortech.2011.10.040 |
| [18] |
Liu S, Feng X, Li X. Bioelectrochemical approach for control of methane emission from wetlands[J]. Bioresource Technology, 2017, 241: 812-820. DOI:10.1016/j.biortech.2017.06.031 |
| [19] |
Fang Z, Song HL, Cang N, et al. Performance of microbial fuel cell coupled constructed wetland system for decolorization of azo dye and bioelectricity generation[J]. Bioresource Technology, 2013, 144: 165-171. DOI:10.1016/j.biortech.2013.06.073 |
| [20] |
Oon YL, Ong SA, Ho LN, et al. Role of macrophyte and effect of supplementary aeration in up-flow constructed wetland-microbial fuel cell for simultaneous wastewater treatment and energy recovery[J]. Bioresource Technology, 2017, 224: 265-275. DOI:10.1016/j.biortech.2016.10.079 |
| [21] |
Arends JBA, Speeckaert J, Blondeel E, et al. Greenhouse gas emissions from rice microcosms amended with a plant microbial fuel cell[J]. Appl Microbiol Biotechnol, 2014, 98(7): 3205-3217. DOI:10.1007/s00253-013-5328-5 |
| [22] |
Liu S, Song H, Li X, et al.Power generation enhancement by utilizing plant photosynthate in microbial fuel cell coupled constructed wetland system[J].International Journal Of Photoenergy, 2013.ID: 172010.
|
| [23] |
Liu S, Song H, Wei S, et al. Bio-cathode materials evaluation and configuration optimization for power output of vertical subsurface flow constructed wetland - microbial fuel cell systems[J]. Bioresource Technology, 2014, 166: 575-583. DOI:10.1016/j.biortech.2014.05.104 |
| [24] |
Leang C, Malvankar NS, Franks AE, et al. Engineering Geobacter sulfurreducens to produce a highly cohesive conductive matrix with enhanced capacity for current production[J]. Energy & Environmental Science, 2013, 6(6): 1901-1908. |
| [25] |
Fu Y, Xu Q, Zai X, et al. Low electrical potential anode modified with Fe/ferric oxide and its application in marine benthic microbial fuel cell with higher voltage and power output[J]. Applied Surface Science, 2014, 289: 472-477. DOI:10.1016/j.apsusc.2013.11.011 |
| [26] |
Zhou YL, Yang Y, Chen M, et al. To improve the performance of sediment microbial fuel cell through amending colloidal iron oxyhydroxide into freshwater sediments[J]. Bioresource Technology, 2014, 159: 232-239. DOI:10.1016/j.biortech.2014.02.082 |
| [27] |
Corbella C, Garfi M, Puigagut J. Vertical redox profiles in treatment wetlands as function of hydraulic regime and macrophytes presence:surveying the optimal scenario for microbial fuel cell implementation[J]. Sci Total Environ, 2014, 473: 751-751. |
| [28] |
Xu L, Zhao Y, Fan C, et al. First study to explore the feasibility of applying microbial fuel cells into constructed wetlands for cod monitoring[J]. Bioresource Technology, 2017, 243: 846-854. DOI:10.1016/j.biortech.2017.06.179 |
| [29] |
Freguia S, Rabaey K, Yuan Z, et al. Sequential anode-cathode configuration improves cathodic oxygen reduction and effluent quality of microbial fuel cells[J]. Water Research, 2008, 42(6-7): 1387-1396. DOI:10.1016/j.watres.2007.10.007 |
| [30] |
Wen HY, Wang GZ, Huang WM, et al. The influence of community structure of anode biofilms on microbial fuel cells bioelectricity generation using different inocula[J]. International Journal of Engineering Science and Generic Research, 2018, 4(2): 375-386. |
| [31] |
Wang J, Song X, Wang Y, et al. Bioenergy generation and rhizodegradation as affected by microbial community distribution in a coupled constructed wetland-microbial fuel cell system associated with three macrophytes[J]. Sci Total Environ, 2017, 607: 53-62. |
| [32] |
Jiang X, Shen J, Lou S, et al. Comprehensive comparison of bacterial communities in a membrane-free bioelectrochemical system for removing different mononitrophenols from wastewater[J]. Bioresource Technology, 2016, 216: 645-652. DOI:10.1016/j.biortech.2016.06.005 |
| [33] |
Wang J, Song X, Wang Y, et al. Nitrate removal and bioenergy production in constructed wetland coupled with microbial fuel cell:establishment of electrochemically active bacteria community on anode[J]. Bioresource Technology, 2016, 221: 358-365. DOI:10.1016/j.biortech.2016.09.054 |
| [34] |
Fang Z, Cao X, Li X, et al. Electrode and azo dye decolorization performance in microbial-fuel-cell-coupled constructed wetlands with different electrode size during long-term wastewater treatment[J]. Bioresource Technology, 2017, 238: 450-460. DOI:10.1016/j.biortech.2017.04.075 |
| [35] |
Fernando E, Keshavarz T, Kyazze G. Complete degradation of the azo dye acid orange-7 and bioelectricity generation in an integrated microbial fuel cell, aerobic two-stage bioreactor system in continuous flow mode at ambient temperature[J]. Bioresource Technology, 2014, 156: 155-162. DOI:10.1016/j.biortech.2014.01.036 |
| [36] |
Timmers RA, Strik DP, Hamelers HVM, et al. Long-term perform-ance of a plant microbial fuel cell with Spartina anglica[J]. Appl Microbiol Biotechnol, 2010, 86(3): 973-981. DOI:10.1007/s00253-010-2440-7 |
| [37] |
Lu L, Xing D, Ren ZJ. Microbial community structure accompanied with electricity production in a constructed wetland plant microbial fuel cell[J]. Bioresource Technology, 2015, 195: 115-121. DOI:10.1016/j.biortech.2015.05.098 |
| [38] |
Deng H, Wu YC, Zhang F, et al. Factors affecting the performance of singlechamber soil microbial fuel cells for power generation[J]. Pedosphere, 2014, 24(3): 330-338. DOI:10.1016/S1002-0160(14)60019-9 |
| [39] |
Li T, Fang Z, Yu R, et al. The performance of the microbial fuel cell-coupled constructed wetland system and the influence of the anode bacterial community[J]. Environmental Technology, 2016, 37(13): 1683-1692. DOI:10.1080/09593330.2015.1127292 |
| [40] |
Zou H, Wang Y. Azo dyes wastewater treatment and simultaneous electricity generation in a novel process of electrolysis cell combined with microbial fuel cell[J]. Bioresource Technology, 2017, 235: 167-175. DOI:10.1016/j.biortech.2017.03.093 |
| [41] |
Gregory KB, Bond DR, Lovley DR. Graphite electrodes as electron donors for anaerobic respiration[J]. Environmental Microbiology, 2004, 6(6): 596-604. DOI:10.1111/emi.2004.6.issue-6 |
| [42] |
Dos Santos, Cervantes AB, FJ Van Lier JB. Review paper on current technologies for decolourisation of textile wastewaters:Perspectives for anaerobic biotechnology[J]. Bioresource Technology, 2007, 98(12): 2369-2385. DOI:10.1016/j.biortech.2006.11.013 |