2. 农业农村部农业转基因生物安全评价(食用)重点实验室, 北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism(Food Safety), Ministry of Agriculture and Rural Affairs, Beijing 100083
点击化学(Click chemistry)又译为链接化学, 自2001年由化学家Sharpless, Kolb及Finn首次提出以来受到越来越多的关注, 其目的是开发一系列强大, 高度可靠, 具有选择性和模块化, 并通过碳-杂原子键(C-X-C)的连接能够快速合成有用的新化合物和组合化学库的反应[1-2]。点击反应的特点主要包括反应的起始原料和试剂易获取; 反应条件简单温和, 对氧、水不敏感; 只产生无害副产物(或者可以通过非色谱方法去除)等。此外, 点击反应的实现需要依靠高热力学驱动力(> 20 kcal/mol), 这也是用于识别点击反应的一大特征[1]。目前点击化学几乎渗透进现代化学、生物学的各个方面, 其应用范围从生物标记、物质表面功能化、生物分子的固定到药物化学、材料科学、高分子科学等, 促进了多领域交叉学科的快速发展。
点击反应的分类方式有多种, 按照加成反应的类型大致可分为四类, 包括环加成反应, 如1, 3-偶极-环加成反应(CuAAC)和狄尔斯-阿尔德(Diels-Alder)反应; 亲核开环反应, 如环氧化物、氮丙啶和环状硫酸酯等发生的反应; 非醇醛的羰基化反应, 如肟醚, 腙和芳香族杂环的形成; 碳-碳多重键加成反应, 如环氧化反应和二羟基化反应, 以及叠氮-膦的偶合反应, 如施陶丁格连接[3]。此外, 点击反应还可以简单分为金属催化的点击反应, 如CuAAC等, 以及无金属催化的点击反应, 如施陶丁格连接和环张力促进的叠氮-炔烃环加成反应(SPAAC)等。CuAAC又称为Husigen[3+2]叠氮-炔烃环加成反应, 是目前使用最广泛的点击反应。事实上, 无催化剂参与的环加成反应早在1963年已由Husigen发现, 但由于反应需要在高温高压下进行, 条件苛刻, 未被广泛利用。Sharpless及其团队将铜(I)作为催化剂参与反应后, 该反应可在温和的条件下进行, 同时提升了反应速率[3]。然而该反应的最大局限性在于无法用于生物学系统中, 因为铜(I)具有潜在的细胞毒性, 纯化较难, 体内摄入过量时会产生副作用引发疾病, 如肝炎、阿尔兹海默病及神经紊乱等[2]。因此, 现在无金属催化的点击反应, 如施陶丁格连接, 狄尔斯-阿尔德反应等, 受到越来越多的关注。
施陶丁格反应作为无金属催化的点击反应代表, 在各种复杂的生物系统以及体外检测中都扮演着重要的角色。目前, 施陶丁格连接已广泛应用于材料表面功能化、各种生物大分子的合成包括功能聚合物合成和树枝状化合物合成、生物标记如聚糖、脂类、DNA和蛋白质的标记等方面。同时, 在靶物质递送, 特别是药物的合成与递送及生物传感器等方面的应用具有较大发展空间。生物传感器是将固定化的生物敏感材料, 包括生物体本身, 如细胞、微生物、组织等以及生物成分, 如酶、蛋白质、DNA等作为识别原件, 利用其敏感特性与适当的化学检测器相结合产生的一种快速检测各种物理、化学和生物量的分析工具[4]。首先, 敏感材料能够特异地选择性识别目标物, 而检测器则是捕捉二者之间的作用过程, 随后将反应的程度转化成电信号, 通过对电信号的检测从而推算出目标物的量[4]。多种点击反应已广泛应用于生物传感器中, 从而实现其功能的多样化。因此, 本文主要围绕无金属催化的点击化学反应——施陶丁格连接进行综述, 详细介绍了施陶丁格连接的反应机理、影响反应动力学、连接产率以及反应进程的多种因素, 及其介导的生物标记技术。在此基础上, 针对不同靶物质论述了施陶丁格连接介导的生物传感相关应用, 包括核酸、小分子荧光生物传感器; 细胞成像技术在核酸、聚糖中的应用; 以及药物合成与递送中的应用。最后预测了施陶丁格连接未来的发展方向以及在生物传感中的应用前景。
1 施陶丁格连接机理及性质1919年Staudinger和Meyer发现并提出了有机叠氮化物与膦之间发生的经典施陶丁格还原反应。其中, 反应物膦是磷化氢(PH3)分子中的氢原子全部或部分被烃基取代而形成的一类化合物, 如三烷基膦或三苯基膦(TPP)常用于施陶丁格连接反应。如图 1-A所示, 叠氮化物与TPP反应首先释放氮气生成中间体膦亚胺, 随后在水溶液中自发水解生成伯胺和稳定的三苯基氧化膦(TPPO)[2, 5-6]。这一反应的优点在于能够在温和条件下几乎定量地进行, 同时没有明显的副产物形成, 常用于有机合成以引入胺[5-6]。
2000年, Saxon和Bertozzi[7]发现了施陶丁格还原反应作为生物偶联方法的潜力并进行了改进, 即在反应物之间设计了一种能够选择性生成酰胺键的化学连接, 称为施陶丁格连接。同年, Raines小组[8]和Bertozzi[9]小组同时报道了一种特殊的施陶丁格连接, 其中Raines小组[8]将施陶丁格连接应用于肽片段的连接, 反应能够生成一个天然的酰胺键且连接产物中不含残留的氧化膦, 这就是无痕施陶丁格连接。施陶丁格连接的反应机理与经典的还原反应不同, 经改进后通过分子内环化反应利用位于反应物中膦原子邻位的酯构建TPP作为亲电子捕获剂, 从而能够在水溶液条件下捕获亲核的氮杂内鎓盐中间体作为酰胺, 因此实现了两个分子的共价“结合”[2, 10-12](图 1-B)。无痕施陶丁格连接则是在施陶丁格连接的基础上的进一步改进, 其“无痕”体现在水解步骤中生成酰胺键的同时从最终产物中除去TPPO(图 1-C)。这一连接反应由于能够形成天然酰胺键而成为替代化学连接的强有力的肽段连接工具[2, 5-6]。
施陶丁格连接是一种具有生物正交特性的反应。生物正交反应是指在生命系统中能够在不干扰生物自身生化过程的前提下进行的化学反应[10]。其应具备以下3个要素:反应必须在水溶液中发生; 参与反应的催化剂或反应物无毒; 最重要的一点是两个功能基团不存在于生物系统中并且不与生物系统中的任何功能化基团发生交叉反应。同时, 生物正交反应还应具有点击反应的特性, 包括反应动力学快, 产率高, 无多余副产物, 溶剂适配性高以及反应起始材料易获取等[2]。因此, 生物正交这一概念是对点击化学的延伸, 拓宽了施陶丁格连接在各种复杂的生物系统中的应用[6]。
2 施陶丁格连接反应的影响因素施陶丁格连接具有生物正交性, 能够在室温、水溶液中, 无需金属离子催化等温和条件下发生反应。然而, 其反应动力学、连接产率以及反应进程同样会受到多种物理及化学因素的影响, 如反应体系中溶剂的极性、反应物中功能基团的位置与结构、稳定性、pH及水溶性等, 通过优化这些影响因素能够进一步促进施陶丁格连接更加高效的进行。
施陶丁格连接的速率常数范围在(1.8-2.2)×10-3m-1 s-1之间, 无痕施陶丁格的反应速率常数变化范围为(0.12-7.7)×10-3m-1 s-1, 这与CuAAC最高能达到的反应速率常数104 m-1 s-1比相差很多[11-12]。因此, 施陶丁格连接在反应动力学上受到限制, 反应速率较慢。施陶丁格还原反应的动力学研究表明反应属于一级动力或者二级动力反应取决于反应物的性质。Lin等[13]通过实验证实了限制施陶丁格连接反应速率与限制施陶丁格还原反应速率的步骤相似, 均为反应的初始阶段, 即膦上的孤对电子进攻叠氮化物中的末端氮原子从而生成膦基叠氮化物的过程。大部分影响因素会作用于这一限速步骤, 从而实现对整个反应速率的影响。
另一方面, 膦基叠氮化物发生分子内重排形成中间体膦亚胺, 这一中间体之后的反应路径将直接影响施陶丁格连接产物及其生成率。若一部分中间体膦亚胺被消耗进行施陶丁格还原反应, 在水溶液中水解生成氧化膦和胺, 将直接减少能继续发生连接反应的膦亚胺含量, 也就意味着连接产率的降低, 产物的减少[13]。因此, 反应影响因素对产率的影响主要表现在是否促进反应向着施陶丁格连接的方向进行。
2.1 反应体系中溶剂极性对反应速率的影响一般情况下, 极性大的溶剂有助于加快施陶丁格连接限速步骤的反应速率。Lin等[13]发现限速步骤处于一种极性过渡状态, 能够通过极性溶剂稳定。因此, 在具有较高介电常数的溶剂中反应能进行的更快。然而也有特殊情况存在。例如, CD3OD和CD3CN的介电常数大小相似, 但前者施陶丁格连接的反应速率常数远大于后者。这说明溶剂还能够通过氢键或其它直接的相互作用对限速步骤的过渡状态进行稳定。此外, 不同溶剂中水的比例变化也会对限速步骤的反应速率造成影响。
2.2 反应物中功能基团位置与结构对反应速率及产率的影响膦和叠氮化物是发生施陶丁格连接的两个要素。膦的结构和位置会通过空间位阻和电子修饰对施陶丁格连接反应速率及产率产生影响。Lin等[13]合成了一组三苯基膦, 并分别将多种取代基直接连接在磷原子对位的其中一个苯基上。利用哈密特图分析了反应速率与反应中心电荷变化的情况, 结果表明直接与磷原子相连的供电子取代基会加速这一反应。与此同时, 在合成的另一组不同结构的三苯基膦中一个苯基上连有酯基(-COOR), 分别由甲基、乙基、异丙基以及叔丁基取代(即R=Me, Et, i-Pr和t-Bu)。当与叠氮化物发生施陶丁格连接反应时, 酯基会发生断裂, 形成连有不同取代基(R)的酯离去基团。研究结果显示, 不同的酯离去基团对总体反应速率没有显着影响, 但会影响产物比率。较小的酯离去基团, 如甲基, 乙基或异丙基等, 反应后只观察到施陶丁格连接产物, 而当离去基团对空间要求更高时, 如叔丁基, 除了连接产物外, 还会有显著量的膦亚胺水解产物氧化膦产生, 从而降低了施陶丁格连接的产率。
此外, 对叠氮化物结构的优化同样会影响施陶丁格连接的反应动力学。Lin等[13]发现芳基叠氮化物对反应速率的影响取决于分子内酰胺键形成的步骤, 而不是生成膦基叠氮化物的初始反应。最新研究显示, 全氟芳基叠氮化物(PFAAs)和芳基膦之间能够发生快速的施陶丁格反应, 实验表明PFAA施陶丁格反应在CD3CN/D2O(1:1)中反应速率常数达到18 m-1 s-1, 同时证明了该反应是很好的生物正交反应, 能够在细胞环境中应用[14]。
2.3 反应物中功能基团pH对反应速率及产率的影响有研究指出施陶丁格连接的产物生成率会受到反应物pH的影响。Tam等[15]在合成蛋白质的研究中首先合成了硫代膦硫酯(4), 并通过对巯基脱保护进一步形成酸性膦硫醇(2), 利用13C Nuclear Magnetic Resonance(NMR)技术对(2)介导的无痕施陶丁格连接的反应能力进行监控。如图 2所示, 酸性膦硫醇(2)介导的反应, 其生成物的产量很大程度上依赖于混合反应物, 即叠氮化物与硫代膦酸酯(4)的pH。在pH为碱性的情况下产率增大, 但同样会导致硫酯的水解反应加速进行, 因此二者无法兼得。经优化后, 在中性pH附近进行(2)介导的无痕施陶丁格连接反应最理想。
受此启发, 研究人员发现参与施陶丁格连接反应的关键原子必须是未质子化的, 特别是中间体膦亚胺中的氮原子, 在质子性溶剂中易被质子化而促使反应向着施陶丁格还原反应的方向进行最终生成胺和氧化膦。因此, 利用分子内库仑相互作用来调节中间体膦亚胺的酸度, 合成了一种新型碱性膦硫醇, 即(对二甲基氨基乙基)膦基甲硫醇(3)。在对(3)介导无痕施陶丁格反应的能力进行评估时发现, 与(2)相同, 产物酰胺的量取决于叠氮化物与对应的硫代膦酸酯(5)的pH, 产量随着pH值的升高而增大。然而, 在碱性条件下, 产率依然能达到94%。同时还发现, 在各pH下, 碱性膦硫醇(3)的连接产率远高于酸性膦硫醇(2)的连接产率[15]。由此可以看出, 反应物中功能基团pH的高低会直接影响施陶丁格连接的反应产率。
2.4 反应物中功能基团水溶性对反应产率的影响功能基团的水溶性也是影响施陶丁格连接反应的重要因素。事实上, 在施陶丁格连接应用的初期, 特别是在无痕施陶丁格连接的研究中, 大多数反应是在有机溶剂或者有机溶剂与水溶液的混合物中进行的。为了保证施陶丁格连接的生物正交性, Tam等[15]首次实现了在水溶液中发生无痕施陶丁格连接反应。研究人员开发的碱性膦硫醇(3)具有良好的水溶性, 与另外两种酸性膦硫醇(1)和(2)相比, 这种水溶性膦硫醇结构上包含二甲基氨基, 不但能大大提高水溶性, 而且还能阻止中间体膦亚胺中氮的质子化, 促进反应在水溶液中向着生成酰胺键而非直接水解成氧化膦的方向进行(图 2)。
2.5 反应物中功能基团稳定性对反应进程的影响与点击化学家族中的其他反应相比, 尤其是CuAAC, 施陶丁格连接的应用仍未十分广泛, 主要受到反应物膦稳定性的制约, 如三烷基膦/三苯基膦容易被空气、二硫键和单线态氧氧化。目前, 已有相关研究通过改善反应机制去避免膦被氧化对实验结果产生的影响。Hangauer和Bertozzi[16]研究设计了一个基于分子内荧光共振能量转移(FRET)荧光淬灭的膦探针。膦-荧光团偶联物通过酯键连接FRET淬灭剂而不发荧光, 在与叠氮化物反应后, 酯键断开, 淬灭剂被释放并开启荧光。因此该探针已成功用于在活细胞中对叠氮化物官能化的聚糖进行成像。因此, 运用类似方法对反应机理进行改良从而巧妙地避免反应物膦被氧化。
3 施陶丁格连接介导的生物标记技术施陶丁格连接中的膦及叠氮化物都具有生物正交特性, 其中叠氮化物的化学惰性决定其在生理条件下的分子大小和高度稳定性, 使其十分适用于生物偶联, 目前该方法已广泛应用于生物大分子的标记。另外, 通过化学方法或生物合成途径也能将叠氮化物掺入聚糖、蛋白质、脂质和核酸中。施陶丁格连接在生物标记中的作用, 拓宽了其应用范围, 特别是为开发相关的生物传感器奠定了基础。下面主要从施陶丁格连接介导的生物标记在不同生物大分子中的应用展开讨论[5, 7]。
3.1 施陶丁格连接在核酸分子标记中的应用 3.1.1 DNA标记施陶丁格连接常用于将小分子标记在DNA上, 标记形式主要有两种:将叠氮化物修饰的核苷酸掺入DNA链中以及将化学报告基团通过酶法引入DNA中[5]。Wang等[17]通过施陶丁格连接将5’末端修饰了叠氮基团的寡核苷酸与荧光素FAM选择性反应, 形成FAM标记的荧光寡核苷酸。所得的荧光寡核苷酸能够作为引物通过桑格测序法生成带有荧光的DNA片段并利用DNA测序仪以单碱基分辨率进行检测。另外, Weisbrod和Marx[18]设计了一种新型位点特异性的共价标记方法。研究显示经叠氮化物修饰的非天然核苷酸通过施陶丁格连接能成功地引入DNA中, 实现对DNA的修饰。同时证明了经标记的核苷酸能够被DNA聚合酶接受, 通过聚合反应形成并扩增带有标记的DNA链。首先, 研究人员合成了叠氮基-2'-脱氧腺苷-5'-O-三磷酸(dATP)类似物, 并通过来自噬热细菌Pyrococcus woesei(Pwo)的DNA聚合酶将含有叠氮基的核苷三磷酸引入DNA中。随后, 叠氮化物修饰的双链DNA作为底物与经生物素化的三苯基膦发生施陶丁格连接反应。产物中生物素能够与链霉亲和素功能化的材料进一步偶联, 应用于生物分子的分析和纯化[16]。Anna等[19]在此基础上进行了类似的研究, 利用相同的原理设计了另外两种叠氮化物修饰的2'-脱氧胸苷-5'-O-三磷酸(dTTP)类似物并成功地实现了对DNA片段的修饰。
3.1.2 RNA标记与DNA类似, 通过施陶丁格连接将功能化的非天然核苷酸引入RNA中实现对其标记主要有两种方式:固相合成与酶介导。然而, Jawalekar等[20-21]对固相合成方式存在质疑。这是由于研究中发现磷(Ⅲ)的化合物, 如亚磷酰胺会与叠氮化物之间发生交叉反应, 导致利用叠氮基修饰的核苷酸固相合成RNA存在问题。尽管如此, Michaela的团队通过将修饰核苷酸的浓度调至较低水平实现了利用具有位点特异性的2'-叠氮基核苷固相合成小干扰RNA(siRNA)[20-22]。施陶丁格连接可应用于siRNA中2'-叠氮基与荧光染料的连接, 实现细胞中siRNA的定位和追踪。延伸该方法通过固相合成将2'-叠氮基胞苷和2'-叠氮基鸟苷引入RNA中[23]。Frommer等[24]也实现了用3'-叠氮基腺苷在RNA的3'末端进行标记。
固相合成标记RNA存在局限性, 如耗时、成本高、需特殊设备处理以及RNA长度受限等[5]。因此, 酶介导标记RNA的方法受到越来越多的关注。Rao等[25]合成了含有叠氮基的尿苷三磷酸类似物并在体外转录期间被T7 RNA聚合酶有效地结合, 引入RNA寡核苷酸中。随后, 可通过施陶丁格连接将含有叠氮基的RNA寡核苷酸与经功能化修饰的三苯基膦发生反应, 实现RNA的标记。此外, 相似的研究还有通过施陶丁格连接成功将含膦的淬灭剂分子标记在RNA上。目前, RNA化学或酶合成的方法仅适用于体外标记, 但可通过后续的施陶丁格连接进一步偶联, 应用于RNA的功能研究。对于体内靶向特异性标记RNA尚未实现, 有报道称RNA的后合成修饰有望解决这一难题[5]。
随着荧光激活系统的发展, 利用修饰有叠氮基团的荧光物质标记RNA, 并通过模板化施陶丁格反应实现对哺乳动物和细菌细胞中RNA的成像。Pianowski等[26]设计了两种细胞渗透性胍基肽核酸(GPNA)探针, 分别用荧光前体叠氮罗丹明和三烷基膦标记, 通过模板化施陶丁格反应检测完整细胞中编码O-6-甲基鸟嘌呤-DNA甲基转移酶的mRNA。随后, Gorska等[27]同样利用依赖于两种肽核酸探针之间的模板化施陶丁格反应实现了在几个小时内对miRNA的快速荧光成像。结果表明这一方法适用于显示细胞中miRNA的水平, 同时在不同细胞系中观察到miRNA水平和荧光强度之间存在良好相关性, 说明该方法可以通过流式细胞术对悬浮细胞进行荧光定量。
3.2 施陶丁格连接在非核酸类物质生物标记中的应用 3.2.1 聚糖标记施陶丁格连接介导的聚糖标记为实现聚糖在原生环境中参与多种生物变化过程的可视化及探测细胞内相互作用提供了新的可能性。细胞产生的聚糖总量, 即糖组, 是细胞生理学的动态指标。糖组会随着细胞发育、活化以及疾病的影响从健康状态转变为病理状态而发生变化。因此, 细胞表面的聚糖成像对疾病的诊断与治疗具有重要意义[28]。由于聚糖不是由基因组直接编码, 因此用于分析蛋白质和DNA的大部分现有分子生物学技术不能延伸以研究聚糖。聚糖成像可以通过两种方法进行:一是通过凝集素和抗体进行成像, 但体内使用该方法会受到低亲和力的限制; 另一种方法则是用醛或酮形成席夫碱, 但在体内应用时聚糖会与内源性代谢物非特异性结合而产生问题[5]。相比之下, 施陶丁格连接作为一种化学选择性连接, 参与反应的功能基团基本上在生物分子内部或细胞表面不发生反应, 十分适用于细胞内聚糖标记并进行成像。
近年来施陶丁格连接中具有生物正交性的膦及叠氮化物的引入促进了细胞表面聚糖成像的发展。Saxon和Bertozzi[14]将施陶丁格连接最早应用于聚糖的成像与检测。首先, 考虑到叠氮化物尺寸较小以及合成作为代谢前体的叠氮糖的难度较小, 因此选择将叠氮化物装载在细胞表面的糖缀合物内, 形成N-叠氮基乙酰甘露糖胺(ManNAz)作为生物正交化学报告基团, 叠氮基的加入不会影响糖缀合物本身的特性。随后, 与经生物素或荧光基团标记的三苯基膦发生施陶丁格连接反应, 生成稳定的细胞表面加合物, 从而实现了聚糖成像方面的突破[5, 7]。在此基础上, Chang等[29]利用细胞自身的生物合成机制, 将两种小功能基团酮和叠氮化物分别引入目标分子唾液酸和N-乙酰半乳糖胺(GalNAc)残基中。这些化学报告基团在生物环境下是惰性存在的, 但是可以通过高度选择性的共价反应用外源递送的探针检测。针对上述两种代谢标记, 分别设计使用两种荧光探针同时对相关的细胞表面聚糖进行成像。此外, 许多新型的荧光探针以及成像技术得到了快速开发。Cohen等[28]设计了一种新型膦探针对细胞表面聚糖进行实时生物发光成像。所使用的膦-萤火虫荧光素探针通过施陶丁格连接与叠氮化物标记的聚糖反应后, 游离的荧光素扩散进入细胞。在荧光素酶的催化作用下转化成氧合虫荧光素并伴随着光子的产生, 可以使用电荷耦合器件(CCD)照相机进行检测。
3.2.2 蛋白质标记施陶丁格连接在蛋白质标记中的应用基础是通过引入叠氮化物或膦作为功能标签, 实现其功能化。相比起膦在水溶液中易发生氧化的特性, 叠氮化物的性质更加稳定, 是施陶丁格连接对蛋白质进行标记的关键。将叠氮化物引入蛋白质中主要有两种方法, 一种是化学方法, 如通过重氮基转移反应或生物化学反应将叠氮化物引入蛋白质中, 另一种是生物方法, 如通过基因工程在蛋白质中引入含叠氮基的氨基酸或通过翻译对蛋白质进行修饰等[5]。
目前, 施陶丁格连接多应用于将非天然氨基酸导入蛋白质中, 有效地实现了蛋白质的选择性修饰。通过多种化学反应将合成的分子共价偶联在天然蛋白质上, 所形成的生物偶联产物已经成为研究天然蛋白质的重要工具。然而, 传统的生物偶联反应对天然氨基酸的位点特异性较差。因此, 近年来多种具有独特反应性的非天然氨基酸被设计合成, 为与蛋白质的生物正交偶联创造了新的可能性[30]。Tsao等[31]将合成的非天然氨基酸叠氮基苯丙氨酸导入噬菌体展示肽和突变的Z-结构域蛋白。随后, 利用荧光素标记的三苯基膦通过施陶丁格连接反应高选择性及高效地修饰了这些含叠氮基的蛋白质。这项工作为用各种合成试剂选择性修饰蛋白质提供了一个强大的新工具。研究证明施陶丁格连接不影响噬菌体活力, 并且在连接完成后能够轻易地实现富集。因此该方法能够选择性修饰蛋白质而不改变其功能, 可应用于产生高度均匀的聚乙二醇化蛋白质, 表面固定化蛋白质、用光谱或亲和试剂修饰的蛋白质。
3.2.3 脂质标记近年来, 多种脂质标记的化学选择性偶联方法得到应用, 例如酰胺, 硫醇-马来酰亚胺偶联, 亚胺或腙键及CuAAC等。通过改善制备表面官能化脂质体常规方法中的繁琐步骤, 如脂质偶联物的完全合成, 脂质组分的制备等, 实现了不同配体能够以模块化方式在脂质体的外表面对脂质骨架进行修饰。脂质体在药物递送以及对治疗药物的包埋中扮演了关键的角色[11]。Vabbilisetty等[32]通过施陶丁格连接利用乳糖的偶氮衍生物对脂质体表面进行功能化修饰。就脂质体大小和包埋药物的渗漏率而言, 施陶丁格连接在保证脂质双层膜完整性的同时提供了适用于靶向药物递送的完美功能性囊泡。与施陶丁格连接以及CuAAC相比, 其他偶联方法缺乏特异性, 导致脂质体与目标生物分子之间的共价键不能稳定存在和被控制。其中, 施陶丁格连接反应能够在室温, 水溶液以及无催化剂的条件下对脂质进行标记, 同时与许多生物分子中无保护的功能基团互相适配, 从而制备出的多种功能化脂质体产率较高[2, 11]。
4 施陶丁格连接在生物传感中的应用随着施陶丁格连接应用范围的不断拓宽以及生物传感器在检测中的快速发展, 施陶丁格连接介导的生物传感器逐渐增多。由于连接反应中产生的酯离去基团能够被设计用于特定的生物应用中, 如将离去基团赋予显色或荧光性质, 或是用作前体药物[13], 因此目前施陶丁格连接多应用于荧光生物传感器中, 为检测核酸以及小分子物质提供了快速便利的方式。下文将按照靶标为核酸与小分子两大类对施陶丁格连接介导的生物传感应用进行论述。
4.1 施陶丁格连接介导的核酸荧光生物传感器施陶丁格连接介导的核酸荧光生物传感器主要是通过模板化施陶丁格反应激活荧光信号对DNA、RNA进行检测, 随后不断优化相关参数, 刷新检测限低值。过去的技术受到了反应动力学缓慢、背景信号值高等问题的制约。在引入点击反应, 如施陶丁格连接后, 其生物正交性与反应动力学, 有助于提升检测灵敏度荧光强度, 同时削弱背景信号。在模板化施陶丁格反应的基础上, 开发了多种荧光探针与其相结合用于核酸的检测。Abe等[33]开发了一种还原触发荧光探针(REFA)用于寡核苷酸的检测, 探针中的新荧光化合物是罗丹明衍生物, 标记在与靶标链互补的DNA链上, 其中的叠氮基团能够与另一条DNA链上标记的TPP发生施陶丁格反应, 叠氮基团被还原后出现荧光信号。在靶标DNA或RNA存在下, 无任何酶或试剂参与的情况下自动进行, 10-20 min内产生荧光信号, 该荧光化合物的荧光强度信号/背景比值达到2 100倍的增长。REFA探针已经成功应用于检测溶液中单核苷酸水平的寡核苷酸和细菌细胞中的内源RNA。
目前使用比较广泛的另一种荧光探针是Franzini和Kool[34]设计的一种多功能模板荧光激活探针, 被称为淬灭施陶丁格触发α-叠氮醚释放(Q-STAR)探针。这一DNA探针含有荧光基团, 与α-叠氮醚接头相连的猝灭基团会使荧光淬灭失活。通过TPP与叠氮官能团发生施陶丁格反应触发接头的断开, 导致淬灭基团的释放, 引发稳健的荧光信号。这一探针已用于在大肠杆菌和肠道沙门氏菌中表达的特定RNA靶标的体外检测[35]。随后, Franzini和Kool将Q-STAR探针进行了改进, 开发了具有单核苷酸特异性的DNA靶标的双色鉴别方法, 即同时使用花青染料标记的淬灭释放探针(NIR STAR)特异性地与一条靶标链杂交, 在与TPP-DNA探针进行模板反应后提供近红外荧光信号, 而另一条靶标链与特异性的绿色STAR探针杂交则提供绿色荧光信号。改进后的模板荧光探针通过显微镜和流式细胞术增强对致病细菌的分析, 这种多色探针可用于复杂样品中核酸的多重检测[36]。
此外, 针对PCR检测方法依赖于线性信号放大而阻碍了对少量遗传物质进行检测的问题, 近期Velema和Kool[37]开发了一种非酶促的荧光扩增级联模板反应用于单核苷酸水平的核酸检测。检测结合了两个核酸模板反应, 首先第一个是靶序列模板化学连接反应, 形成一种不稳定的产物, 与模板序列分离后, 进入第二个模板化施陶丁格反应, 从而产生荧光产物。结果表明, 利用该方法以浓度依赖性的方式检测靶序列, 检测限可低至10 pmol/L, 同时具有高选择性与生物相容性。
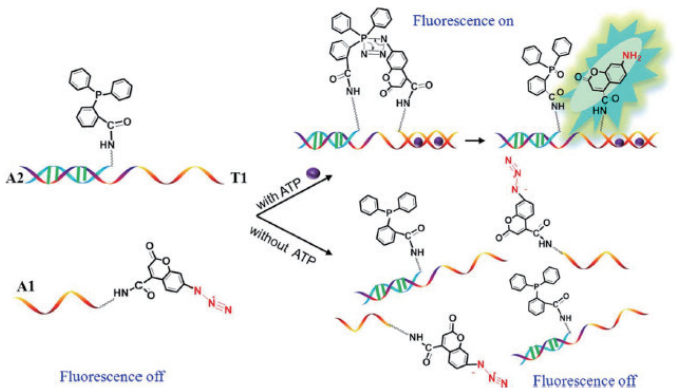
4.2 施陶丁格连接介导的小分子荧光生物传感器施陶丁格介导的荧光传感器用于小分子检测的研究比较少。最近, Yu等[38]报道了利用重要的能量储存生物分子三磷酸腺苷(ATP)作为生物催化剂诱导链间施陶丁格反应从而实现高选择性、高效率检测ATP。如图 3所示, 实验设计了一条用弱荧光叠氮基-香豆素功能化的ATP劈裂适配体A1;第二条DNA链A2则与TPP共价连接, 能够通过施陶丁格反应选择性且有效地将叠氮基还原为氨基。首先将A2与另一半设计更长的DNA链(T1)杂交。T1的后半部分是ATP的劈裂适配体, 并选择性地识别ATP与A1形成三明治结构。ATP与适配子之间的特异性相互作用促使两个功能性DNA链(A1和A2)上的叠氮基与TPP互相靠近, 引发了fmol-nmol浓度水平的链间施陶丁格连接反应, 荧光基团被还原成7-氨基香豆素, 产生荧光, 可用作ATP示踪的指示剂。同时, 反应产物的荧光信号对ATP浓度具有剂量响应[38]。这种链式施陶丁格反应可以扩展到为其他小功能分子构建基于适配体的荧光生物传感器。
Peng等[39]的最新研究是基于施陶丁格连接开发了一种新型激发态分子内质子转移(ESIPT)高选择性荧光探针, 用于灵敏地检测有机叠氮化物。该探针可检测线性响应高达40 μmol/L的苯基叠氮化物, 检测下限为227 nmol/L, 在多种分析物存在的情况下也能表现出高选择性。另外, 该探针具有低毒性, 已成功应用于活体肝癌SMMC-7721细胞中有机叠氮化物的成像。
5 施陶丁格连接在药物合成与递送中的应用点击化学目前主要应用于材料科学, 高分子化学以及生物技术中, 但是Sharpless及其团队最初提出点击化学这一概念时, 主要目的就是将其应用于药物合成与递送。施陶丁格连接中参与反应的叠氮化物与膦都具有生物正交性质, 因此十分适用于靶向的药物递送与释放。2006年, Azoulay等[40]研究人员开发了一种具有改性亲电子阱的膦探针, 并首次成功地利用这一潜在的前药释放系统, 通过施陶丁格连接有效地选择性释放药物, 获得较高产率。在施陶丁格连接的触发作用下, 多柔比星药物前体被激活, 随着时间的增加, 药物前体不断转化成多柔比星, 3 h后反应完成接近90%, 实现了多柔比星的缓释。通过高效液相色谱法(HPLC)对多柔比星及其药物前体的释放进行了量化和监控, 二者的保留时间分别为3 min和23 min, 线性范围为10-5 mol/L-1.5 x 10-3 mol/L[40]。
靶向脂质体是药物递送中的重要媒介, 其合成通常需要靶向配体与脂质体表面的化学偶联。由于施陶丁格连接能够在温和的反应条件下以高产率进行并且与多数生物分子的未保护官能团具有相容性, 因此适用于靶向药物递送的生物偶联物的新型合成方法[8]。Xu等[41]将装载有钙黄绿素或多柔比星的转铁蛋白(Tf)-共轭脂质体通过施陶丁格连接法合成, 所得到的脂质体在细胞摄取和体外细胞毒性方面具有高度功能化, 偶联反应具有高度特异性及稳定性, 可应用于将来开发靶向给药系统。
6 施陶丁格连接对纳米材料的生物功能化随着新型材料的特性不断被发掘, 纳米材料作为其中一员, 因其结构庞大, 负载能力高以及独特且可调控的物理、化学性质而成为药物递送系统开发中的重要工具[42]。施陶丁格连接介导的纳米材料药物递送技术也得到一定程度的发展。2008年Parkhouse等开发了靶向基因递送系统的模块化合成新方法, 首次实现将施陶丁格连接用于纳米颗粒的功能化。研究人员利用末端为叠氮基的聚乙二醇化聚酰胺-胺聚合物和DNA纳米颗粒通过施陶丁格连接反应与肽配体偶联, 从而形成离散的小尺寸纳米颗粒[11, 43]。目前, Gobbo等[42]的最新研究是通过施陶丁格连接将叠氮基标记的CRGDK肽与金纳米粒子结合。由于CRGDK肽能够靶向不同癌细胞系的生物分子, 反应后得到的AuNP-CRGDK生物偶联物将成为潜在的广谱型靶向剂, 便于在抗癌药物递送中应用。
7 施陶丁格连接介导的生物传感器的未来发展方向施陶丁格连接具有生物正交性、与多种荧光基团偶联的适用性, 同时无需金属离子催化而无潜在细胞毒性等优势, 使其成为点击反应中应用较为广泛的代表之一。目前, 施陶丁格连接在细胞及体内成像中的应用已经较为成熟, 但在生物传感器中的应用仍然具有较大的发展空间。本文将从以下几点对施陶丁格连接在生物传感器中的应用进行展望。
7.1 反应局限性的优化相较于应用最为广泛的点击反应CuAAC, 施陶丁格连接的局限性主要体现在两个方面:反应物中膦易被氧化以及反应动力学较慢, 二者限制了施陶丁格连接在体外检测, 尤其是生物传感器中的应用。目前, 已陆续有研究提出相应的解决办法来减小局限性对施陶丁格连接在实际应用中的影响。例如, 文中提到的通过优化叠氮化物的结构, 形成全氟芳基叠氮化物, 与膦发生施陶丁格连接反应, 能够加快反应速率[14]。其次, 在不使用金属离子催化剂的前提下, 研究适用于施陶丁格连接且无潜在细胞毒性的催化剂, 加快反应速率, 增大产率。除此之外, 研究叠氮化物和膦中各主要基团的位置和距离对反应速率的影响, 总结规律, 针对不同的探针或靶标标记条件最优的叠氮基和膦, 从而构建高效的生物传感器。
7.2 拓宽生物传感器的种类在生物传感方面, 目前施陶丁格连接主要集中应用于靶标为核酸以及小分子的荧光传感器, 使得搭载的生物传感器类型较为缺乏且单一。因此, 在将施陶丁格连接局限性最小化的同时, 可以参考已经发展较为成熟的点击反应, 如CuAAC在电化学传感器[44]、可视显色传感器[45]及光谱生物传感器[46]中的应用, 尝试将施陶丁格连接引入多种生物传感器中, 打破施陶丁格连接应用单一的局面, 进一步拓宽施陶丁格连接的应用范围。
7.3 新材料的功能化及应用施陶丁格连接在新材料中的应用有待开发。文中提到已有将施陶丁格连接应用于金纳米粒子的报道, 但是仅停留于对金纳米粒子进行功能化的初期, 具体的应用仍然空缺[42]。因此, 可以借鉴CuAAC或SPAAC等点击反应在金纳米粒子[47]、碳纳米管[48]、磁纳米粒子[49]中的应用方法, 开发施陶丁格连接在这些新材料功能化及生物传感中的应用。
7.4 减小在生物大分子上标记功能基团的难度和成本目前已有多种在生物大分子上分别修饰叠氮基团和膦的方法, 其中叠氮基团作为CuAAC反应的主要功能基团, 在修饰生物大分子中相对较为成熟, 但施陶丁格连接在实际应用中的普及率相对较低, 同时购买用于标记的叠氮化物和膦的原始材料成本较高, 从而大大影响了在生物大分子上标记功能基团的商业化程度以及合成方法, 尤其是核酸探针修饰方法的发展。这也是目前施陶丁格连接在生物传感器中应用的主要限制因素之一。因此, 若能总结并优化现有的修饰方法, 并在此基础上积极开发新型可持续发展、可广泛应用的合成及修饰手段, 从根本上解决施陶丁格连接主要功能基团在修饰生物大分子上的难题, 将极大地拓宽施陶丁格连接的应用前景。
| [1] |
Kolb HC, Finn MG, Sharpless KB. Click chemistry:diverse chemical function from a few good reactions[J]. Chembiochem, 2001, 40(11): 2005-2021. |
| [2] |
Lahann J. Click chemistry for biotechnology and materials science[M]. Chichester: John Wiley & Sons, 2009.
|
| [3] |
Nwe K, Brechbiel MW. Growing applications of "click chemistry" for bioconjugation in contemporary biomedical research[J]. Cancer Biotherapy and Radiopharmaceuticals, 2009, 24(3): 289-302. DOI:10.1089/cbr.2008.0626 |
| [4] |
Turner APF, Karube I, Wilson GS, et al. Biosensors:fundamentals and applications[M]. Oxford, New York: Oxford University Press, 1987.
|
| [5] |
van Berkel SS, van Eldijk MB, van Hest J. Staudinger Ligation as a method for bioconjugation[J]. Angewandte Chemie International Edition, 2011, 50(38): 8806-8827. DOI:10.1002/anie.v50.38 |
| [6] |
Köhn M, Breinbauer R. The Staudinger ligation—a gift to chemical biology[J]. Angewandte Chemie International Edition, 2004, 43(24): 3106-3116. DOI:10.1002/(ISSN)1521-3773 |
| [7] |
Saxon E, Bertozzi C R. Cell surface engineering by a modified Staudinger reaction[J]. Science, 2000, 287(5460): 2007-2010. DOI:10.1126/science.287.5460.2007 |
| [8] |
Nilsson BL, Kiessling LL, Raines RT. Staudinger ligation: a peptide from a thioester and azide[J]. Organic Letters, 2000, 2(13): 1939-1941. DOI:10.1021/ol0060174 |
| [9] |
Saxon E, Armstrong JI, Bertozzi R. A "Traceless" staudinger ligation for the chemoselective synthesis of amide bonds[J]. Organic Letters, 2000, 2(14): 2141-2143. DOI:10.1021/ol006054v |
| [10] |
Carroll L, Evans HL, Aboagye EO, et al. Bioorthogonal chemistry for pre-targeted molecular imaging-progress and prospects[J]. Organic & Biomolecular Chemistry, 2013, 11(35): 5772-5781. |
| [11] |
Schilling CI, Jung N, Biskup M, et al. Bioconjugation via azide-Staudinger ligation:an overview[J]. Chemical Society Reviews, 2011, 40(9): 4840-4871. DOI:10.1039/c0cs00123f |
| [12] |
Rahim MK, Kota R, Lee S, et al. Bioorthogonal chemistries for nanomaterial conjugation and targeting[J]. Nanotechnology Reviews, 2013, 2(2): 215-227. |
| [13] |
Lin FL, Hoyt HM, van Halbeek H, et al. Mechanistic investigation of the Staudinger ligation[J]. J Am Chem Soc, 2005, 127(8): 2686-2695. DOI:10.1021/ja044461m |
| [14] |
Sundhoro M, Jeon S, Park JH, et al. Perfluoroaryl azide-staudinger reaction:a fast and bioorthogonal reaction[J]. Angewandte Chemie International Edition, 2017, 56(2017): 12117-12121. |
| [15] |
Tam A, Soellner MB, Raines RT. Water-soluble phosphinothiols for traceless Staudinger ligation and integration with expressed protein ligation[J]. J Am Chem Soc, 2007, 129(37): 11421-11430. DOI:10.1021/ja073204p |
| [16] |
Hangauer MJ, Bertozzi CR. A FRET-based fluorogenic phosphine for live-cell imaging with the staudinger ligation[J]. Angewandte Chemie, 2008, 47(13): 2394-2397. DOI:10.1002/(ISSN)1521-3773 |
| [17] |
Wang CCY, Seo TS, Li Z, et al. Site-specific fluorescent labeling of DNA using Staudinger ligation[J]. Bioconjug Chem, 2003, 14(3): 697-701. DOI:10.1021/bc0256392 |
| [18] |
Weisbrod S H, Marx A. A nucleoside triphosphate for site-specific labelling of DNA by the Staudinger ligation[J]. Chem Commun, 2007, 18(2007): 1828-1830. |
| [19] |
Baccaro A, Weisbrod SH, Marx A. DNA conjugation by the Staudinger ligation:new thymidine analogues[J]. Synthesis, 2007, 13(2007): 1949-1954. |
| [20] |
Schulz D, Rentmeister A. Current approaches for RNA Labeling in vitro and in cells based on click reactions[J]. Chembiochem, 2014, 15(16): 2342-2347. DOI:10.1002/cbic.201402240 |
| [21] |
Jawalekar AM, Meeuwenoord N, Cremers JSGO, et al. Conjugation of nucleosides and oligonucleotides by[J]. The Journal of Organic Chemistry, 2008, 73(1): 287-290. |
| [22] |
Aigner M, Hartl M, Fauster K, et al. Chemical synthesis of site-specifically 2'-Azido-modified rna and potential applications for bioconjugation and RNA interference[J]. Chembiochem, 2011, 12(1): 47-51. |
| [23] |
Fauster K, Hartl M, Santner T, et al. 2'-Azido RNA, a versatile tool for chemical biology:synthesis, X-ray structure, siRNA applications, click Labelling[J]. ACS Chemical Biology, 2012, 7(3): 581-589. DOI:10.1021/cb200510k |
| [24] |
Frommer J, Hieronymus R, Selvi Arunachalam T, et al. Preparation of modified long-mer RNAs and analysis of FMN binding to the ypaA aptamer from B.subtilis[J]. RNA Biology, 2014, 11(5): 609-623. DOI:10.4161/rna.28526 |
| [25] |
Rao H, Sawant AA, Tanpure AA, et al. Posttranscriptional chemical functionalization of azide-modified oligoribonucleotides by bioorthogonal click and Staudinger reactions[J]. Chem Commun, 2012, 48(4): 498-500. DOI:10.1039/C1CC15659D |
| [26] |
Pianowski Z, Gorska K, Oswald L, et al. Imaging of mRNA in Live cells using nucleic acid-templated reduction of azidorhodamine probes[J]. J Am Chem Soc, 2009, 131(18): 6492-6497. DOI:10.1021/ja809656k |
| [27] |
Gorska K, Keklikoglou I, Tschulena U, et al. Rapid fluorescence imaging of miRNAs in human cells using templated Staudinger reaction[J]. Chemical Science, 2011, 2(10): 1969-1975. DOI:10.1039/c1sc00216c |
| [28] |
Cohen AS, Dubikovskaya EA, Rush JS, et al. Real-time bioluminescence imaging of glycans on live cells[J]. J Am Chem Soc, 2010, 132(25): 8563-8565. DOI:10.1021/ja101766r |
| [29] |
Chang PV, Prescher JA, Hangauer MJ, et al. Imaging cell surface glycans with bioorthogonal chemical reporters[J]. J Am Chem Soc, 2007, 129(27): 8400-8401. DOI:10.1021/ja070238o |
| [30] |
De Graaf AJ, Kooijman M, Hennink WE, et al. Nonnatural amino acids for site-specific protein conjugation[J]. Bioconjug Chem, 2009, 20(7): 1281-1295. DOI:10.1021/bc800294a |
| [31] |
Tsao ML, Tian F, Schultz PG. Selective Staudinger modification of proteins containing p-azidophenylalanine[J]. Chembiochem, 2005, 6(12): 2147-2149. DOI:10.1002/cbic.v6:12 |
| [32] |
Vabbilisetty P, Sun XL. Liposome surface functionalization based on different anchoring lipids via Staudinger ligation[J]. Organic & Biomolecular Chemistry, 2014, 12(8): 1237-1244. |
| [33] |
Abe H, Wang J, Furukawa K, et al. A reduction-triggered fluorescence probe for sensing nucleic acids[J]. Bioconjug Chem, 2008, 19(6): 1219-1226. DOI:10.1021/bc800014d |
| [34] |
Franzini RM, Kool ET. Efficient nucleic acid detection by templated reductive quencher release[J]. J Am Chem Soc, 2009, 131(44): 16021-16023. DOI:10.1021/ja904138v |
| [35] |
Di Pisa M, Seitz O. Nucleic acid templated reactions for chemical biology[J]. ChemMedChem, 2017, 12(12): 872-882. DOI:10.1002/cmdc.v12.12 |
| [36] |
Franzini RM, Kool ET. Improved templated fluorogenic probes enhance the analysis of closely related pathogenic bacteria by microscopy and flow cytometry[J]. Bioconjug Chem, 2011, 22(9): 1869-1877. DOI:10.1021/bc2003567 |
| [37] |
Velema WA, Kool ET. Fluorogenic templated reaction cascades for RNA detection[J]. J Am Chem Soc, 2017, 139(15): 5405-5411. DOI:10.1021/jacs.7b00466 |
| [38] |
Yu H, Zheng J, Yang S, et al. Use of a small molecule as an initiator for interchain staudinger reaction:A new ATP sensing platform using product fluorescence[J]. Talanta, 2018, 178(2018): 282-286. |
| [39] |
Peng F, Gao J, Zhang W, et al. ESIPT-based highly selective fluorescent probe for organic azides through Staudinger ligation[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2017. |
| [40] |
Azoulay M, Tuffin G, Sallem W, et al. A new drug-release method using the Staudinger ligation[J]. Bioorganic & medicinal chemistry Letters, 2006, 16(12): 3147-3149. |
| [41] |
Xu S, Liu Y, Tai H C, et al. Synthesis of transferrin(Tf)conjugated liposomes via Staudinger ligation[J]. International Journal of Pharmaceutics, 2011, 404(1): 205-210. |
| [42] |
Gobbo P, Luo W, Cho SJ, et al. Small gold nanoparticles for interfacial Staudinger-Bertozzi ligation[J]. Organic & Biomolecular Chemistry, 2015, 13(15): 4605-4612. |
| [43] |
Parkhouse SM, Garnett MC, Chan WC. Targeting of polyamidoamine-DNA nanoparticles using the Staudinger ligation:attachment of an RGD motif either before or after complexation[J]. Bioorganic & Medicinal Chemistry, 2008, 16(13): 6641-6650. |
| [44] |
Galán T, Prieto-Simón B, ALvira M, et al. label-free electrochemical DNA sensor using "click"-functionalized PEDOT electrodes[J]. Biosensors and Bioelectronics, 2015, 74(2015): 751-756. |
| [45] |
Zhou Y, Wang S, Zhang K, et al. Visual detection of copper(Ⅱ)by azide-and alkyne-functionalized gold nanoparticles using click chemistry[J]. Angewandte Chemie, 2008, 120(39): 7564-7566. DOI:10.1002/ange.v120:39 |
| [46] |
Palla M, Kumar S, Li Z, et al.Click chemistry based biomolecular conjugation monitoring using surface-enhanced Raman spectroscopy mapping[C].2016 IEEE SENSORS, 2016.
|
| [47] |
Zhu K, Zhang Y, He S, et al. Quantification of proteins by functionalized gold nanoparticles using click chemistry[J]. Anal Chem, 2012, 84(10): 4267-4270. DOI:10.1021/ac3010567 |
| [48] |
Qi H, Ling C, Huang R, et al. Functionalization of single-walled carbon nanotubes with protein by click chemistry as sensing platform for sensitized electrochemical immunoassay[J]. Electrochimica Acta, 2012, 63(2012): 76-82. |
| [49] |
Fratila RM, Navascuez M, Idiago-López J, et al. Covalent immobilisation of magnetic nanoparticles on surfaces via strain-promoted azide-alkyne click chemistry[J]. New Journal of Chemistry, 2017, 41(19): 10835-10840. DOI:10.1039/C7NJ01822C |