2. 北京农业职业学院, 北京 102442
2. Beijing Vocational College of Agriculture, Beijing 102442
铅离子是对人体极为有害的重金属离子, 且性质稳定, 进入人体后不易降解, 尤其是在儿童的生长发育阶段, 铅离子对儿童的神经系统产生的影响更为严重。铅由于其在环境中的长期持久性和在生命组织中的潜在毒性, 已被列入强污染物范围。近几年, 儿童铅中毒的消息层出不穷:2014年, 湖南某镇有300多个孩子被查出血铅超标, 与当地化工厂排出的过量重金属有关; 2014年, 广东东莞一个4个月婴儿使用红丹爽身粉, 引发重度铅中毒以致脑瘫; 2016年, 深圳5名儿童被查出血铅严重超标, 原因是服用了一家凉茶店自行配制的药粉。不仅国内, 对全球儿童而言, 铅中毒也是最重要的环境卫生问题之一。世界卫生组织制定的饮用水水质标准中铅离子的浓度标准是不超过0.01 mg/L, 美国环保署规定的食品中铅离子最大浓度是72 nmol/L[1]。
目前国内外大型仪器法主要包括高效液相色谱法、原子吸收光谱法和原子发射光谱法等。这些方法能够准确定量金属含量和不同价态, 但是具有一定的局限性, 如前处理复杂、仪器设备繁重、检测时间长、专业人员操作及实时原位检测困难等。而功能核酸则具有易于修饰、价格低廉、稳定性高及特异性强等优点, 所以基于功能核酸的生物传感器受到了更多人的关注。铅离子依赖型脱氧核酶是一种以铅离子作为辅因子催化切割脱氧核酸的核酶, 其基本原理是, 在铅离子存在的条件下催化酶链发挥切割作用, 将底物链一分为二。它具有容易被筛选、对化学降解和环境变化不敏感等优点。本文主要介绍Pb2+依赖性功能核酸及其不同生物传感器的研究进展, 将不同的方法及其优缺点进行了简述, 意在为今后对Pb2+的功能核酸生物传感器的研究提供更全面的参考。
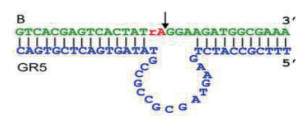
1 Pb2+依赖型功能核酸 1.1 GR-5 DNAzymeGR-5 DNAzyme是一种RNA剪切型脱氧核酶, 它是1994年Breaker和Joyce等[2]通过体外分子进化技术得到的第一个DNAzyme, 结构如图 1所示。它由底物链和酶链组成, 底物链上有一个核糖核酸分子, 可以作为该底物链的切割位点。在Pb2+存在的条件下, 底物链会被切割成两部分并与酶链分离, 即将Pb2+的信号转化成核酸的信号, 因此通过常见的核酸检测方法即可完成对Pb2+的检测, 如琼脂糖电泳、聚丙烯酰胺凝胶电泳等。同时还可以可视化检测, 即是根据核酸的一些特性, 如依赖于单链核酸与金纳米离子之间的吸附作用可以稳定金纳米离子的状态, 使反应溶液维持蓝色; 或者依赖于核酸的序列组成, 富G序列在K+存在的条件下与氯高铁血红素(hemin)共孵育产生类过氧化物酶活性, 催化3, 3′, 5, 5′-四甲基联苯胺(3, 3′, 5, 5′-Tetramethylbenzidine, TMB)和2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2, 2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS]显色。
|
| 图 1 GR-5 DNAzyme结构示意图 |
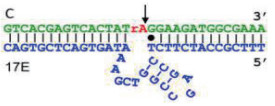
8-17 DNAzyme(图 2)是另一种RNA剪切型脱氧核酶。它由脱氧核酶由一条底物链(17DS)和一条酶链(17E)组成, 在Pb2+存在下显示出很高的催化活性。底物链是一个DNA/RNA嵌合体, 其剪切位点为腺嘌呤核酸核苷(rA), 其余全部为脱氧核糖核苷酸[3-5]。在Pb2+存在的条件下, 底物链被酶剪切为两段, 同样可以将Pb2+信号转化成核酸信号, 进而根据聚合酶链式反应(Polymerase chain reaction, PCR)、杂交链式反应(Hybrid chain reaction, HCR)、滚环扩增反应(Rolling circle amplification, RCA)等核酸放大方式将信号进一步放大, 然后进行比色、荧光、电化学等信号进行输出即可。
|
| 图 2 8-17 DNAzyme结构示意图 |
相较于8-17 DNAzyme而言, GR-5 DNAzyme对Pb2+具有更高的特异性[5-6], 因而近年来常被用于与不同方法相结合, 开发特异性检测铅离子的功能核酸生物传感器。
2 Pb2+功能核酸生物传感器的分类 2.1 比色生物传感器比色生物传感器检测重金属是最理想的一种方法, 主要是由于它操作简单、价格低廉, 且可通过直接的颜色变化进行半定量分析, 对于实时原位检测具有较好的检测效果。
2.1.1 金纳米粒子比色生物传感器金属材料具有良好的纳米材料性质, 尤其是金纳米粒子(AuNPs), 其直径在1-100 nm之间, 具备高电子密度、介电特性和催化作用。它可以与多种生物大分子结合, 且不影响生物大分子的生物活性[7]。13 nm AuNPs的分散和聚集状态对应着红色和蓝色, 因为盐诱导的筛查效应会使单独的金纳米粒子发生聚集。由于DNA的聚阴离子性质使功能化的DNA AuNPs稳定存在于摩尔级的NaCl溶液中[8]。
图 3为基于金纳米粒子和8-17 DNAzyme的Pb2+比色生物传感器, 由13 nm AuNPs, 8-17 DNAzyme核酶组成。在Pb2+存在的情况下, 8-17 DNAzyme催化底物链水解, 产生单链DNA可以在高盐浓度下稳定AuNPs, 使其呈现红色; 若Pb2+不存在时, 酶链和底物链以双链形式存在在高盐条件下不会与AuNPs结合, 因而AuNPs聚集呈蓝色。通过分光光度计可以在522-700 nm波长条件下对颜色进行检测[8], 进而分析Pb2+含量。
2.1.2 G-四联体功能核酸比色生物传感器G-四联体是由富含鸟嘌呤的DNA或RNA折叠形成的高级结构。G-四联体与hemin共孵育可以形成类过氧化物酶活性, 与蛋白质酶相比, G-四联体具有合成本低, 稳定性好等优点, 因而逐渐受到广泛关注。
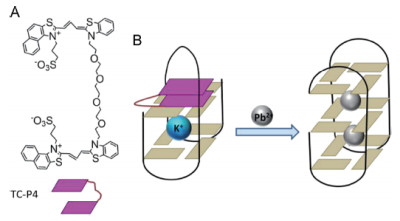
Sun等[9]于2014年发明了一个基于夹状花青素染料的G-四联体识别探针, 对Pb2+具有高选择性的比色生物传感器。研究发现一个新颖的夹状花青素染料TC-P4(图 4-A), 它是具有与花青染料相似取代基的花青染料分子。取代基非常大, 因此使花青染料与G-四联体结合提供了大的空间效应, 只有那些对TC-P4具有高亲和力的G-四联体才能与TC-P4结合。进一步的研究表明, K+诱导的PS2.M的G-四联体可以与TC-P4结合, 并引起TC-P4吸收光谱的显着变化, 但是Pb2+诱导G-四联体不能做到这一点, 因此可以根据吸光值的变化可以对Pb2+实现定量检测, 确保了Pb2+的高灵敏度检测, 检出限能够达到1 nmol/L[9]。
2.2 荧光生物传感器荧光生物传感器基于荧光信号进行检测, 大体可以分为两种:标记荧光基团的生物传感器和无标记荧光基团的生物传感器。其突出优点是具有很高的灵敏度, 合成方法商业化, 现已经被广泛地应用于Pb2+功能核酸生物传感器。
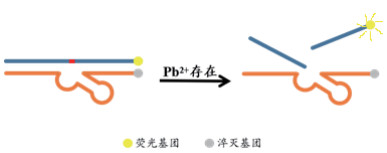
2.2.1 荧光基团荧光生物传感器DNA本身没有荧光特性, 因此, 通常需要在DNA链的末端增加荧光信号基团进行标记[10]。基于Pb2+依赖型DNAzyme的Pb2+检测的荧光传感器, 如图 5所示, 其中生物传感器在酶链17E的5′端标记淬灭基团(Dabcyl), 底物链17DS的3′端标记(TAMRA)[11]。定量检测线在3个数量级范围内, 最低检出限为10nmol/L, 并且此传感器对Pb2+的选择性比其他二价金属离子高80%以上。
|
| 图 5 荧光基团荧光生物传感器示意图 |
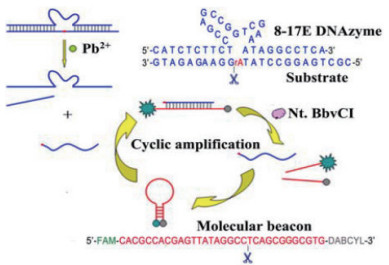
Zhao等[12]发明基于Pb2+依赖型DNAzyme(8-17E DNAzyme)和辅助信号级联扩增的切克内切酶(Nt.BbvCI)构建了一种灵敏度高, 选择性好的Pb2+检测荧光功能能核酸生物传感器。在Pb2+存在条件下, 8-17E DNAzyme可以催化底物切割, 切割产物可以与分子信标(Molecular beacon, MB)杂交互补。MB由于本身存在的荧光基团与猝灭基团相互靠近, 所以本底值很低, 而当切割产物结合后可以打开MB二级结构释放荧光, 同时由于互补双链上含有切克内切酶的识别位点, 可以将MB切割, 释放切割产物与下一轮的MB结合, 可以循环放大输出信号。这种新设计避免了对DNAzyme和底物的修饰, 并且显著提高了灵敏度, 检测限低至1.0×10-10 mol/L。此外, 据实验数据分析, 该方法的回收率为96.1%-108%[12](图 6)。
2.2.2 量子点荧光生物传感器量子点是一种三维尺寸均限制在纳米尺度的半导体纳米晶体, 由于其尺寸小表现出特殊的量子限域效应、表面效应、介电限域效应和量子隧道效应。由于以上这些效应, 量子点具有传统有机染料无法比拟的荧光特征, 如量子点的尺寸控制光吸收和发射光谱、具有较大的荧光峰红移、峰形对称、激发光波长范围宽、荧光强度高、稳定性好等优点[13]。当Pb2+存在条件下, 溶液中的Pb2+能和CdSe/ZnS量子点相互作用, 使量子点发生荧光淬灭, 在一定Pb2+浓度范围内, 量子点荧光强度会随着Pb2+浓度的增大而降低。利用Pb2+的浓度和量子点荧光强度之间建立数量关系, 进行Pb2+的定量检测[6]。
2.2.3 无标记荧光生物传感器标记荧光基团的生物传感器价格昂贵, 构建复杂, 而且增加的荧光基团会对功能核酸的活性产生影响。因此, 无标记荧光基团的荧光生物传感器是逐渐受到人们的关注。Zhang等[14]报道可以利用双链DNA螯合染料Picogreen和17E DNAzyme螯合对Pb2+进行检测。在Pb2+不存在时染料结合双链DNA, 产生高荧光值; 加入Pb2+之后, 核酶中的底物链被催化切割, 释放螯合的染料, 荧光值降低, 获得10 nmol/L检出限的生物传感器[14]。
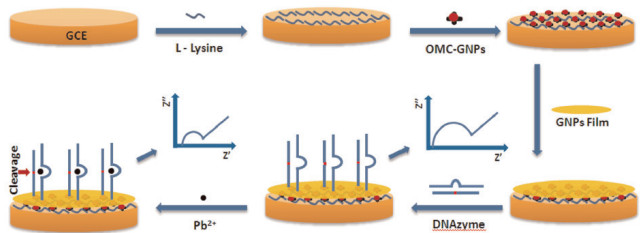
2.3 电化学生物传感器近年来, 电化学生物传感器因其灵敏度高、选择性好、操作简单、成本低而受到广泛关注。典型的电化学生物传感器是在电极表面固定功能核酸和纳米材料进而对Pb2+实现特异性检测。例如, Zeng等[16]开发了一种基于介孔碳纳米金和DNAzyme催化探针的新型的无标记Pb2+传感器, 首先将金纳米材料沉积固定在电极上, 然后和DNAzyme催化探针杂交, 在Pb2+存在时, DNAzyme能激活切割底物链, 导致电化学性质发生改变, 进而完成Pb2+的检测, 检测限可以达到200 pmol/L[15](图 7)。
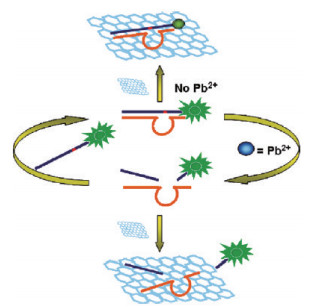
2.4 非金属纳米材料生物传感器氧化石墨烯(Graphene oxide, GO), 一般由石墨经强酸氧化而得, 具有许多优异的性能, 如荧光共振能量转移的高荧光猝灭能力, 良好的生物兼容性, 以及对特定生物分子的高亲和力。由于其独特的性质, 氧化石墨烯被广泛应用于Pb2+检测生物传感器。例如, Zhao等[16]开发了一种基于石墨烯和DNAzyme的Pb2+ "turn on"荧光生物传感器, 检测限可达到300 pmol/L。在他们的研究中, 荧光基团(6-carboxy-fluorescein, FAM)修饰底物链与酶链杂交, 形成一个环状的双链DNA。然后, DNA与石墨烯氧化物结合, 具有很强的淬灭能力。当Pb2+存在时, 基质链断裂成两部分, 释放出大量的短片段, 导致荧光强增加, 具体过程如图 8所示。
Yun等[17]设计了一个基于DNAzyme的分枝连接结构, 用来同时检测Mg2+, Cu2+和Pb2+。所有的DNA序列都由不同DNAzyme的酶链(E-DNA)和底物链(S-DNA)组成, 将3个不同的荧光基团分别标记在E-DNA的末段。3个DNA序列之间部分存在互补关系, 使之相互杂交形成分枝连接结构。没有靶标金属离子时, 主要通过dsDNA与氧化石墨烯连接, 分枝连接结构的DNAzyme荧光信号较强。在靶标金属离子存在时, S-DNA的rA位点被切割, 被切割的S-DNA片段被释放, 与氧化石墨烯通过π-π堆积的形式结合, 荧光信号显著淬灭。这种方法能同时检测3种金属离子, 检测时间25 min, 且Mg2+检测限达到200 nmol/L。DNAzyme和氧化石墨烯结合具有很好的水溶性、生物相容性及很好的荧光淬灭能力[17]。
2.5 表面增强拉曼光谱生物传感器随着纳米技术在生物传感器方面应用的逐步深入, 分析研究者们开发了一种适用于表面增强拉曼光谱的DNA生物传感器。使用能够特异性识别待测物的DNA序列作为生物敏感元件, 通过化学键结合在金、银等金属纳米粒子, 同时将修饰有拉曼信号分子的DNA结合在上面。这种结构不仅能够高灵敏的检测到待测物质而且还能够起到对拉曼信号的增强作用。
基于表面增强拉曼光谱的生物传感器技术在生物分子检测、癌细胞检测等很多方面取得了丰富的研究成果。俞汝勤教授课题组利用这种生物传感器实现了对可卡因的特异性定量检测。鞠熀先教授课题组利用"分子灯塔"生物传感器, 实现了目标DNA的痕量检测, 其检测限达到了10-13 mol/L[18]。
2.6 活细胞传感器 2.6.1 表达GFP的细菌生物传感器近年来, 许多科学家提出把重组细菌作为检测重金属的工具, 构建细菌生物传感器, 通过绿色荧光蛋白(Green fluorescence protein, GFP)或红色荧光蛋白(Red fluorescence protein, RFP)等的表达作为输出信号, 进而完成对重金属的检测。感知Pb2+的遗传元件包括调控蛋白(Regulatory protein gene, PbrR), 以及来自抗性操纵子的操纵子/启动子(Operator/promoter, PbrO/P), 同时PbrO/P也控制着GFP报告基因的表达。因此, Chakraborty等在2008年构建了一个用于Pb2+的细菌生物传感器, 其检测范围是50-400 μmol/L[19]。
2.6.2 表达ZntA的细菌生物传感器ZntA是一种可以转运Pb2+等金属阳离子转运ATP酶, 可以从大肠杆菌中分离得到。通过对纯化的ZntA的金属依赖性的研究, 可以发现其对Pb2+的特异性。通过在质粒上构建ZntA与LacZ的融合物, 然后使用Selifonova等[20]的方法, 通过体内重组转移至A噬菌体。在特定的引物下可以进行该质粒的增殖。在不同的金属阳离子作用下, 启动子会被诱导。其中Pb2+在0.5 mmol/L下产生3.8倍的启动子诱导[21]。
2.7 纳米孔道传感器最近, 纳米孔或纳米通道中独特的质量传递性质由于在传感系统中的潜在应用而受到了广泛关注。通常, 用于纳米孔或纳米通道中的生物分析的传统方法有电阻脉冲检测(Resistance pulse sensing RPS)和离子电流整流(Ion current rectification, ICR)等。RPS和薄纳米孔的组合已成功应用于许多领域, 特别是用于DNA检测[21-27]。1997年, Bard等[28]首次发现了ICR现象, 从那时起, 基于ICR的传感器逐渐出现[29-34], 但这种方法可能导致目标与纳米通道分离。Gyurcsányi等提出了一种新的无标记DNA分析策略, 即用探针离子扩散使目标通过纳米通道[35-36]。自此, 这种方法逐渐被广泛用于生化分析[37-42]。
为了在纳米通道中获得高灵敏度分析, 已经提出了各种扩增策略。其中一种方法是通过使用纳米颗粒来增强空间效应阻断剂[43-44], 这种方法与纳米粒子的大小有很大的关系; 另一种方法是通过将中性条件下得到的生物探针固定在纳米通道中来减少背景信号, 然后使用低离子强度放大靶信号[45]。在本研究中, 将中性的吗啉与(GGGT)4特异性核酸序列结合并固定在PAA膜纳米通道中, 它可以特异性结合Pb2+以形成调节电化学探针扩散的G4结构。Pb2+具有很高的G4稳定效率, 它可以使morpholino-DNA装置具有高灵敏度和选择性, 用于感应Pb2+, 用这种方法可以检测存在于水, 土壤和食物中的铅离子污染物[46]。
2.8 纳米机器/纳米马达生物传感器微电机是材料科学最前沿的新型自推进材料, 可以自主运行以执行特定任务[47-52]。这些微机械或微型机器人在许多领域都有很大的发展前景。它们目前已经能够进行广泛的工作, 包括生物医学应用[53]、运输[54]和环境修复[55-56]。
通过实验目前已经证明微型机器人可以选择性地检测水中Pb2+的存在。微型机器人由在其内表面上的过氧化氢催化分解成氧气, 氧气在末端排出气泡提供推进动力, 以这种方式推动微型机器人前进。通常存在于污水中的Pb2+和Cd2+作为两种主要代表性离子被用作有毒害作用的物质来使微型机器人作用减弱[57]。超纯水环境的运动可以作为对照比较不同环境微型机器人的运动效果。通过选择性引入重金属盐Pb(NO3)2和Cd(NO3)2, 可以系统地研究无机Pt微机器人中毒对运动的影响。与Cd(NO3)2相比, 在用Pb(NO3)2中毒期间观察到无机Pt微型机器人的活性和速度的有更大程度的降低。与Cd2+相比, 铂的Pb2+吸附性质导致无机Pt微型机器人的活性降低更多。Pb2+与无机Pt微机器人的区分行为允许选择性检测Pb2+和Cd2+。这可以用作通过光学可视化无机Pt微型机器人的活动和移动性来连续监测污染物的潜在途径。
2.9 其他类型的生物传感器免疫检测技术是基于抗体与抗原直径的高选择性反应而建立起来的一种生物化学分析方法, 具有很强的选择性和灵敏度。按照抗体的种类, 分为单克隆抗体免疫检测和多克隆抗体免疫检测。常用的是酶联免疫分析(Enzyme Linked immunosorbent assay, ELISA)和荧光偏振免疫分析(Fluorescence polarization immunoassay, FPLA)。
免疫检测目前仍存在一些不足之处, 首先, 目前已经获得的关于铅离子的单抗和多抗数量有限, 主要原因是生物大分子与铅离子的偶联比较困难, 这方面的研究需要进一步突破; 其次是目前的检测仍停留在试验阶段, 有待开发商品化的试剂盒, 检测技术没有将科研成果真正转化并服务于生产生活。
3 展望目前Pb2+功能核酸生物传感器的研究迅猛, 而且针对简单、快速、灵敏的生物传感器开发也不再少数。现已开发的生物传感器具有很多优点, 但仍然存在一些缺点和不足, 主要表现在:(1)目前Pb2+功能核酸生物传感器依赖的功能核酸单一, 主要集中在8-17、GR-5及其变体, 并且生物传感器的输出信号大多以比色、荧光和电化学为主; (2)当前Pb2+生物传感器大多停留在实验室研究阶段, 实际应用于现场检测的生物传感器较少; (3)Pb2+对人体危害较大, 因此对于实验室开发传感器阶段, 实验样品的污染问题有待解决; (4)大多数Pb2+生物传感器主要应用在简单的检测体系, 如实验室自来水、湖泊水及尿液等, 而对于前处理复杂的池塘污泥、火山岩石及食品等的Pb2+进行检测相对较少, 即复杂的前处理问题亟需解决。
因此, Pb2+功能核酸生物传感器在未来的发展方向主要集中在:(1)开发特异性更强的Pb2+依赖性功能核酸, 提高灵敏度以满足Pb2+检测标准的需要; (2)解决复杂且耗时的前处理过程, 设计并应用可以适用于现场检测的Pb2+传感器, 即实时原位检测; (3)完善Pb2+在体内的检测方法, 以预防Pb2+超标对人体的危害。
| [1] |
Xu M, Gao Z, Wei Q, et al. Hemin/G-quadruplex-based DNAzyme concatamers for in situ amplified impedimetric sensing of copper(II)ion coupling with DNAzyme-catalyzed precipitation strategy[J]. Biosens Bioelectron, 2015, 74(18): 1-7. |
| [2] |
Breaker RR, Joyce GF. A DNA enzyme that cleaves RNA[J]. Chemistry & Biology, 1994, 1(4): 223-229. |
| [3] |
Lan T, Furuya K, Lu Y. A highly selective lead sensor based on a classic lead DNAzyme[J]. Chem Commun, 2010, 46(22): 3896-3898. DOI:10.1039/b926910j |
| [4] |
Brown AK, Li J, Pavot CMB, et al. A lead-dependent DNAzyme with a two-step mechanism[J]. Biochemistry, 2003, 42(23): 7152-7161. DOI:10.1021/bi027332w |
| [5] |
Wang Z, Lee JH, Lu Y. label-free colorimetric detection of lead ions with a nanomolar detection Limit and tunable dynamic range by using gold nanoparticles and DNAzyme[J]. Advanced Materials, 2008, 20(17): 3263-3267. DOI:10.1002/adma.v20:17 |
| [6] |
Liu JW, Lu Y. A colorimetric lead biosensor using DNAzyme-directed assembly of gold nanoparticles[J]. Journal of the American Chemical Ssociety, 2003, 125(22): 6642-6643. DOI:10.1021/ja034775u |
| [7] |
Ernest SK, Audrey P. Nanotechnology, nanomedicine and the development of new effective therapies for cancer[J]. Chemical Reviews, 2005, 105(4): 1547-1562. DOI:10.1021/cr030067f |
| [8] |
Wei H, Li B, Li J, et al. DNAzyme-based colorimetric sensing of lead(Pb2+)using unmodified gold nanoparticle probes[J]. Nanotechnology, 2008, 19(9): 095501. DOI:10.1088/0957-4484/19/9/095501 |
| [9] |
Sun H, Yu L, Chen H, et al. A colorimetric lead(II)ions sensor based on selective recognition of G-quadruplexes by a clip-like cyanine dye[J]. Talanta, 2015, 136: 210-214. DOI:10.1016/j.talanta.2015.01.027 |
| [10] |
Liu CW, Huang CC, Chang HT. Highly selective DNA-based sensor for lead(II)and mercury(II)ions[J]. Anal Chem, 2009, 81(6): 2383-2387. DOI:10.1021/ac8022185 |
| [11] |
Li J, Lu Y. A highly sensitive and selective catalytic DNA biosensor for lead ions[J]. Journal of the American Chemical Society, 122(2000): 10466-10467. |
| [12] |
Zhao YX, Lin QI, Yang WJ, et al. Amplified fluorescence detection of Pb2+, using Pb2+ -dependent DNAzyme combined with nicking enzyme-mediated enzymatic recycling amplification[J]. Chinese Journal of Anal Chem, 2012, 40(8): 1236-1240. DOI:10.1016/S1872-2040(11)60568-9 |
| [13] |
伊魁宇. CdTe量子点的合成及其基于荧光淬灭作用的分析应用[D].沈阳: 东北大学, 2009.
|
| [14] |
Zhang L, Han B, Li T, et al. label-free DNAzyme-based fluorescing molecular switch for sensitive and selective detection of lead ions[J]. Chem Commun, 2011, 47(11): 3099-3101. DOI:10.1039/c0cc04523c |
| [15] |
Zeng G, Zhou Y, Tang L, et al. Label free detection of lead using impedimetric sensor based on ordered mesoporous carbon-gold nanoparticles and DNAzyme catalytic beacons[J]. Talanta, 2016, 146: 641-647. DOI:10.1016/j.talanta.2015.06.063 |
| [16] |
Zhao XH, Kong RM, Zhang XB, et al. Graphene-DNAzyme based biosensor for amplified fluorescence "turn-on" detection of Pb2+ with a high selectivity[J]. Anal Chem, 2011, 83(13): 5062-5066. DOI:10.1021/ac200843x |
| [17] |
Yun W, Wu H, Liu X, et al. Simultaneous fluorescent detection of multiple metal ions based on the DNAzymes and graphene oxide[J]. Analytica Chimica Acta, 2017, 986: 115-117. DOI:10.1016/j.aca.2017.07.015 |
| [18] |
类成存.基于表面增强拉曼光谱的生物传感器研制[D].青岛: 青岛科技大学, 2014.
|
| [19] |
Alam A. GFP expressing bacterial biosensor to measure lead contamination in aquatic environment[J]. Current Science, 2008, 207(9): 2003-2017. |
| [20] |
Selifonova O, Burlage R, Barkay T. Bioluminescent sensors for the detection of bioavailable Hg(II)in the environment[J]. Applied & Environmental Microbiology, 1993, 59: 3083-3090. |
| [21] |
Garaj S, Hubbard W, Reina A, et al. Graphene as a sub-nanometer trans-electrode membrane[J]. Nature, 2010, 467(7312): 190-193. DOI:10.1038/nature09379 |
| [22] |
Dekker C. Solid-state nanopores[J]. Nat Nanotechnol, 2007, 2(4): 209-2015. DOI:10.1038/nnano.2007.27 |
| [23] |
Li J, Stein D, Mcmullan C, 等. Ion-beam sculpting at nanometre Length scales[J]. Nature, 2001, 412(6843): 166-169. |
| [24] |
Kawano R, Osaki T, Sasaki H, et al. Rapid detection of a cocaine-binding aptamer using biological nanopores on a chip[J]. J Am Chem Soc, 2011, 133(22): 8474-8477. DOI:10.1021/ja2026085 |
| [25] |
Li WW, Gong L, Bayley H. Single-molecule detection of 5-hydroxymethylcytosine in DNA through chemical modification and nanopore analysis[J]. Angewandte Chemie, 2013, 125(16): 4446-4451. DOI:10.1002/ange.201300413 |
| [26] |
Wang G, Wang L, Han Y, et al. Nanopore detection of copper ions using a polyhistidine probe[J]. Biosens Bioelectron, 2014, 53(9): 453-458. |
| [27] |
Makra I, Jágerszki G, Bitter I, et al. Nernst-Planck/Poisson model for the potential response of permselective gold nanopores[J]. Electrochimica Acta, 2012, 73(7): 70-77. |
| [28] |
Chang W, Bard AJ, Feldberg SW. Current rectification at quartz nanopipet electrodes[J]. Anal Chem, 1997, 69(22): 4627-4633. DOI:10.1021/ac970551g |
| [29] |
Siwy Z, Trofin L, Kohli P, et al. Protein biosensors based on biofunctionalized conical gold nanotubes[J]. J Am Chem Soc, 2005, 127(14): 5000-5001. DOI:10.1021/ja043910f |
| [30] |
Tian Y, Hou X, Wen L, et al. A biomimetic zinc activated ion channel[J]. Chem Commun, 2010, 46(10): 1682-1684. DOI:10.1039/b918006k |
| [31] |
Li C, Ma F, Wu Z, et al. Solution-pH-modulated rectification of ionic current in highly ordered nanochannel arrays patterned with chemical functional groups at designed positions[J]. Advanced Functional Materials, 2013, 23(31): 3836-3844. DOI:10.1002/adfm.v23.31 |
| [32] |
Shang Y, Zhang Y, Li P, et al. DNAzyme tunable lead(II)gating based on ion-track etched conical nanochannels[J]. Chem Commun, 2015, 51(27): 5979-5981. DOI:10.1039/C5CC00288E |
| [33] |
He H, Xu X, Wang P, 等. The facile surface chemical modification of a single glass nanopore and its use in the nonenzymatic detection of uric acid[J]. Chem Commun, 2015, 51(10): 1914-1917. |
| [34] |
Liu M, Zhang H, Li K, et al. A bio-inspired potassium and pH responsive double-gated nanochannel[J]. Advanced Functional Materials, 2015, 25(3): 421-426. |
| [35] |
Gyurcsányi RE, Vigassy T, Pretsch E. Biorecognition-modulated ion fluxes through functionalized gold nanotubules as a novel label-free biosensing approach[J]. Chem Commun, 2003, 9(20): 2560-2561. |
| [36] |
Jágerszki G, Gyurcsányi RE, Höfler L, et al. Hybridization-modulated ion fluxes through peptide-nucleic-acid-functionalized gold nanotubules. A new approach to quantitative label-free DNA analysis[J]. Nano Letters, 2007, 7(6): 1609-1612. DOI:10.1021/nl0705438 |
| [37] |
Li SJ, Li J, Wang K, 等. A nanochannel array-based electrochemical device for quantitative label-free DNA analysis[J]. ACS Nano, 2010, 4(11): 6417-6424. |
| [38] |
Gao HL, Wang M, Wu ZQ, et al. Morpholino-functionalized nanochannel array for label-free single nucleotide polymorphisms detection[J]. Anal Chem, 2015, 87(7): 3936-3941. DOI:10.1021/ac504830e |
| [39] |
Yu J, Luo P, Xin C, et al. Quantitative evaluation of biological reaction kinetics in confined nanospaces[J]. Anal Chem, 2014, 86(16): 8129-8135. DOI:10.1021/ac501135u |
| [40] |
Li SJ, Xia N, Yuan BQ, et al. A novel DNA sensor using a sandwich format by electrochemical measurement of marker ion fluxes across nanoporous alumina membrane[J]. Electrochimica Acta, 2015, 159: 234-241. DOI:10.1016/j.electacta.2015.02.010 |
| [41] |
Gao HL, Li CY, Ma FX, et al. A nanochannel array based device for determination of the isoelectric point of confined proteins[J]. Physical Chemistry Chemical Physics, 2012, 14(26): 9460-9467. DOI:10.1039/c2cp40594f |
| [42] |
Li CY, Tian YW, Shao WT, et al. Solution pH regulating mass transport in highly ordered nanopore array electrode[J]. Electrochemistry Communications, 2014, 42(5): 1-5. |
| [43] |
De EA, Chunglok W, Surareungchai W, et al. Nanochannels for diagnostic of thrombin-related diseases in human blood[J]. Biosens Bioelectron, 2013, 40(1): 24-31. DOI:10.1016/j.bios.2012.05.021 |
| [44] |
Alfredo DE, Merkoçi A. A nanochannel/nanoparticle-based filtering and sensing platform for direct detection of a cancer biomarker in blood[J]. Small, 2015, 7(5): 675-682. |
| [45] |
Wang X, Smirnov S. label-free DNA sensor based on surface charge modulated ionic conductance[J]. ACS Nano, 2009, 3(4): 1004-1010. DOI:10.1021/nn900113x |
| [46] |
Chen ZM, Shen GZ, Li YP, et al. A novel biomimetic logic gate for sensitive and selective detection of Pb(II)base on porous alumina nanochannels[J]. Electrochemistry Communications, 2015, 60: 83-87. DOI:10.1016/j.elecom.2015.08.013 |
| [47] |
Paxton WF, Sundararajan S, Mallouk TE, et al. Chemical locomotion[J]. Cheminform, 2006, 37(42): 5420-5429. |
| [48] |
Dr SS, Dr MP. Nanorobots:The ultimate wireless self-propelled sensing and actuating devices[J]. Cheminform, 2010, 4(9): 1402-1410. |
| [49] |
Fischer P, Ghosh A. Magnetically actuated propulsion at low reynolds numbers:towards nanoscale control[J]. Nanoscale, 2011, 3(2): 557-563. DOI:10.1039/C0NR00566E |
| [50] |
Sengupta S, Ibele ME, Sen A. Fantastic voyage:designing self-powered nanorobots[J]. Angewandte Chemie International Edition, 2012, 51(34): 8434-8445. DOI:10.1002/anie.201202044 |
| [51] |
Wang J. Can man-made nanomachines compete with nature biomotors?[J]. ACS Nano, 2009, 3(1): 4-9. DOI:10.1021/nn800829k |
| [52] |
Mei Y, Solovev AA, Sanchez S, et al. Rolled-up nanotech on polymers:from basic perception to self-propelled catalytic microengines[J]. Chemical Society Reviews, 2011, 40(5): 2109-2119. DOI:10.1039/c0cs00078g |
| [53] |
Patra D, Sengupta S, Duan W, et al. Intelligent, self-powered, drug delivery systems[J]. Nanoscale, 2013, 5(4): 1273-1283. DOI:10.1039/C2NR32600K |
| [54] |
Gao W, Pei A, Feng X, et al. Organized self-assembly of Janus micromotors with hydrophobic hemispheres[J]. J Am Chem Soc, 2013, 135(3): 998-1001. DOI:10.1021/ja311455k |
| [55] |
Orozco J, Cheng G, Vilela D, et al. Micromotor-based high-yielding fast oxidative detoxification of chemical threats[J]. Angewandte Chemie International Edition, 2013, 125(50): 13518-13521. |
| [56] |
Soler L, Magdanz V, Fomin VM, et al. Self-propelled micromotors for cleaning polluted water[J]. ACS Nano, 2013, 7(11): 9611-9620. DOI:10.1021/nn405075d |
| [57] |
Järup L. Treatment of heavy metal contamination[J]. British Medical Bulletin, 2003, 68(486): 167-182. |