2. 中国科学院生态环境研究中心/城市与区域生态国家重点实验室, 北京 100085;
3. 中央民族大学生物成像与系统生物学研究中心, 北京 100081
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences/State Key Laboratory of Urban and Regional Ecology, Beijing 100085;
3. Centre for Imaging & System Biology, Minzu University of China, Beijing 100081
沙冬青属(Ammopiptanthus)植物是第三纪古地中海沿岸的孑遗植物, 也是西北荒漠生态系统中唯一超旱生常绿阔叶灌木[1], 该属仅有新疆沙冬青(A.nanus(M.Pop.)Cheng f.)和蒙古沙冬青(A.mongolicus(Maxim)Cheng f.)2个种。其中, 新疆沙冬青被列为国家二级保护植物(濒危种), 蒙古沙冬青被列为国家三级保护植物(渐危种)[2], 且2个种遗传多样性均较低[3]。沙冬青属植物大多数分布于砾质或沙质黏土的荒漠地带, 能够在年降水量低于200 mm, 蒸发量2 000-4 000 mm, 极端低温-24.8℃和极端高温37.7℃的恶劣环境下正常生长[4]。研究表明, 在逆境信号的诱导下, 植物可通过一系列信号转导调节细胞内相关抗逆蛋白质和基因的表达, 进而调整自身的形态结构和生理生化水平来提高对逆境的耐受能力[5]。沙冬青属植物在长期适应恶劣环境过程中进化出较强的耐低温、耐干旱、耐盐碱等抗逆能力, 对于开展植物抗逆机制和适应机制的研究具有重要的生态价值和科研价值。
随着基因组计划的完成, 生命科学进入以"组学"为代表的后基因时代。蛋白质组(Proteome)概念由澳大利亚学者Wilkins等[6]于1994年首次提出, 其定义为"一个基因组所表达的全部蛋白质", 即细胞或组织或机体在特定时间和空间上表达的所有蛋白质。蛋白质组学从大规模水平上研究蛋白质的特征, 进而探索蛋白质的表达模式和功能模式。迄今为止, 研究蛋白质组学的核心技术包括双向电泳(Two-dimensional electrophoresis, 2-DE)、质谱(Mass spectrometry, MS)和生物信息学(Bioin-formatics)等[7]。除此之外, 相对和绝对定量同位素标记(Isobaric-tags for relative and absolute quantita-tion, iTRAQ)[8]、四维正交凝胶电泳系统(Four-dimensional orthogonal electrophoresis system, 4-DES)[9]、新型的邻近催化标记分子工具(Pupylation-based interaction tagging, PUP-IT)[10]、基质辅助激光解吸电离飞行时间质谱(Matrix-assisted Laser desorption ionization time of flight MS, MALDI-TOF-MS)[11]、液相色谱-串联质谱(Liquid chromatography-tandem MS, LC-MS/MS)[12]等新型蛋白质组学技术推动了定量蛋白质组学、蛋白质复合体以及蛋白质相互作用标记或网络分析的发展。
植物在生长发育周期中会受到各种不利环境因子影响, 蛋白质不仅通过调整生理特性直接参与形成新的表型以适应环境变化[13], 还可以在转录水平和蛋白质水平调控植物逆境胁迫应答[14]。因此, 蛋白质在植物胁迫响应中的作用是至关重要的。利用蛋白质组学方法系统地研究沙冬青属植物响应胁迫时其细胞内蛋白质组成及其活动规律, 可以从整体和动态的蛋白质水平上来探讨并揭示其对不良环境条件的适应机制和防御机制。
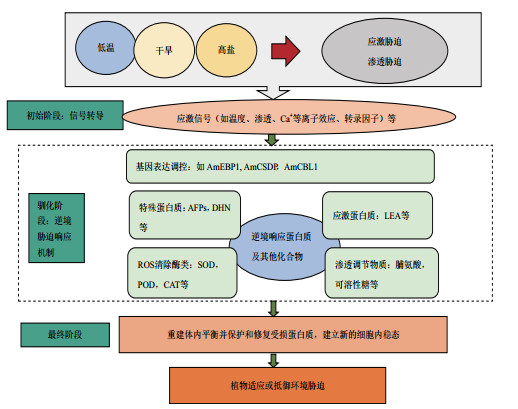
沙冬青属植物受到非生物胁迫时会通过一系列的信号转导、基因调控和蛋白质表达等过程完成对逆境信号的转导和响应。如初始阶段:非生物胁迫引起沙冬青属植物强氧化应激和渗透应激, 诱导应激信号触发下游信号传导; 驯化阶段:基因表达调控以及诱导合成特殊蛋白质、应激蛋白质、活性氧清除酶和渗透保护剂等; 最终阶段:重建体内平衡并保护和修复受损蛋白质, 建立新的细胞内稳态(图 1)。
近年来, 以蒙古沙冬青为研究对象利用基因组学在分子水平研究其响应逆境胁迫机制已取得一些重要成果, 如Fei等[15]通过miRNAs介导的基因调控提高了蒙古沙冬青的耐旱性, 并鉴定了一些保守和新的非保守miRNAs; Tao等[16]利用Illumina/Solexa测序技术对蒙古沙冬青转录组测序并鉴定了一系列cDNA unigenes, 促进冷应激相关基因的研究。但是, 目前对于沙冬青属植物响应逆境胁迫的蛋白质组学研究相对较少。因此, 本文主要综述了沙冬青属植物对低温、干旱和盐碱等非生物胁迫响应的蛋白质组学最新研究进展, 旨在从蛋白质组水平为珍稀濒危沙冬青属植物抗逆分子机制的研究及保育工作提供一定的参考依据。
1 沙冬青属植物对低温胁迫的响应低温是影响植物生长发育和地理分布的重要非生物胁迫因子之一, 尤其是对多年生木本植物具有显著的影响[18]。沙冬青属植物对低温的耐受能力是对极端环境条件长期适应的结果。近年来, 随着蛋白质组学分析手段的发展与完善, 沙冬青属植物响应低温胁迫分子机制研究得到进一步解析。低温会影响沙冬青属植物蛋白质表达丰度的变化。Lu等[19]利用2-DE比较-29℃和-5℃ 2种不同环境条件下的新疆沙冬青叶片的蛋白质组特征, 发现在-29℃极端温度条件下, 沙冬青叶片中共有39个蛋白质点表达丰度发生了显著变化, 其中19个蛋白质点表达上调, 20个蛋白质点表达下调。利用MALDI-TOF- TOF鉴定了在2种不同环境条件下沙冬青叶片中多种差异显著蛋白质, 主要包括液泡膜H+-ATPase A1亚基、甘氨酸裂解系统T蛋白质等, 这些差异蛋白质的功能主要涉及光合作用、蛋白质合成及生物防御等。
低温胁迫下沙冬青属植物体内会有大量基因表达, 诱导合成冷胁迫响应蛋白质来抵御不利环境, 如热稳定的抗冻蛋白质(Antifreeze proteins, AFPs)、胚胎发育晚期丰富蛋白质(Late embryogenesis abundant proteins, LEA)等。研究表明, 逆境诱导蛋白质对于植物适应逆境环境起到保护作用, 可以提高植物耐胁迫能力[20]。一些植物中的热稳定蛋白质和抗冻性有关[21], 并发现它们和品种的抗冻性呈现相关性, 可以作为抗冻指标[22]。
1994年, Fei等[23]首次分离和部分纯化了木本植物蒙古沙冬青高活性的AFPs, 其抗冻活性高于鱼类及黑麦AFPs活性。随后研究从蒙古沙冬青分离纯化出了含糖基的抗冻蛋白质, 其二级结构中α-螺旋占11%, 反平行β-折叠占34%, 无规则卷曲占55%。植物AFPs与某些鱼类的AFPs具有一定的相似性, 但植物AFPs可能通过降低过冷点、抑制重晶化以及与其他多种抗寒冻因子协同响应低温胁迫[24]。Wei等[25]利用双向电泳-电泳回收法也进行相关蒙古沙冬青叶片中AFPs分离的研究, 获得AFPs分子量为40 kD, pI为9.0, 热滞活性为0.9℃(20 mg/ml)。经研究确定AFPs是一种糖蛋白。AFPs在蒙古沙冬青体内广泛分布且叶片中含量较高, 推测可能是维持蒙古沙冬青抗冻性的重要物质。在天山高寒区珠芽蓼(Polygonum viviparum L.)叶片中也发现具有抗冻活性的糖蛋白, 塑造了冰缘植物抵御特殊高寒环境的抗冻机制[26]。研究表明AFPs是维持蒙古沙冬青和珠芽蓼抗冻性的重要蛋白质。
为了揭示沙冬青抗冻蛋白质抗冻特性的本质以及其热滞机制, 周晓蕾等[27]利用差示扫描量热法测定了沙冬青叶片的(Differential scanning calorimeter, DSC)曲线, 提取沙冬青叶片中的16种蛋白质组分直接配置成水溶液进行测定。以非抗冻蛋白质-牛血清白蛋白质(Bovine serum albumin, BSA)溶液为对照组, 发现沙冬青叶片16个蛋白质中, 非抗冻蛋白质的DSC曲线与BSA的DSC曲线十分相似, 而抗冻蛋白质与对照差别很大。结果表明, 当抗冻蛋白质体系内只含有少量冰晶核(< 5%)时, 即接近于自然条件下植物遭遇冻害袭击时, 体内部分组织器官开始结冰初期的真实状况, 此时AFPs发挥显著的效应起到降低冰点的作用。
为了积极抵御极端低温环境, 沙冬青属植物体内也会积累起保护作用的功能性应激蛋白质LEA, LEA是一类亲水性的小分子蛋白质。相关研究从沙冬青叶片EST文库中获得了胚胎发育晚期丰富蛋白质基因AmlEA14, 该基因序列全长579 bp, 含有1个459 bp的开放阅读框, 编码152个氨基酸。推测该基因编码蛋白质为第4类LEA蛋白质, 含有一个比较保守的N2末端区域, 该区域可形成兼性α-螺旋, 构成保护结构域。亚细胞定位该蛋白质为细胞质蛋白质, 主要参与沙冬青长期低温防御机制[28]。上述研究结果表明, 沙冬青属植物适应寒冷沙漠生境的重要分子机制可能就在于这种特殊抗冻蛋白质、应激蛋白质等的存在与作用。
低温逆境信号也会诱导沙冬青属植物合成调控性蛋白质, 主要调控寒冷信号的传导以及相关抗寒冻基因的表达, 包括一些信号分子和转录因子等。未驯化植物感受到逆境胁迫信号刺激时会破坏其内稳态, 经过一系列调控从而建立新的耐受机制。王红蕾等[29]以蒙古沙冬青为研究对象, 克隆获得冷休克结构域蛋白质基因AmCSDP, 序列全长540 bp。其编码的冷休克结构域蛋白质(Cold shock domain, CSD)是含有不同数量冷休克结构域的低温响应蛋白质。该蛋白质含有180个氨基酸, 二级结构由8.9%的α-螺旋、47.8%的β-折叠和43.3%的无规则卷曲组成, N端含有冷休克结构域。
低温胁迫诱导AmCSDP在蒙古沙冬青中表达, 可能参与低温信号的转导, 调控参与植物抗寒力的形成。低温不仅诱导基因的表达, 还会影响低温响应蛋白质的翻译合成。Cao等[18]分析了蒙古沙冬青erbB-3结合蛋白1基因AmEBP1的功能表达, 其编码erbB-3结合蛋白质1(erbB-3bindingprotein1, EBP1)是重要的转录因子和转录共调节因子, 属于一类新型蛋白质。AmEBP1存在于细胞核中, 通过促进核糖体的合成及与相关冷诱导转录因子作用以及对下游保护蛋白质的翻译后修饰来提高低温胁迫下植物的抗寒性。
生理生态学研究表明, 低温会改变能量代谢, 即减少酶催化反应导致代谢不平衡引起氧化应激, 使胞内活性氧(Reactive oxygen species, ROS)清除酶活性增强。宋春祥等[30]以新疆沙冬青和蒙古沙冬青幼苗为研究材料, 在0℃、-5℃和-15℃低温处理后, 两种沙冬青叶片叶绿体内抗氧化酶类, 如超氧化物歧化酶(Superoxide dismutase, SOD)和过氧化物酶(Peroxidase, POD)活性随温度降低呈上升趋势。郁万文等[31]研究银杏(Ginkgo biloba Linn.)时, 同样发现低温胁迫下银杏叶片SOD和POD活性随着胁迫强度的加强不断升高, 清除体内有毒物质, 减少银杏因低温而造成的伤害。因此, 抗氧化酶系统可以作为低温胁迫评价的关键指标之一。
低温胁迫下沙冬青属植物虽然采取积极策略应对不良环境, 但低温也会使参与光合作用的相关蛋白质会受损, 不利于植物的光合作用。在0℃、-5℃和-15℃低温处理后, 沙冬青属植物叶绿素a(Chlorophyll a, Chla)和叶绿素b(Chlorophyll b, Chlb)含量显著降低, 而Chla/Chlb比值则呈上升趋势, Chla/Chlb可反映光系统的核心复合物与外周天线复合体对低温的损伤程度。结果表明, 低温条件下2种沙冬青外周天线复合体, 尤其是光系统Ⅰ(PhotosystemⅠ, PSⅠ)天线复合体严重受损, 导致光合作用效率降低。
2 沙冬青属植物对干旱胁迫的响应干旱是限制荒漠植物生长发育及繁殖的重要的环境因子。沙冬青属植物分布区处于我国荒漠区的东部及荒漠草原地, 所在地生境严酷, 气候干旱[32]。研究表明, 当植物受到干旱胁迫时会导致细胞和组织水势降低[14], 进而会引起植物在生理水平、细胞水平等发生一系列的变化[33]。
在生理水平上, 干旱胁迫会影响沙冬青属植物碳代谢过程和抗氧化代谢过程。干旱胁迫引起植物叶片气孔关闭, 二氧化碳摄入量减少, 导致光合电子传递过程与碳同化之间不平衡, 光合作用相关蛋白质受损。何芳兰等[34]以沙冬青幼苗为研究材料, 研究发现在干旱胁迫下光合作用减弱是由于气孔限制转变为非气孔限制, 严重损伤了光系统Ⅱ(PhotosystemⅡ, PSⅡ)反应中心, PSⅡ是存在于类囊体膜中的多亚基色素蛋白质复合体, 引起其光能原初捕捉能力和光能同化率减弱, 导致其光合作用能力减弱。
干旱胁迫引起的细胞代谢失衡也会影响蒙古沙冬青叶片光合作用过程中碳固定酶类的表达量发生变化。付晨熙等[35]对蒙古沙冬青叶片组织进行模拟干旱处理发现, 干旱处理1 h后, 蒙古沙冬青叶片中固定CO2的关键酶(Ribulose-1, 5-bisphosphate carboxylase/oxygenase, Rubisco)大亚基表达量下调, 干旱处理72 h后其表达量又恢复到正常水平; 而叶绿体中负责光合过程碳固定的磷酸丙糖异构酶(Triosephosphate isomerase, TIM)表达量则持续上调。
综上所述, 干旱胁迫影响了蒙古沙冬青叶片的光合作用碳代谢过程, 但其能够采取积极的应答策略以适应逆境胁迫。在生理生化水平上荒漠植物为了抵御环境胁迫在体内也形成了一套抗氧化系统来保护植物细胞免受活性氧的氧化损害。刘家琼等[36]研究发现, 沙冬青在无灌溉条件下POD和过氧化氢酶(Catalase, CAT)活性均高于有灌溉条件下酶活性, 通过抗氧化酶活性升高来适应较高干旱胁迫的环境。也有相关研究报道干旱胁迫下沙冬青体内POD和CAT活性远高于中生植物, 表明沙冬青在干旱逆境下加强细胞免于伤害的能力和抗旱性。在荒漠半荒漠地区优势种超旱生灌木红砂(Reaumuria soongorica)体内POD和CAT活性也随着干旱胁迫的加剧而显著提高[37]。
在细胞水平上, 沙冬青属植物主要通过积累游离氨基酸和产生干旱诱导蛋白质来适应干旱环境。干旱胁迫可以诱导蛋白质的水解和氨基酸的积累, 刺激谷氨酸(Glutamic acid, Glu)合成脯氨酸(Proline, Pro)及其化合物, 同时抑制其氧化和蛋白质的合成[38]。脯氨酸是水溶性最大的氨基酸, 亲水性强, 具有较强的水合能力[39]。研究表明, 在轻微干旱时植物中就可以表现出脯氨酸的积累, 如柠条(Caragana korshinskii)、沙拐枣(Calligonum mongolicum)等荒漠植物[40]。
夏晗等[41]通过10%聚乙二醇(Polyethylene glycol, PEG)模拟干旱处理下蒙古沙冬青子叶脯氨酸质量浓度明显高于正常条件下子叶脯氨酸的含量。随后研究从蒙古沙冬青中克隆获得了脯氨酸转运体基因AmProT, 其编码的蛋白质二级结构含有11个跨膜区域, 属于典型的转运蛋白质[42]。
干旱胁迫也会使植物体内产生干旱诱导蛋白质。干旱诱导蛋白质一般分功能性蛋白质和调节性蛋白质两大类, 前者在细胞内发挥直接保护作用, 包括渗调蛋白质、离子通道蛋白质、LEA和代谢酶类等; 后者起间接保护作用, 主要参与水分胁迫的信号转导以及相关基因的表达调控, 包括磷脂酶、蛋白激酶、钙调素、G蛋白质、转录因子和一些信号分子等[43-44]。Guo等[45]研究发现, 在干旱胁迫下沙冬青钙信号转导蛋白基因AmCBl1表达量上调来提高抗旱性, 信号转导蛋白质(Calcineurin B-like proteins1, CBl1)与其下游的激酶(CBl-interacting protein kinase, CIPK)共同组成信号通路在植物应答生物和非生物胁迫中发挥重要作用。随后研究分离纯化了沙冬青CBl1蛋白质, 表明三体蛋白质可能是沙冬青CBl1发挥功能的单位[46]。由此可见, 沙冬青感受环境胁迫刺激后, 通过一系列信号转导, 激活下游的信号传递体, 使其尽可能快地对逆境做出反应, 增加其抗旱性。
干旱环境还会诱导植物产生一种特殊脱水蛋白质(Dehydrin, DHN), 通过对55个完整的脱水蛋白质氨基酸测序发现, 其都含有一个富含赖氨酸的K片段, 由K片段可形成一个兼性α螺旋。通过分析蒙古沙冬青AmDHN的表达, 发现其编码脱水蛋白质也含有K片段, 以提高其抗旱性。脱水蛋白质基因在其他荒漠植物也有表达, 如紫花针茅(Stipa purpurea)的SpDHN1和雪莲(Saussurea involucrata Kar.et Kin.)的SiDHN能够提高转基因拟南芥和转基因烟草的耐旱性[47]。从代谢和物种进化的角度来分析, 脱水蛋白质是荒漠植物对干旱环境趋同适应的分子水平表现。
近年来, 随着蛋白质组学技术的不断发展与完善, 相关研究解析了部分蒙古沙冬青适应干旱环境的抗逆分子机制。如付晨熙等[35]以蒙古沙冬青叶组织为研究对象, 以0 h为对照组, 比较20% PEG 6000胁迫处理沙冬青叶片1 h和72 h的2-DE电泳图谱, 发现差异表达蛋白质。利用MALDI-TOF- TOF共鉴定了40个差异表达蛋白质点, 主要包括PSⅡ亚基、Rubisco大亚基、Rubisco活化酶(Plant rubisco activase, RCA)、硫氧还蛋白质(Thioredoxin, Trx)等光合作用和ROS清除相关蛋白质; 通过GO功能分析表明这些蛋白质主要涉及到光合作用、ROS清除、蛋白质的合成、加工与降解等相关蛋白质。结果表明, 蒙古沙冬青叶片通过改变不同功能蛋白质的表达来维持光合作用进而适应干旱胁迫。
Sun等[48]利用iTRAQ技术研究了短期干旱胁迫下的蒙古沙冬青根部蛋白质磷酸化修饰特征, 并利用LC-MS/MS鉴定了参与短期干旱胁迫响应的磷酸化蛋白质, 通过GO功能分析表明这些蛋白主要涉及参与信号转导和转录调控、渗透调节、应激反应和防御、表观遗传调控等相关蛋白质。推测蒙古沙冬青可能通过磷酸化蛋白质以及相关信号传导和代谢途径对干旱胁迫作出应答。
3 沙冬青属植物对盐胁迫的响应土壤盐渍化是严重影响植物生长发育和区域分布的非生物限制因子, 与植物生理和代谢密切相关。盐胁迫对植物的危害主要体现在离子胁迫和渗透胁迫等方面。离子胁迫使大量的Na+进入到植物体内, 打破植物体内原有的离子平衡, 影响细胞的代谢以及细胞K+/Na+比率, 破坏膜结构和酶系统。渗透胁迫使土壤中的水势降低, 引起植物体内水分亏缺。
植物受到环境高盐信号诱导后, 通过信号转导调控基因表达和代谢方式, 进而调整自身的形态或生理状态以适应不利环境。研究表明, 一些参与编码通道蛋白质、信号转导途径组分以及位于信号级联系统中介导信号传递的各种激酶在植物盐胁迫应答过程中发挥重要作用。智冠华等[49]研究表明, 在盐胁迫下沙冬青锌指蛋白基因AmZFPG表达上调, 锌指蛋白(Zinc finger protein, ZFPG)是普遍存在于真核生物中参与细胞的分化、增殖、凋亡等多种重要生命活动的转录因子之一。ZFPG参与高盐胁迫相关的信号转导和应答反应, 调控下游效应基因的表达, 进而调节植物生理生化, 提高植物的耐盐性。
Wang等[50]研究发现胡杨(Populus euphratica)的一个锌指蛋白基因PSTZ在烟草中过表达使转基因烟草的抗盐性较野生型显著提高。为了减轻盐对植物的伤害, 植物通过其他途径调整盐胁迫防御策略, 如植物在H+ -ATP酶的驱动下, 通过质膜Na+/H+逆向转运蛋白将Na+排出胞外, 同时依赖于液泡膜Na+/H+逆向转运蛋白将Na+泵入液泡实现离子区域化, 形成胞外、胞质、液泡三者间的离子平衡。Wei等[51]克隆和分析了沙冬青Na+/H+逆向转运蛋白(Tonoplast Na+/H+ antiporters, NHX)基因AmNHX2的功能表达, 研究表明在盐胁迫下沙冬青Na+/H+逆向转运蛋白基因AmNHX2表达上调, 减少盐胁迫的毒害作用。
生理生态研究表明, 沙冬青属植物为清除高盐产生活性氧ROS, 细胞内相关ROS类物质清除途径相关酶类活性增强。李婧男等[52]研究了盐胁迫对蒙古沙冬青幼苗抗氧化酶类活性的变化, 低浓度(0-0.7%)盐胁迫下SOD和POD的活性升高, SOD对盐胁迫所产生超氧阴离子自由基、POD对产生的过氧化氢发挥着有效清除作用。沙冬青属植物为了积极响应盐胁迫, 通过积累可溶性糖等渗透调节物质调节细胞的渗透势, 同时渗透调节物质作为活性氧的清除剂, 保护蛋白质分子和酶活性。
4 小结与展望植物对逆境胁迫的响应是十分复杂的生理生化过程, 其分子机制至今尚未完全阐明。近年来, 蛋白质组学被引入沙冬青属植物响应逆境胁迫的研究中, 从模式植物扩展到木本植物的蛋白质组学研究。目前, 应用2-DE和质谱鉴定技术、iTRAQ技术进行的沙冬青属蛋白质组学研究发现, 在低温、干旱及盐胁迫下, 一些参与信号转导途径的信号分子或转录因子表达量升高, 揭示胁迫和信号物质间的关系, 并调控下游相关效应基因的表达, 提高植物的耐受力。
在低温胁迫条件下发现并分离纯化了高活性的热稳定的抗冻蛋白质, 可以揭示沙冬青属植物适应极端低温荒漠生境的分子机制。干旱胁迫下会诱导合成干旱诱导蛋白, 主要是与光合作用、参与信号转导和转录调控、ROS清除、蛋白质的合成、加工与降解等相关蛋白质。干旱胁迫下会诱导植物合成脱水蛋白质等, 是荒漠植物响应干旱环境趋同适应的分子体现。在盐胁迫下相关离子通道蛋白的表达上调, 表明离子或渗透压平衡发生了变化。此外, ROS清除剂在低温、干旱、高盐胁迫时其活性升高, 表明沙冬青属植物在高ROS水平下会采取抗氧化的预防措施。上述研究从一定程度上揭示了沙冬青适应极端环境的抗逆分子机制。
沙冬青属植物对逆境胁迫的响应是一个非常复杂的动态变化过程。目前, 沙冬青属植物蛋白质组研究主要依赖二维凝胶电泳, 基于非凝胶的定量蛋白质组学技术运用并不广泛。2-DE分离蛋白质范围较窄、低丰度膜蛋白质难以检测等不足极大限制了其进一步的应用。未来研究可应用多种新型蛋白质组学技术, 如CE、PUP-IT、4-DES等, 来研究蛋白质的翻译后修饰、蛋白质复合体及蛋白质-蛋白质相互作用网络。截至目前, 沙冬青属植物蛋白质组研究主要集中于蒙古沙冬青, 而新疆沙冬青的蛋白质组研究相对较少; 沙冬青属植物响应各种生物逆境胁迫的蛋白质组学研究尚处于起步阶段, 未来研究应进一步探讨沙冬青属植物应答各种生物胁迫的机制。鉴于此, 综合利用蛋白质组学、基因组学、转录组学、代谢组学、生物信息学等多种分析方法有利于沙冬青属植物抗逆分子机制的深度揭示及保育工作的有效开展。
| [1] |
王有德, 何全发, 王兴东, 等. 天然沙冬青生长、更新状况调研及利用前景探讨[J]. 宁夏农林科技, 2004(3): 28-31. DOI:10.3969/j.issn.1002-204X.2004.03.013 |
| [2] |
傅立国. 中国植物红皮书:稀有濒危植物.第一册[M]. 北京: 科学出版社, 1991.
|
| [3] |
苏志豪, 师玮, 卓立, 等.沙冬青(Ammopiptanthus)的遗传结构与保育[J]. 2018(1): 163-171.
|
| [4] |
李慧卿, 马文元, 李慧勇. 沙冬青抗逆性及开发利用前景分析研究[J]. 世界林业研究, 2000, 13(5): 67-71. DOI:10.3969/j.issn.1001-4241.2000.05.012 |
| [5] |
Huang G, Ma S, Bai L, et al. Signal transduction during cold, salt, and drought stresses in plants[J]. Molecular Biology Reports, 2012, 39(2): 969-987. DOI:10.1007/s11033-011-0823-1 |
| [6] |
Wasinger VC, Cordwell SJ, Cerpa-Poljak A, et al. Progress with gene-product mapping of the Mollicutes:Mycoplasma genitalium[J]. Electrophoresis, 1995, 16(7): 1090-1094. |
| [7] |
王兴华, 王光耀, Keong TK, 等. 蛋白质组学研究的原理、技术与应用[J]. 智慧健康, 2016, 2(4): 7-12. |
| [8] |
Xia F, Yao X, Tang W, et al. Isobaric tags for relative and absolute quantitation(iTRAQ)-based proteomic analysis of hugan qingzhi and its protective properties against free fatty acid-induced L02 hepatocyte injury[J]. Frontiers in Pharmacology, 2017, 8: 99. |
| [9] |
Wang X, Chen G, Liu H, et al. Four-dimensional orthogonal electrophoresis system for screening protein complexes and protein-protein interactions combined with mass spectrometry[J]. Journal of Proteome Research, 2010, 9(10): 5325-5334. DOI:10.1021/pr100581x |
| [10] |
Liu Q, Zheng J, Sun W, et al. A proximity-tagging system to identify membrane protein-protein interactions[J]. Nature Methods, 2018, 15(9): 715-722. DOI:10.1038/s41592-018-0100-5 |
| [11] |
Sriram R, Sahni AK, Dudhat VL, et al. Matrix-assisted Laser desorp-tion/ionization-time of flight mass spectrometry(MALDI-TOF MS)for rapid identification of Mycobacterium abscessus[J]. Medical Journal Armed Forces India, 2018, 74(1): 22-27. DOI:10.1016/j.mjafi.2017.02.006 |
| [12] |
Wu M, Sun R, Wang M, et al. Analysis of perfluorinated compounds in human serum from the general population in Shanghai by Liquid chromatography-tandem mass spectrometry(LC-MS/MS)[J]. Chemosphere, 2017, 168: 100-105. DOI:10.1016/j.chemosphere.2016.09.161 |
| [13] |
Kosová K, Vítámvás P, Urban MO, et al. Plant abiotic stress proteomics:The major factors determining alterations in cellular proteome[J]. Frontiers in Plant Science, 2018, 9: 122. DOI:10.3389/fpls.2018.00122 |
| [14] |
Kosová K, Vítámvás P, Prášil IT, et al. Plant proteome changes under abiotic stress-contribution of proteomics studies to understanding plant stress response[J]. Journal of Proteomics, 2011, 74(8): 1301-1322. DOI:10.1016/j.jprot.2011.02.006 |
| [15] |
Fei G, Ning W, Li H, et al. Identification of drought-responsive microRNAs and their targets in Ammopiptanthus mongolicus by using high-throughput sequencing[J]. Sci Rep, 2016, 6: 34601. DOI:10.1038/srep34601 |
| [16] |
Tao P, Ye C, Xia X, et al. De novo sequencing and transcriptome analysis of the desert shrub, Ammopiptanthus mongolicus, during cold acclimation using Illumina/Solexa[J]. BMC Genomics, 2013, 14(1): 488. DOI:10.1186/1471-2164-14-488 |
| [17] |
Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures:towards genetic engineering for stress tolerance[J]. Planta, 2003, 218(1): 1-14. DOI:10.1007/s00425-003-1105-5 |
| [18] |
Cao P, Song J, et al. Characterization of multiple cold induced genes from Ammopiptanthus mongolicus and functional analyses of gene AmEBP1[J]. Plant Mol Biol, 2009, 69(5): 529-539. DOI:10.1007/s11103-008-9434-1 |
| [19] |
Lu C, Yin L, Li K. Proteome expression patterns in the stress tolerant evergreen Ammopiptanthus nanus under conditions of extreme cold[J]. Plant Growth Regulation, 2010, 62(1): 65-70. DOI:10.1007/s10725-010-9487-4 |
| [20] |
Chory J, Wu D. Weaving the complex web of signal transduction[J]. Plant Physiol, 2001, 125(1): 77-80. DOI:10.1104/pp.125.1.77 |
| [21] |
Kazuoka T, Oeda K. heat-stable COR(cold-regulated)proteins associated with frezzing tolerance in spinach[J]. Plant & Cell Physiology, 1992, 33(7): 1107-1114. |
| [22] |
Houde M, Danyluk J, Laliberté J-F, et al. Cloning, characterization, and expression of a cDNA encoding a 50-kilodalton protein specifically induced by cold acclimation in wheat[J]. Plant Physiol, 1992, 99(4): 1381-1387. DOI:10.1104/pp.99.4.1381 |
| [23] |
Fei Y, Sun L, Huang T, et al. Isolation and identification of antifreeze protein with high activity in Ammopiptanthus mongolicus[J]. Acta Botanica Sinica, 1994, 36(8): 649-650. |
| [24] |
费云标, 魏令波, 等. 沙冬青抗冻蛋白的分离、纯化及其理化特性分析[J]. 科学通报, 2000, 45(20): 2185-2189. DOI:10.3321/j.issn:0023-074X.2000.20.012 |
| [25] |
Wei L, Jiang Y, Shu N, et al. Biological characterization of heat-stable antifreeze proteins from Leaves of Ammopiptanthus mongolicus[J]. Acta Botanica Sinica, 1999, 41(8): 837-841. |
| [26] |
祭美菊, 安黎哲, 陈拓, 等.天山寒区冰缘植物珠芽蓼叶片抗冻蛋白的发现[J]. 2001, 23(4): 342-345.
|
| [27] |
周晓蕾, 陈滔滔, 王保怀, 等. 沙冬青抗冻蛋白热滞活性的DSC研究[J]. 物理化学学报, 2001, 17(1): 66-69. DOI:10.3866/PKU.WHXB20010114 |
| [28] |
师静, 等. 沙冬青胚胎晚期发生丰富蛋白基因序列及表达特性分析[J]. 北京林业大学学报, 2012, 34(4): 114-119. |
| [29] |
王红蕾, 王艳萍, 等. 沙冬青AmCSDP基因特性及转基因烟草的抗寒性分析[J]. 园艺学报, 2017, 44(4): 712-722. |
| [30] |
宋祥春, 赵惠新, 等. 低温对两种沙冬青幼苗光合生理指标的影响[J]. 新疆大学学报:自然科学版, 2009, 26(3): 342-346. |
| [31] |
郁万文, 曹福亮, 汪贵斌. 低温胁迫下银杏活性氧代谢与膜伤害的关系[J]. 东北林业大学学报, 2010, 38(7): 46-48. DOI:10.3969/j.issn.1000-5382.2010.07.015 |
| [32] |
刘家琼, 邱明新. 沙冬青植物群落研究[J]. 中国沙漠, 1995, 15(2): 109-115. |
| [33] |
Rovedahoyos G, Fonsecamoreno LP. Proteomics:a tool for the study of plant response to abiotic stress[J]. Agronomía Colombiana, 2011, 29(2): 412-422. |
| [34] |
何芳兰, 韩生慧, 等. 土壤水分对沙冬青幼苗生长及其光合荧光参数的影响[J]. 中国农学通报, 2014, 30(16): 62-66. DOI:10.11924/j.issn.1000-6850.2013-2955 |
| [35] |
付晨熙, 肖自华, 高飞, 等. 干旱胁迫下蒙古沙冬青叶片蛋白质组学研究[J]. 生物技术通报, 2017, 33(6): 69-80. |
| [36] |
刘家琼, 周湘红. 几种固沙植物过氧化物酶、过氧化氢酶活性及其同工酶的初步分析[M]. 兰州: 甘肃科技出版社, 1993.
|
| [37] |
白娟, 龚春梅, 王刚, 等.干旱胁迫下荒漠植物红砂叶片抗氧化特性[J]. 2010, 30(12): 2444-2450.
|
| [38] |
Riazi A, Matsuda K, Arslan A. Water-stress induced changes in concentrations of proline and other solutes in growing regions of young barley leaves[J]. J Exp Bot, 1985, 36(172): 1716-1725. |
| [39] |
李慧卿, 马文元. 沙生植物抗旱性比较的主要指标及分析方法[J]. 干旱区研究, 1998(4): 12-15. |
| [40] |
罗青红, 宁虎森, 何苗, 等. 5种沙地灌木对干旱胁迫的生理生态响应[J]. 林业科学, 2017, 53(11): 29-42. DOI:10.11707/j.1001-7488.20171104 |
| [41] |
夏晗, 黄金生. 低温、干旱和盐胁迫下沙冬青幼苗脯氨酸含量的变化[J]. 吉林林业科技, 2007, 36(4): 1-2. DOI:10.3969/j.issn.1005-7129.2007.04.001 |
| [42] |
岳光振, 金曼, 李俊林, 等. 沙冬青脯氨酸转运体基因的克隆及表达分析[J]. 生物技术通报, 2015, 31(5): 106-112. |
| [43] |
颜华, 贾良辉, 王根轩. 植物水分胁迫诱导蛋白的研究进展[J]. 生命的化学, 2002, 22(2): 165-168. DOI:10.3969/j.issn.1000-1336.2002.02.028 |
| [44] |
林秀琴, 袁坤, 王真辉, 等. 植物响应逆境胁迫的比较蛋白质组学研究进展[J]. 热带农业科学, 2009, 29(2): 52-57. DOI:10.3969/j.issn.1009-2196.2009.02.013 |
| [45] |
Guo L, Yu Y, Xia X, et al. Identification and functional characterisation of the promoter of the calcium sensor gene CBl1 from the xerophyte Ammopiptanthus mongolicus[J]. BMC Plant Biology, 2010, 10: 18. DOI:10.1186/1471-2229-10-18 |
| [46] |
丁志强, 尚桂军, 李娜, 等. 沙冬青CBl1蛋白纯化及性质研究[J]. 中国生物工程杂志, 2011, 31(2): 23-29. |
| [47] |
张美, 张会. 胚胎发育晚期丰富蛋白(LEA蛋白)与植物抗逆性研究进展[J]. 生物资源, 2017, 39(3): 155-161. |
| [48] |
Sun H, Xia B, Wang X, et al. Quantitative phosphoproteomic analysis provides insight into the response to short-term drought stress in Ammopiptanthus mongolicus roots[J]. International Journal Molecular Sciences, 2017, 18(10): 2158. DOI:10.3390/ijms18102158 |
| [49] |
智冠华, 史军娜, 赵晓鑫, 等. 转沙冬青锌指蛋白基因AmZFPG烟草非生物胁迫抗性分析[J]. 园艺学报, 2013, 40(4): 713-723. |
| [50] |
Wang J, Xia X, Wang J, et al. Stress responsive zinc-finger protein gene of Populus euphratica in tobacco enhances salt tolerance[J]. J Integr Plant Biol, 2008, 50(1): 56-61. DOI:10.1111/jipb.2008.50.issue-1 |
| [51] |
Wei Q, Guo Y, Cao H, et al. Cloning and characterization of an AtNHX2-like Na +/H + antiporter gene from Ammopiptanthus mongolicus(Leguminosae)and its ectopic expression enhanced drought and salt tolerance in Arabidopsis thaliana[J]. Plant Cell Tissue & Organ Culture, 2011, 105(3): 309-316. |
| [52] |
李婧男, 刘强, 贾志宽, 等. 盐胁迫对沙冬青幼苗生长与生理特性的影响[J]. 植物研究, 2009, 29(5): 553-558. |