手性胺及其衍生物是单一对映体药物的重要分支, 是众多医药中间体及农用化学品的结构单元[1], 目前有超过70%的药物都是手性胺及其衍生物, 包括神经类、抗高血压及心脑血管等药物[2]。手性胺的不对称合成方法主要包括化学法合成或生物酶催化法合成, 使用化学法合成手性胺合成步骤繁多, 条件苛刻, 污染严重, 在实际大规模生产中有诸多限制[3-4]。因此, 探索更加绿色高效的生物酶催化法显得尤为重要。
手性胺的生物酶催化法常用的酶主要包括转氨酶[5]、单胺氧化酶[6]、脱氢酶[7]和亚胺还原酶[8]等。相比其他几种酶, 亚胺还原酶具有催化合成手性仲胺和叔胺的独特优势[9], 近几年来逐渐成为生物催化合成手性胺的研究热点。
亚胺还原酶主要来源于链霉菌属、芽孢杆菌属、类芽孢杆菌属等微生物, 催化S或R构型的手性胺的合成, 其中S型亚胺还原酶相较R型来说底物识别范围更广[1], 来源于蜡状芽孢杆菌的亚胺还原酶就是一种S型亚胺还原酶。Man等[10]通过底物特异性的研究发现这种来源的酶能催化多种亚胺还原成手性胺, 相比Mitsukura等[11]发现的链霉菌中的S-亚胺还原酶来说在相同反应条件下活性更高。然而, 由于亚胺还原酶是一类依赖于辅酶NADPH的氧化还原酶, 该酶催化前手性的亚胺不对称合成手性胺的过程中需要消耗等量的辅酶NADPH[12], 而辅酶NADPH价格昂贵且稳定性低, 极大地提高了手性合成胺的成本。
本研究以来源于蜡状芽孢杆菌的亚胺还原酶和来源于枯草芽孢杆菌的葡萄糖脱氢酶为模板, 利用无缝克隆的手段在pET28a质粒中引入第二个T7启动子和rbs序列, 首次构建了S-亚胺还原酶和葡萄糖脱氢酶的单质粒双启动子共表达系统, 并以大肠杆菌为表达宿主实现了辅酶NADPH的再生, 以全细胞为催化剂催化手性仲胺的合成。由于很多亚胺在水溶液中不稳定, 因此, 本研究选取了pH中性条件下在水溶液中几乎不会水解的亚胺2-甲基吡咯啉(2MPN)为模式底物, 检验双酶共表达的全细胞催化剂的反应效率。同时, 本研究探究了温度、pH及有机溶剂对胞内双酶反应的影响, 进一步优化了全细胞双酶反应的条件, 旨为亚胺还原酶高效合成手性胺奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种和质粒实验所用菌株E.coli DH5α和Bl21(DE3)以及质粒pET28a为本实验室保藏, 重组质粒pET28a-IRED及pET28a-GDH为本实验室构建及保藏。
1.1.2 培养基LB培养基包括0.5%酵母提取物, 1%蛋白胨, 1%氯化钠和1.5%琼脂(固体培养基添加), 于121℃灭菌15 min, 添加卡那霉素至终浓度100 mg/ml。
1.1.3 主要试剂TaqDNA Polymerase购于Takara公司, Exnase购于Vazyme公司, DpnⅠ酶购于Thermo Fisher Scientific公司, PCR产物回收试剂盒、质粒小提试剂盒和DNA trans2K PlusMarker购于TransGen公司, NADP+购于北京赛谱锐思公司, GITC、2-MPN和S-2MP购于上海笛柏生物公司, 引物合成和测序由北京睿博兴科公司完成。
1.1.4 主要仪器PCR仪和SDS-PAGE蛋白电泳系统购于美国Bio-rad公司, 高效液相色谱仪Waters600购于美国Waters公司。
1.2 方法 1.2.1 共表达重组质粒pET28a-IRED-GDH的构建利用无缝克隆的技术将质粒pET28a-GDH中酶切位点Bgl Ⅱ至gdh片段克隆至质粒pET28a-IRED中, 构建共表达重组质粒pET28a-IRED-GDH, 使得共表达基因具有独立的T7启动子和rbs序列。以质粒pET28a-IRED和质粒pET28a-GDH为模板, 分别以28a-IRED-F/R和GDH-F/R为引物, PCR扩增制备线性化克隆载体pET28a-IRED和插入片段, 使用DpnⅠ酶降解PCR扩增产物中的环状质粒模板, PCR产物胶回收后, 配制重组反应体系, 37℃反应30 min, 重组反应后的产物转化到大肠杆菌DH5α中, 涂布到卡那抗性平板并通过菌液PCR验证阳性克隆, 送至公司测序。菌液PCR所用引物为IRED-GDH-F/R。将测序验证结果正确的阳性转化子转化至大肠杆菌表达宿主Bl21(DE3)中, 构建重组共表达菌Bl21(DE3)/pET28a-IRED-GDH。
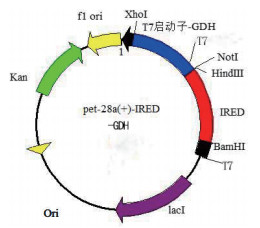
|
| 图 1 亚胺还原酶-葡萄糖脱氢酶共表达质粒构建图 |
将构建好的共表达重组菌株Bl21(DE3)/ pET28a-IRED-GDH接种于100 mL卡那抗性的LB培养基中, 37℃、200 rpm恒温摇菌3 h, 至OD600值约为0.8时加入0.1 mmol/L IPTG诱导蛋白表达, 于20℃诱导过夜。诱导21 h后收集菌体, 磷酸缓冲液洗涤菌体后重悬菌体, 冰浴超声破碎15 min, 离心后取上清用于SDS-PAGE检测蛋白表达和酶活测定。亚胺还原酶和葡萄糖脱氢酶的酶活测定方法参考文献[1, 13]。酶活力单位U定义为:在30℃, pH 7.5条件下, 每分钟还原(氧化)1 µmol NADPH(NADP+)的酶量。
1.2.3 重组菌全细胞催化制备手性胺以重组共表达菌株为全细胞催化剂, 催化亚胺2-甲基吡咯啉(2MPN)合成(S)-2-甲基吡咯烷((S)-2MP)。活性测定的标准反应体系包括5 mmol/L 2MPN、50 mmol/L D-葡萄糖、0.5 mmol/L NADP+、适量有机溶剂甲醇, 以10 g/L重组菌株作为催化剂, 反应在30℃、pH 7.5的磷酸缓冲液中进行。反应结束后用二氯甲烷萃取产物。实验以菌株Bl21(DE3)/ pET28a为空白对照。
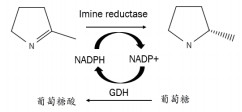
|
| 图 2 双酶反应合成手性胺示意图 |
HPLC检测产物(S)-2MP的生成参考文献[1]的方法。以2, 3, 4, 6-乙酰基-β-D-吡喃葡萄糖基异硫氰酸酯(GITC)为柱前衍生化试剂, 取50 µL反应后的溶液, 与100 µL 0.8%(W/V)的GITC(溶于乙腈)和50 µL 0.2%(V/V)的三乙胺(溶于乙腈)混合, 40℃反应1 h后用HPLC检测产物生成情况。采用色谱柱为普通C18反向色谱柱, 流动相为甲醇:水=1:1, 流速为1 mL/min, 检测波长为254 nm。柱前衍生化后HPLC可将2-甲基吡咯烷的对映体分开, 利用HPLC图谱中产物峰面积和浓度成正比的关系可绘制产物标准曲线, 通过标准曲线和实际反应后的产物峰面积, 可计算产物浓度, 从而计算反应转化率=实际反应产物峰面积/理论完全反应产物峰面积*100%[11]。
1.2.5 温度、pH和有机溶剂对双酶反应的影响设置10-50℃的温度梯度, 初始pH 7.5, 添加5 mmol/L 2MPN、50 mmol/L D-葡萄糖、0.5 mmol/L NADP+和适量甲醇, 反应24 h; 设置pH 5-11的pH梯度, 添加5 mmol/L 2MPN、50 mmol/L D-葡萄糖、0.5 mmol/L NADP+和适量甲醇, 30℃反应24 h; 设置0-40%的有机溶剂甲醇浓度梯度, 初始pH 8, 添加5 mmol/L 2MPN、50 mmol/L D-葡萄糖、0.5 mmol/L NADP+, 30℃反应24 h。通过测定反应的转化率, 研究温度、pH和有机溶剂浓度对全细胞双酶反应的影响。在最优反应条件下测定高底物浓度条件下全细胞双酶反应的转化率。
2 结果 2.1 重组共表达菌株Bl21(DE3)/pET28a-IRED-GDH的构建以pET28a-GDH为模板, 以GDH-F/R为引物, PCR扩增出重组质粒中酶切位点Bgl Ⅱ至gdh片段, 目的片段约1 000 bp; 以pET28a-IRED为模板, 以28a-IRED-F/R为引物, PCR扩增出线性化克隆载体, 线性化载体片段约6 300 bp(图 3-A)。DpnⅠ酶降解PCR产物中的环状质粒模板, 胶回收后的目的片段和线性化克隆载体在重组酶的作用下发生同源重组反应, 反应后转化入大肠杆菌DH5α中, 利用菌液PCR的方法筛选阳性克隆, 菌液PCR结果如图 3-B所示, IRED-GDH片段约2 000 bp大小。PCR鉴定成功的阳性克隆送至公司测序, 经测序序列与已知序列一致。将构建成功的重组质粒转化至大肠杆菌表达宿主Bl21(DE3)中, 成功构建重组共表达菌株Bl21(DE3)/pET28a-IRED-GDH。
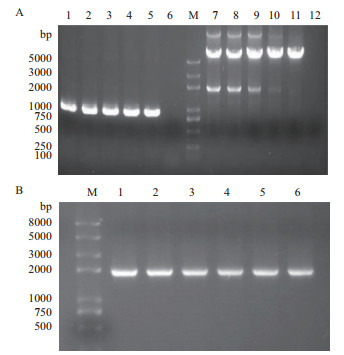
|
| 图 3 T7-GDH片段和线性化克隆载体的PCR扩增及阳性克隆鉴定 A:1-6:分别是 T7-GDH 片段在 50-70℃退火温度下的 PCR 产物,7-12:分别是线性化克隆载体 pET28a-IRED 在 50-70℃退火温度下的 PCR 产物;B:1-6:分别为转化后的单克隆菌液 PCR 结果;M:trans2K plus DNA marker |
重组共表达菌株Bl21(DE3)/pET28a-IRED-GDH经过诱导后收集菌体, 以12%的SDS-PAGE检测蛋白表达。SDS-PAGE结果如图 4所示, 重组菌株在35 kD和38 kD的位置有明显的蛋白表达。本研究使用的亚胺还原酶的理论蛋白大小约为35 kD, 由于其N端带有his tag和T7 tag大约为3 kD, 故表达的重组亚胺还原酶约为38 kD。本研究中的葡萄糖脱氢酶理论蛋白大小约为29 kD, 但由于其N端带有his tag和T7 tag, C端也带有his tag, 标签蛋白大小约为6 kD, 故表达的蛋白大小约为35 kD。SDS-PAGE电泳图的目的条带位置与两种蛋白的预测大小一致。酶活测定结果显示IRED和GDH的酶活分别为68 U/g和58 U/g。
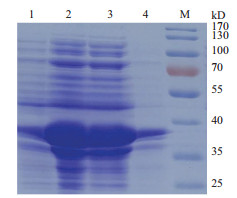
|
| 图 4 重组共表达菌株的SDS-PAGE检测 1:重组共表达菌株诱导前总蛋白;2:重组共表达菌株诱导后总蛋白;3:重组共表达菌株诱导后上清蛋白;4:重组共表达菌株诱导后沉淀蛋白;M:预染蛋白 Marker |
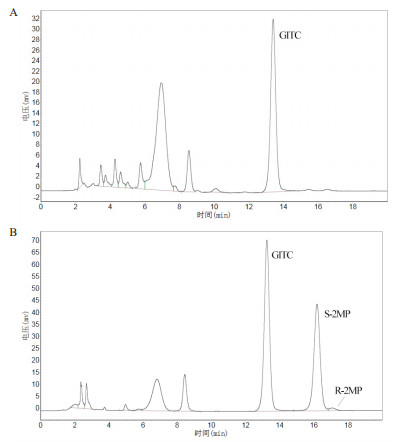
以重组共表达菌株Bl21(DE3)/ pET28a-IRED-GDH为催化剂, 以氧化型辅酶NADP+为辅酶供体, 催化5 mmol/L 2MPN的不对称还原反应, 反应后溶液经柱前衍生化后以HPLC检测手性仲胺S-2MP的产率和光学纯度, 结果如图 5所示。通过对比空质粒对照菌株反应液柱前衍生化后的HPLC检测图, 可看出反应后生成了手性胺S-2MP, 光学纯度﹥95%。
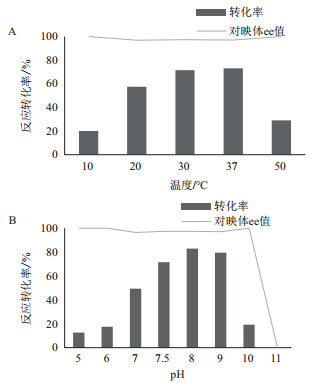
2.4 温度和pH对双酶反应的影响温度和pH对酶活有极大的影响, 不同的酶在作为生物催化剂时都有不同的最适温度和pH, 但当双酶偶联同时催化反应时, 需要综合考虑温度和pH对两种酶的酶活的影响。本研究分别考察了温度和pH对全细胞转化反应的影响, 结果如图 6所示。反应结果表明, 在30-37℃之间, IRED和GDH的活性都较强, 反应转化率较高; 双酶反应在弱碱性条件下转化率更高, 在pH 8时反应转化率达到最高。
|
| 图 5 重组共表达菌株生物催化反应HPLC图谱 A:对照菌株 HPLC 检测结果;B:重组共表达菌株 HPLC 检测结果 |
|
| 图 6 温度和pH对全细胞双酶反应的影响 |
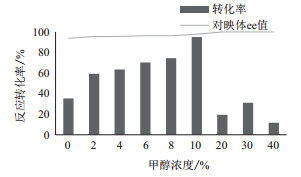
IRED可催化亚胺还原为手性胺, 而很多亚胺和手性胺不溶于水, 故在反应体系中添加适量的有机溶剂对于底物助溶和提高反应的转化率有重要意义。本研究考察了不同甲醇浓度对双酶反应的影响, 结果如图 7所示。结果表明, 利用全细胞进行双酶偶联反应时, 适量的甲醇对反应有促进作用, 当添加的甲醇浓度为10%时对反应速率的促进作用最大, 甲醇浓度大于10%时会抑制双酶反应的进行, 反应转化率较低。
|
| 图 7 甲醇浓度对双酶反应的影响 |
在最优反应条件下, 添加低浓度辅酶, 重组共表达菌株催化手性胺S-2MP合成的转化率及光学纯度均 > 95%;当提高底物浓度至30 mmol/L, 反应的转化率为55.9%, 光学纯度为93.4%ee。
3 讨论自2010年Mitsukura等[11]筛选出5种具有手性还原亚胺活性的链霉菌, 越来越多来源的亚胺还原酶被发现。目前亚胺还原酶的研究方向主要集中于新型亚胺还原酶的筛选及酶学性质的探索[15-16]。已有的研究表明, 纯化后的亚胺还原酶在辅酶NADPH的参与下可以催化手性胺的合成, 且与葡萄糖脱氢酶或葡萄糖-6磷酸脱氢酶联用可以实现辅酶再生, 有效减少辅酶在反应中的使用量[17]。但目前报道的辅酶再生系统都是添加游离的纯酶作为催化剂实现辅酶再生, 关于构建胞内双酶共表达偶联体系以实现辅酶NADPH再生的研究仍然较少。
以游离的两种纯酶偶联虽然也能实现辅酶NADPH的再生, 但需要菌体破碎和酶纯化等步骤, 反应后纯酶与产物难以分离, 操作繁琐且成本高昂, 相较之下利用全细胞转化则有更大的优势, 还可以重复利用[13]。通过构建亚胺还原酶和葡萄糖脱氢酶的双酶共表达菌株, 可以实现两种酶在同一个细胞内的表达, 减少了双菌双酶反应可能存在的双层细胞膜屏障问题[18]。本研究利用无缝克隆的手段在pET28a中引入了第二个T7启动子和rbs序列, 使得每个基因有独立的T7启动子系统, 构建了亚胺还原酶和葡萄糖脱氢酶的单质粒共表达系统。这种双启动子共表达系统相比于单启动子共表达系统来说, 蛋白表达量往往更高[19]。实验结果也显示, 在双启动子共表达系统的蛋白表达中, 上下游基因均有明显的蛋白表达。
本研究以S-亚胺还原酶和葡萄糖脱氢酶的共表达菌株为全细胞催化剂催化手性仲胺S-2MP的合成, 与亚胺还原酶和葡萄糖-6磷酸脱氢酶的纯酶联用反应相比[10], 减少了超声破碎及纯化蛋白的复杂步骤, 且共表达菌株在低辅酶的条件下反应转化率和光学纯度均可达到 > 95%的水平, 相较于Leipold等[20]利用单酶表达的重组菌催化反应, 使用的菌体量降低, 反应转化率提至1.7倍。本研究尝试提高底物浓度至30 mmol/L, 转化率仍然 > 55%, 说明大肠杆菌胞内共表达体系的构建有效解决了其胞内辅酶NADPH不足的问题, 保障了不对称转化过程中的辅酶供给。同时, 本研究以葡萄糖为辅酶再生底物, 相较于葡萄糖-6磷酸, 底物价格更为低廉, 有效降低了反应成本。但提高底物浓度后反应转化率下降, 其原因可能是反应过程中产生的大量葡萄糖酸引起了体系中pH的变化, 导致酶活下降, 这也说明利用该辅酶再生系统大规模制备手性胺需要严格控制pH的条件。
多酶共催化的最适反应条件往往需要综合考虑不同酶的酶活, 因此本研究还探究了温度和pH对胞内双酶反应的影响。根据已有的研究报道, 亚胺还原酶的最适温度在40℃左右, 最适pH往往在6.0-7.5之间[21], 该酶的最适pH就为6, 但共表达菌株在催化反应时pH的碱性耐受性更高, 在pH值达到9时仍能保留较高酶活, 这可能是因为细胞膜的保护作用减少了外部环境变化对酶活的影响。通过添加不同浓度甲醇, 全细胞催化的转化率也有所不同, 当甲醇浓度低于10%时, 甲醇浓度与转化率呈正相关的关系, 这有可能是因为低浓度的甲醇对底物有助溶作用且改变了细胞膜通透性, 当甲醇浓度高于10%时, 高浓度的有机溶剂使得胞内酶的酶活降低所致。
本研究通过构建葡萄糖脱氢酶和S-亚胺还原酶的胞内共表达体系实现了辅酶NADPH在胞内的再生, 以全细胞为催化剂反应增加了酶对外部环境变化的适应性, 减少了辅酶使用量, 降低了合成手性胺的成本, 为手性胺的规模制备奠定了基础。后续我们也将尝试利用该体系催化合成更复杂的手性胺及其衍生物。
4 结论本研究利用无缝克隆的手段构建了S-亚胺还原酶和葡萄糖脱氢酶的重组共表达菌株Bl21(DE3)/ pET28a-IRED-GDH, 在双启动子的调控下上下游基因均有明显的表达, SDS-PAGE结果显示蛋白大小与预期相符。以重组共表达菌株为全细胞催化剂催化手性仲胺的合成, 辅酶NADPH使用量大大降低。通过对反应温度、pH和有机溶剂甲醇浓度的探索, 优化了全细胞双酶反应的条件为:最适反应温度37℃, 最适反应pH 8, 最适甲醇浓度10%。
| [1] |
Mitsukura K, Kuramoto T, Yoshida T, et al. A NADPH-dependent(S)-imine reductase(SIR)from Streptomyces sp. GF3546 for asymmetric synthesis of optically active amines:purification, characterization, gene cloning, and expression[J]. Appl Microbiol Biotechnol, 2013, 97: 8079-8086. DOI:10.1007/s00253-012-4629-4 |
| [2] |
Ward J, Wohlgemuth R. High-Yield biocatalytic amination reactions in organic synthesis[J]. Current Organic Chemistry, 2010, 14(17): 1915. |
| [3] |
Guo C, Sun DW, Yang S, et al. Iridium-catalyzed asymmetric hydrogenation of 2-pyridyl cyclic imines:A highly enantioselective approach to nicotine derivatives[J]. J Am Chem Soc, 2015, 137(1): 90-93. DOI:10.1021/ja511422q |
| [4] |
Constable DJC, Dunn PJ, Hayler JD, et al. Key green chemistry rese-arch areas - a perspective from pharmaceutical manufacturers[J]. Green Chemistry, 2007, 9(5): 411-420. DOI:10.1039/B703488C |
| [5] |
Fuchs M, Kozelewski D, Tauber K, et al. Chemoenzymatic asymme-tric total synthesis of(S)-Rivastigmine using ω-transaminases[J]. Chem Commun, 2010, 46(30): 5500-5502. DOI:10.1039/c0cc00585a |
| [6] |
Ghislieri D, Turner N. Biocatalytic approaches to the synthesis of enantiomerically pure chiral amines[J]. Topics in Catalysis, 2014, 57(5): 284-300. DOI:10.1007/s11244-013-0184-1 |
| [7] |
Abrahamson MJ, Wong JW, Bommarius AS. The evolution of an amine dehydrogenase biocatalyst for the asymmetric production of chiral amines[J]. Advanced Synthesis & Catalysis, 2013, 355(9): 1780-1786. |
| [8] |
Mangassanchez J, France SP, Montgomery SL, et al. Imine reductases(IREDs)[J]. Current Opinion in Chemical Biology, 2016, 37: 19-25. |
| [9] |
Lenz M, Borlinghaus N, Weinmann L, et al. Recent advances in imine reductase-catalyzed reactions[J]. World J Microbiol Biotechnol, 2017, 33(11): 199. DOI:10.1007/s11274-017-2365-8 |
| [10] |
Man H, Wells E, Hussain S, et al. Structure, activity and stereosele-ctivity of NADPH-dependent oxidoreductases catalysing the S-sele-ctive reduction of the imine substrate 2-methylpyrroline[J]. Chembiochem, 2015, 16: 1052-1059. DOI:10.1002/cbic.v16.7 |
| [11] |
Mitsukura K, Suzuki M, Tada K, et al. Asymmetric synthesis of chiral cyclic amine from cyclic imine by bacterial whole-cell catalyst of enantioselective imine reductase[J]. Org Biomol Chem, 2010, 8: 4533-4535. DOI:10.1039/C0OB00353K |
| [12] |
Grogan G, Turner NJ. InspIRED by Nature:NADPH-dependent imine reductases(IREDs)as catalysts for the preparation of chiral amines[J]. Chemistry, 2016, 22: 1900-1907. DOI:10.1002/chem.201503954 |
| [13] |
杨兴龙, 穆晓清, 聂尧, 等. 亮氨酸脱氢酶与葡萄糖脱氢酶高效共表达制备L-叔亮氨酸[J]. 微生物学报, 2016, 56(11): 1709-1718. |
| [14] |
王玺, 段胜林, 熊舒莉, 等. 自诱导系统在酶促合成2' -脱氧胞苷中的应用[J]. 生物技术通报, 2014, 30(11): 225-232. |
| [15] |
Ganda M, Müllera H, Wardengab R, et al. Characterization of three novel enzymes with imine reductase activity[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 110(8): 126-132. |
| [16] |
Aleku GA, Man H, France SP, et al. Stereoselectivity and structural characterization of an imine reductase(IRED)from Amycolatopsis orientalis[J]. Acs Catalysis, 2016, 6: 3380-3889. |
| [17] |
Lenz M, Scheller PN, Richter SM, et al. Cultivation and purification of two stereoselective imine reductases from Streptosporangium roseum and Paenibacillus elgii[J]. Protein Expression & Purification, 2017, 133: 199-204. |
| [18] |
胡媛周, 文瑜, 魏东芝, 等. gdh和Ldh基因共表达重组大肠杆菌合成D-乳酸研究[J]. 药物生物技术, 2014, 21(1): 13-17. |
| [19] |
Kim JK, Kim HE, Lee KH, et al. Two-promoter vector is highly efficient for overproduction of protein complexes[J]. Protein Science, 2004, 13(6): 1698-1703. DOI:10.1110/(ISSN)1469-896X |
| [20] |
Leipold F, Hussain S, Ghislieri D, et al. Asymmetric reduction of cyclic imines catalyzed by a whole-cell biocatalyst containing an(S)-imine reductase[J]. Chemcatchem, 2013, 5(12): 3505-3508. DOI:10.1002/cctc.201300539 |
| [21] |
Mitsukura K, Suzuki M, Shinoda S, et al. Purification and character-ization of a novel(R)-imine reductase from Streptomyces sp. GF3587[J]. Biosci Biotechnol Biochem, 2011, 75: 1778-1782. DOI:10.1271/bbb.110303 |





