核酸适配体,又称适体(Aptamer),是一类短链的功能性寡核苷酸片段,可以是RNA、单链DNA,偶见报道为双链DNA。适体在盐溶液中形成凸环、发卡、假结、G-四碱基体等特殊的三维空间结构,在氢键、疏水作用力、范德华力等作用力下与靶标分子特异性结合[1]。适体与靶标分子结合特异性高且亲和力强,解离常数范围在10-12-10-9 mol/L之间[2],已被广泛地应用于分析、检测、治疗、传感器等多个领域[3]。作为功能性分子,适体在经过体外筛选后,需要对其特异性、稳定性、亲和力及与靶标间的相互作用等功能进行表征。现阶段常用的表征方法有点杂交、荧光免疫、流式细胞术和高效液相等。近年来,将适体作为识别分子应用于生物传感器也显示出了良好的应用前景[4]。石英晶体微天平(Quartz crystal microbalance,QCM)是利用石英晶体的压电效应,将电极表面的质量变化转化为振荡电路输出的电信号频率变化的一种生物传感器,由于具有灵敏度高,检测方便、迅速,装置简单,且在检测过程中无需标记等优点而得到重视[5]。现今基于适体的QCM传感器已经被用于小分子[6]、蛋白质[7]、细胞[8]、细菌[9]和病毒[10]等多种靶标的检测,并表现出一定的普适性。此外,QCM还具有实时监测,精确度高,稳定性强及可再生等优点[11]。因此,该技术被广泛地应用于高灵敏度生物传感器领域。基于此,本文将对基于适体的石英晶体传感器的相关研究及应用进行综述,旨在为适体的筛选以及适体在基础医学、临床诊断和疾病治疗中的进一步应用提供参考。
1 基于适体传感器的分类从结构上来看,基于适体的生物传感器主要由两个部分组成:一是利用适体分子作为感受器,具有识别能力;二是信号转换器,主要包括电化学信号转换器、光学信号转换器、压电石英晶体转换器等。当待测靶标分子与适体分子特异性结合后产生一个生物信号,适体传感器通过信号转换器将此信号转变并放大为可以输出的信号。
以电极作为换能器的电化学传感器起步较早,是将检测到的生物信号转换为电信号的一种传感系统,依据待测靶标与适体结合前后构象的变化,可以设计Signal-off[12-13]和Signal-on[14]两种模式的适体电化学传感器,前者出现结合后信号降低,而后者结合后信号增强,前者的灵敏度一般低于后者。目前来说,电化学生物传感器技术相对成熟,应用广泛。后期研究将其结合适体的特异性和亲和力研制出一种新型的电流型电化学传感器,用于针对凝血酶不同表位的两种适体的检测,最低可检测出10 nmol/L的凝血酶[15-17]。另外,我国西南大学实验室构建的基于壳聚糖/碳纳米管/石墨烯/铁氰化镍(CS-CNTs-Gra-FP)纳米复合材料的电化学适体传感器用于检测凝血酶适体也取得良好的结果。他们利用(CS-CNTs-Gra-FP)作为FP的固相载体,并结合金纳米技术,此方法不仅增大了电极的比表面积、电子的传输速率,同时也增加了FP的固载量,从而极大的提高了该类适体传感器的灵敏度,用来检测凝血酶适体检测限能达到3 pmol/L[18]。
光学生物传感器是利用待测靶标与光发生相互作用时,光的一些参数会发生变化,通过检测这些参数的变化,分析待测靶标的浓度和结构等特征来实现检测的。光学适体传感器可将适体识别得到的生物信号转化为光学信号输出,该技术可利用荧光、干涉、折射、表面等离子共振技术(Surface plasmon resonance technology,SPR)、椭偏、化学发光等多种方式进行检测,同时根据所选的检测材料的不同主要可分为光纤维适体传感器、表面等离子共振适体传感器、化学发光适体传感器和荧光适体传感器等。化学发光传感器作为学科交叉与渗透的产物,成为近年来非常活跃的研究领域,如酶基化学发光传感器[19]、免疫化学发光传感器[20]、化学发光反应同时作为分子识别反应的传感器[21]等。严喜鸾等[22]利用基于适体生物传感器的碱性磷酸酯酶化学发光检测腺苷,该方法以羧基磁珠为固相载体,将腺苷适体与地高辛修饰过的腺苷适体互补序列固定到羧基磁珠的表面,检测时先加入一定的待测靶标腺苷,再加入抗地高辛的碱性磷酸酯酶,用化学发光法检测发光值,根据靶标加入前后化学发光的变化强度来定量腺苷浓度,结果显示,在1.0×10-7-1.0×10-3 mol/L范围内,腺苷浓度的对数与发光强度呈线性关系(R2=0.976 9),检测限能达到1.0×10-7 mol/L。而Lee等[23]利用适体光纤生物传感器定量检测凝血酶与凝血酶适体的结合能力,检测限低至10 nmol/L。
压电晶体生物传感器是利用晶体的压电效应发展起来的,相对于之前的各种基于适体的生物传感器具有实时在线监测,灵敏度高,且不需要任何的标记,方便快捷的优势。此类传感器的研究相对更多,如压电免疫传感器[24]、氰根离子压电传感器[25]、石英晶体微天平[26]等。其中压电免疫传感器是在压电晶体的表面固定一层能与待测靶标特异性结合的适体,引起压电晶体的频率变化,根据频率的变化数值来定量测定待测靶标的含量。氰根离子压电传感器是在镀银的石英晶体表面修饰一层硫化银膜,该膜可选择性的与氰根小分子适体结合,引起压电晶体振荡频率的改变,此传感器用以检测水中的游离氰离子的线性范围可达到2×10-5-0.02 μmol/L。石英晶体微天平则是利用石英晶体芯片一面的电极进行化学反应,此芯片表面同时为质量传感器的传感面,可用来在线跟踪电极表面的质量变化。Abadian等[27]在芯片表面修饰了一层有代表性输尿管支架表面的聚合物,随后用尿素酶涂覆,以促进磷酸钙和磷酸镁的结晶,使用QCM定量检测聚合物表面上晶体沉积的变化。
2 基于适体的石英晶体微天平传感器基本原理该技术以适体为感应元件,石英晶体芯片作为换能器,将芯片表面吸附物质的质量信号转换为频率信号,用于检测适体与靶标间相互作用的一种质量敏感型压电传感器[28]。信号采集是在检测过程中石英晶体受到交变电压的影响产生振荡电路,当振荡频率与石英晶体的固有频率不一致时无法被记录,只有当两者的共振频率一致时,晶体芯片的振动信号最大,从而被记录。在一定条件下,当石英晶体表面吸附物质质量改变时,晶体固有频率随吸附质量的大小而改变,从而使得到的信号发生改变。1959年,Sauerbrey[29]研究表明,石英晶体表面质量负载与石英晶体频率变化之间存在以下关系:
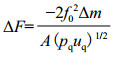
式中f0为石英晶体的基频,A为石英晶体电极的有效面积,ρq为石英晶体密度,μq为石英晶体剪切模量,Δm为石英晶体表面的质量变化,负号表明表面质量增加引起石英谐振器频率降低。由Sauerbrey方程可知,晶体表面质量变化与频率变化存在线性关系。基于适体的石英晶体微天平传感器在晶体芯片表面固定适体作为特异性的感应元件,与靶标结合过程中引起芯片表面吸附质量增大,从而引起频率下降,用于定性或者定量分析适体与靶标间的相互作用。
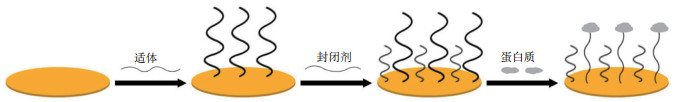
3 石英晶体微天平传感器在适体功能性表征方面的应用自1990年至今,已有大量适体被筛选出来,其靶标可分为小分子化合物、蛋白质、细胞、细菌、病毒及寄生虫,甚至是特异性的组织[30]等,石英晶体微天平所具有的特性,使其逐步成为近年来适体与靶标相互作用的表征和用于构建高灵敏的适体石英晶体传感器的方法之一。根据靶标的不同,现已应用于功能性表征的靶标主要为小分子或离子、蛋白质(图 1)、细胞或者细菌和病毒等,如表 1所示。
|
| 图 1 QCM用来表征蛋白质类靶标适体的示意图 |
石英晶体微天平技术作为微质量传感器,它独特的优势使得其被广泛应用于化学、物理、生物、医学和表面科学等领域中,用于进行待测物质的成分分析或者质量测定和黏弹性结构检测等,它表现出来的在线跟踪检测过程的变化是其他方法无法比拟的,将其应用于适体与靶标的亲和力表征中也同样不可替代。
4.1 表征小分子靶标的优势石英晶体微天平为质量依赖型传感器,相对分子质量较小,需要构建高灵敏度的生物传感器信号放大的过程必不可少。由于金纳米颗粒的密度大,适体修饰的金纳米颗粒易于修饰合成,故而金纳米颗粒的放大作用在检测中的使用最为广泛[43]。Dong等[44]根据Hg2+与短链HS-5'-(CH2)6-TTTT-3'能够形成T-Hg(Ⅱ)-T“三明治”结构的原理,并结合纳米金颗粒等材料,构建了基于适体的QCM传感器用于高敏检测Hg2+。该技术检测限可低至0.24 nmol/L,在特异性、可重复利用性不变的情况下,比Chen和Sheng等[45-46]构建的同类型的传感器检测限低一个数量级,比常规使用的比色法和荧光测定法高10-100倍。此外,Zheng等[47]结合金纳米颗粒的放大作用,利用特异性核酸适体不仅与靶标分子可进行特异性结合,同时可与互补链形成双链的特点,设计了末端带有-SH修饰的核酸适体互补序列,构建了基于适体与腺苷和互补序列间竞争性结合腺苷特异性检测QCM传感器,在腺苷浓度为0-2 μmol/L时,存在较好的线性关系(R2=0.991 48)。与之相似,Dong等[33]利用了两种两端可形成双链,中间部分均含茶碱特异性结合单元的RNA适体,利用QCM通过金纳米颗粒的放大作用,构建了高灵敏度的茶碱的检测方法,检测限可降低至8.2 nmol/L。Song等[48]构建了一种酶循环放大信号的ATP基于适体的QCM传感器,该方法延续了Özalp[32]基于适体QCM传感器进行ATP定量检测的高特异性,同时通过金纳米颗粒和酶循环方法双重方式进行信号放大,将检测限由10 μmol/L降低至1.3 nmol/L,是原方法的近10 000倍。
4.2 表征蛋白质靶标的优势以蛋白质为靶标的适体QCM传感器应用较广泛。首先,可用于适体使用条件的优化,Hianik等[49]利用QCM检测适体浓度、盐离子浓度、pH等因素对适体与凝血酶在芯片表面结合的影响,动态检测了适体与凝血酶结合过程中各影响因素造成的结合行为变化。Nübel等[50]通过适体QCM检测发现,特异性的肿瘤坏死因子α(Tumor necrosis factor α,TNFα)适体趋向于与多聚体形式的TNFα进行特异性结合,破解了该适体与靶细胞亲和力高但与靶蛋白的亲和力较弱的谜题,为该适体后期的使用提供了较有力的理论依据。其次,可用于蛋白质高灵敏度的检验,Chen等[35]利用金纳米粒的放大作用,运用适体QCM传感器将凝血酶的检测限由12.5 nmol/L降低至0.1 nmol/L,并在实际血清样品中取得较好的检测效果。另外,He等[51]通过金纳米粒检测技术和滚环扩增技术联合使用,将凝血酶的检测限降低至0.78 aM,可用于超高灵敏度的凝血酶检测。
4.3 表征病毒靶标的优势在病毒检测方面,Brockman等[42]构建了基于适体的QCM传感器用于检测禽流感病毒H5N1,结合磁性纳米微粒的信号放大作用,该传感器的检测限可达到1 HAU,并具有较高的特异性,同类型病毒H7N2、H9N2和H5N9等引起的信号响应均较小。此外,Wang等[52]结合高分子水凝胶技术,合成特异性的适体-高分子水凝胶复合物,固定在QCM表面后用于病毒的检测,检测限为0.0128 HAU,比Brockman的方法灵敏度高100倍,检测时间也由1 h缩短为0.5 h。随后,该团队结合碳量子点技术,将检测范围由原来的0.0128-0.64 HAU提升至0.4-32 HAU,检测时间有所缩短,并且该传感器有非常好的稳定性,存放96 d后其检测性能依然较好[53]。
对于石英晶体微天平传感器在适体性能表征方面的研究重点主要在于信号放大作用,但信号放大的过程中易造成非特异性偏差。本课题组正在利用QCM-D技术开展靶标为蛋白质的适体相关的实验项目[54],从目前的研究中推测:在使用QCM-D技术时需要特别关注的是蛋白质在芯片表面的非特异性吸附,所以不同的适体固定方法需要考虑添加不同的封闭剂进行封闭。现阶段对于细胞、细菌和病毒相关基于适体的石英晶体微天平传感器的报道较少,主要原因是这几类靶标在石英晶体微天平检测过程中易出现沉降现象及由于细胞等在溶液中可处于浮动状态,与芯片上固定的适体直接结合时会出现信号响应过小的现象,本课题组也相应的进行了精子细胞与对应适体的结合力表征,并联合显微镜等常规技术用以监测精子细胞在石英晶体芯片上的动态过程,目前精子细胞作为靶标相关的数据处理模型仍处于研发状态。因此,基于适体的石英晶体微天平传感器的应用中需要对信号响应放大及减少非特异性吸附等方面进行改进。同时,QCM-D技术的使用价格稍贵,仪器设备需要小心维护。
5 展望随着该类传感器越来越被学者关注,传感器存在的以上问题正在被逐步解决,应用范围也在逐渐扩大。适体化学成分可为DNA、RNA等,不仅可以用于适体与靶标结合行为的表征和高灵敏高特异性传感器的构建,还可作为其他基于适体传感器构建过程中辅助技术,常用于适体在传感器表面固定量的实时检测,并可与其他表征技术联用,多方面进行分子间相互作用的表征。除此之外,QCM在检测适体与靶标分子相互作用时越来越受到认可,可作为其他技术的验证性方法。
| [1] |
Hermann T, Patel DJ. Adaptive recognition by nucleic acid aptamers[J]. Science, 2000, 287(5454): 820-825. DOI:10.1126/science.287.5454.820 |
| [2] |
Huang R, Xi Z, He N. Applications of aptamers for chemistry analysis, medicine and food security[J]. Science China Chemistry, 2015, 58(7): 1122-1130. DOI:10.1007/s11426-015-5344-7 |
| [3] |
Song K, Lee S, Ban C. Aptamers and their biological applications[J]. Sensors, 2012, 12(12): 612-631. |
| [4] |
Jing M, Bowser MT. Methods for measuring aptamer-protein equilibria:a review[J]. Anal Chim Acta, 2011, 686(1-2): 9-18. DOI:10.1016/j.aca.2010.10.032 |
| [5] |
Cheng CI, Chang Y, Chu Y. Biomolecular interactions and tools for their recognition:focus on the quartz crystal microbalance and its diverse surface chemistries and applications[J]. Chem Soc Rev, 2012, 41(5): 1947-1971. DOI:10.1039/C1CS15168A |
| [6] |
Zhao M, Fan G, Chen J, et al. Highly sensitive and selective photoelectrochemical biosensor for Hg2+ detection based on dual signal amplification by exciton energy transfer coupled with sensitization effect[J]. Anal Chem, 2015, 24: 12340-12347. |
| [7] |
Politi J, Rea I, Nici F, et al. Nanogravimetric and optical characterizations of thrombin interaction with a self-assembled thiolated aptamer[J]. Journal of Sensors, 2016, 2016: 1-8. |
| [8] |
Shan W, Pan Y, Fang H, et al. An aptamer-based quartz crystal microbalance biosensor for sensitive and selective detection of leukemia cells using silver-enhanced gold nanoparticle label[J]. Talanta, 2014, 126: 130-135. DOI:10.1016/j.talanta.2014.03.056 |
| [9] |
Ozalp VC, Bayramoglu G, Erdem Z, et al. Pathogen detection in complex samples by quartz crystal microbalance sensor coupled to aptamer functionalized core-shell type magnetic separation[J]. Anal Chim Acta, 2015, 853: 533-540. DOI:10.1016/j.aca.2014.10.010 |
| [10] |
Xu L, Wang R, Kelso LC, et al. A target-responsive and size-dependent hydrogel aptasensor embedded with QD fluorescent reporters for rapid detection of avian influenza virus H5N1[J]. Sensors and Actuators B:Chemical, 2016, 234: 98-108. DOI:10.1016/j.snb.2016.04.156 |
| [11] |
MacKay S, Wishart D, Xing JZ, et al. Developing trends in aptamer-based biosensor devices and their applications[J]. IEEE Trans Biomed Circuits Syst, 2014, 8(1): 4-14. DOI:10.1109/TBCAS.2014.2304718 |
| [12] |
Hansen JA, Wang J, Kawde A, et al. Quantum-dot/aptamer-based ultrasensitive multi-analyte electrochemical biosensor[J]. J Am Chem Soc, 2006, 128(7): 2228-2229. DOI:10.1021/ja060005h |
| [13] |
Lu Y, Zhu N, Yu P, Mao L. Aptamer-based electrochemical sensors that are not based on the target binding-induced conformational change of aptamers[J]. Analyst, 2008, 133(9): 1256-1260. DOI:10.1039/b807913g |
| [14] |
Kang Y, Feng KJ, Chen JW, et al. Electrochemical detection of thrombin by sandwich approach using antibody and aptamer[J]. Bioelectrochemistry, 2008, 73(1): 76-81. DOI:10.1016/j.bioelechem.2008.04.024 |
| [15] |
Arroyo-Currás N, Scida K, Ploense KL, et al. High surface area electrodes generated via electrochemical roughening improve the signaling of electrochemical aptamer-based biosensors[J]. Anal Chem, 2017, 89(22): 12185-12191. DOI:10.1021/acs.analchem.7b02830 |
| [16] |
Abi A, Mohammadpour Z, Zuo X, et al. Nucleic acid-based electrochemical nanobiosensors[J]. Biosens Bioelectron, 2018, 102: 479-489. DOI:10.1016/j.bios.2017.11.019 |
| [17] |
Ikebukuro K, Kiyohara C, Sode K. Novel electrochemical sensor system for protein using the aptamers in sandwich manner[J]. Biosens Bioelectron, 2005, 20(10): 2168-2172. DOI:10.1016/j.bios.2004.09.002 |
| [18] |
肖丽娟, 孙娟, 柴雅琴. 基于壳聚糖/碳纳米管/石墨烯/铁氰化镍纳米复合材料构建的电化学适体传感器用于凝血酶的检测[J]. 化学传感器, 2014(3): 53-57. DOI:10.3969/j.issn.1008-2298.2014.03.009 |
| [19] |
Lv Y, Zhang Z, Chen F. Chemiluminescence microfluidic system sensor on a chip for determination of glucose in human serum with immobilized reagents[J]. Talanta, 2003, 59(3): 571-576. DOI:10.1016/S0039-9140(02)00568-4 |
| [20] |
Marquette CA, Blum LJ. Regenerable immunobiosensor for the chemiluminescent flow injection analysis of the herbicide 2, 4-D[J]. Talanta, 2000, 51(2): 395-401. DOI:10.1016/S0039-9140(99)00298-2 |
| [21] |
Zhao L, Li B, Zhang Z, et al. Chemiluminescent flow-through sensor for automated dissolution testing of analgin tablets using manganese dioxide as oxidate[J]. Sensors and Actuators, 2004, 97(2/3): 266-271. |
| [22] |
严喜鸾, 陈馨, 肖义陂, 等. 基于适体生物传感器的碱性磷酸酯酶化学发光检测腺苷[J]. 分析测试学报, 2017(4): 565-569. DOI:10.3969/j.issn.1004-4957.2017.04.022 |
| [23] |
Lee M, Walt DR. A fiber-optic microarray biosensor using aptamers as receptors[J]. Anal Biochem, 2000, 282(1): 142-146. DOI:10.1006/abio.2000.4595 |
| [24] |
Plomer M, Guilbault GG, Hock B. Development of a piezoelectric immunosensor for the detection of enterobacteria[J]. Enzyme Microb Technol, 1992, 14(3): 230-235. DOI:10.1016/0141-0229(92)90071-U |
| [25] |
Sun H, Zhang YY, Si SH, et al. Piezoelectric quartz crystal (PQC) with photochemically deposited nano-sized Ag particles for determining cyanide at trace levels in water[J]. Sensors and Actuators B:Chemical, 2005, 108(1-2): 925-932. DOI:10.1016/j.snb.2004.12.120 |
| [26] |
Bunroddith K, Viseshakul N, Chansiri K, et al. QCM-based rapid detection of PCR amplification products of Ehrlichia canis[J]. Anal Chim Acta, 2018, 1001: 106-111. DOI:10.1016/j.aca.2017.10.037 |
| [27] |
Abadian PN, Buch P, Goluch ED, et al. Real-time monitoring of urinary encrustation using a quartz crystal microbalance[J]. Anal Chem, 2018. DOI:10.1021/acs.analchem |
| [28] |
Song S, Wang L, Li J, et al. Aptamer-based biosensors[J]. TrAC Trends in Anal Chem, 2008, 27(2): 108-117. DOI:10.1016/j.trac.2007.12.004 |
| [29] |
Sauerbrey G. The use of quartz oscillators for weighing layers and for micro-weighing[J]. Z Physik, 1959, 155-206. |
| [30] |
Groff K, Brown J, Clippinger AJ. Modern affinity reagents:Recombinant antibodies and aptamers[J]. Biotechnology Advances, 2015, 33(8): 1787-1798. DOI:10.1016/j.biotechadv.2015.10.004 |
| [31] |
Osypova A, Thakar D, Dejeu J, et al. Sensor based on aptamer folding to detect low-molecular weight analytes[J]. Anal Chem, 2015, 87(15): 7566-7574. DOI:10.1021/acs.analchem.5b01736 |
| [32] |
Özalp VC. Acoustic quantification of ATP using a quartz crystal microbalance with dissipation[J]. Analyst, 2011, 136(23): 5046-5050. DOI:10.1039/c1an15762k |
| [33] |
Dong ZM, Zhao GC. A theophylline quartz crystal microbalance biosensor based on recognition of RNA aptamer and amplification of signal[J]. Analyst, 2013, 138(8): 2456-2462. DOI:10.1039/c3an36775d |
| [34] |
Yao C, Qi Y, Zhao Y, et al. Aptamer-based piezoelectric quartz crystal microbalance biosensor array for the quantification of IgE[J]. Biosens Bioelectron, 2009, 24(8): 2499-2503. DOI:10.1016/j.bios.2008.12.036 |
| [35] |
Chen Q, Tang W, Wang D, et al. Amplified QCM-D biosensor for protein based on aptamer-functionalized gold nanoparticles[J]. Biosens Bioelectron, 2010, 26(2): 575-579. DOI:10.1016/j.bios.2010.07.034 |
| [36] |
Sun W, Song W, Guo X, et al. Ultrasensitive detection of nucleic acids and proteins using quartz crystal microbalance and surface plasmon resonance sensors based on target-triggering multiple signal amplification strategy[J]. Anal Chim Acta, 2017, 978: 42-47. DOI:10.1016/j.aca.2017.04.047 |
| [37] |
Wu C, Du L, Zou L, et al. A biomimetic bitter receptor-based biosensor with high efficiency immobilization and purification using self-assembled aptamers[J]. Analyst, 2013, 20: 5989-5994. |
| [38] |
Du L, Wu C, Peng H, et al. Piezoelectric olfactory receptor biosensor prepared by aptamer-assisted immobilization[J]. Sensors and Actuators B:Chemical, 2013, 187: 481-487. DOI:10.1016/j.snb.2013.02.009 |
| [39] |
Pan Y, Guo M, Nie Z, et al. Selective collection and detection of leukemia cells on a magnet-quartz crystal microbalance system using aptamer-conjugated magnetic beads[J]. Biosens Bioelectron, 2010, 25(7): 1609-1614. DOI:10.1016/j.bios.2009.11.022 |
| [40] |
Wang L, Wang R, Chen F, et al. QCM-based aptamer selection and detection of Salmonella typhimurium[J]. Food Chem, 2017, 221: 776-782. DOI:10.1016/j.foodchem.2016.11.104 |
| [41] |
Yu X, Chen F, Wang R, et al. Whole-bacterium SELEX of DNA aptamers for rapid detection of E. coli O157:H7 using a QCM sensor[J]. J Biotechnol, 2018, 266: 39-49. DOI:10.1016/j.jbiotec.2017.12.011 |
| [42] |
Brockman L, Wang R, Lum J, et al. QCM Aptasensor for rapid and specific detection of avian influenza virus[J]. Open Journal of Applied Biosensor, 2013, 02(04): 97-103. DOI:10.4236/ojab.2013.24013 |
| [43] |
冯阳阳, 李杜娟, 叶尊忠, 等. 纳米颗粒在石英晶体微天平生物传感器中的应用与研究进展[J]. 中国生物医学工程学报, 2011(02): 299-307. DOI:10.3969/j.issn.0258-8021.2011.02.021 |
| [44] |
Dong Z, Zhao G. Quartz crystal microbalance aptasensor for sensitive detection of mercury (ii) based on signal amplification with gold nanoparticles[J]. Sensors, 2012, 6: 7080-7094. |
| [45] |
Chen Q, Wu X, Wang D, et al. Oligonucleotide-functionalized gold nanoparticles-enhanced QCM-D sensor for mercury (Ⅱ) ions with high sensitivity and tunable dynamic range[J]. The Analyst, 2011, 136(12): 2572. DOI:10.1039/c1an00010a |
| [46] |
Sheng Z, Han J, Zhang J, et al. Method for detection of Hg2+ based on the specific thymine-Hg2+-thymine interaction in the DNA hybridization on the surface of quartz crystal microbalance[J]. Colloids and Surfaces B:Biointerfaces, 2011, 87(2): 289-292. DOI:10.1016/j.colsurfb.2011.05.031 |
| [47] |
Zheng B, Cheng S, Liu W, et al. Small organic molecules detection based on aptamer-modified gold nanoparticles-enhanced quartz crystal microbalance with dissipation biosensor[J]. Anal Biochem, 2013, 438(2): 144-149. DOI:10.1016/j.ab.2013.03.030 |
| [48] |
Song W, Zhu Z, Mao Y, et al. A sensitive quartz crystal microbalance assay of adenosine triphosphate via DNAzyme-activated and aptamer-based target-triggering circular amplification[J]. Biosens Bioelectron, 2014, 53: 288-294. DOI:10.1016/j.bios.2013.09.067 |
| [49] |
Hianik T, Ostatná V, Sonlajtnerova M, et al. Influence of ionic strength, pH and aptamer configuration for binding affinity to thrombin[J]. Bioelectrochemistry, 2007, 70(1): 127-133. DOI:10.1016/j.bioelechem.2006.03.012 |
| [50] |
Nübel C, Appel B, Hospach I, et al. Challenges and opportunities in the development of aptamers for TNFα[J]. Appl Biochem Biotechnol, 2016, 179(3): 398-414. DOI:10.1007/s12010-016-2002-2 |
| [51] |
He P, Liu L, Qiao W, et al. Ultrasensitive detection of thrombin using surface plasmon resonance and quartz crystal microbalance sensors by aptamer-based rolling circle amplification and nanoparticle signal enhancement[J]. Chem Commun (Camb), 2014, 50(12): 1481-1484. DOI:10.1039/C3CC48223E |
| [52] |
Wang R, Li Y. Hydrogel based QCM aptasensor for detection of avian influenzavirus[J]. Biosens Bioelectron, 2013, 42: 148-155. DOI:10.1016/j.bios.2012.10.038 |
| [53] |
Xu L, Wang R, Kelso LC, et al. A target-responsive and size-dependent hydrogel aptasensor embedded with QD fluorescent reporters for rapid detection of avian influenza virus H5N1[J]. Sensors and Actuators B:Chemical, 2016, 234: 98-108. DOI:10.1016/j.snb.2016.04.156 |
| [54] |
苏雪, 何逸婷, 林俊生. 适体和蛋白质解离常数检测方法比较分析[J]. 传感器与微系统, 2016(11): 47-50. |





