2. 中国农业大学 北京食品营养与人类健康高精尖创新中心,北京 100083
2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, China Agricultural University, Beijing 100083
纳米材料是指在结构上具有纳米尺度特征的材料,有“21世纪最有前途的材料”的美誉。当物质的结构单元小到纳米量级时,会产生特异的表面效应、宏观量子隧道效应、体积效应以及量子尺寸效应[1],因而表现出一些新异的独特的理化及光学性质,在光电学、环境科学及生物医学等领域有着广阔的应用前景。
纳米材料在结构上与常规晶态和非晶态材料有很大差别,突出地表现在小尺寸颗粒和庞大的体积百分数的界面,界面原子排列和键的组态的较大无规则性,使纳米材料出现了一些不同于常规材料的光学性质[2]。纳米材料能吸收红、紫外线的特征是很多普通材料不具备的,这主要是基于纳米粒子的尺寸变化,从而导致其发生不同程度的物理或化学变化,能尽量避免红、紫外线给人体带来的伤害。
一些纳米材料还具有良好的光热转化能力,可用于临床上癌症的光热治疗。然而,由于机体组织缺乏在近红外区域有显著光热效应的物质,不能将照射的光能充分转化为热能,在安全的激光功率范围内无法实现温度的有效升高。因此,光热治疗的实施需要在近红外区域(700-1 100 nm)有强吸收的光热剂(光热转换材料)的辅助。为促使光热治疗技术的快速应用,开发高生物相容性高光热转化效率的光热剂是当前的一个研究重点。大部分光热剂为纳米材料,根据材料类型的不同,可分为无机和有机纳米光热剂两大类[3]。
本文主要介绍了不同的纳米材料及其光学和光热应用。
1 光学纳米材料纳米粒子的一个明显特征是尺寸小。当纳米粒子的粒径与超导相干波长、玻尔半径以及电子的德布罗意波长相当、甚至更小时,其量子尺寸效应将十分显著,使得纳米材料呈现出与众不同的光学特性,并且纳米材料对可见光具有反射率低、吸收率高的特性。
1.1 多孔硅多孔硅是一种呈海绵状结构、同时拥有较大比表面积的新型多孔硅基纳米材料。其独特的海绵状结构导致多孔硅呈现出很多与单晶硅不同的物理化学性质,在传感器技术、光电子器件、微加工、生物技术等领域得到广泛应用。此外,多孔硅在室温时就具有可发光的特点,又因为多孔硅的多孔结构具有优良的吸附特性,其光电性质因其多孔结构内吸附物质的不同而随之变化。1997年Lin和Sailor等[4]基于多孔硅的吸附特性研制出了多孔硅光学生物传感器。此后,在生物传感器的研究领域中,多孔硅作为基体的生物传感器研究得到广泛的关注[5-6]。
1.2 半导体量子点半导体量子点是三个维度的尺寸均在纳米量级的一种荧光纳米颗粒。其中典型的范例是由IIB和VIA族元素(如CdS、CdSe、ZnS、CdTe等)组成的[7]。由于存在量子尺寸效应,半导体量子点会表现出与多环芳烃等有机大分子相似的光学性质,可以发射荧光[8]。半导体量子点不仅具有高效的可灵活调控的光学性质,还具备传统有机染料不具备的特性,使其在催化、传感、光电器件、光学材料、生物标记、生命分析等领域具有可观的应用前景[9-10]。
1.3 碳、石墨烯量子点2004,Xu等[11]在利用电弧放电法制备单壁碳纳米管时,发现了一类粒径在10 nm以下具有良好分散性且可以发射荧光的准球形碳纳米颗粒。这些碳纳米颗粒被称之为碳量子点(碳纳米点),简称碳点。众多文献报道碳点具有较小的尺寸、良好的生物相容性、多光子激发性质、优异的光稳定性、电化学发光性能、易与生物分子结合以及良好的化学惰性,是一种优异的荧光材料[12]。
石墨烯量子点(Graphene quantum dots,GQDs)是继富勒烯[13]、碳纳米管[14]及石墨烯[15]之后最热门的新型纳米材料之一。GODs具有比表面积大、功能化位点丰富等特性,—般是由单层、双层或多层石墨烯片组成的粒径小于100 nm的零维纳米颗粒[16-17]。零维的GQDs与二维的石墨烯相比具有明显的边缘效应和量子效应,因而具有特殊的光学性质、导电性和化学惰性,其在环境监测、生物医药、生物成像和光电器件等领域有着良好的应用前景[18]。GQDs与传统量子点相比,不仅具有优良的光学性能(如荧光强度高、抗光漂白性好、发光颜色可调等)与小尺寸特性,而且生物相容性好,易于实现表面功能化。
1.4 金纳米颗粒金纳米颗粒(Gold nanoparticles,AuNPs)有着十分显著的表面等离子体共振效应(SPRE),已逐渐在新型生物传感器的构建中占据一席之地,目前被广泛用于环境监测、生化分析、药物输送、蛋白质检测等领域[19-20]。AuNPs的聚集会导致溶液颜色从红色变为蓝色,当聚集的AuNPs再分散时,溶液的颜色又会从蓝色变为红色。AuNPs的这种由于团聚状态和分散状态的改变而引起的颜色变化,可被用来构建基于被测物直接或间接地诱导AuNPs聚集或再分散的比色分析平台。基于AuNPs比色法的一般设计策略是通过在AuNPs表面组装上可特异性识别待测物质的组分,然后通过特异性识别过程使AuNPs之间的距离减小或增大,造成AuNPs发生聚集与分散状态之间的转换,同时伴随着溶液颜色的变化,紫外-可见吸收光谱也会出现吸收峰的变化,从而实现对待测物质的检测[21]。
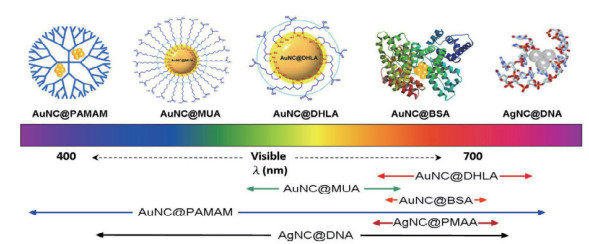
1.5 金纳米团簇金纳米团簇(Nanoclusters,AuNCs)是指在有机分子层(如硫醇类化合物或者蛋白质等)的保护下,由几个到几百个金原子组成的相对稳定的聚集体,粒径通常在2nm以下[22]。金纳米团簇由于神奇的小尺寸效应,自身可发出不同颜色的荧光,通过对AuNCs粒径大小的调节可以实现其荧光发射光谱在可见光到近红外光区范围内的变化,同时保护基团也可以对其荧光性质产生影响,特定的保护基团可以影响特定的发射波长[23](图 1)。
AuNCs具有光物理性质好、比表面积大、表面易于修饰以及荧光性质可调等优点,使其在功能材料学、光电子学、生物传感与成像、分析检测、生物医学和其它领域有着十分广泛的应用前景[24-25]。
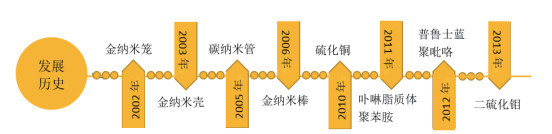
2 光热纳米材料光热纳米材料能吸收某种光尤其是近红外光(因为它的波长范围可透过人体皮肤和深层组织而不被吸收)的能量,通过等离子体共振或者能量跃迁带,将吸收的光能转化为热能,从而导致局部高温。根据这一性质,光热纳米材料被广泛用来杀死肿瘤细胞。图 2总结了常用光热纳米材料的发展历史。
|
| 图 2 光热纳米材料发展历史 |
用于肿瘤光热治疗的贵金属纳米粒子包括金、银、铂和钯等。这些贵金属纳米材料均有着较强的局部LSPR效应,通过进一步调节尺寸、形状,能将这些材料的等离子体共振峰延伸到近红外区域,使其可以将吸收的近红外光转化为热能。
金纳米材料具有局域表面等离子体共振(Loca-lized surface plasmon resonance,LSPR)效应,能在激光照射下迅速升温,再加上其易合成、易表征、易修饰等优点,是肿瘤光热治疗的研究热点之一。目前用于光热治疗的金纳米粒子包括金纳米棒、金纳米壳、金纳米笼和金纳米星[26]。2006年,Huang等[27]最早将金纳米棒应用于细胞成像和治疗,取得了很好的治疗效果。金纳米壳以二氧化硅为电解质内核,通过调节壳核比例,可使表面共振现象(也被称为“生物窗口”)从可见光区调整到近红外区,利用该性质可将金纳米壳用于恶性肿瘤的诊断与光热治疗[28]。2003年,美国莱斯大学的Halas课题组[29]最早将金纳米壳应用于肿瘤光热治疗中。2002年Sun等[30]首先制备了金纳米笼结构,并探索了这种大小形状可控的结构在药物传递、纳米封装和肿瘤光热治疗方面的应用。Pallavicini等[31]制备了一种关于金纳米星的新型结构,先将金纳米星聚乙二醇化再结合上铜离子,这种新型结构可用于正电子发射计算机断层显像(Positron emission computed tomography,PET)和近红外激光的光热治疗。
除了金基纳米粒子,银、铂和钯等贵金属纳米粒子在肿瘤光热治疗中的应用也得到了较多关注。Boca等[32]制备了一种壳聚糖包裹的三角状银纳米粒子,通过体内外实验证明了它是一种有效的光热治疗剂,相比于聚乙二醇修饰的金纳米棒,光热效果更好。Manikandan等[33]通过成核还原反应来还原铂前体物,制备出一种无毒的铂纳米粒子,表现出对肿瘤细胞有效的光热杀伤能力。钯有更高的熔点和光热稳定性,在近红外光区域具有可控的局部表面等离子体共振作用,因此钯纳米粒子具有很好的近红外光吸收能力和较高的光热转换效率[34]。2011年厦门大学郑南峰课题组利用一氧化碳作为表面控制剂合成了“钯蓝”[35],在近红外光照射下对QGY-7703人肝癌细胞具有很好的光热治疗效果。为了促进其进入细胞的能力,他们又发展了Pd@SiO2、Pd@Ag和Pd@Ag@SiO2等钯基纳米材料用于光热治疗[36]都取得了良好的治疗效果。
2.1.2 碳基纳米材料碳纳米材料在可见-近红外区具有较强的光吸收,能将光能快速转化为热能,具有显著的光热效应。碳纳米材料经靶向修饰后可定位到肿瘤组织,近红外光照射后产生热量杀死肿瘤细胞,近年来广泛应用于肿瘤的光热治疗[37]。
2005年,斯坦福戴宏杰课题组[38]首次报道将碳纳米管应用于肿瘤的光热治疗。之后,许多课题组开始研究不同的靶向分子修饰的碳纳米管用于细胞和活体光热治疗。Chakravart等[39]合成的CD22/CD25抗体靶向单壁碳纳米管能特异性靶向人恶性淋巴瘤细胞(Daudi细胞),在激光照射下能有效杀伤肿瘤细胞。Hashida等[40]合成的肽修饰碳纳米管SWCNT-(KFKA)7在近红外光照射下能快速升温到43℃,有效抑制皮下接种的结肠癌生长,表现出良好的细胞水平和动物水平上的光热治疗效果。
石墨烯纳米粒子对紫外到近红外区域的激光均有较强的吸收能力和光热效应,因此在肿瘤光热治疗领域也得到了不少关注[34]。Novoselov等[41]报道发现一种二维结构的金属石墨烯,其显示出很强的场效应。Zhu等[42]采用壳聚糖包被的氧化石墨烯进行细胞和动物水平上的光热治疗,并取得了良好的效果。为了提高治疗效果,氧化石墨烯可以进一步被还原成还原石墨烯,其在近红外区域的吸光度提高近7-8倍[43]。经聚乙二醇修饰后,通过尾静脉注射到小鼠体内,达到同样的光热治疗效果,所用激光功率更低,所需材料剂量更小[44]。Su和Qiu等[45]设计了一种卟啉官能化的氧化石墨烯用于光热治疗,其在808 nm光照下具有高吸收度。生物相容性卟啉作为收集光子能量并将其转移到氧化石墨烯以增强光热效应的介导物,卟啉固定氧化石墨烯的光热转换效率比纯氧化石墨烯高1.6倍。
2.1.3 金属硫族化合物硫化铜(CuS)纳米粒子是金属硫族化合物纳米粒子中的典型代表,其特点为成本低、光热稳定性好、细胞毒性低以及粒径形貌可控等。Li等[46]首次报道了CuS纳米颗粒在近红外区特别是900 nm波长处有强烈吸收,用808 nm激光照射硫化铜纳米粒子水溶液聚集的地方温度升高,可用于光热治疗。除了上述的CuS纳米粒子,近年来还有一种新的金属硫族化合物作为光热治疗剂进入了研究者的视野。这种新型的纳米光热材料被统称为二维过渡金属硫化物[Two-dimensional(2D)transition-metal dichalcogenides,TMDCs],包括二硫化钼(MoS2)、二硒化钼(MoSe2)、二硒化钨(WSe2)和二硫化钨(WS2)等[34]。Chou等[47]首次证明,MoS2纳米片可用作一种新型的近红外吸收纳米光热治疗剂;Wang等[48]设计了一种二维MoS2/Bi2Se3复合诊疗纳米系统,可用于肿瘤的光热治疗、CT及光声成像;Cheng等[49]用莫里森法制备单层WS2纳米片,然后在WS2纳米片表面修饰聚乙二醇,大大提高了该材料的生物稳定性和生物相容性。
2.1.4 磁性纳米材料常见的磁性纳米材料有纳米Fe3O4颗粒、磁性脂质体、磁流体、铁磁微晶玻璃、碳铁复合物和超顺磁性氧化铁。将磁性纳米材料注射到肿瘤组织,在外加激光作用下发热。肿瘤组织中血液供给不足,使得肿瘤细胞中热量扩散较慢,导致局部高温,从而杀死肿瘤细胞[50]。有研究报道,聚硅氧烷包覆的结晶态氧化铁纳米粒子在功率为2.5 W/cm2的激光下表现出极高的温度提升(33℃)作用,比商用磁性纳米粒子具有更好的光热疗效[51]。
2.1.5 其它无机纳米材料除了上述几大类无机纳米光热材料外,还有其它几种无机纳米材料也可用于肿瘤的光热治疗,如量子点和上转换纳米粒子(Upconversion nanoparticles,UCNPs)等。Sun等[52]制备了一种超小黑磷量子点,该量子点可表现出高达28.4%的光热转换效率、良好的光热稳定性和较低的细胞毒性,提示这是一种极具潜力的纳米光热治疗剂。此外,Liu等[53]制备了一种基于铯的UCNPs,可以实现上转换发光(Upconversion luminescence,UCL)/CT双模态成像引导的化学-光热协同治疗。
2.2 有机纳米材料 2.2.1 近红外染料近红外染料的优点是近红外区吸收高、生物相容性较好和能荧光成像等,缺点是存在浓度依赖性、稳定性较差、在生物体内易与生物大分子发生作用等[54]。
吲哚菁绿(ICG)是美国食品和药物管理局(FDA)批准的可用于临床近红外成像的有机小分子,同时它也是一种理想的光热试剂[55]。Zheng等[56]设计了磷脂聚乙二醇(PL-PEG)修饰的ICG,并在其表面偶联上叶酸(FA)和整合素RGD双重靶向分子,实现了对U87肿瘤细胞很好的光热治疗。最近,Qian等[57]发现一种新的pH敏感染料吲哚克酮酸(Croconine)在和白蛋白(HSA)自组装后,成为新型的pH响应的光热试剂。Lovell等[58]在2011年首次报道了卟啉脂质体的光热治疗效果,他们把卟啉脂质体通过尾静脉注射到小鼠体内后发现,这种纳米颗粒的血液循环寿命长达8.5 h,近红外光照射后显著抑制肿瘤生长;而且这种颗粒可被生物降解,生物安全性极高。普鲁士蓝是FDA批准作为临床上治疗铊等放射性元素中毒的解毒剂,也是一种古老的蓝色染料,有着良好的生物相容性。它在近红外区有较强的吸收,其摩尔消光系数与纳米金处于同一个数量级,比碳纳米管、硫化铜等光热剂要高2-3个数量级。2012年Fu等[59]首次报道了普鲁士蓝可作为新一代的光热剂,并将其应用于细胞水平的癌症治疗。随后Cheng和Liu等[60]将普鲁士蓝纳米管经聚乙二醇修饰后注射入小鼠体内,实现了光声/核磁双模式成像指导下的光热治疗。最新的研究中,Cai等[61]成功制备了尺寸均一且稳定分散的空心介孔普鲁士蓝纳米粒子,并实现抗癌药物阿霉素(DOX)的共装载,首次成功实现了紫外/光声双模式下的光热与化疗的协同肿瘤治疗。
2.2.2 共轭聚合物有机共轭高分子在近红外区域有较强光吸收,光热稳定性较好,光热转换效率较高,在光热治疗的应用中具有良好的稳定性和生物相容性[54]。
2011年,Yang等[62]首次报道聚苯胺聚合物在808 nm激光作用下可以杀死肿瘤细胞。聚苯胺在近红外光照射下,产生的高温可以失活合成DNA或者RNA所需要的细胞成分,从而阻断细胞的生长和增殖,最终导致细胞死亡[54]。聚吡咯在近红外区域表现出较强的光学吸收,可用于肿瘤的光热治疗,这一作用是由Yang等[63]报道的。他们利用聚吡咯的近红外吸收作用进行了体内和体外的肿瘤光热治疗实验,结果表明聚吡咯集中在瘤内,经超低剂量的近红外光照射后,肿瘤显著减小甚至消失,且没有明显的副作用。Cheng等[64]报道了另一种共轭高分子纳米材料聚噻吩(PEDOT:PSS),该纳米材料经尾静脉注射后富集在肿瘤区域,激光照射后可完全消除肿瘤。Liu等[65]合成的多巴胺包裹的黑色素有机纳米粒子在近红外区域有很好的光学吸收,其主要的优点是体内可降解、光热转换效率高,且已在活体水平取得良好的治疗效果。Huang等[66]报道了一种由小分子染料靛蓝形成的新型光热胶体纳米粒子,该粒子具有良好的光热稳定性,可将近红外光的能量转化为热能,且长期使用对细胞毒性较小。
3 光学生物传感器随着纳米技术的发展,基于纳米材料的信号放大系统实现了高灵敏度和高选择性的原位或在线生物分子检测。与传统检测手段相比,纳米信号放大系统检测过程速率快且简单易行[67-68]。一般而言,利用纳米材料构建信号放大系统是通过在纳米材料的表面修饰生物功能分子,识别靶标的过程中利用光学信号进行反应现象的放大,从而实现对靶标分子的检测。
3.1 基于硅纳米粒子的光学生物传感器二氧化硅纳米粒子具有大的表面积、通用的官能团、生物相容性和多孔性质等优势,使得硅纳米粒子在基因和药物运载、多通道生物成像、光动力、光疗和化疗等领域受到广泛关注。硅纳米粒子还可以作为信号放大因子和载体用于构建荧光偏振传感体体系。Liu课题组[69]基于二氧化硅纳米粒子放大的荧光偏振传感分析检测凝血酶,首先让修饰有链霉亲和素的二氧化硅纳米粒子与修饰有生物素的一段凝血酶适配体链相互作用,此时加入另外一段标记荧光素的凝血酶识别适配体链,适配体链本身体积小,溶液只会产生微弱的偏振值,在此基础上再加入凝血酶与其适配体序列特异性作用,形成一个夹心结构,凝血酶和带荧光素的适配体链都固定在纳米粒子表面,偏振值增加,基于偏振值的变化,实现对凝血酶的灵敏检测。
目前最新的研究表明石墨烯可以改变多孔硅表面态,极大提高多孔硅的光致发光性能。钱栋梁等[70]通过电化学腐蚀法制备出不同孔径的多孔硅,利用湿法转移法将石墨烯转移至多孔硅衬底上。结果表明石墨烯/多孔硅复合材料的光致发光性能远远好于多孔硅。这种提高多孔硅光致发光的方法简便,为以后多孔硅应用于光学传感器奠定了实验基础。
3.2 基于金纳米粒子的光学生物传感器AuNPs的一个重要光学性质是表面等离子体共振吸收特性。AuNPs在分散态和聚集态具有不同的表面等离子体共振吸收而构建的比色传感体系[71-72],采用紫外吸收光谱法或目视法对靶标分子进行定性和定量分析。Mirkin等[72]首次报道了基于寡聚核糖修饰的AuNPs比色法检测核酸。AuNPs能猝灭大部分染料的荧光,近年来基于这一性质构建了大量的以AuNPs作为荧光受体的荧光传感体系。Qiang[73]课题组利用AuNPs的荧光猝灭性质,在AuNPs表面组装适配体修饰的掺杂罗丹明的荧光硅纳米粒子,当靶标RNA不存在时,罗丹明的荧光被AuNPs猝灭,当遇到信使RNA(mRNA)的时候,适配体就会与相应的目标mRNA杂交,导致适配体的茎结构被破坏,构象发生变化,荧光硅纳米粒子和金纳米粒子间会发生荧光能量共振转移,罗丹明的荧光就会恢复。通过对比目标mRNA加入前后荧光强度的变化,就能对多种mRNA进行定性、定量分析。
3.3 基于石墨烯的光学生物传感器石墨烯具有良好的荧光猝灭效应,可以与荧光染料之间发生荧光共振能量转移(Fluorescenct resonance energy transfer,FRET),从而猝灭染料的荧光。Sun和He等[74]利用石墨稀和荧光素之间的FRET构建了检测金色葡萄球菌胞外核酸酶的传感体系。由于石墨烯对单链DNA的吸附使其荧光素FAM的荧光被猝灭,当加入核酸酶时,剪切单链DNA至寡核苷酸碎片,由于石墨烯对寡核苷酸碎片的弱吸附,使得荧光素FAM标记的寡核苷酸碎片的荧光恢复,从而实现了核酸酶的检测。
石墨烯具有高的热力学稳定性、易于合成和修饰,以及较大的体积等性质[75]。Liu[75]课题组使用石墨烯作为纳米信号放大因子和纳米支架设计了一种简单、灵敏的实时检测三磷酸腺苷(Adenosine triphosphate,ATP)的荧光各向异性生物传感器。当无ATP存在时,荧光素吸附在石墨烯上具有较高的偏振值,当存在ATP时,荧光素脱离GO表面而使偏振值降低,通过监测体系的各向异性的变化,实现ATP的灵敏检测。
4 光及光热纳米材料的药物靶向递送如何将药物分子高效集中在病灶部位并发挥作用是疾病治疗过程中的关键因素,尤其是一些疏水性或水溶性差的药物分子。基于纳米材料的载药系统的引入,实现了药物分子只在病灶部位定点释放的目的,降低了药物分子对其它组织器官的副作用,大大提高了药物分子运输到病灶部位的效率。
4.1 光响应型载体许多材料对人体伤害不大的电磁辐射(主要有紫外光、可见光和近红外光)具有敏感性,因此光响应性作为一种应用较为广泛的外部刺激,具有洁净、高效、无创等基本特征,在药物控释方面具有潜在的应用价值。2003年,日本的Mal和Tanaka等[76]在自然杂志上报道了基于香豆素改性的介孔二氧化硅纳米粒子的可逆光控药物释放系统。该系统第一次实现了光响应性对药物的控制与释放,为该领域的后续研究打下了良好的基础。Yang等[77]将荧光分子作为药物模型载入介孔孔道,用一种对光敏感的硝基苯衍生物修饰金纳米粒子表面,通过金纳米粒子与介孔二氧化硅纳米粒子之间的静电相互作用,引入金纳米粒子封堵介孔,研究了这种金-介孔二氧化硅复合纳米粒子的光控效果。
4.2 光热响应型载体光热药物控释系统是基于具有光吸收的纳米粒子在光照之后通过光热转换使局部升温,促使药物从载体中释放出来。光热药物控释系统不仅能通过外加的光源控制药物释放,还可以通过光热转换产生的热能杀死癌细胞,同时具备药物治疗和光热切除治疗的功能。2010年,美国德克萨斯大学的Li教授课题组[78]报道了可同时实现光热癌症切除和近红外辐射药物释放的双功能化的中空金纳米球。浙江大学周民团队[79]将抗癌药物多柔比星装载于介孔二氧化硅纳米粒子中,再用CuS纳米点封装介孔二氧化硅的介孔。该载体递送至体内后,在近红外光的照射下,CuS产生光热效应使二氧化硅解体,释放多柔比星,实现药物的递送。
4.3 近红外光-pH响应型载体肿瘤部位呈酸性,其pH远低于正常组织部位[80],利用这种pH环境的差异可设计出众多针对肿瘤组织进行药物传递的pH敏感药物载体。为了进一步提高药物释放效率,pH/NIR响应型药物载体也得到广泛应用。2018年,Li等[81]以磷酸钙为壳,金纳米棒为芯,合成了装载有多柔比星的药物载体。经外部光源的照射,金纳米棒产生光热效应使载体温度升高,同时肿瘤组织内的酸性环境溶解磷酸钙,二者的协同作用使得多柔比星大量释放,其释放效果远远优于任何一种释放方式单独作用的效果。
5 光热材料的生物成像目前,利用影像学进行疾病诊断的方式主要有光学成像、核磁共振成像(MRI)、超声成像(US)、正电子放射断层造影术成像、单光子发射计算机化断层显像(SPECT)及计算机断层扫描(CT)。每种成像方式都有各自的不足之处,纳米材料在疾病诊断中的应用很大程度上弥补了传统成像方式的不足。
Zhu等[82]研究发现具有优良生物学性能的近红外核交联聚合胶束纳米粒子(NIRF-CCPM),对其表面糖基化(氨基葡萄糖修饰,DG)修饰后可获得同时用于核素/红外显像的111In-DG-NIRF-CCPM纳米粒子。将具有肿瘤靶向性的多肽RGD(精氨酸-甘氨酸-天冬氨酸)与该纳米粒子偶联,通过放射性核素111In标记构成核素显像探针,111InCCPM-RGD分子探针表现出良好的放射标记/光学性质同时兼具光学和核医学显像功能,通过SPECT/CT及活体荧光成像系统观察到该纳米分子探针在U87移植模型鼠中具有明显的肿瘤摄取[83]。性能优良的新型双模态纳米分子探针,能够提高肿瘤的诊断效能,为建立光学/核医学用于肿瘤靶向双模式成像奠定理论基础。Wang等[84]研究发现微泡可作为超声造影剂呈现明显的超声影像,靶向纳米微泡在肿瘤区的峰值强度及持续时间明显增加,肿瘤局部超声信号增强,证实纳米微泡光学成像成为肿瘤诊疗的新手段。
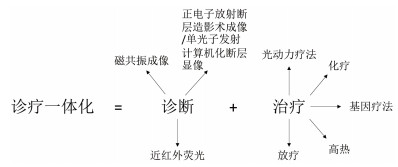
6 成像指导的肿瘤光热治疗Funkhouser[85]在2002年首次提出“theranostic”一词,即诊疗一体化,定义为药物集疾病诊断与治疗为一体的复合体系,即在一个注射剂量下诊疗体系可以将诊断试剂和治疗药物同时运输到病灶部位,得出诊断结果的同时进行疾病治疗[86],用一个公式可以很好地解释:Theranostic=Diagnostic(诊断)+ Therapeutic(治疗),如图 3所示。
|
| 图 3 诊疗一体化示意图 |
此外,在肿瘤光热治疗的过程中,为了提高纳米材料体内示踪的灵敏度和肿瘤治疗效果,多模态成像指导的联合治疗成为新的发展趋势。Li等[81]利用肿瘤内的酸性环境,设计了金纳米棒与磷酸钙的复合纳米颗粒,对pH/NIR敏感且具有CT/PA双模式成像能力。体外实验表明该纳米颗粒在808 nm光照射下,光疗协同化疗对癌细胞杀伤可达90%。深圳大学黄鹏教授和温州大学杨云研究员等[87]最近报道了一种生物可降解的光响应纳米摇铃,研究者将金纳米棒(Gold nanorods,GNR)与全氟戊烷(Perfluoropentane,PFP)同时负载到介孔二氧化硅中,得到纳米颗粒GNR@SiO2-PFP。在激光激发下,GNR的光热效应激发PFP产生微泡,进行超声/光声双模态成像的同时实现对癌症的光热治疗;另外,介孔二氧化硅作为载体,不仅可以延长纳米颗粒的血液循环时间,还因其可生物降解的特性从而降低纳米颗粒的体内毒性。
7 总结与展望纳米材料具有常规材料所不能比拟的光学性质,将其用于构建光学生物传感新体系,不仅可大大改善传感器的检测性能,还为发展高灵敏生物传感器提供了新的思路。尽管许多纳米材料广泛应用于光学传感器的构建,但由于材料本身的性质,如易聚集、易受环境影响等,限制了这些光学传感器的实际应用。未来,研究者们需要解决应用过程中的现实问题,并将构建的传感器从实验室转换至实际应用的场景和市场中。
具有光热转换能力的纳米材料及新型的治疗方式在纳米生物医学中发挥重要的作用。虽然纳米材料为肿瘤的光热治疗提供了新的途径并取得了长足的发展,但是还有一些问题和挑战需要面对。无机纳米材料在体内较难降解的问题对其临床应用是一个巨大的挑战,因此需要发展生物可降解的安全的纳米材料用于光热治疗,纳米材料的大小和表面修饰也需要进一步优化,保证其在人体循环的安全时间内得到清除。此外,通过化学方法将不同功能的材料有机结合在一起以发展成像模式指导下的肿瘤光学治疗以及将新型的光热治疗和传统的治疗方式(手术、化疗、放疗)相结合,实现1+1 > 2的协同效应,以提高肿瘤治愈的可行性并防止转移复发,将为未来肿瘤治疗新方法的发展带来巨大的机遇。
| [1] |
Valiev R. Materials science - Nanomaterial advantage[J]. Nature, 2002, 419(6910): 887, 889. |
| [2] |
白木, 周洁. 纳米材料的光学特性[J]. 机电新产品导报, 2002(Z1): 149-150. |
| [3] |
de Melo-Diogo D, Pais-Silva C, Dias DR, et al. Strategies to improve cancer photothermal therapy mediated by nanomaterials[J]. Adv Healthc Mater, 2017, 6(10). DOI:10.1002/adhm.20170073 |
| [4] |
Lin VS, Motesharei K, Dancil KP, et al. A porous silicon-based optical interferometric biosensor[J]. Science, 1997, 278(5339): 840-843. DOI:10.1126/science.278.5339.840 |
| [5] |
Li P, Jia ZH, Lu XY, et al. Spectrometer-free biological detection method using porous silicon microcavity devices[J]. Optics Express, 2015, 23(19): 24626-24633. DOI:10.1364/OE.23.024626 |
| [6] |
Jenie SNA, Prieto-Simon B, Voelcker NH. Development of L-lactate dehydrogenase biosensor based on porous silicon resonant microcav-ities as fluorescence enhancers[J]. Biosensors & Bioelectronics, 2015, 74: 637-643. |
| [7] |
Hou LR, Zhang Q, Ling LT, et al. Interfacial fabrication of single-crystalline Zn Te nanorods with high blue fluorescence[J]. J Am Chem Soc, 2013, 135(29): 10618-10621. DOI:10.1021/ja4047476 |
| [8] |
Rosenthal SJ. Bar-coding biomolecules with fluorescent nanocrystals[J]. Nature Biotechnology, 2001, 19(7): 621-622. DOI:10.1038/90213 |
| [9] |
Wegner KD, Hildebrandt N. Quantum dots:bright and versatile in vitro and in vivo fluorescence imaging biosensors[J]. Chem Soc Rev, 2015, 44(14): 4792-4834. DOI:10.1039/C4CS00532E |
| [10] |
穆亲.量子点荧光探针的设计及检测应用[D].上海: 华东理工大学, 2014,
|
| [11] |
Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2015, 126(40): 12736-12737. |
| [12] |
朱守俊.碳基荧光材料的制备、发光机理及水相应用[D].长春: 吉林大学, 2014, .
|
| [13] |
Kroto HW, Heath JR, O'Brien SC, et al. C60:Buckminsterfull-erene[J]. Nature, 1985, 318(6042): 162-163. DOI:10.1038/318162a0 |
| [14] |
Iijima S. Helical microtubules of graphitic carbon[J]. Nature, 1991, 354(6348): 56-58. DOI:10.1038/354056a0 |
| [15] |
Du X, Skachko I, Barker A, et al. Approaching ballistic transport in suspended graphene[J]. Nat Nanotechnol, 2008, 8: 491-495. |
| [16] |
Wu T, Shen H, Sun L, et al. Nitrogen and boron doped monolayer graphene by chemical vapor deposition using polystyrene, urea and boric acid[J]. New J Chem, 2012, 36(6): 1385-1391. DOI:10.1039/c2nj40068e |
| [17] |
Ponomarenko LA, Schedin F, Katsnelson MI, et al. Chaotic Dirac billiard in graphene quantum dots[J]. Science, 2007, 320(5874): 356-358. |
| [18] |
Luo PH, Ji Z, Li C, et al. Aryl-modified graphene quantum dots with enhanced photoluminescence and improved pH tolerance[J]. Nanoscale, 2013, 5(16): 7361-7367. DOI:10.1039/c3nr02156d |
| [19] |
Zhou W, Gao X, Liu DB, et al. Gold Nanoparticles for in vitro diagnostics[J]. Chem Rev, 2015, 115(19): 10575-10636. DOI:10.1021/acs.chemrev.5b00100 |
| [20] |
靳浪平, 王平, 蒋中英. 金纳米颗粒在电化学传感中的应用[J]. 化学与生物工程, 2015(6): 1-5. DOI:10.3969/j.issn.1672-5425.2015.06.001 |
| [21] |
Zhao W, Brook MA, Li Y. Design of gold nanoparticle-based colorimetric biosensing assays[J]. Chembiochem, 2008, 15: 2363. |
| [22] |
Zheng J, Zhang C, Dickson RM. Highly fluorescent, water-soluble, size-tunable gold quantum dots[J]. Physical Review Letters, 2004, 93(7): 077402. DOI:10.1103/PhysRevLett.93.077402 |
| [23] |
Lin J, Lee CH, Hsieh JT, et al. Review:Synthesis of fluorescent metallic nanoclusters toward biomedical application:recent progress and present challenges[J]. Journal of Medical & Biological Engineering, 2009, 29(6): 276-283. |
| [24] |
Shang L, Dong SJ, Nienhaus GU. Ultra-small fluorescent metal nanoclusters:Synthesis and biological applications[J]. Nano Today, 2011, 6(4): 401-418. DOI:10.1016/j.nantod.2011.06.004 |
| [25] |
Shang L, Nienhaus GU. Gold nanoclusters as novel optical probes for in vitro and in vivo fluorescence imaging[J]. Biophysical Reviews, 2012, 4(4): 313-322. DOI:10.1007/s12551-012-0076-9 |
| [26] |
Young JK, Figueroa ER, Drezek RA. Tunable Nanostructures as photothermal theranostic agents[J]. Ann Biomed Eng, 2012, 40(2): 438-459. DOI:10.1007/s10439-011-0472-5 |
| [27] |
Huang XH, El-Sayed IH, Qian W, et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J]. J Am Chem Soc, 2006, 128(6): 2115-2120. DOI:10.1021/ja057254a |
| [28] |
Gao YP, Li YS, Wang Y, et al. Controlled Synthesis of multilayered gold nanoshells for enhanced photothermal therapy and SERS detection[J]. Small, 2015, 11(1): 77-83. DOI:10.1002/smll.201402149 |
| [29] |
Hirsch LR, Stafford RJ, Bankson JA, et al. Nanoshell-mediated near-infrared thermal therapy of tumors under magnetic resonance guidance[J]. Proc Natl Acad Sci USA, 2003, 100(23): 13549-13554. DOI:10.1073/pnas.2232479100 |
| [30] |
Sun YG, Mayers BT, Xia YN. Template-engaged replacement reaction:A one-step approach to the large-scale synthesis of metal nanostructures with hollow interiors[J]. Nano Lett, 2002, 5: 481-485. |
| [31] |
Pallavicini P, Bernhard C, Chirico G, et al. Gold nanostars co-coated with the Cu(Ⅱ)complex of a tetraazamacrocyclic ligand[J]. Dalton Trans, 2015, 44(12): 5652-5661. DOI:10.1039/C4DT03042G |
| [32] |
Boca SC, Potara M, Gabudean AM, et al. Chitosan-coated triangular silver nanoparticles as a novel class of biocompatible, highly effective photothermal transducers for in vitro cancer cell therapy[J]. Cancer Letters, 2011, 311(2): 131-140. DOI:10.1016/j.canlet.2011.06.022 |
| [33] |
Manikandan M, Hasan N, Wu HF. Platinum nanoparticles for the photothermal treatment of Neuro 2A cancer cells[J]. Biomaterials, 2013, 34(23): 5833-5842. DOI:10.1016/j.biomaterials.2013.03.077 |
| [34] |
赵承志, 李万万. 无机纳米材料用于肿瘤光热治疗的研究进展[J]. 肿瘤, 2017, 37(3): 289-294. |
| [35] |
Huang XQ, Tang SH, Mu XL, et al. Freestanding palladium nanosheets with plasmonic and catalytic properties[J]. Nat Nanotechnol, 2011, 6(1): 28-32. DOI:10.1038/nnano.2010.235 |
| [36] |
Zhou J, Liu Z, Li FY. Upconversion nanophosphors for small-animal imaging[J]. Chem Soc Rev, 2012, 41(3): 1323-1349. DOI:10.1039/C1CS15187H |
| [37] |
Bartelmess J, Quinn SJ, Giordani S. Carbon nanomaterials:multi-functional agents for biomedical fluorescence and Raman imaging[J]. Chem Soc Rev, 2015, 44(14): 4672-4698. DOI:10.1039/C4CS00306C |
| [38] |
O'Connell M, Wisdom JA, Dai H, et al. Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction[J]. Proc Natl Acad Sci USA, 2005, 102(33): 11600-11605. DOI:10.1073/pnas.0502680102 |
| [39] |
Chakravarty P, Marches R, Zimmerman NS, et al. Thermal ablation of tumor cells with antibody-functionalized single-walled carbon nanotubes[J]. Proc Natl Acad Sci USA, 2008, 25: 8697. |
| [40] |
Hashida Y, Tanaka H, Zhou S, et al. Photothermal ablation of tumor cells using a single-walled carbon nanotube-peptide composite[J]. J Control Release, 2014, 173(1): 59-66. |
| [41] |
Novoselov KS, Geim AK, Morozov SV, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 5696: 666. |
| [42] |
Zhu X, Zhang Y, Huang H, et al. Functionalized graphene oxide-based thermosensitive hydrogel for near-infrared chemo-photothermal therapy on tumor[J]. Journal of Biomaterials Applications, 2016, 30(8): 480-481. |
| [43] |
Robinson JT, Tabakman SM, Liang YY, et al. Ultrasmall reduced graphene oxide with high near-infrared absorbance for photothermal therapy[J]. J Am Chem Soc, 2011, 133(17): 6825-6831. DOI:10.1021/ja2010175 |
| [44] |
Yang K, Wan J, Zhang S, et al. The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J]. Biomaterials, 2012, 33(7): 2206-2214. DOI:10.1016/j.biomaterials.2011.11.064 |
| [45] |
Su SH, Wang JL, Vargas E, et al. Porphyrin immobilized nano-graphene oxide for enhanced and targeted photothermal therapy of brain cancer[J]. ACS Biomater Sci Eng, 2016, 2(8): 429-437. |
| [46] |
Li Y, Lu W, Huang Q, et al. Copper sulfide nanoparticles for photothermal ablation of tumor cells[J]. Nanomedicine, 2010, 5(8): 1161-1171. DOI:10.2217/nnm.10.85 |
| [47] |
Chou SS, Kaehr B, Kim J, et al. Chemically Exfoliated MoS2 as near-infrared photothermal agents[J]. Angew Chem Int Ed Engl, 2013, 52(15): 4160-4164. DOI:10.1002/anie.201209229 |
| [48] |
Wang S, Li X, Chen Y, et al. A facile one-pot synthesis of a two-dimensional moS2/Bi2S3 composite theranostic nanosystem for multi-modality tumor imaging and therapy[J]. Adv Mater, 2015, 27(17): 2775-2782. DOI:10.1002/adma.v27.17 |
| [49] |
Cheng L, Liu J, Gu X, et al. PEGylated WS(2)nanosheets as a multifunctional theranostic agent for in vivo dual-modal CT/photoacoustic imaging guided photothermal therapy[J]. Adv Mater, 2014, 26(12): 1886-1893. DOI:10.1002/adma.v26.12 |
| [50] |
张宏遒, 梅林. 磁性纳米颗粒在癌症诊疗一体化中的应用进展[J]. 国际生物医学工程杂志, 2016, 39(2): 120-125. DOI:10.3760/cma.j.issn.1673-4181.2016.02.012 |
| [51] |
Chen H, Burnett J, Zhang F, et al. Highly crystallized iron oxide nanoparticles as effective and biodegradable mediators for photothermal cancer therapy[J]. Journal of Materials Chemistry B, 2014, 2(7): 757-765. DOI:10.1039/C3TB21338B |
| [52] |
Sun Z, Xie H, Tang S, et al. Ultrasmall black phosphorus quantum dots:synthesis and use as photothermal agents[J]. Angew Chem Int Ed Engl, 2015, 127(39): 11526-11530. DOI:10.1002/ange.201502974 |
| [53] |
Liu Y, Li L, Guo Q, et al. Novel Cs-based upconversion nanopart-icles as dual-modal CT and UCL imaging agents for chemo-photothermal synergistic therapy[J]. Theranostics, 2016, 6(10): 1491-1505. DOI:10.7150/thno.15111 |
| [54] |
张小娟, 李文星. 用于肿瘤光热治疗的纳米材料研究进展[J]. 中国医药工业杂志, 2016, 47(8): 1065-1069. |
| [55] |
宋雪娇, 刘庄. 有机纳米材料在肿瘤光热治疗中的应用[J]. 化学通报, 2015, 78(4): 292-298. |
| [56] |
Zheng X, Xing D, Zhou F, et al. Indocyanine green-containing nanostructure as near infrared dual-functional targeting probes for optical imaging and photothermal therapy[J]. Mol Pharm, 2011, 8(2): 447-456. DOI:10.1021/mp100301t |
| [57] |
Qian C, Liu X, Zeng J, et al. Albumin-NIR dye self-assembled nanoparticles for photoacoustic pH imaging and pH-responsive photothermal therapy effective for large tumors[J]. Biomaterials, 2016, 98: 23-30. DOI:10.1016/j.biomaterials.2016.04.041 |
| [58] |
Lovell JF, Jin CS, Huynh E, et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents[J]. Nature Materials, 2011, 10(4): 324-332. DOI:10.1038/nmat2986 |
| [59] |
Fu GL, Liu W, Feng SS, et al. Prussian blue nanoparticles operate as a new generation of photothermal ablation agents for cancer therapy[J]. Chem Commun, 2012, 48(94): 11567-11569. DOI:10.1039/c2cc36456e |
| [60] |
Cheng L, Gong H, Zhu WW, et al. PEGylated Prussian blue nanocubes as a theranostic agent for simultaneous cancer imaging and photothermal therapy[J]. Biomaterials, 2014, 35(37): 9844-9852. DOI:10.1016/j.biomaterials.2014.09.004 |
| [61] |
Cai XJ, Jia XQ, Gao W, et al. A Versatile Nanotheranostic agent for efficient dual-mode imaging guided synergistic chemo-thermal tumor therapy[J]. Adv Funct Mater, 2015, 25(17): 2520-2529. DOI:10.1002/adfm.201403991 |
| [62] |
Yang J, Choi J, Bang D, et al. Convertible organic nanoparticles for near-infrared photothermal ablation of cancer cells[J]. Angew Chem Int Ed Engl, 2011, 50(2): 441-444. DOI:10.1002/anie.201005075 |
| [63] |
Yang K, Xu H, Cheng L, et al. In vitro and in vivo near-infrared photothermal therapy of cancer using polypyrrole organic nanoparticles[J]. Adv Mater, 2012, 24(41): 5586-5592. DOI:10.1002/adma.201202625 |
| [64] |
Cheng L, Yang K, Chen Q, et al. Organic stealth nanoparticles for highly effective in vivo near-infrared photothermal therapy of cancer[J]. ACS Nano, 2012, 6(6): 5605. DOI:10.1021/nn301539m |
| [65] |
Liu Y, Ai K, Liu J, et al. Dopamine-melanin colloidal nanospheres:an efficient near-infrared photothermal therapeutic agent for in vivo cancer therapy[J]. Adv Mater, 2013, 25(9): 1353-1359. DOI:10.1002/adma.v25.9 |
| [66] |
Huang S, Kannadorai RK, Chen Y, et al. A narrow-bandgap benzobisthiadiazole derivative with high near-infrared photothermal conversion efficiency and robust photostability for cancer therapy[J]. Chem Commun, 2015, 51(20): 4223-4226. DOI:10.1039/C4CC09399B |
| [67] |
Yao J, Yang M, Duan Y. Chemistry, Biology, and medicine of fluorescent nanomaterials and related systems:new insights into biosensing, bioimaging, genomics, diagnostics and therapy[J]. Chem Rev, 2014, 114(12): 6130-6178. DOI:10.1021/cr200359p |
| [68] |
Lei JP, Ju HX. Signal amplification using functional nanomaterials for biosensing[J]. Chem Soc Rev, 2012, 41(6): 2122-2134. DOI:10.1039/c1cs15274b |
| [69] |
Yue Q, Shen T, Lei W, et al. A convenient sandwich assay of thrombin in biological media using nanoparticle-enhanced fluorescence polarization[J]. Biosensors & Bioelectronics, 2014, 56(56): 231-236. |
| [70] |
钱栋梁, 葛道晗, 程产贵. 石墨烯对多硅光学性质的影响[J]. 微纳电子技术, 2017(9): 585-590. |
| [71] |
Byun JY, Shin YB, Kim DM, et al. A colorimetric homogeneous immunoassay system for the C-reactive protein[J]. Analyst, 2013, 138(5): 1538-1543. DOI:10.1039/c3an36592a |
| [72] |
Mirkin CA, Letsinger RL, Mucic RC, et al. A DNA-based method for rationally assembling nanoparticles into macroscopic materials[J]. Nature, 1996, 382(6592): 607-609. DOI:10.1038/382607a0 |
| [73] |
Qiang W, Liu H, Li W, et al. Label-free detection of adenosine based on fluorescence resonance energy transfer between fluorescent silica nanoparticles and unmodified gold nanoparticles[J]. Anal Chim Acta, 2014, 828(5800): 92-98. |
| [74] |
Sun XL, Zhu B, Ji DK, et al. Selective fluorescence detection of monosaccharides using a material composite formed between graphene oxide and boronate-based receptors[J]. ACS Appl Mater Interfaces, 2014, 6(13): 10078-10082. DOI:10.1021/am500801g |
| [75] |
Liu J, Wang C, Jiang Y, et al. Graphene signal amplification for sensitive and real-time fluorescence anisotropy detection of small molecules[J]. Anal Chem, 2013, 85(3): 1424-1430. DOI:10.1021/ac3023982 |
| [76] |
Mal NK, Fujiwara M, Tanaka Y. Photocontrolled reversible release of guest molecules from coumarin-modified mesoporous silica[J]. Nature, 2003, 421(6921): 350-353. DOI:10.1038/nature01362 |
| [77] |
Yang Y, Lin YZ, et al. Gold nanoparticle-gated mesoporous silica as redox-triggered drug delivery for chemo-photothermal synergistic therapy[J]. J Colloid Interface Sci, 2017, 508: 323-331. DOI:10.1016/j.jcis.2017.08.050 |
| [78] |
You J, Zhang G, Li C. Exceptionally high payload of doxorubicin in hollow gold nanospheres for near-infrared light-triggered drug release[J]. ACS Nano, 2010, 4(2): 1033-1041. DOI:10.1021/nn901181c |
| [79] |
Wei Q, Chen Y, Ma X, et al. High-efficient clearable nanoparticles for multi-modal imaging and image-guided cancer therapy[J]. Adv Funct Mater, 2018. DOI:10.1002/adfm.201704634 |
| [80] |
de la Rica R, Aili D, Stevens MM. Enzyme-responsive nanoparticles for drug release and diagnostics[J]. Advanced Drug Delivery Reviews, 2012, 64(11): 967-978. DOI:10.1016/j.addr.2012.01.002 |
| [81] |
Li GL, Chen YD, Zhang Lñ, et al. Facile approach to synthesize gold nanorod@polyacrylic acid/calcium phosphate yolk-shell nanoparticles for dual-mode imaging and ph/nir-responsive drug delivery[J]. Nano-Micro Letters, 2018, 10(1): 7. DOI:10.1007/s40820-017-0155-3 |
| [82] |
Zhu H, Zhao J, Lin X, et al. Design, synthesis and evaluation of dual-modality glyco-nanoparticles for tumor imaging[J]. Molecules, 2013, 18(6): 6425. DOI:10.3390/molecules18066425 |
| [83] |
Zhu, Hua, Li, et al. Design and Synthesis of ~(111)In-CCPM-RGD nanoparticles for dual-modality molecular imaging[J]. Acta Chimica Sinica, 2014, 72(4):427. http://en.cnki.com.cn/Article_en/CJFDTOTAL-HXXB201404002.htm
|
| [84] |
Wang LF, Zhang M, Tan BK, et al. Preparation of nanobubbles carrying androgen receptor sirna and their inhibitory effects on androgen-independent prostate cancer when combined with ultrasonic irradiation[J]. PLoS One, 2014, 9(5): e96586. DOI:10.1371/journal.pone.0096586 |
| [85] |
Funkhouser J. Reinventing pharma: The theranostic revolution[J]. 2002.
|
| [86] |
杜若鸿.叶酸受体介导的磁性纳米给药系统的构建及用于肿瘤诊治的实验研究[D].合肥: 中国科学技术大学, 2017, .
|
| [87] |
Li C, Zhang Y, Li Z, et al. Light-responsive biodegradable nanorattles for cancer theranostics[J]. Adv Mater, 2018, 30(8). DOI:10.1002/adma.201706150 |