2. 中国农业大学生物学院,北京 100083
2. College of Biology, China Agricultural University, Beijing 100083
磁小体(Bacterial magnetosomes,BMs)是由趋磁细菌(Magnetotactic bacteria,MTB)合成的用于在其水生栖息地中进行地磁导航的专用细胞器。细菌磁小体的合成是通过高度控制磁性晶体的生物矿化来实现的。BMs由生物膜包裹的纳米晶体组成,纳米晶体大多数为磁铁矿(Fe3O4),较少数的为硫复铁矿(Fe3S4)[1]。BMs在细菌细胞中成链状排列,增加了细菌细胞的磁偶极矩[2]。BMs表面带负电荷,可以很容易的被其他功能活性基团修饰[3]。BMs粒径分布在35-120 nm之间[4],是单磁畴纳米粒子[5],具有顺磁性[6]。此外,其还具有形态均匀[5]、比表面积大[7]及生物相容性高等特点[4]。基于这些特性,科学家主要将其应用于医疗领域,包括:核磁共振成像[8-9]、靶向药物递送[4]、肿瘤磁热疗[10]等。
作为一种天然磁性纳米材料,目前,基于BMs的生物传感器相对较少,且不论是电化学生物传感器还是荧光生物传感器都主要通过在BMs表面共价或非共价修饰上抗体,利用抗原(靶物质)抗体之间的特异性免疫反应来达到检测靶物质的目的,检测方法相对较单一。本文着重综述了近些年来细菌磁小体介导的生物传感器研究进展,旨为进一步研发该项技术及其应用奠定理论基础及提供技术支撑。
1 磁小体的基本特性及特点 1.1 磁小体的结构及组成BMs由外部的膜和内部的磁性纳米晶体组成。BMs内部的磁性纳米晶体大多数为磁铁矿(Fe3O4),较少数的为硫复铁矿(Fe3S4)[1],磁铁矿晶体形态根据提取它的细菌菌株而变化[2],有立方八面体型、子弹型及矩形[11]。此外,还有泪滴状、薄片状等。BMs的外层膜为脂质双层膜,与生物体内的细胞膜系统相似,由98%脂质和2%其他化合物组成,包括蛋白质;磷脂占总脂质的58%,磷脂酰乙醇胺占总磷脂的50%。此外,一些蛋白质还与磁小体的形成有关[5, 12-13]。磁螺菌MS-1的磁小体膜中含有中性脂质和游离脂肪酸,其中糖脂、硫脂和磷脂重量比为1: 4: 6,磷脂包括磷脂酰丝氨酸和磷脂酰乙醇氨基[4]。2014年,Xu等[14]在BMs表面检测到超过200种蛋白质,其中有些是磁小体特有的。Mam C和Mam F是趋磁细菌MSR-1中磁小体膜上最丰富的蛋白质,是分别由125个氨基酸(12.4 kD)和111个氨基酸(12.3 kD)组成的小蛋白质。相较于人工合成的磁性纳米粒子,磁细菌产生的BMs具有非常完美的晶体结构,而且种类较多,很多研究者都将BMs作为理想晶形的标准[15]。
1.2 磁小体的基本特性作为具有独特结构的天然磁性纳米粒子,BMs具有多种特性。当趋磁细菌在最佳条件下培养时,磁小体的粒径分布窄且形态均匀。磁小体通常是大的单磁畴纳米粒子,在生理温度下具有热稳定的磁矩[5],并且磁铁矿的磁矩比硫复铁矿强得多[3]。另外,BMs还具有顺磁性[6]及高生物相容性[4]。典型的BMs粒径是在35-120 nm之间,然而在一些细菌中,也发现了大于200 nm的晶体[4]。但大部分的BMs表现出40-50 nm的尺寸分布[2]。小尺寸和完整的磁小体膜使BMs具有很大的表面积与体积比[7]。含有氨基残基的磁小体膜覆盖了每个BMs,可以利用交联剂将蛋白质固定在BMs表面[12]或通过羧基和氨基的反应形成酰胺键修饰上其他功能活性基团。此外,Li等[16]从AMB-1菌株中提取出BMs并发现其具有固有的类过氧化物酶活性,可依赖这种活性清除活性氧,并且在可见光的照射下类过氧化物酶活性会增强。
1.3 磁小体的毒性随着磁小体在生物医药领域的研究应用,对磁小体进行毒性评估是必要的。Xiang等[17]评估了提取自磁螺菌MSR-1中的已经纯化和灭菌的BMs在体外对小鼠成纤维细胞的毒性,发现该BMs在体外对小鼠成纤维细胞没有毒性。Sun等[18]检测了BMs的急性毒性、免疫毒性和细胞毒性,确定了注射到SD大鼠舌下静脉中BMs的LD50值是62.7 mg/kg。当进一步注射40 mg/kg BMs时,在常规血液检查结果,肝脏和肾脏功能测试,主要器官脏器指数或与ConA和/或LPS抗原结合的淋巴细胞刺激指数方面,BMs处理组和对照组大鼠之间没有显着差异;BMs处理大鼠的主要器官组织学检查显示除了肝中的空泡数量增加和肺中的小叶间隔稍厚外,没有明显的病理学变化。BMs对H22,HL60或EMT-6细胞几乎没有细胞毒性作用,用9 mg/mL BMs孵育时,3种细胞的生长都没有被抑制也没有被刺激,对DNA含量、细胞大小或细胞膜完整性也没有影响。最近,Revathy等[19]在多种模型中对BMs的毒性进行了评估,其中包括人类红细胞、白细胞、小鼠巨噬细胞系(J774)、洋葱根尖和鱼(Oreochromis mossambicus)。当BMs浓度较低时,红细胞和J774细胞没有观察到可检测的形态改变,没有检测到白细胞的染色体畸变。此外,对鱼也没有毒性。他们得出结论,磁小体在较低浓度下是安全的,并且不会对生态系统造成任何潜在风险。
1.4 磁小体的提取和纯化方法Erdal等[3]提到BMs的制备步骤较困难。在BMs提取和纯化过程中一般都会辅助以超声波加快BMs的分离。Chen等[7]利用超声波破碎培养的磁螺菌MSR-1细菌细胞,然后再用Nd-Fe-B磁铁对BMs进行富集,最后再纯化得到BMs。Guo等[20]开发了一种新的快速连续程序,用于大规模提取和纯化磁螺菌MSR-1细胞中的BMs。该程序主要包括4步:第一步,用高压匀浆器破碎细菌细胞,直到超过90%被裂解,裂解率可通过显微镜进行测定;第二步,用持续磁力分离系统MIS并伴随低功率超声波处理和尿素处理分离BMs,直到废弃物中的蛋白质在280 nm的吸光度下检测不到;第三步,用蛋白酶K去除被吸附的蛋白质和表面蛋白质并采用电洗脱去除核酸,直到检测不到蛋白质和核酸污染物;最后一步,用磁力搅拌系统中的蒸馏水代替缓冲液洗涤BMs。在冷冻干燥和用γ射线处理后,将纯化的BMs保存在-20℃即可。可以通过采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、聚合酶链式反应(Polymerase chain reaction,PCR)和傅立叶变换红外光谱对所得到的BMs的纯度进行评价。Pi等[21]从一种可以容易地在常规实验室或商业环境中孵育的MTB中提取出了15 nm大小的BMs。他们先将含有MTB的肉汤培养基进行离心,多次洗涤得到没有细胞碎片的纯沉淀物,再利用超声波细胞破碎系统设置10 s超声和3 s间隔,超声破碎30 min以从MTB体中释放BMs。
1.5 磁小体形态结构表征和组分元素分析对BMs形态结构进行解析能够便于研究者更好地利用BMs来进行实验。可以通过扫描电镜图(Scanning electron microscope,SEM)来观察BMs[22]。透射电子显微镜(Transmission electron microscope,TEM)也可用于对BMs的结构进行观察,TEM提供了许多关于磁小体结构的重要发现。Mann等[23]采用高分辨率透射电子显微镜(High resolution transmission electron microscopy,HRTEM)探究了从磁球菌细胞中分离的磁铁矿颗粒。结果显示颗粒具有与磁铁矿结构一致的晶格图像,并且是单畴结构,具有高度的晶体完美性。Feng等[24]在研究Mms 6磁小体蛋白质的整合自组装以形成铁应答结构时表示,Mms 6是来自磁螺菌菌株AMB-1的60个氨基酸的小蛋白质,其可以促进顺磁磁铁矿纳米晶体的体外生长,在水溶液中组装形成球形胶束可通过TEM可视化。但是,利用TEM进行观察需要对生物样品进行如固定、染色、脱水、包埋和薄切片等实验操作,这些过程均可能会损害或改变生物标本的天然结构。利用原子力显微镜(Atomic force microscope,AFM)观察时,在样品的光栅扫描期间,样品的表面轮廓通过检测样品与AFM针头之间的相互作用而成像。AFM能够在接近原始的条件下以高信噪比使生物标本可视化,在分子分辨率下也能够观察到亚细胞大小的细菌细胞器的构成[25]。Yamamoto等[25]应用AFM来调查磁性螺旋菌AMB-1中BMs的空间构型。AFM观察结果表明包裹在磁铁矿晶体周围的有机层的厚度大约为7 nm,并且BMs相关蛋白Mam A位于有机层的表面,BMs的最外层是由BMs相关蛋白的无定形层形成。将TEM与X射线能量色散谱(EDXS-TEM)结合能够分析BMs的化学组分,空气-乙炔火焰光谱能用来对元素进行分析[21]。
2 磁小体用于靶物质富集 2.1 磁小体用于病原菌富集在BMs表面固定上抗体,通过抗原抗体反应吸附病原菌,然后利用外部施加的磁场可实现病原菌的快速富集和分离。早在20世纪末,就有科学家利用BMs来对致病菌进行富集和检测,Nakamura等[12]就用将异硫氰酸荧光素缀合的单克隆抗大肠杆菌抗体固定在细菌磁性颗粒BMs上用于高选择性的富集和除去细菌悬浮液中的大肠杆菌。2010年,Li等[26]通过双琥珀酰亚胺辛二酸酯钠盐(BS3)交联剂将多克隆抗体与BMs表面上的氨基进行连接以形成功能磁性载体,并用于捕获食品样品中的沙门氏菌,利用外部的磁场实现样品中沙门氏菌的富集与分离。2014年,Xu等[14]利用表面展示技术通过将葡萄球菌蛋白A(Staphylococcal protein A,SPA)(一种来自金黄色葡萄球菌细胞壁的免疫球蛋白结合蛋白)与Mam C或Mam F这两种BMs(来自趋磁细菌MSR-1)膜表面最多的蛋白质进行融合,从而使SPA在BMs上大量表达。这种重组磁小体表面的SPA能够与哺乳动物抗体(Abs)的Fc区自主装。将得到的磁小体/抗体复合物用于捕获富集致病菌,发现1 mg的复合物能够捕获多达1.74×107个副溶血性弧菌细胞。
2.2 磁小体用于磷酸化肽富集不久前,Huang等[27]首次报道BMs可以直接将Zr4+和Fe3+吸附在其表面上不需要任何其他的修饰,这种吸附了金属离子的表面对α-、β-和牛奶酪蛋白的胰蛋白酶消化物中的磷酸化肽具有选择能力,可在30 s内快速富集磷酸化肽。结果显示每克BMs可以固定5.909×10-4 moL的Fe3+和3.946×10-4 moL的Zr4+,因此Fe3+固定的BMs可在较低浓度条件下检测磷酸化肽。离子固定的量之间存在差异可以用两种离子之间不同配位性质来解释:BMs膜上除了磷脂之外,还含有硫脂,因此,Fe3+可以通过Fe-O(磷脂)和Fe-S(硫脂)配位键连接到BMs上,而Zr4+只有Zr-O(磷脂)配位。并且当Fe3+固定的BMs只能富集单一的磷酸化肽时,Zr4+固定的BMs可以同时富集多种磷酸化肽。此外,BMs本身还可以直接通过BMs和磷酸化肽之间的弱相互作用从α-酪蛋白消化物中富集一种磷酸化肽。
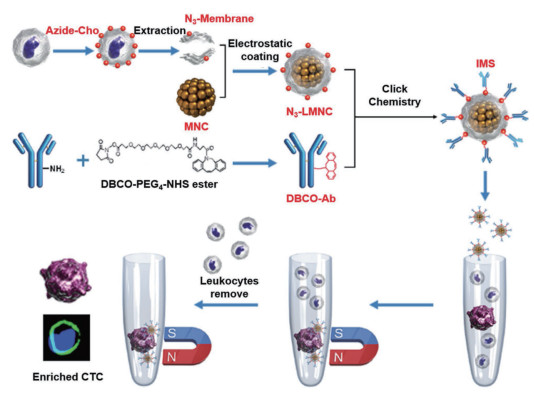
2.3 磁小体用于肿瘤细胞富集2016年,Xiong等[28]合成了仿生免疫磁小体用于高通量富集血液中的循环肿瘤细胞(Circulating tumor cells,CTCs)。如图 1所示,首先通过静电相互作用在Fe3O4磁性纳米簇(Magnetic nanoclusters,MNCs)表面覆盖一层白细胞膜碎片形成复合物(LMNC)。这层白细胞膜带有叠氮化物(N3),是作者通过将白细胞与叠氮化胆碱共同孵育在白细胞膜上产生N3预先设计的。随后,N3-LMNCs可以用高活性的二苯并环辛烯基团修饰的抗体(DBCO-Ab)通过点击化学以可控的密度进行修饰。由此产生的抗体修饰的仿生免疫磁小体被赋予了优越的CTCs识别效率,近90%的罕见肿瘤细胞可在15 min内被该免疫磁小体从全血中捕获;由于同源性,免疫磁小体与白细胞之间存在斥力因此可显著降低白细胞干扰,在富集的CTCs中检测不到白细胞的存在。
2.4 磁小体用于真菌毒素富集最近,Pi等[21]通过化学键合将黄曲霉毒素B1(Aflatoxin B1,AFB1)多克隆抗体连在天然BMs上构建了一种磁小体-AFB1抗体免疫磁性探针,并用这种磁性探针富集和除去植物油中的AFB1毒素。用此免疫磁性探针从人为AFB1污染的商业植物油中富集AFB1的15 min过程中,回收率可高达93.7%。与传统的Fe3O4磁性纳米颗粒-AFB1抗体探针相比(4 ng/mg),这种新构建的磁小体-AFB1抗体免疫磁性探针对植物油中AFB1毒素的富集能力(115 ng/mg)高了28倍。且这种免疫磁性探针经过简单的激活可以重复使用,通过在BMs表面附着上不同的抗体还可以开发出一系列磁小体-抗体免疫磁性探针用于其他靶物质的富集。
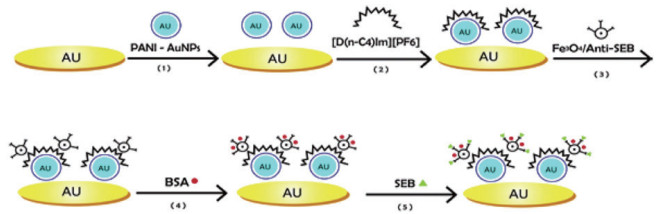
3 磁小体介导的电化学生物传感器将BMs应用于电化学生物传感器的研究相对较少,目前仅发现一例。即2013年,Wu等[22]首次构建了一种基于BMs的电化学免疫传感器用于检测葡萄球菌肠毒素B(Staphylococcal enterotoxin B,SEB)。这种电化学免疫传感器主要依赖SEB孵育后电极阻抗的变化来对SEB进行定量测定。其构建过程如图 2所示。在实验中,该免疫传感器是直接通过物理吸附逐层组装构建的,通过共价键合法合成SEB抗体功能化的BMs。所使用的BMs不仅提供了更大的比表面积以增加抗体的固定量和免疫反应速率,而且还提供了良好的分散性以在金电极表面形成光滑致密的膜。已经构建好的传感器能够在大约20 min内实现对SEB的快速检测,检测范围0.05-5 ng/mL,检测限为0.017 ng/mL;而采用没有BMs的检测方法检测SEB,检测限为0.033 ng/mL,相对更高。该方法具有线性范围宽、检出限低、特异性好、稳定性强、回收率高、重现性好等优点,最重要的是可以将其应用于实际样品的检测。
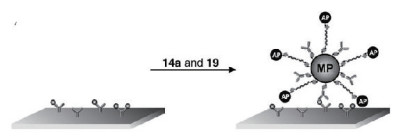
4 磁小体介导的荧光生物传感器基于BMs构建荧光生物传感器相较于其他类型生物传感器研究较多。Ota等[29]通过使用基于BMs的杂交方法检测转化生长因子-β1(Transforming growth factor-β1,TGF-β1)基因内的单核苷酸多态性(Single nucleotide polymorphism,SNP)。先使用交联剂将用于检测TGF-β1中SNP的短(9个碱基)和特异性DNA检测探针固定在BMs上。用荧光染料香豆素标记TGF-β1的PCR产物(139 bp),并与BMs上的检测探针杂交,最后通过测定荧光强度来成功区分SNP基因型。与一个碱基错配杂交相比,完全互补杂交产生的荧光强度要高出4倍。这种方法适用于自动化工作系统,以实现高通量SNP检测。该系统还具有对其他类型的SNP进行基因分型的潜力,并且还可用于鉴定插入或缺失多态性。Ceyhan等[6]采用了两种策略在BMs的表面修饰上生物素得到生物素化的BMs。随后,他们采用链霉亲和素作为连接体在生物素化的BMs表面连接上生物素修饰的寡核苷酸链或抗体形成官能化BMs纳米复合物。作者基于这种纳米复合物设计了荧光生物传感器用于蛋白质检测实验,小鼠免疫球蛋白G(Immunoglobulin G,IgG)作为检测模型。其构建原理如图 3所示,首先通过免疫吸附将捕获抗体(多克隆抗小鼠IgG)固定在微孔反应板上用于小鼠IgG抗原固定,随后让连接有抗小鼠IgG和寡核苷酸链的双功能化的BMs纳米复合物与微孔反应板上固定化抗原结合,然后让双功能化的纳米复合物通过特异性DNA杂交来捕获DNA-链霉亲和素-碱性磷酸酶缀合物,最后加入荧光碱性磷酸酶的底物Attophos,根据测量得到的荧光信号强度来判定IgG的含量。
在2009年,Chen等[7]通过荧光免疫实验使用从磁螺菌MSR-1中提取出的细菌磁粒子BMs与抗体和异硫氰酸荧光素形成的复合物对两种果树病毒:枯枝坏死环斑病毒(Prunus necrotic ring spot virus,PNRSV)和葡萄扇叶病毒(Grapevine fanleaf virus,GFLV)进行了精确高灵敏检测。采用这种方法,可以检测到极低的抗原浓度(原始样品浓度的1×106稀释)。而使用双抗体夹心酶联免疫反应(Double antibody sandwich enzyme linked immunosorbent assay,DAS-ELISA),最小抗原检测浓度是原始样品浓度。因此,基于BMs的方法比基于ELISA检测PNRSV和GFLV的方法灵敏度提高了6个数量级(106)。两种病毒的浓度线性检测范围都在1×10-6-1×10-3。
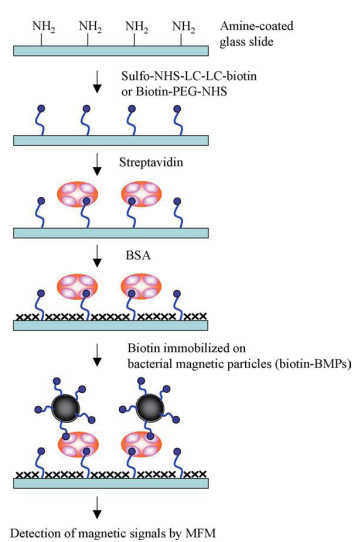
5 磁小体介导的磁生物传感器由于BMs的单磁畴和顺磁特性,常常被用作磁标记物应用于生物传感器中。Amemiya等[30]开发了一种使用缀合了生物素的BMs用于链霉亲和素检测的系统,如图 4所示。其中,BMs用作磁力显微镜(Magnetic force microscopy,MFM)成像的磁性标记物。这是第一篇使用单畴纳米磁性颗粒作为生物传感的磁性标记的报告。在实验中,使用MFM可以在不施加外部磁场的情况下从单个颗粒中获得磁信号。该技术的最低链霉亲和素检测限为1 pg/mL,比常规的荧光检测系统灵敏度高100倍。该测定系统还可用于高灵敏度的免疫测定和DNA检测。
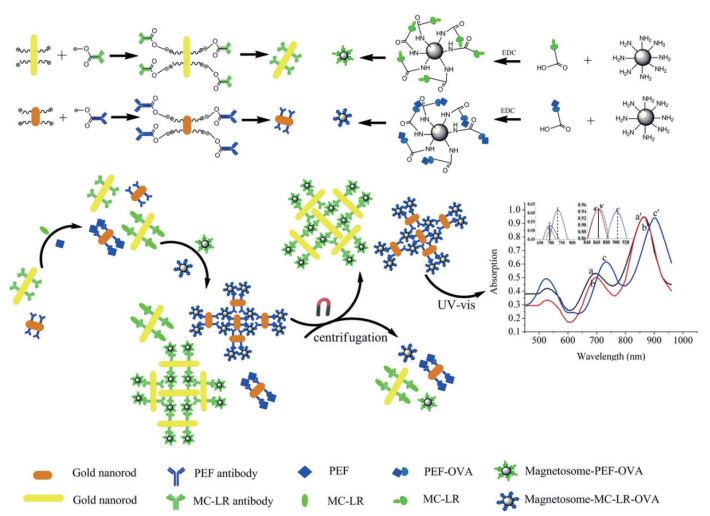
6 磁小体介导的其他生物传感技术 6.1 纵向表面等离子体共振检测法2013年,Sun等[31]第一次使用抗体功能化的金纳米棒(Gold nanorods,GNRs)作为信号探针和抗原-卵白蛋白(Ovalbumin,OVA)修饰的生物磁小体作为信号放大探针,开发了一种简单的纵向表面等离子共振(Longitudinal surface plasmon resonance,LSPR)检测方法,用于同时进行紫外-可见检测海鲜中的培氟沙星(Pefloxacin,PEF)和微囊藻毒素LR(Microcystin-LR,MC-LR)。如图 5所示,该传感器是根据抗原-OVA可以与抗体和游离抗原进行竞争的原理构建的。抗体功能化的GNRs和抗原-OVA修饰的BMs可以根据游离抗原的浓度形成不同大小的聚集体。组装到GNRs表面的BMs的数量越多,GNR的LSPR的红移越高。随着游离抗原浓度的增加,组装的BMs数量会减少,GNRs的红移也会随之减少。通过磁分离和信号放大效应及当GNRs纵横比发生变化时,LSPR吸收光谱产生的独特光学性质;LSPR免疫测定法可灵敏和选择性的同时检测PEF和MC-LR。整个分析时间少于3 h,PEF和MC-LR的检测线性范围均为1-20 ng/mL。与无BMs的LSPR测定相比,响应信号放大2.5-5.0倍。
6.2 磁免疫-PCRWacker等[32]在传统的免疫-PCR的技术上进行创新构建了磁免疫-PCR(Magneto immuno-PCR,M-IPCR)。这种M-IPCR是在抗体功能化的BMs上建立的。抗体功能化的磁小体结合物主要用于产生信号的检测复合物的固定和磁性富集。M-IPCR的一般原理与双面(三明治)免疫分析法相似。该实验的抗原检测模型是重组乙型肝炎表面抗原(Hepatitis B surface antigen,HBsAg)。首先,使用NHS-生物素将BMs膜初始生物素化,然后使用膜结合的生物素基团结合链霉亲和素;随后,将链霉亲和素官能化的BMs与生物素化的抗HBsAg抗体偶联形成复合物,再以HBsAg抗原作为连接体,通过抗原抗体反应连上DNA-抗体结合物形成了可产生信号的检测复合物;使用磁力分离法洗涤所得到的检测复合物颗粒,重新悬浮后,将确定体积的检测复合物溶液转移至含有PCR主混合物的微孔板中以实现固定化抗原的实时PCR检测。其线性检测范围为200 ng/mL-320 pg/mL,检测限为320 pg/mL。作者将BMs与商业用磁珠作为磁性载体进行了比较发现,使用BMs构建的M-IPCR具有更高的信噪比,更低的标准偏差和更好的灵敏度。相比较于商业用磁珠而言,灵敏度提高了约25倍。
7 结语目前,相较于人工合成磁纳米粒子,科学家将磁细菌产生的天然磁性纳米颗粒BMs应用到生物传感器中的研究相对较少,且形式较单一,没有比色和化学发光等类型的生物传感器,这可成为未来的研究方向。且不管何种类型的生物传感器,都主要通过在BMs表面共价或非共价修饰上抗体,利用抗原抗体之间的特异性免疫反应来达到检测靶物质的目的,检测的靶物质主要倾向于蛋白质类的生物大分子,没有发现对寡核苷酸链、糖苷类、金属离子等物质的检测。这是今后基于BMs构建生物传感器需要克服的关键技术之一。
利用抗体功能化的BMs来实现靶物质的检测局限性较大,能够检测的靶物质较少,且制作成本较高。BMs膜表面含有大量的氨基,可以通过在BMs表面共价修饰上各种不同的功能活性物质,如适配体等,并结合BMs的顺磁特性来构建生物传感器实现其他类型的靶物质的快速检测。BMs的毒性较低,可在外部磁场的控制下定向移动,因此,将其应用于体内实现体内物质的检测也是未来科学家可以进行研究突破的。BMs相较于人工合成磁性纳米粒子具有突出的优势,BMs介导的生物传感器应用前景广泛。
| [1] |
Faivre D, Schuler D. Magnetotactic bacteria and magnetosomes[J]. Chem Rev, 2008, 108(11): 4875-4898. DOI:10.1021/cr078258w |
| [2] |
Jacob JJ, Suthindhiran K. Magnetotactic bacteria and magnetosomes-Scope and challenges[J]. Materials Science and Engineering:C, 2016, 68: 919-928. DOI:10.1016/j.msec.2016.07.049 |
| [3] |
Erdal E, Demirbilek M, Yeh Y, et al. A Comparative study of receptor-targeted magnetosome and HSA-coated iron oxide nanoparticles as MRI contrast-enhancing agent in animal cancer model[J]. Appl Biochem Biotechnol, 2018, 185(1): 91-113. DOI:10.1007/s12010-017-2642-x |
| [4] |
Sun J, Li Y, Liang XJ, et al. Bacterial magnetosome:a novel biogenetic magnetic targeted drug carrier with potential multifunctions[J]. J Nanomater, 2011(2011): 469031-469043. |
| [5] |
Alphandéry E. Applications of magnetosomes synthesized by magnetotactic bacteria in medicine[J]. Frontiers in Bioengineering and Biotechnology, 2014, 2: 5. |
| [6] |
Ceyhan B, Alhorn P, Lang C, et al. Semisynthetic biogenic magnetosome nanoparticles for the detection of proteins and nucleic acids[J]. Small, 2006, 2(11): 1251-1255. DOI:10.1002/(ISSN)1613-6829 |
| [7] |
Chen JF, Li Y, Wang ZF, et al. High-sensitivity detection of fruit tree viruses using bacterial magnetic particles[J]. Journal of Integrative Plant Biology, 2009, 51(4): 409-413. DOI:10.1111/jipb.2009.51.issue-4 |
| [8] |
Xiang Z, Yang X, Xu J, et al. Tumor detection using magnetosome nanoparticles functionalized with a newly screened EGFR/HER2 targeting peptide[J]. Biomaterials, 2017, 115: 53-64. DOI:10.1016/j.biomaterials.2016.11.022 |
| [9] |
Boucher M, Geffroy F, Prévéral S, et al. Genetically tailored magnetosomes used as MRI probe for molecular imaging of brain tumor[J]. Biomaterials, 2017, 121: 167-178. DOI:10.1016/j.biomaterials.2016.12.013 |
| [10] |
Alphandéry E, Guyot F, Chebbi I. Preparation of chains of magnetosomes, isolated from Magnetospirillum magneticum strain AMB-1 magnetotactic bacteria, yielding efficient treatment of tumors using magnetic hyperthermia[J]. International Journal of Pharmaceutics, 2012, 434(1-2): 444-452. DOI:10.1016/j.ijpharm.2012.06.015 |
| [11] |
Lins U, Freitas F, Keim CN, et al. Electron spectroscopic imaging of magnetotactic bacteria:magnetosome morphology and diversity[J]. Microscopy and Microanalysis, 2000, 6(5): 463-470. |
| [12] |
Grünberg K, Müller EC, Otto A, et al. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense[J]. Applied and Environmental Microbiology, 2004, 70(2): 1040-1050. |
| [13] |
Nakamura N, Burgess JG, Yagiuda K, et al. Detection and removal of Escherichia coli using fluorescein isothiocyanate conjugated monoclonal antibody immobilized on bacterial magnetic particles[J]. Anal Chem, 1993, 65(15): 2036-2039. DOI:10.1021/ac00063a018 |
| [14] |
Xu J, Hu J, Liu L, et al. Surface expression of protein A on magnetosomes and capture of pathogenic bacteria by magnetosome/antibody complexes[J]. Frontiers in Microbiology, 2014, 5: 136. |
| [15] |
刘珺, 周培国. 趋磁细菌应用于重金属废水处理的研究进展[J]. 环境科技, 2008, 21(6): 60-63. |
| [16] |
Li K, Chen C, Chen C, et al. Magnetosomes extracted from Magnetospirillum magneticum strain AMB-1 showed enhanced peroxidase-like activity under visible-light irradiation[J]. Enzyme and Microbial Technology, 2015, 72: 72-78. DOI:10.1016/j.enzmictec.2015.02.009 |
| [17] |
Xiang L, Wei J, Jianbo S, et al. Purified and sterilized magnetosomes from Magnetospirillum gryphiswaldense MSR-1 were not toxic to mouse fibroblasts in vitro[J]. Letters in Applied Microbiology, 2007, 45(1): 75-81. DOI:10.1111/lam.2007.45.issue-1 |
| [18] |
Sun J, Tang T, Duan J, et al. Biocompatibility of bacterial magnet-osomes:acute toxicity, immunotoxicity and cytotoxicity[J]. Nanotoxicology, 2010, 4(3): 271-283. DOI:10.3109/17435391003690531 |
| [19] |
Revathy T, Jayasri MA, Suthindhiran K. Toxicity assessment of magnetosomes in different models[J]. 3 Biotech, 2017, 7(2): 126. DOI:10.1007/s13205-017-0780-z |
| [20] |
Guo F, Liu Y, Chen Y, et al. A novel rapid and continuous procedure for large-scale purification of magnetosomes from Magnetospirillum gryphiswaldense[J]. Applied Microbiology and Biotechnology, 2011, 90(4): 1277-1283. DOI:10.1007/s00253-011-3189-3 |
| [21] |
Pi F, Sun J, Liu W, et al. Elimination of aflatoxin B1 in vegetable oil based on immuno-magnetosomes probes from a novel magnetotactic bacterium[J]. Food Control, 2017, 80: 319-326. DOI:10.1016/j.foodcont.2017.04.004 |
| [22] |
Wu L, Gao B, Zhang F, et al. A novel electrochemical immunosen-sor based on magnetosomes for detection of staphylococcal enterotoxin B in milk[J]. Talanta, 2013, 106: 360-366. DOI:10.1016/j.talanta.2012.12.053 |
| [23] |
Mann S, Moench TT, Williams RJP. A high resolution electron microscopic investigation of bacterial magnetite. implications for crystal growth[J]. Proceedings of the Royal Society of London, 1984, 221(1225): 385-393. DOI:10.1098/rspb.1984.0040 |
| [24] |
Feng S, Wang L, Palo P, et al. Integrated self-assembly of the Mms6 magnetosome protein to form an iron-responsive structure[J]. International Journal of Molecular Sciences, 2013, 14(7): 14594-606. DOI:10.3390/ijms140714594 |
| [25] |
Yamamoto D, Taoka A, Uchihashi T, et al. Visualization and structural analysis of the bacterial magnetic organelle magnetosome using atomic force microscopy[J]. Proc Natl Acad Sci, 2010, 107(20): 9382-9387. DOI:10.1073/pnas.1001870107 |
| [26] |
Li A, Zhang H, Zhang X, et al. Rapid separation and immunoassay for low levels of Salmonella in foods using magnetosome-antibody complex and real-time fluorescence quantitative PCR[J]. Journal of Separation Science, 2010, 33(21): 3437-3443. DOI:10.1002/jssc.v33:21 |
| [27] |
Huang J, Guo L, Zheng L M. Rapid enrichment and determination of phosphopeptides using bacterial magnetic particles via both strong and weak interactions[J]. Analyst, 2010, 135(3): 559-563. DOI:10.1039/b920985a |
| [28] |
Xiong K, Wei W, Jin Y, et al. Biomimetic immuno-magnetosomes for high-performance enrichment of circulating tumor cells[J]. Adv Mater, 2016, 28(36): 7929-7935. DOI:10.1002/adma.201601643 |
| [29] |
Ota H, Takeyama H, Nakayama H, et al. SNP detection in transforming growth factor-β1 gene using bacterial magnetic particles[J]. Biosens Bioelectron, 2003, 18(5-6): 683-687. DOI:10.1016/S0956-5663(03)00015-0 |
| [30] |
Amemiya Y, Tanaka T, Yoza B, et al. Novel detection system for biomolecules using nano-sized bacterial magnetic particles and magnetic force microscopy[J]. J Biotechnol, 2005, 120(3): 308-314. DOI:10.1016/j.jbiotec.2005.06.028 |
| [31] |
Sun X, Wu L, Ji J, et al. Longitudinal surface plasmon resonance assay enhanced by magnetosomes for simultaneous detection of Pefloxacin and Microcystin-LR in seafoods[J]. Biosens Bioelectron, 2013, 47: 318-323. DOI:10.1016/j.bios.2013.03.046 |
| [32] |
Wacker R, Ceyhan B, Alhorn P, et al. Magneto immuno-PCR:a novel immunoassay based on biogenic magnetosome nanoparticles[J]. Biochemical and Biophysical Research Communications, 2007, 357(2): 391-396. DOI:10.1016/j.bbrc.2007.03.156 |