水稻是我国的重要粮食作物之一。水稻害虫是水稻丰产和稳产的重要限制因子,每年给我国水稻生产造成的损失可占总产量的5%-10%,且有逐年加重之趋势,其中鳞翅目害虫是水稻生产危害最大的害虫。至今,水稻中还未发现抗这类害虫的种质资源,因此通过常规育种方法很难培育出抗鳞翅目害虫水稻,利用生物技术手段培育抗虫水稻为解决上述问题提供了广阔的前景。
苏云金芽孢杆菌(Bacillus thuringiensis,Bt)能产生对多种昆虫有害的杀虫晶体蛋白(Insecticidal crystal proteins,ICPs)。Bt杀虫晶体蛋白(ICP)可特异性毒杀不同的昆虫,包括鳞翅目、鞘翅目、双翅目和螨类等害虫,而对人畜无害,是目前农业生产转基因育种中主要使用的抗虫蛋白。cry1C基因所编码的Bt杀虫蛋白可以抑制和杀死鳞翅目害虫,是在野生型Cry1Ca5基因的基础上通过序列优化人工合成的抗虫基因[1]。目前,利用生物技术手段将cry1C基因导入到各种植物中,包括水稻[2-4]、大豆[5-6]、玉米[7-8]和油菜[9]等,成功获得了对抗鳞翅目害虫具有抗性的转基因植物。
随着转基因技术的发展,国内外大量的转基因植物已进入生物安全评价阶段,部分产品已进入商业化阶段。快速、精准、高通量的转基因生物及产品检测技术是转基因生物安全管理的重要依据[10]。目前,转基因作物中检测蛋白的方法主要有Western Blot法和酶联免疫吸附法(ELISA)等,很多研究团队建立了依据这两种方法的蛋白定性和定量检测方法和体系[11-12],而这些方法都需要目的蛋白抗体。市面上的cry1C抗体不仅价格昂贵,而且检测cry1C转基因水稻特异性不强。因此,cry1C抗体的制备在抗鳞翅目害虫转基因植物研究中发挥重要的作用。
本研究利用生物信息学方法预测cry1C蛋白的抗原表位并命名为Δcry1C,优化Δcry1C核苷酸序列并进行人工合成,构建原核表达载体pET28b(+)-Δcry1C,高效表达His6-Δcry1C重组蛋白,制备cry1C兔多克隆抗体及验证其特异性,旨在获得价格低廉且特异性较强的cry1C多克隆抗体,为深入研究鳞翅目害虫提供前提条件。
1 材料与方法 1.1 材料 1.1.1 实验材料转cry1C基因抗虫水稻由本实验室创制或保存。
1.1.2 主要试剂Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶、大肠杆菌感受态细胞均购自大连宝生物工程有限公司;植物蛋白提取试剂盒、ECL试剂盒均购自北京康为世纪生物公司;实验引物和抗原表位区人工合成来自上海生工生物工程有限公司。
1.2 方法 1.2.1 cry1C基因抗原表位预测及核苷酸序列的人工合成根据已报道的cry1C核苷酸序列[1]推导氨基酸序列,利用TMHMMOL/L Server v.2.0(http://www.cbs.dtu.dk/services/TMHMMOL/L)及DNAstar软件分析跨膜区、亲水性、表面可及性及抗原性的预测,筛选cry1C蛋白的抗原表位区。在不改变抗原表位区氨基酸序列的前提下,根据大肠杆菌密码子的偏爱性,优化抗原表位区核苷酸序列并命名为Δcry1C,委托上海生工生物人工合成,人工合成时5'端和3'端分别设计了Nde Ⅰ和Xho Ⅰ酶切位点。
1.2.2 原核重组表达载体构建以人工合成的Δcry1C抗原片段为模板,进行PCR扩增,引物序列为Δcry1C-F:5'-CATATGGTCGAAGCATTCAAGGA-3'(下划线序列为NdeⅠ酶切位点),Δcry1C-R:5'-CTCGAGTTATTTCTGCGCGCGTT-3'(下划线序列为XhoⅠ酶切位点)。PCR产物与原核表达载体pET28b(+)质粒用Nde Ⅰ和Xho Ⅰ进行双酶切后用T4 DNA连接酶连接。将连接产物转化大肠杆菌感受态菌株TOP10,筛选阳性克隆,提取重组质粒DNA,双酶切确认片段大小。原核重组表达载体序列经上海生工生物测序、比对分析验证序列的正确性。
1.2.3 重组蛋白的诱导表达与可溶性分析将重组质粒pET28b(+)-Δcry1C转化到E.coli感受态细胞BL21(DE3),以0.5 mmol/L的IPTG,分别在20℃过夜和37℃诱导表达4 h,未加IPTG诱导剂的作为阴性对照。将离心收集的菌体用PBS缓冲液悬浮,冰浴下超声破碎,在12 000 r/min、4℃条件下离心30 min,收集上清和沉淀。沉淀采用500 µL包涵体溶解液(8 mol/L Urea,50 mmol/L Tris-HCl,150 mmol/L NaCl,pH8.0)溶解。
上清液和溶解的包涵体分别与protein loading buffer混匀、沸水处理10 min,通过SDS-PAGE电泳,考马斯亮蓝染色液染色,观察分析重组蛋白存在的部分。
1.2.4 重组表达蛋白的扩培、纯化及鉴定将含有重组质粒pET28b(+)-Δcry1C的BL21(DE3)菌液进行扩增培养4 L,以0.5 mmol/L的IPTG、37℃诱导表达4 h,离心收集细胞菌体。将收集的细菌菌体用破碎Buffer(20 mmol/L PB,300 mmol/L NaCl,0.1% Triton X-100,1 mmol/L DTT,pH 8.0)溶解,冰浴中超声破碎菌体,弃上清、取沉淀。将收集的沉淀用破碎Buffer(8 mmol/L Urea,20 mmol/L PB,300 mmol/L NaCl,0.1% TritonX-100,1 mmol/L DTT,pH 8.0)溶解,冰浴中超声破碎菌体,离心后取上清。His6-Δcry1C重组蛋白采用镍琼脂糖亲和层析方法进行纯化,重组蛋白经过0.45 µm滤膜之后上样于Ni-NTA Spin Columns亲和层析柱结合1 h,重复过柱3次,用Wash buffer(20 mmol/L/50 mmol/L Imidazole,8 mmol/L Urea,20 mmol/L PB,300 mmol/L NaCl,0.1% TritonX-100,1 mmol/L DTT,pH 8.0)洗杂4次,经不同浓度的Imidazole Elution buffer(20/50/500 mmol/L Imidazole,8 mmol/L Urea,20 mmol/L PB,300 mmol/L NaCl,pH 8.0)洗脱。将纯度较好的500 mmol/L Imidazole洗脱组分透析至10 mmol/L PBS,0.1% SKL,pH 8.0中,浓缩,过滤除菌,保存于-80℃。
1.2.5 cry1C兔多克隆抗体血清的制备将纯化后的His6-Δcry1C重组蛋白与弗氏完全佐剂混合,分别对4只4月龄新西兰大白兔按常规免疫周期进行免疫注射。共注射4次,一免后的第21天、第35天和第49天分别为二免、三免和四免时期。一免用0.3 mg重组蛋白与等体积弗氏完全佐剂混合进行,二免、三免和四免用0.15 mg重组蛋白与等体积弗氏完全佐剂混合后进行加强免疫注射。三免和四免后7-10 d从兔耳缘静脉取血1 mL,采用抗体间接ELISA法测定抗体滴度。抗血清效价达到要求后,采集颈动脉全血,血样先沉淀提纯血清,血清进行抗原抗体亲和纯化。
1.2.6 抗cry1C血清效价的测定利用间接ELISA法测定抗体效价,以免疫前兔血清作为阴性对照。将His6-Δcry1C抗原蛋白用0.05 mol/L的碳酸盐缓冲液(pH 9.6)稀释成2 ng/μL后,包被酶标板,4℃孵育过夜后用PBST溶液洗涤酶标板。用5%脱脂奶粉封闭液,37℃封闭60 min,用PBST(0.05% Tween-20)洗板。将抗cry1C血清分别按照梯度稀释后,每个梯度设置3次重复,37℃孵育酶标板60 min,用PBST洗板。用HRP标记的羊抗兔二抗,37℃孵育45 min,用PBST洗涤。加入底物TMB显色液反应15 min,加入终止液终止反应。在450 nm波长下测定OD值,计算平均值,将OD阳性/OD阴性 ≥ 2.1时所对应的最高稀释倍数作为抗cry1C血清效价。
1.2.7 cry1C多克隆抗体的特异性分析cry1C抗体用Western Blot方法进行特异性分析。利用植物蛋白提取试剂盒提取cry1C抗虫转基因水稻叶片总蛋白,测定浓度。将20 μg总蛋白用10% SDS-PAGE进行电泳。用半干转膜仪转到硝酸纤维素膜(Hybond-NC)之后,用5%脱脂乳在37℃封闭1 h。1:2 000稀释的cry1C抗体在4℃孵育12 h,用1:5 000稀释的HRP标记的羊抗兔二抗在37℃孵育1 h,用ECL化学发光显色在X-光片上。
2 结果 2.1 cry1C蛋白抗原表位预测根据已报道的抗鳞翅目害虫Bt基因cry1C的核苷酸序列推导氨基酸序列并进行该蛋白的跨膜区、亲水性、表面可及性及抗原性指数预测。TMHMMOL/L Server v.2.0跨膜预测结果表明cry1C的N端第1-43个氨基酸位于膜内,第44-66氨基酸肽链包含一个跨膜区,第67-630个氨基酸位于膜外,N端跨膜区可能会使得cry1C的表达受阻(图 1-A)。运用DNAstar-Protean软件预测结果(图 1-B)表明:cry1C蛋白亲水性区段分布较广,第37-69个氨基酸为疏水区,其余区段为亲水区;cry1C蛋白表面可及性结果表明,N端32-109个氨基酸位置表面可及性小,表面可及性大的位置主要位于117-126、189-263、345-353、412-429和517-532区段,蛋白表面可及性较大的区段易于接触溶剂分子,出现抗原表位的可能性较大;线性抗原性指数预测结果表明,cry1C蛋白存在大量潜在抗原表位位点,可能的抗原表位区域为第110-630个氨基酸区段。综合分析跨膜区、亲水性、抗原性指数预测结果,去掉N端存在的跨膜区和疏水区以免表达受阻,可能的抗原表位区为第110-630氨基酸,该区段确定为抗原表位区并命名为Δcry1C。

|
| 图 1 抗原表位区预测 A:cry1C跨膜区结构预测;B:Kyte-Doolittle法分析cry1C蛋白亲水性(Emini法分析cry1C表面可及性,Jameson-Wolf法分析cry1C蛋白抗原指数) |
抗原表位区Δcry1C的氨基酸序列长度为520 aa、理论分子量大小为58.8 kD。在不改变抗原表位区氨基酸序列的前提下,根据大肠杆菌密码子的偏爱性,优化抗原表位区核苷酸序列,并进行人工合成,该序列长度为1 578 bp(图 2-A)。Δcry1C序列与原cry1C核苷酸序列的同源性为75%,与氨基酸序列的同源性为100%。

|
| 图 2 重组表达载体pET28b(+)-Δcry1C的构建 A:人工合成Δcry1C的PCR扩增结果(M:DNA标准分子量;1:Δcry1C);B:pET28b(+)-Δcry1C双酶切鉴定(M:DNA标准分子量;1:用NdeⅠ和XhoⅠ双酶切pET28b(+)-Δcry1C质粒) |
抗原片段核苷酸序列Δcry1C插入到原核表达载体pET28b(+)的NdeⅠ和XhoⅠ酶切位点,构建pET28b(+)-Δcry1C重组表达载体。将重组表达载体质粒用Nde Ⅰ和Xho Ⅰ进行双酶切,分别获得了5 368 bp和1 578 bp的载体片段和Δcry1C抗原片段,与预期片段大小一致(图 2-B)。测序结果表明抗原片段Δcry1C已正确插入到pET28b(+)载体中。
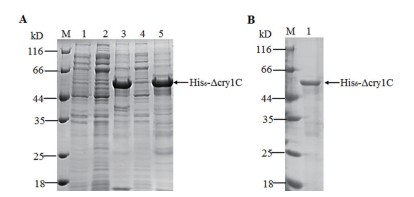
2.3 His6-Δcry1C重组蛋白的诱导表达及纯化将重组质粒pET28b(+)-Δcry1C转化到E.coli感受态细胞BL21(DE3),以0.5 mmol/L的IPTG,分别在20℃过夜和37℃条件下4 h诱导表达。上清液和包涵体进行SDS-PAGE分析,结果(图 3-A)在包涵体中获得了60 kD左右的重组蛋白,其表达量高、蛋白大小与预期大小一致,可确定该蛋白就是His6-Δcry1C重组蛋白,说明该重组蛋白在大肠杆菌包涵体中成功表达。
|
| 图 3 His6-Δcry1C重组蛋白的诱导表达及纯化 A:His6-Δcry1C重组蛋白的诱导表达SDS-PAGE分析(M:Protein Marker;1:诱导前总蛋白;2:20℃上清;3:20℃沉淀;4:37℃上清;5:37℃沉淀)。B:纯化后的His-cry1C*重组蛋白(M:Protein marker;1:His6-Δcry1C重组蛋白) |
将含有重组质粒pET28b(+)-Δcry1C的BL21(DE3)菌液进行扩增培养之后,以0.5 mmol/L的IPTG、37℃诱导表达4 h。将收集的细菌菌体用包涵体破碎Buffer溶解,冰浴中超声破碎菌体,经滤膜过滤后采用镍琼脂糖亲和层析方法进行纯化、透析。纯化后的重组蛋白用SDS-PAGE电泳分析发现在相应位置出现明显条带,得到了60 kD的His6-Δcry1C重组蛋白(图 3-B)。
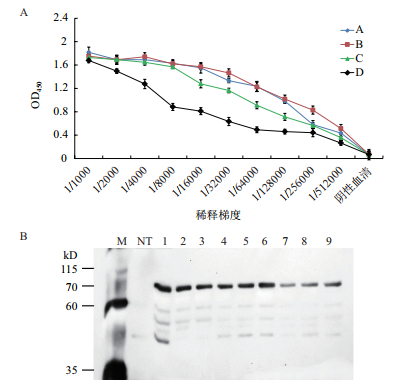
2.4 cry1C兔多克隆抗体的制备纯化的His6-Δcry1C重组蛋白为抗原免疫对新西兰大白兔制备多克隆抗体。三免和4免后7 d,从兔耳缘静脉取血1 mL,经间接ELISA法测定抗体效价(图 4-A),结果表明4只不同免疫兔(A、B、C和D)抗体效价均在1:512 000以上,达到了要求。采集颈动脉全血,血样先沉淀提纯血清,将血清进行抗原抗体亲和纯化。
|
| 图 4 抗cry1C血清效价及抗体特异性检测 A:抗cry1C血清效价;B:cry1C抗体特异性检测(M,Protein marker;NT,阴性对照;1-9:cry1C转基因水稻的不同株系的叶片总蛋白) |
为了检测cry1C多克隆抗体的特异性,提取cry1C转基因水稻叶片总蛋白,采用Western Blot方法检测目的蛋白cry1C的表达情况。结果(图 4-B)获得71 kD左右的明显条带,与预期条带大小一致,说明制备的cry1C多克隆抗体具有cry1C蛋白特异性,能够准确检测cry1C蛋白。
3 讨论目前,利用生物技术手段将cry1C基因导入到各种植物中,获得了多种抗鳞翅目害虫转基因植物[2-9]。这些转基因植物的蛋白定量和定性检测都需要cry1C抗体。目前,郑晓东等[13]、倪庚等[14]制备了cry1C兔单克隆抗体;林智敏等[15]制备了水稻密码子优化的cry1Ca多克隆抗体;张丽萍等[16]优化改造基因序列并构建和鉴定了cry1C重组表达载体,但尚未应用在cry1C转基因植物的检测上。
本研究根据已报道的cry1C基因序列,通过TMHMMOL/L Server v.2.0和DNAstar软件综合分析跨膜区、亲水性、抗原性指数[17-19],预测了该蛋白的抗原表位区。为了避免原核表达过程中受阻和不易形成抗原表位去掉了N端跨膜区109个氨基酸,其余非跨膜区段确定为抗原表位区。在保持原氨基酸序列不变的情况下,根据大肠杆菌密码子的偏爱性,优化改造核苷酸序列,构建重组表达载体,经过诱导表达获得了预期大小的、高效表达的His6-Δcry1C重组蛋白,但重组蛋白主要以包涵体形式存在。尽管为了高效表达和避免包涵体的形成,根据大肠杆菌密码子偏好性的优化改造序列、优化诱导表达条件(温度、时间、IPTG浓度等),但效果不理想。在宿主系统中高效表达外源重组蛋白时,形成包涵体是一种普遍现象,主要原因是当外源蛋白高水平表达时由于合成速度过快,没有足够的时间进行正确折叠或缺乏某些蛋白质折叠的辅助因子造成[20]。本研究中包涵体经过8M尿素溶解液进行溶解、Ni-NTA亲和层析柱纯化、透析复姓、浓缩获得了纯度较高的His6-Δcry1C重组蛋白。
以His6-Δcry1C重组蛋白为抗原,免疫新西兰大白兔、分离并纯化兔多抗血清。利用间接ELISA法测定抗体效价,结果表明cry1C兔多克隆抗体效价达到了1:512 000。Western Blot分析结果表明cry1C兔多克隆抗体对cry1C转基因抗虫水稻具有较强的特异性。虽然多克隆抗体比单克隆抗体特异性差,但具有制备方法简单、制备时间短、成本低等优点。因此,制备特异性强、效价高的多克隆抗体可以弥补单克隆抗体制备时间长、成本高等的缺点。本研究中的cry1C抗体可应用于cry1C转基因植物表达的cry1C蛋白的定性或定量检测,包括ELISA,Western Blot,IP/ChIP等免疫学手段,为深入研究抗鳞翅目害虫植物具有重要意义。
4 结论本研究生物信息学方法预测cry1C的抗原表位区,优化并人工合成抗原序列Δcry1C,构建原核表达载体。在大肠杆菌中原核表达,纯化His6-Δcry1C重组蛋白,免疫兔子获得cry1C多克隆抗体,其效价可达1:512 000。采用Western Blot方法检测cry1C转基因水稻的目的蛋白结合,特异性较高。
| [1] |
林拥军, 张启发.改造合成的苏云金芽孢杆菌杀虫晶体蛋白基因Cry1C*: 中国, CN1483823A[P]. 2002.
|
| [2] |
Tang W, Chen H, Xu C, et al. Development of insect-resistant transgenic indica rice with a synthetic Cry1C* gene[J]. Molecular Breeding, 2006, 18(1): 1-10. DOI:10.1007/s11032-006-9002-9 |
| [3] |
于志晶, 刘丽, 李淑芳, 等. 转Cry1C*基因抗虫水稻的培育[J]. 分子植物育种, 2011, 9(6): 702-708. DOI:10.3969/mpb.009.000702 |
| [4] |
崔莹.二价抗虫基因cry1C*/cry2A*对寒区超级稻松粳9号的遗传转化[D].哈尔滨: 黑龙江大学, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1940319
|
| [5] |
姚瑶, 钱雪艳, 李闯, 等. 抗虫基因Cry1C转化大豆的研究[J]. 安徽农业科学, 2014, 42(35): 12461-12463. DOI:10.3969/j.issn.0517-6611.2014.35.023 |
| [6] |
贾宝辉, 李娜, 于希森, 等. 大豆胚尖转化体系优化和cry1C*基因转化大豆的研究[J]. 大豆科学, 2015, 34(5): 910-913, 917. |
| [7] |
Du D, Geng C, Zhang X, et al. Transgenic maize lines expressing a cry1C* gene are resistant to insect pests[J]. Plant Molecular Biology Reporter, 2014, 32: 549-557. DOI:10.1007/s11105-013-0663-3 |
| [8] |
张士龙, 贺正华, 张祖新, 等. 聚合Cry1C*和VHb基因玉米抗虫耐渍新种质的创制[J]. 玉米科学, 2014, 22(2): 46-52. DOI:10.3969/j.issn.1005-0906.2014.02.010 |
| [9] |
万丽丽, 王转茸, 辛强, 等. 转Bt基因油菜的抗虫性分析[J]. 湖北农业科学, 2016, 55(9): 2386-2391, 2422. |
| [10] |
张大兵, 郭金超. 转基因生物及其产品检测技术和标准化[J]. 生命科学, 2011, 23(2): 27-29. |
| [11] |
陈笑芸, 汪小福, 周育, 等. 转Bt基因水稻种子中Bt蛋白含量测定方法的研究[J]. 中国粮油学报, 2012, 27(3): 121-124. DOI:10.3969/j.issn.1003-0174.2012.03.026 |
| [12] |
李冬雪, 田崇兵, 刘长华, 等. 转cry1C*基因抗虫超级粳稻田间目的基因表达及抗螟虫性研究[J]. 中国农学通报, 2017, 33(36): 131-138. |
| [13] |
郑晓东, 倪庚, 沈金儿, 等.一种抗Cry1C晶体蛋白兔单克隆抗体的制备方法: 中国, 102120771A[P]. 2010.
|
| [14] |
倪庚, 沈金儿, 热米拉, 等. 抗Cry1c蛋白兔单克隆抗体的制备和鉴定[J]. 中国食品学报, 2012, 12(2): 131-136. DOI:10.3969/j.issn.1009-7848.2012.02.020 |
| [15] |
林智敏, 陈在杰, 胡太蛟, 等. 水稻密码子优化的cry1Ca基因在大肠杆菌中表达、纯化及抗体制备[J]. 福建农业学报, 2011, 26(1): 24-28. DOI:10.3969/j.issn.1008-0384.2011.01.006 |
| [16] |
张丽萍, 查仁明, 李尚伟. 抗虫基因Cry1C*重组表达载体的构建与鉴定[J]. 贵州农业学报, 2014, 42(6): 6-9. |
| [17] |
黄丽娜, 程婷婷, 王新绘, 等. 棉铃虫β-actin基因的克隆、表达及多克隆抗体制备[J]. 生物技术通报, 2015, 31(12): 138-145. |
| [18] |
郭晓晓, 李文, 王永飞, 等. 大豆过敏原Glym4蛋白抗原表位特征预测[J]. 大豆科学, 2017, 36(3): 365-370. |
| [19] |
孙静娟, 邱景璇, 曾海娟, 等. 单增李斯特菌CdaA的抗原表位分析及抗体的制备[J]. 生物技术通报, 2018, 34(7): 1-6. |
| [20] |
井明艳, 孙建议. 蛋白质的折叠调控与包涵体的形成[J]. 浙江大学学报:农业与生命科学版, 2004, 30(6): 690-696. |




