藏鸡是分布在我国青藏高原地区的一种蛋肉兼用的原始地方鸡种,在四川的甘孜、阿坝等藏民聚居区也有少量分布[1]。藏鸡具有肉质鲜美,氨基酸含量高及必需氨基酸比例大等特点[2],是一种良好的遗传资源。因此,对藏鸡的肉质进行研究特别是对藏鸡肉质性状的遗传性状的研究具有重要的作用。影响动物肉质的因素有很多,其中肌内脂肪对动物的肉质具有重要的作用,而遗传因素是调控影响动物肌内脂肪沉积的重要方面[3]。
IRX3(iroquoishomeobox 3)是属于IRX家族基因的转录因子,其家族最早在果蝇的神经系统发育的研究中发现,其参与中枢神经系统[4]、微血管系统[5]、肾[6]和心脏[7]等系统和组织的的形态和发育。其在胚胎早起的系统器官发育、干细胞的更新分化、脂质代谢和能量平衡等方面均有重要的影响,与机体的发育和新陈代谢密切相关[8]。以前的研究证实了肥胖相关基因(Fat mass and obesity associated,FTO)与人下丘脑调控食物摄入及能量平衡有关,而FTO SNP的功能性远距离靶标IRX3基因对机体质量和成分具有重要影响[9-10]。研究发现IRX3具有促进人白色脂肪组织褐变的能力[11]。同时也有研究表明脂肪细胞的功能与IRX3和IRX5的表达调控有关,可将其棕色脂肪细胞转变为白色脂肪细胞从而储存能量[12-13]。与正常小鼠相比,IRX3基因敲除小鼠体重显著下降,且棕色脂肪组织的活化和能量消耗的增加[8];超表达IRX3能抑制人类脂肪细胞的产热[14]。以上研究均说明IRX3在脂代谢中具有重要作用,但尚未发现IRX3基因在藏鸡中的作用报道,且在脂质代谢中的作用机制尚不明确。因此,本实验拟阐明藏鸡IRX3基因的组织表达特性,及其在肌肉组织中的表达水平与肌内脂肪沉积的关联,旨在为进一步研究该基因在藏鸡脂代谢和脂肪沉积中的作用提供基础数据。
1 材料与方法 1.1 材料 1.1.1 实验样品采集本研究动物来源于成都益生康健农业有限公司藏鸡养殖基地孵化1、81、119、154和210日龄的健康藏鸡(公母各8只,共80只)为实验对象。禁食12 h后于第2天清晨放血屠宰,进而采集其去除结缔组织的右侧胸肌和腿肌组织样品,装于样品袋中于-20℃保存用于测定肌内脂肪含量。同时采集154日龄的心、肝、脾、肺、肾、皮下脂肪、胸肌和腿肌等组织样品(公母各4只),用锡箔纸包裹DEPC水清洗后的组织样品,并置于无RNA酶的冻存管中,于液氮中保存备用。
1.1.2 试剂Trizol试剂、荧光定量试剂盒SYBR® Premix Ex TaqTM(2×)购自TaKaRa公司(美国),反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)购自Thermo公司(美国)。
1.2 方法 1.2.1 引物合成根据克隆测序获得的IRX3基因序列和3-磷酸甘油醛脱氢酶(Glyceraldehyde 3-phosp-hate dehydrogenase,GAPDH)基因设计特异引物。
1.2.2 反转录利用Trizol法提取154日龄藏鸡(公母各4只)的心、肝、脾、肺、肾、皮下脂肪、胸肌和腿肌组织及1、81、119、154和210 d藏鸡(公母各8只)的胸肌和腿肌的总RNA,并合成cDNA。
1.2.3 反应体系和反应条件20 μL反应体系:SYBR® Premix Ex TaqTM(2×)10 μL,cDNA 1 μL,10 μmol/L上、下游引物各1 μL,RNase Freed H2O 7 μL。PCR反应条件:95℃预变性3 min;95℃变性10 s,66℃退火20 s,72℃延伸30 s,39个循环。
1.2.4 藏鸡IRX3基因组织表达分析利用实时荧光定量PCR技术检测IRX3在公母藏鸡心、肝、脾、肺、肾、胸肌、腿肌和脂肪组织中的相对表达情况,PCR反应体系和反应条件同1.2.3,每个待测样本设2个重复。用2-ΔΔCt法计算荧光定量结果。
1.2.5 藏鸡IRX3基因时序表达分析利用实时荧光定量PCR检测IRX3在公母藏鸡不同日龄(0 d、81 d、119 d、154 d及210 d)胸肌与腿肌中的相对表达情况。PCR反应体系和反应条件同1.2.3,每个阶段每个组织设2个重复。用2-ΔΔCt法计算荧光定量结果。
1.2.6 肌内脂肪含量的测定利用索氏抽提法测定公母藏鸡不同日龄(81 d、119 d、154 d及210 d)胸肌与腿肌肌内脂肪含量。
1.2.7 统计方法数据结果均以“x±s”表示。采用SPSS 18.0进行单因素方差分析和相关分析。
2 结果 2.1 藏鸡IRX3基因组织表达分析藏鸡IRX3基因的组织表达结果(图 1)显示IRX3基因在公藏鸡肺组织中表达水平最高,显著高于脂肪组织(P < 0.05),极显著高于其他组织(P < 0.01);其次在肝中表达水平较高,与脂肪组织差异不显著(P > 0.05),极显著高于其他组织(P < 0.01)。在母藏鸡中,肺组织中表达水平也最高,极显著高于其他组织(P < 0.01);其次在脾和脂肪中表达水平较高,显著高于其他组织(P < 0.05)。
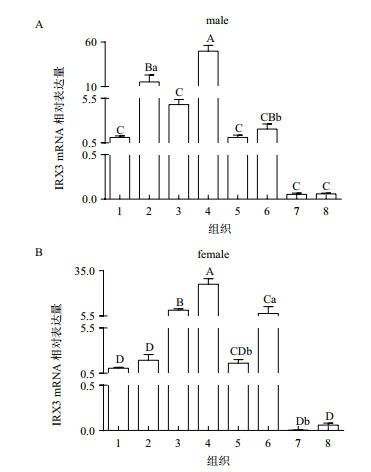
|
| 图 1 IRX3 mRNA在藏鸡不同组织中的相对表达水平 A:荧光定量检测IRX3 mRNA在154日龄公藏鸡各组织中的相对表达量,以心组织的表达水平为对照,n=8;1:心;2:肝;3:脾;4:肺;5:肾;6:脂肪;7:胸肌;8:腿肌,GAPDH作为内参。B:荧光定量检测IRX3 mRNA在154日龄母藏鸡各组织中的相对表达量,以心组织的表达水平为对照,n=8;1:心;2:肝;3:脾;4:肺;5:肾;6:脂肪;7:胸肌;8:腿肌,GAPDH作为内参;不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01),相同字母表示差异不显著(P > 0.05) |
藏鸡IRX3基因的时序表达结果(图 2)显示,随着日龄的增加,公藏鸡不同肌肉组织中IRX3 mRNA表达水平均呈逐渐增加的趋势,其210日龄相对表达水平较高,极显著高于与其他日龄(P < 0.01)。而母藏鸡腿肌中表达水平则呈先升后降的趋势,但其相对表达差异不显著(P > 0.05);在胸肌中相对表达量则相反,1日龄相对表达水平较高,极显著高于其他日龄(P < 0.01)。
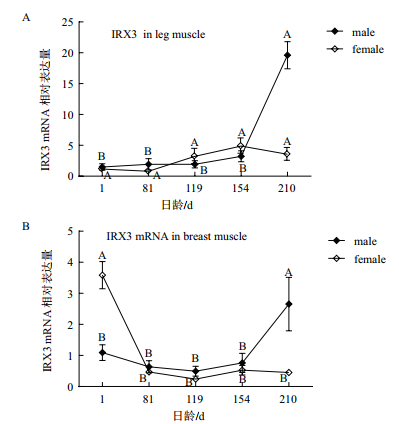
|
| 图 2 IRX3 mRNA在藏鸡不同发育阶段肌肉组织中的相对表达水平 A:荧光定量检测IRX3mRNA在不同年龄段(1、81、119、154和210日龄)的公母藏鸡腿肌中的相对表达量,以1日龄的表达水平为对照,n=8,同一性别作组间比较;GAPDH作为内参。B:荧光定量检测IRX3mRNA在不同年龄段(1、81、119、154和210日龄)的公母藏鸡胸肌中的相对表达量,以1日龄的表达水平为对照,n=8,同一性别作组间比较;GAPDH作为内参;不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01),相同字母表示差异不显著(P > 0.05) |
根据测定的肌内脂肪含量数据(81、119、154和210日龄的公母藏鸡各8只)与本实验所得公母藏鸡IRX3基因的时序表达结果,对不同发育阶段公母藏鸡不同肌肉组织中IRX3 mRNA表达水平与其肌内脂肪含量进行相关分析。藏鸡不同肌肉部位肌内脂肪含量结果(图 3)表明,210日龄不同肌肉组织肌内脂肪含量均极显著高于其他日龄(P < 0.01)。
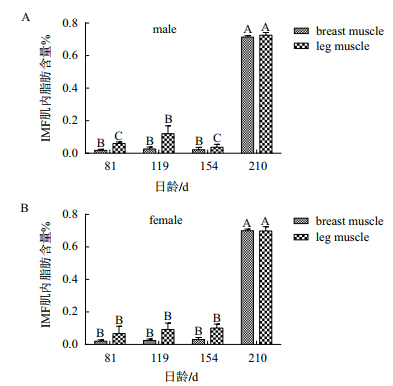
|
| 图 3 藏鸡腿肌和胸肌内脂肪含量的发育性变化 n=8。相同字母表示差异不显著,不同字母表示差异显著(P < 0.01) |
藏鸡不同肌肉部位IRX3基因时序表达与其肌内脂肪含量相关性结果(表 1)表明,不同发育阶段的藏鸡肌肉组织中IRX3 mRNA表达水平与其IMF含量呈不同相关性,在藏鸡腿肌中均呈正相关,而在公鸡中呈高度正相关,其相关性为r=0.671(P < 0.01);在藏鸡胸肌中则与性别有关,在公鸡中呈正相关,其相关性为r=0.119(P > 0.05),而在母鸡中则呈显著负相关,其相关性为r=-0.428(P < 0.01)。
为了满足人们对物质营养的追求,提高肉的品质是科研人员关注和研究的重点。有研究发现,肉的品质与肌内脂肪含量呈正相关,且肌内脂肪含量决定着肉的嫩度[15]。因此,研究肌内脂肪对提高肉质品质具有重要的作用。而随着对肌内脂肪的深入研究,人们发现脂肪的大量摄入不仅会导致肥胖,而且还会引发机体脂质代谢异常,进而导致某些疾病。随着对IRX3基因研究深入,发现IRX3基因与机体的脂质代谢具有密切的联系,但在藏鸡的研究中尚未发现报道。因此,为了阐明IRX3在藏鸡中表达模式与藏鸡肌内脂肪的沉积关系,本研究利用荧光定量PCR检测IRX3在藏鸡不同组织和不同发育阶段肌肉组织中的表达水平,并分析其与肌内脂肪含量的相关,为深入研究其与藏鸡脂肪代谢的作用机制提供依据。
本实验发现IRX3基因在藏鸡各组织中均有表达,且在公母藏鸡肺组织中表达水平最高。IRX3基因在公藏鸡肝中表达水平较高,脂肪中较低,而在母藏鸡肝中则相对较低,脂肪中较高,推测IRX3基因组织表达存在性别差异。Houwelin和Van等[16-17]指出IRX3在小鼠心和肺中呈高表达,在脊髓、肾脏中也有表达。樊红樱等[18]发现,IRX3在呼伦贝尔羊尾部脂肪组织中的表达模式无性别差异,但是由于不同性别间脂肪组织分布不同,导致其在深层脂肪和浅层脂肪的表达模式存在差异,说明IRX3在不同物种中的表达模式存在差异。研究发现,肌内脂肪与动物生长日龄呈正相关,随着日龄的增加,肌内脂肪也在不断沉积,且不同组织中肌内脂肪含量差异显著[19-20],这与本实验结果相似。本研究的时序表达结果说明IRX3在不同性别藏鸡在同一肌肉组织中的表达模式存在性别差异,而且同性别藏鸡在不同肌肉组织中的表达模式存在差异。聂晓庆等[21]发现PID1基因在藏鸡不同肌肉组织中表达存在年龄及性别差异,林森等[22]发现FTO基因在藏鸡胸肌和腿肌中具有不同表达模式,这与本实验结果相似,提示藏鸡不同肌肉组织的发育机制可能存在差别。本实验对藏鸡不同组织和不同发育阶段肌肉组织中的IRX3基因表达水平及其肌内脂肪含量进行相关性分析,结果显示,不同性别不同年龄段的藏鸡IRX3 mRNA及肌内脂肪含量呈不同的相关性,存在性别差异。藏鸡由于其生长环境的特殊性,与其他品种在相关性及能量代谢方面存在差异。同时IRX3基因在公母藏鸡不同肌肉组织不同发育阶段中差异性表达,进而在不同肌肉组织中,不同性别藏鸡IRX3 mRNA表达水平与IMF含量呈不同相关性。但要深入了解IRX3在藏鸡脂肪沉积中的功能,则需要在细胞水平进行进一步研究。
4 结论本研究表明IRX3基因在藏鸡各组织中均有表达,其在藏鸡肺组织中表达水平最高。IRX3 mRNA在藏鸡不同发育阶段不同肌肉组织中具有不同程度的表达模式,且存在性别差异。不同性别不同年龄段的藏鸡IRX3 mRNA与肌内脂肪含量呈不同相关性,存在性别差异。
| [1] |
陈国宏, 王克华, 王金玉, 等. 中国禽类遗传资源[M]. 上海: 上海科学技术出版社, 2004.
|
| [2] |
强巴央宗, 张浩, 商鹏, 等. 藏鸡屠宰性能及肉质特性[J]. 中国农业大学学报, 2008, 13(1): 47-50. DOI:10.3321/j.issn:1007-4333.2008.01.010 |
| [3] |
甘麦邻, 堵晶晶, 杨琼, 等. 动物肌内脂肪对肉质的影响及其分子机制研究进展[J]. 现代畜牧兽医, 2017(10): 51-57. |
| [4] |
Bellefroid EJ, Kobbe A, Gruss P, et al. Xiro3 encodes a Xenopus homolog of the Drosophila Iroquois genes and functions in neural specification[J]. EMBO J, 1998, 17(1): 191-203. DOI:10.1093/emboj/17.1.191 |
| [5] |
Scarlett K, Pattabiraman V, Barnett P, et al. The proangiogenic effect of iroquoishomeobox transcription factor Irx3 in human microvascular endothelial cells[J]. J Biol Chem, 2015, 290(10): 6303-6315. DOI:10.1074/jbc.M114.601146 |
| [6] |
Reggiani L, Raciti D, Airik R, et al. The prepattern transcription factor Irx3 directs nephron segment identity[J]. Genes & Development, 2007, 21(18): 2358-2370. |
| [7] |
Zhang SS, Kim KH, Rosen A, et al. Iroquois homeobox gene 3 establishes fast conduction in the cardiac His-Purkinje network[J]. Proc Natl Acad Sci USA, 2011, 108(33): 13576-13581. DOI:10.1073/pnas.1106911108 |
| [8] |
Scott Smemo, Tena JJ, Kim KH, et al. Obesity-associated variants within FTO form long-range functional connections with IRX3[J]. Nature, 2014, 507(7492): 371-375. DOI:10.1038/nature13138 |
| [9] |
Huang T, Qi Q, Li Y, Hu FB, et al. FTO genotype, dietary protein, and change in appetite:the preventing overweight using novel dietary strategies trial[J]. American Journal of Clinical Nutrition, 2014, 99(5): 1126-1130. DOI:10.3945/ajcn.113.082164 |
| [10] |
Muc M, Padez C, Manco L. Influence of physical activity on the association between the FTO variant rs9939609 and adiposity in young adults[J]. Am J Hum Biol, 2015, 27(5): 734-738. DOI:10.1002/ajhb.22712 |
| [11] |
Zou YY, Lu P, Shi J, Liu W, et al. IRX3 promotes the browning of white adipocytes and its rare variants are associated with human obesity risk[J]. EBioMedicine, 2017, 24: 64-75. DOI:10.1016/j.ebiom.2017.09.010 |
| [12] |
Sidossis L, Kajimura S. Brown and beige fat in humans:thermogenic adipocytes that control energy and glucose homeostasis[J]. J Clin Invest, 2015, 125(2): 478-486. DOI:10.1172/JCI78362 |
| [13] |
Adeyemo A, Chen G, Zhou J, et al. FTO genetic variation and asso-ciation with obesity in West Africans and African Americans[J]. Diabetes, 2010, 59(6): 1549-1554. DOI:10.2337/db09-1252 |
| [14] |
Claussnitzer M, Dankel SN, Kim KH, et al. FTO obesity variant circuitry and adipocyte browning in humans[J]. N Engl J Med, 2015, 373(10): 895-907. DOI:10.1056/NEJMoa1502214 |
| [15] |
郭秀兰, 唐仁勇, 刘达玉, 等. 肌内脂肪对猪肉品质的影响及其营养调控[J]. 中国畜牧兽医, 2011, 38(5): 214-216. |
| [16] |
Houweilin AC, DildropR, Peters T, et al. Gene and cluster-specific expression of the Iroquois family members during mouse development[J]. Mech, 2001, 107(1): 169-175. |
| [17] |
Van Tuyl M, Liu J, Groenman F, et al. Iroquois genes influence proximo-distal morphogenesis during rat lung development[J]. American Journal of Physiology. Lung Cellular and Molecular Physiology, 2005, 290(4): L777-L789. |
| [18] |
樊红樱.呼伦贝尔绵羊尾部脂肪组织的转录组差异表达分析[D].兰州: 甘肃农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10733-1016902416.htm
|
| [19] |
Kolatad K. Fat deposition and distribution measured by computer tomography in threegenetic groups of pigs[J]. Livestock Production Science, 2001, 67(3): 281-292. DOI:10.1016/S0301-6226(00)00195-0 |
| [20] |
王贝贝, 李琦华, 李玉, 等. 肉鸡肌内脂肪沉积的研究进展[J]. 黑龙江畜牧兽医, 2014(21): 65-67. |
| [21] |
聂晓庆, 林亚秋, 徐亚欧, 等. 藏鸡磷酸酪氨酸互作结构域1(PID1)的克隆及组织表达谱研究[J]. 畜牧兽医学报, 2016, 47(6): 1102-1111. |
| [22] |
林森, 林亚秋, 朱江江, 等. 藏鸡FTO基因表达的时空特性及与肌内脂肪含量的相关分析[J]. 畜牧兽医学报, 2017, 07(48): 1191-1201. |





