非生物胁迫如盐、干旱、冷等都能影响植物生长发育。为了保护自身免受不利条件的伤害,植物已经发展出许多生理、细胞和分子机制[1]。研究得最深入的保护机制之一为脯氨酸代谢。植物中的应激反应通常伴随着脯氨酸在不同组织中的积累[2]。累积的脯氨酸可以作为细胞内渗透剂[3]、活性氧(Reactive oxygen species,ROS)清除剂[4]、细胞结构维持者[5]和信号转导分子,引发多种应激反应途径[6]。在植物体中,已知有两条途径合成脯氨酸,一条为谷氨酸途径,另一条为鸟氨酸途径[7-8],而谷氨酸衍生的途径是植物在胁迫条件下合成脯氨酸的主要途径[9]。在谷氨酸衍生途径中,谷氨酸被Δ1-吡咯啉-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)还原为γ-谷氨酸半醛(GSA),然后GSA环化自身形成P5C[10]。在这一途径中,P5CS是关键酶,同时它也是一个双功能酶,在其N端与谷氨酰激酶(γ-GK)同源,C端与谷氨酸-γ-半醛脱氢酶(GSA)同源,这使得P5CS同时具有这两种酶的活性。P5CS可直接催化谷氨酸生成GSA,且经研究表明,在渗透胁迫下,植物体内的脯氨酸积累水平主要受P5CS的影响,该酶是植物合成脯氨酸的关键酶,其活性受到脯氨酸的反馈调节[11]。
目前已经从拟南芥[12]、蒺藜苜蓿[13]、紫花苜蓿[14]、番茄[15]、菜豆[16]、高粱[17]及番木瓜[18]等不同植物中克隆出了P5CS基因。研究表明,拟南芥P5CS基因受到干旱、盐碱和ABA等胁迫的诱导[11]。油菜中P5CS1和P5CS2受到ABA、NaCl、PEG的诱导[19]。干旱胁迫条件下转VaP5CS基因的转基因烟草脯氨酸及生物量的积累明显高于非转基因烟草[20]。同样,马铃薯、水稻、小麦中过量表达P5CS明显增强转基因植株的脯氨酸含量以及胁迫耐受能力[21-23]。因此,P5CS基因在调控植物体内脯氨酸的合成、提高植物抵御逆境胁迫过程中发挥重要的作用。
柠条锦鸡儿(Caragana korshinskii)是豆科锦鸡儿属旱生植物,在中国分布于内蒙古西部、陕西北部及宁夏等地区。柠条锦鸡儿抗逆性强,能耐低温及酷热,具有防风固沙、保土蓄水、改良和维持生态环境及调节小气候等作用,是荒漠、荒漠草原地带植树造林和防风固沙的先锋树种。目前,柠条锦鸡儿P5CS基因的克隆与功能研究还未见报道。本研究从柠条锦鸡儿中分离脯氨酸合成关键酶基因P5CS的全长cDNA序列,分析该基因的序列特征、进化关系和不同胁迫诱导下的表达模式,旨在为利用该基因改良荒漠植物的抗逆境胁迫能力和指导荒漠地区植被建设提供参考依据。
1 材料与方法 1.1 材料挑选籽粒饱满、大小均匀的柠条锦鸡儿种子分别播种到MS培养基中,在温度为25℃,光照强度130 µmol·m-2·s-1,光照时间为16 h的培养箱中培养4周,待柠条锦鸡儿植株长至10 cm左右,转入不同条件进行不同种类的非生物胁迫。
1.1.1 盐胁迫用Hoagland营养液配制的不同浓度的NaCl溶液(0 mol/L、0.05 mol/L、0.1 mol/L、0.15 mol/L和0.2 mol/L)浸泡同批生长的柠条锦鸡儿植株,48 h后分别剪取不同处理的柠条锦鸡儿叶片,提取RNA并测定脯氨酸的含量。
1.1.2 低温胁迫将同批生长的柠条锦鸡儿植株苗置于4℃环境进行不同时间段(0 h、12 h、24 h、36 h和48 h)处理,分别剪取不同处理的柠条锦鸡儿叶片用于RNA的提取。
1.1.3 PEG渗透胁迫用Hoagland营养液配制不同质量分数的PEG-6000溶液(0%、5%、10%、15%和20%)来模拟不同的干旱程度,处理48 h后剪取不同处理的柠条锦鸡儿叶片,提取RNA。
1.2 方法 1.2.1 柠条锦鸡儿P5CS基因的克隆P5CS基因中间片段克隆,利用Trizol试剂进行柠条锦鸡儿叶片总RNA的提取,以提取的RNA为模板,用PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒进行合成第一链cDNA。通过GenBank查找下载已经克隆得到的植物P5CS基因序列,进行序列对比,根据比对的结果,在相对保守的区域设计了5对简并引物CkP5CSU1、CkP5CSD1;CkP5CSU2、CkP5CSD2;CkP5CSU3、CkP5CSD3;CkP5CSU4、CkP5CSD4;CkP5CSU5、CkP5CSD5(表 1),每对引物预期扩增序列有部分重叠。以柠条锦鸡儿反转录所得到的cDNA为模板,按照Premix Ex Taq DNA Polymerase的反应要求说明用25 μL反应体系进行PCR扩增,反应体系:模板:1 μL,上下游引物:各1 μL,Premix Ex Taq酶:12.5 μL,ddH2O:9.5 μL,总体积:25 μL。扩增结束后,用0.8%琼脂糖凝胶进行电泳电泳,依据离心柱型EasyPure Quick Gel Extraction Kit回收试剂盒方法回收,回收产物连接pTG19-T载体,转化大肠杆菌感受态细胞,过夜培养,随机挑取若干白斑菌落进行PCR及酶切鉴定,将鉴定合适的阳性克隆送华大基因公司测序。
RACE方法克隆P5CS基因全长,以提取到的柠条锦鸡儿总RNA为模板,按照3'-Full RACE Core Set Ver.2.0(TaKaRa公司)的操作说明进行3'-RACE扩增反应,根据已得到的柠条锦鸡儿P5CS的序列片段设计基因特异性引物3'RU1和3'RU2(表 1),总RNA的反转录依据试剂盒说明进行操作,以反转录得到的cDNA为模板,用引物3'RU1和试剂盒中自带的引物3'RACEO(TACCGTCGTTCCACTAGTGATTT)进行一扩PCR,以一扩PCR产物为模板,用引物3'RU2和试剂盒自带引物3'RACEI(CGCGGATCCTCCACTAGTGATTT-CACTATAGG)进行二扩PCR。扩增产物用普通琼脂糖凝胶电泳,切胶回收,连接入pTG19-T载体,转化大肠杆菌,鉴定为阳性的克隆进行测序。按照5'RACE System for Rapid Amplification of cDNA Ends,Version 2.0的操作说明进行5'-RACE的扩增,根据克隆的柠条锦鸡儿P5CS基因中间片段序列设计基因特异性上游引物5'RD1和5'RD2(表 1)。按照试剂盒操作说明将总RNA反转录合成cDNA,以cDNA为模板,用引物5'RD1和试剂盒自带上游引物AAP(GGCCACGCGTCGACTAGTACGGGGGGGGGG)进行一扩PCR,以一扩PCR产物为模板,用引物5'RD2和试剂盒自带上游引物AUAP进行二扩PCR。将产物纯化后与pTG19-T载体连接,热激法转化大肠杆菌Trans5α后筛选阳性克隆进行测序。
1.2.2 柠条锦鸡儿P5CS预测蛋白质的生物信息学分析用DNAStar软件Megalign模块中的ClustalW方法进行氨基酸序列比对及保守序列分析;应用蛋白在线分析工具TopPred(http://mobyle.pasteur.fr/cgi-bin/port-al.py?#forms::toppred)对预测蛋白进行疏水性和拓扑结构分析;利用SOPMA(http://www.expasy.org/resources)在线软件对预测蛋白的二级结构进行预测;应用SWISS-MODEL(http://swissmodel.expasy.org/)对预测蛋白的三级结构进行分析。
1.2.3 柠条锦鸡儿P5CS基因的组织特异性表达检测剪取长势一致的柠条锦鸡儿根、茎、叶不同组织部位,根据实时荧光定量PCR的方法,检测柠条P5CS基因在不同组织中的表达量。
1.2.4 逆境对柠条锦鸡儿P5CS基因的转录水平影响采用实时荧光定量PCR,选取长势一致的柠条经不同逆境处理后对P5CS基因表达进行分析,从不同逆境处理后柠条叶片中提取RNA,以反转录得到的cDNA为模板,分别以ActinF(AF)、ActinR(AR)为管家基因引物,以P5CSDL-U、P5CSDL-D为柠条P5CS基因的引物,依据宝生物工程公司的SYBR Premix Ex Taq TM说明操作进行PCR扩增,每个样品做3个重复。扩增程序为:95℃预变性30 s;95℃变性5 s,60℃退火20 s,40个循环;55-95℃每30 s渐进升高0.5℃,81个循环。利用2-△△Ct方法进行数据分析,确定CkP5CS基因的相对表达量。
1.2.5 游离脯氨酸含量的测定依据酸性茚三酮染色法测定胁迫处理后脯氨酸的含量。称取盐胁迫处理的柠条叶片各0.5 g,加入2 mL 3%的磺基水杨酸充分研磨,沸水浴10 min,15 000 r/min,离心15 min,后取上清液0.25 mL,加入3 %的磺基水杨酸0.75 mL,1 mL冰醋酸和2 mL 2.5%的茚三酮,95℃水浴1 h,然后用4 mL甲苯萃取2 h,以甲苯溶液为空白对照,测OD520。
1.2.6 数据分析测得的数据用SPSS 17.0进行分析,用Origin 9.0进行做图。
2 结果 2.1 柠条锦鸡儿P5CS基因的克隆与序列分析将GenBank网站公布的已经克隆得到的植物P5CS基因CDS区序列下载后,用DNAstar软件MegAlign分析模块进行序列同源性对比,根据比对结果,设计了5对兼并性引物。以柠条叶片组织中提取出来的总RNA反转录得到的cDNA为模板,扩增得到了5条大小分别为为663、544、507、417和363 bp的条带,测序后用序列拼接软件进行拼接得到一条长度为1 962 bp的序列片段,与其它植物的P5CS基因序列进行比对发现,与大豆GmP5CS的同源性较高,表明该扩增产物是柠条P5CS基因片段。3'RACE用TaKaRa公司的3'-Full RACE Core Set Ver.2.0试剂盒扩增得到了757 bp左右大小的片段,经序列比对发现该序列5'端序列与前面扩增得到柠条P5CS基因中间片段的3'端序列完全相重叠,说明3'RACE扩增得到的片段与之前克隆得到的部分片段为同一条基因。5'RACE按照Invitrogen公司5'RACE System for Rapid Amplification of cDNA Ends,Version 2.0试剂盒扩增得到了一个305 bp大小的片段。测序结果经序列比对发现该片段3'与前面扩增得到的柠条P5CS基因中间片段的5'端序列完全重叠,说明5'RACE扩增得到的片段与之前克隆得到的中间片段为同一条基因的。
利用软件将扩增的中间片段和RACE扩增的5'端序列和3'端序列进行拼接,得到一条全长为2 604 bp的基因序列(图 1),包含一个2 139 bp的开放阅读框(ORF),编码的蛋白质含712个氨基酸,分子量为76.8 kD,等电点为8.6。起始密码子ATG前5'非翻译区(5'UTR)长102 bp,终止密码子TAA后面有一段363 bp的3'非翻译区(3'UTR),包含11 bp polyA。为了进一步确定以上P5CS基因部分扩增片段,以及5'RACE和3'RACE扩增片段属于同一基因,依据3'RACE和5'RACE扩增得到的序列设计上下游引物进行扩增,得到的片段经序列比对,与拼接序列的碱基完全一致。

|
| 图 1 柠条锦鸡儿CkP5CS全长序列及预测氨基酸序列 |
将GenBank中公布的已经克隆得到的植物P5CS序列,用DNAStar软件中Megalign模块的ClustalW法进行氨基酸序列的比对。结果(图 2)表明,CkP5CS蛋白与许多植物的P5CS蛋白具有较高的相似度,其中与大豆GmP5CS(XM_006573245)、蒺藜苜蓿MtP5CS(XM_013599503)、白刺花SdP5CS(JX307643)、豇豆VuP5CS(AB056452)的相似度分别为84.2%、82.3%、85.1%和82.6%。

|
| 图 2 CkP5CS与其它植物P5CS氨基酸序列比对 Ⅰ:ATP结合位点;Ⅱ:亮氨酸结构域;Ⅲ:谷氨酸激酶结构域;Ⅳ:NAD(P)H结构域;Ⅴ:谷氨酸-γ-半醛(GSA)结构域 |
柠条锦鸡儿CkP5CS基因推测的氨基酸序列的保守区域与大豆GmP5CS、蒺藜苜蓿MtP5CS、白刺花SdP5CS、豇豆VuP5CS基因推测的氨基酸序列的保守结构域一致,含有以下5个主要功能域:ATP结合位点、谷氨酸激酶结构域、谷氨酸-γ-半醛脱氢酶(GSADH)结构域、一个假想的亮氨酸结构域及NAD(P)H结构域(图 2)。CkP5CS基因编码产物的这些特征表明,该基因所控制编码的氨基酸是典型的植物二氢吡咯-5-羧酸合成酶,CkP5CS可能在柠条锦鸡儿脯氨酸合成途径中起作用。
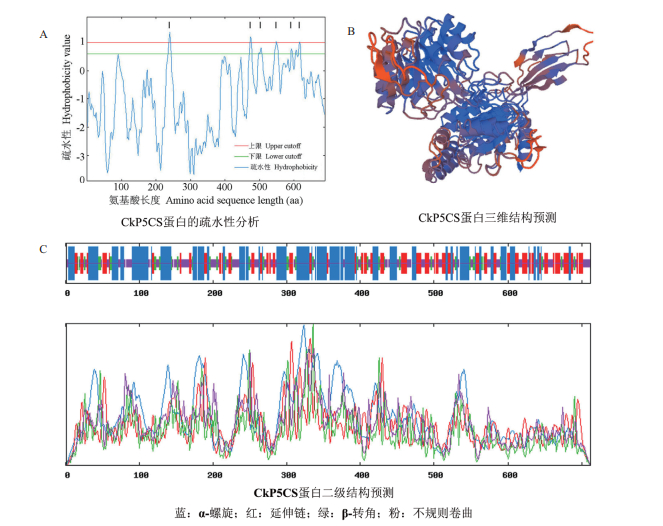
应用蛋白在线分析工具TopPred对CkP5CS预测蛋白进行疏水性和拓扑结构分析,结果显示该预测蛋白为亲水蛋白结构,有6个不确定的跨膜结构域(图 3-A);利用SOPMA在线软件对CkP5CS预测蛋白的二级结构进行预测,结果(图 3-C)显示,柠条CkP5CS预测蛋白包含38.34%的α-螺旋(Alpha helix)、25.7%的延伸链(Extended strand)、9.41%的β-转角(Beta turn)和26.54%的无规则卷曲(Random coil)。应用SWISS-MODEL对CkP5CS蛋白的三级结构进行预测,SWISS-MODEL只预测了同源性部分(氨基酸残基范围:291-711)的模型,已经预测出的三级结构模型(图 3-B)显示,该蛋白为P5CS。
|
| 图 3 CkP5CS蛋白结构分析 |
从长势一致的柠条锦鸡儿植株根、茎、叶中提取RNA,进行实时荧光定量PCR分析,结果(图 4)表明,CkP5CS基因在其根、茎、叶中均有表达,其中叶中的表达量最高;其次是根,在茎中的表达量最低。

|
| 图 4 CkP5CS基因组织特异性表达分析 |
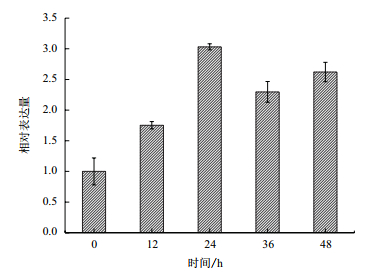
低温胁迫下实时荧光定量PCR实验结果(图 5)表明,柠条锦鸡儿CkP5CS基因的表达量受低温胁迫(4℃)诱导。在4℃处理12 h、24 h、36 h及48 h后,CkP5CS基因的转录水平较对照组分别提高了1.753、3.032、2.297及2.621倍,表现出先升高后降低的趋势。在低温胁迫时间达到24 h时,CkP5CS基因的转录水平达到最大值,随着胁迫时间的延长,CkP5CS基因的转录水平有所下降,但仍然高于对照组,说明在较长时间的低温冷胁迫下,CkP5CS基因的表达能力有所下降,但是对于低温胁迫依旧有所响应。
|
| 图 5 低温胁迫下CkP5CS基因的表达量 |
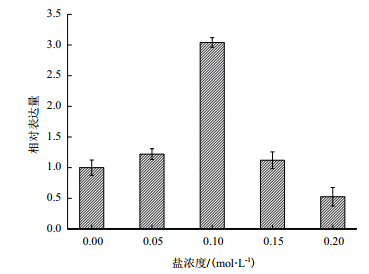
盐胁迫下实时荧光定量PCR实验结果(图 6)表明,柠条锦鸡儿CkP5CS基因的表达量受盐胁迫的诱导。在浓度为0.05、0.1、0.15及0.2 mol/L的NaCl溶液处理后,CkP5CS基因的转录水平较对照组分别提高了1.221、3.042、1.121及0.526倍,呈现出现上升后下降的趋势。在0.1 mol/LNaCl胁迫下,CkP5CS基因的转录水平达到最大值,随着盐胁迫浓度的升高,CkP5CS基因的转录水平逐渐降低,在0.2 mol/LNaCl胁迫时,其表达量仅为对照组的0.526,结果表明CkP5CS基因表达受到低浓度盐胁迫的诱导,高浓度的盐胁迫抑制其表达。
|
| 图 6 盐胁迫下CkP5CS基因的表达量 |
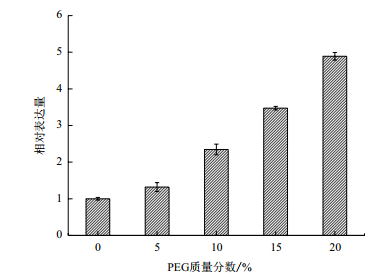
PEG渗透胁迫下实时荧光定量PCR实验结果(图 7)表明,柠条锦鸡儿CkP5CS基因的表达量受PEG渗透胁迫的诱导。在浓度为5%、10%、15%、20%的PEG6000溶液处理后,CkP5CS基因的转录水平较对照组分别上升了1.319、2.346、3.473和4.889倍,随着PEG6000浓度的增加,CkP5CS基因的转录水平也在随之上升,在20%的PEG6000溶液处理下,CkP5CS基因的转录水平达到最大。说明CkP5CS基因的表达对PEG渗透胁迫的诱导较为敏感,且渗透胁迫程度越大其表达越明显。
|
| 图 7 PEG渗透胁迫下CkP5CS基因的表达量 |
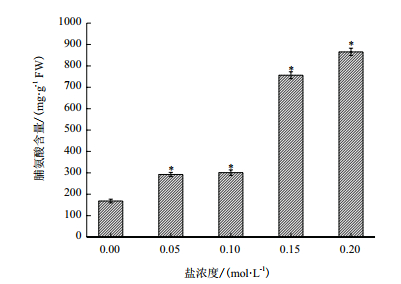
脯氨酸的含量受盐胁迫的诱导,在0.05、0.1、0.15和0.2 mol/L的NaCl处理下,柠条锦鸡儿中脯氨酸的含量与对照组相比分别提高了73.77%、78.69%、349.58%、414.56%,差异达到显著水平(*P < 0.05)(图 8)。表明盐胁迫条件下通过脯氨酸的积累稳定细胞自身结构,降低活性氧积累带来的损伤。
|
| 图 8 盐胁迫过程中柠条锦鸡儿脯氨酸含量的变化 |
植物在遭遇逆境胁迫时,通过主动积累小分子渗透物质来维持细胞内渗透压的平衡。脯氨酸是典型的小分子渗透物质,它能够稳定细胞的膜结构,增加细胞原生质层的浓度防止细胞失水,平衡细胞的渗透压使细胞能够进行正常的生理生化反应。在植物受到渗透胁迫时,植物体内的脯氨酸含量会大幅度的增加。因此,脯氨酸的积累有利于细胞自身结构的稳定,而且能够降低活性氧积累带来的损伤。而P5CS则是植物体内催化谷氨酸途径合成脯氨酸过程中的限速酶,在脯氨酸的合成过程中起着至关重要的作用。本研究中利用RT-PCR结合RACE技术从柠条锦鸡儿中克隆得到了CkP5CS基因,该基因预测蛋白质序列与已知的其它植物该基因的预测蛋白质序列有很高的相似性,说明CkP5CS基因在物种进化上具有很高的保守性。CkP5CS具有高等植物中P5CS蛋白质具有的5个保守结构域:NADPH结合位点、ATP结合位点、谷氨酰激酶(GK)结构域、亮氨酸结构域、谷氨酸半醛(GSA)结构域,预测出的三级结构模型显示,该蛋白符合Δ1-吡咯啉-5-羧酸合成酶三维结构。
实时荧光定量PCR的结果表明,CkP5CS基因在柠条锦鸡儿的根、茎、叶中均表达。此外,CkP5CS基因受低温和PEG渗透胁迫诱导表达,与甜高粱[24]、番木瓜[18]和拟南芥[11]P5CS基因的表达模式相同。说明同一类植物的P5CS基因能够响应不同的逆境胁迫,而不同植物的P5CS基因也能受到同一种胁迫的诱导表达。
柠条锦鸡儿CkP5CS基因的表达受盐胁迫的诱导,随着盐胁迫浓度的升高,CkP5CS基因的表达呈现出现上升后下降的趋势。而柠条锦鸡儿植株中脯氨酸的含量同样受到盐胁迫的诱导,随着盐胁迫浓度的升高,脯氨酸的含量呈上升趋势。但CkP5CS基因的表达的变化与脯氨酸的含量的变化趋势不一致,0.15 mol/L、0.2 mol/L盐处理下脯氨酸的含量增加而CkP5CS基因的表达量下降。Hong等[25]研究表明P5CS基因在植物中催化脯氨酸的生物合成反应中,Pro合成不仅受到P5CS的转录激活的调节,还受到该途径终产物的反馈调节。Silva-Ortega等[26]的研究结果也表明,在盐胁迫条件下,仙人掌P5CS酶活性的变化与P5CS基因转录水平的变化以及脯氨酸含量的变化不成正相关。说明P5CS酶活性不仅受到转录水平的调控,可能还受到转录后水平及蛋白质水平的反馈调控。
4 结论柠条锦鸡儿CkP5CS基因全长2 604 bp,包括5'-UTR 102 bp,3'-UTR 363 bp,开放阅读框2 139 bp,能编码712个氨基酸,预测蛋白质分子量为76.8 kD,理论等电点为8.6,二级结构主要包括α-螺旋、延伸链和无规则卷曲。CkP5CS基因的表达没有组织特异性,其表达受低温、高盐和PEG渗透胁迫的诱导,在柠条锦鸡儿适应低温、高盐和渗透胁迫过程中发挥作用。
| [1] |
Tan CM, Chen RJ, Zhang JH, et al. OsPOP5, A Prolyl oligopeptidase family gene from rice confers abiotic stress tolerance in Escherichia coli[J]. International Journal of Molecular Sciences, 2013, 14(10): 20204-20219. DOI:10.3390/ijms141020204 |
| [2] |
Verbruggen N, Hermans C. Proline accumulation in plants:a review[J]. Amino Acids, 2008, 35(4): 753-759. DOI:10.1007/s00726-008-0061-6 |
| [3] |
Chinnusamy V, Jagendorf A, Zhu JK. Understanding and improving salt tolerance in plants[J]. Crop Science, 2005, 45(2): 437-448. DOI:10.2135/cropsci2005.0437 |
| [4] |
Matysik J, Bhalu BA, Mohanty P, et al. Molecular mechanism of quenching of reactive oxygen species by proline under stress in plants[J]. Current Science, 2002, 82(5): 525-532. |
| [5] |
Verslues PE, Agarwal M, Katiyar-Agarwal S, et al. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status[J]. Plant Journal, 2006, 45(4): 523-539. DOI:10.1111/tpj.2006.45.issue-4 |
| [6] |
Maggio A, Miyazaki S, Veronese P, et al. Does proline accumulation play an active role in stress-induced growth reduction?[J]. Plant Journal, 2002, 31(6): 699-712. DOI:10.1046/j.1365-313X.2002.01389.x |
| [7] |
Adams E. Metabolism of proline and of hydroxyproline[J]. Annual Review of Biochemistry, 1970, 5(49): 1005-1061. |
| [8] |
Delauney AJ, Verma DPS. Proline biosynthesis and osmoregulation in plants[J]. Plant Journal, 1993, 4(4): 215-223. |
| [9] |
Trovato M, Mattioli R, Costantino P. Multiple roles of proline in plant stress tolerance and development[J]. Rendiconti Lincei, 2008, 19(4): 325-346. DOI:10.1007/s12210-008-0022-8 |
| [10] |
Liang X, Zhang L, Natarajan SK, et al. Proline mechanisms of stress survival[J]. Antioxidants & Redox Signaling, 2013, 19(9): 998-1011. |
| [11] |
Yoshiba Y, Kiyosue T, Katagiri T, et al. Correlation between the induction of a gene for Δ1-pyrroline-5-carboxylate synthetase and the accumulation of proline in Arabidopsis thaliana under osmotic stress[J]. Plant Journal for Cell & Molecular Biology, 1995, 7(5): 751-760. |
| [12] |
Strizhov N, Ábrahám E, Ökrész L, et al. Differential expression of two P5CS genes controlling proline accumulation during salt-stress requires ABA and is regulated by ABA1, ABI1 and AXR2 in Arabidopsis[J]. Plant Journal for Cell & Molecular Biology, 1997, 12(3): 557-569. |
| [13] |
Armengaud P, Thiery L, Buhot N, et al. Transcriptional regulation of proline biosynthesis in Medicago truncatula reveals developmental and environmental specific features[J]. Physiologia Plantarum, 2004, 120(3): 442-450. DOI:10.1111/ppl.2004.120.issue-3 |
| [14] |
Ginzberg I, Stein H, Kapulnik Y, et al. Isolation and characterization of two different cDNAs of Δ1-pyrroline-5-carboxylate synthase in alfalfa, transcriptionally induced upon salt stress[J]. Plant Molecular Biology, 1998, 38(5): 755-764. DOI:10.1023/A:1006015212391 |
| [15] |
Fujita T, Maggio A, Garciarios M, et al. Comparative analysis of the regulation of expression and structures of two evolutionarily divergent genes for Δ1-pyrroline-5-carboxylate synthetase from tomato[J]. Plant Physiology, 1998, 118(2): 661-674. DOI:10.1104/pp.118.2.661 |
| [16] |
Chen JB, Zhang XY, Jing RL, et al. Cloning and genetic diversity analysis of a new P5CS gene from common bean(Phaseolus vulgaris L.)[J]. Theor Appl Genet, 2010, 120(7): 1393-1404. DOI:10.1007/s00122-010-1263-3 |
| [17] |
Su M, Li XF, Ma XY, et al. Cloning two P5CS, genes from bioenergy sorghum and their expression profiles under abiotic stresses and MeJA treatment[J]. Plant Science, 2011, 181(6): 652-659. DOI:10.1016/j.plantsci.2011.03.002 |
| [18] |
Zhu X, Li X, Zou Y, et al. Cloning, characterization and expression analysis of Δ1-pyrroline-5-carboxylate synthetase(P5CS)gene in harvested papaya(Carica papaya)fruit under temperature stress[J]. Food Research International, 2012, 49(1): 272-279. DOI:10.1016/j.foodres.2012.08.003 |
| [19] |
Xue X, Liu A, Hua X. Proline accumulation and transcriptional regulation of proline biosynthesis and degradation in Brassica napus[J]. Bmb Reports, 2009, 42(1): 28-34. DOI:10.5483/BMBRep.2009.42.1.028 |
| [20] |
Kishor P, Hong Z, Miao GH, et al. Overexpression of Δ-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants[J]. Plant Physiology, 1995, 108(4): 1387-1394. DOI:10.1104/pp.108.4.1387 |
| [21] |
Hmidasayari A, Gargouribouzid R, Bidani A, et al. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline production and confers salt tolerance in transgenic potato plants[J]. Plant Science, 2005, 169(4): 746-752. DOI:10.1016/j.plantsci.2005.05.025 |
| [22] |
Anoop N, Gupta AK. Transgenic indica, Rice cv, IR-50 Over-expressing Vigna aconitifolia, Δ1-Pyrroline-5-carboxylate synthetase cDNA shows tolerance to high salt[J]. Journal of Plant Biochemistry & Biotechnology, 2003, 12(2): 109-116. |
| [23] |
Vendruscolo ECG, Schuster I, Pileggi M, et al. Stress-induced synthesis of proline confers tolerance to water deficit in transgenic wheat[J]. Journal of Plant Physiology, 2007, 164(10): 1367-1376. DOI:10.1016/j.jplph.2007.05.001 |
| [24] |
Su M, Li XF, Ma XY, et al. Cloning two P5CS, genes from bioenergy sorghum and their expression profiles under abiotic stresses and MeJA treatment[J]. Plant Science, 2011, 181(6): 652-659. DOI:10.1016/j.plantsci.2011.03.002 |
| [25] |
Hong Z, Zhang Z. Removal of feedback inhibition of Δ1-Pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J]. Plant Physiology, 2000, 122(4): 1129-1136. DOI:10.1104/pp.122.4.1129 |
| [26] |
Silva-Ortega CO, Ochoa-Alfaro AE, Reyes-Agüero JA, et al. Salt stress increases the expression of p5cs gene and induces proline accumulation in cactus pear[J]. Plant Physiology & Biochemistry Ppb, 2008, 46(1): 82-92. |