2. 农业部转基因生物食用安全重点实验室(北京),中国农业大学,北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism(Food Safety)of Ministry of Agriculture, China Agricultural University, Beijing 100083
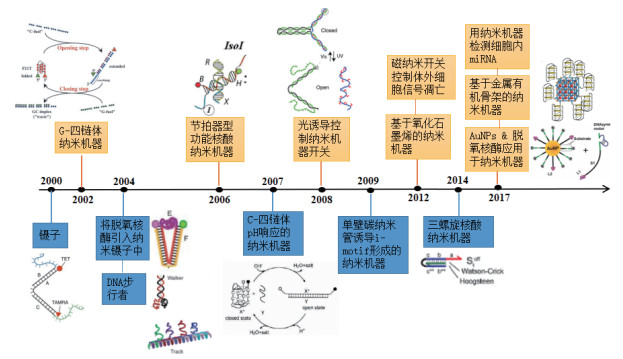
生物纳米机器是天然或人为设计的组件,它们受环境变化所产生的物理或化学刺激而使结构或构象发生变化。生物纳米机器可以用作传感器、马达或用于体外基因表达的逻辑分析[1-2]。最初的生物纳米机器是天然的内源蛋白质,如驱动蛋白、动力蛋白、肌球蛋白、旋转分子马达、DNA解旋酶及RNA聚合酶等[3-5],它们通过构象的变化将三磷酸腺苷(Adenosine triphosphate,ATP)水解产生的化学能转化成机械能,从而实现各种功能。受蛋白质马达的启发,利用沃森-克里克氢键的特异性和可预测性,构建了核酸纳米机器。核酸分子除了能够携带遗传信息以外,单链DNA能够自我折叠成复杂的三级结构,成为具有特异性识别能力以及催化活性的功能核酸。功能核酸的特性由其碱基序列中的编码信息决定,这些碱基可依照沃森-克里克碱基互补配对原则形成不同的结构,如双链体、超分子交叉砖、G-四链体、C-四链体(i-motifs)、碱基-金属-离子复合物等(图 1)[3]。功能核酸纳米机器是天然或人工设计的通过核酸碱基序列特异性相互作用而自组装形成的核酸组件。关于功能核酸纳米机器的研究越来越多(图 2),功能核酸纳米机器的运转可通过两种方式使其结构或构象发生转化而被激活,一种方式是功能核酸与特定信号分子相互作用使其结构发生变化;另一种方式是在外界环境的刺激下(如改变pH、加入离子、用不同的光照射等)使功能核酸构象发生变化。目前,功能核酸纳米机器的表征方法主要有:荧光光谱分析法、凝胶电泳法、透射电子显微镜观察法、扫描电镜观察法、原子力显微镜观察法、动态光散射技术及圆二色谱法。
|
| 图 2 功能核酸纳米机器发展历程图 |
本文总结了经典的功能核酸纳米机器,如G-四链体功能核酸介导的、适配子功能核酸介导的、脱氧核酶介导的、霍利迪结功能核酸介导的、基于非金属、金属材料的、链置换的、点击反应的、三螺旋核酸的、pH响应的、光诱导的功能核酸纳米机器。继而介绍了功能核酸纳米机器在药物靶向递送、生物成像的应用。最后展望了功能核酸纳米机器的应用前景及可能遇到的挑战。
1 G-四链体功能核酸介导的纳米机器G-四链体(G-quadruplexes)是一种特殊的DNA结构,是由富G的核酸序列中4个鸟嘌呤(Guanine,G)两两间形成2个霍氏(Hoogsteen)氢键围成的正方片层堆叠而成[5]。当G-平面堆叠形成G-四链体时,需要金属离子的稳定,尤其是碱金属离子,如K+、Na+等。这些金属离子位于G-平面的中心,与鸟嘌呤的O6有静电作用,因此可利用G-四链体的这种特性来构建核酸纳米机器。
2002年,佛罗里达大学的Tan[6]课题组和法国的Mergny[7]课题组先后利用G-四链体设计出了DNA分子马达。该马达由一条富G的单链DNA组成,在马达两端分别修饰荧光基团和淬灭基团,通过荧光信号强度变化表征马达的运转。在K+、Na+、Li+盐溶液中该单链DNA自组装折叠成G-四链体结构,此时5'和3'端靠近,荧光被淬灭;当加入富C的燃料链,其会与富G链配对结合形成稳定的双链结构,此时5'和3'端远离,荧光恢复。当再加入富G的燃料链通过链置换反应与富C链结合成废弃的双链,DNA又回到四链结构。这种G-四链体纳米机器实质是基于链置换反应,所以这类机器的效率和寿命有限。
G-四链体还可搭建在纳米孔平台上,Hou等[8]利用该特性,通过调节K+浓度来调节G-四链体结构的稳定性,然后诱导有效孔径的变化,进而控制膜的孔隙的离子渗透性。通常固定的DNA链以柔性的随机卷曲状态存在,这允许离子自由扩散进出;在K+存在的情况下,促进了G-四链体的形成,压缩的结构有效地阻止了离子转移;去除钾离子后,四链体展开成柔性单链,恢复了通过膜的渗透性。
此外,G-四链体广泛构建在电化学平台上组装成纳米机器,Wu等[9]将富G的核酸链一端用硫醇修饰,固定在金电极表面,二茂铁衍生物偶联到核酸链末端,用作电化学标记,在不存在K+的情况下二茂铁衍生物(Fe)和金电极之间有良好的电子转移,在K+存在下核酸组装成G-四链体,在得到的刚性结构中,二茂铁衍生物与电极在空间上分离,使得几乎没有任何电子转移。
2 适配体功能核酸介导的纳米机器适配体是能够通过特定的构象来靶向特定的分子的单链DNA或RNA。其通过分子间作用力(如氢键、范德华力和静电力等)与目标分子结合,并具有高度的亲和力和选择性[10-11],可以媲美抗体的优势。适配体是通过SELEX体外筛选得到的[12],可以结合所选择的任何目标,应用范围广。此外,适配体还具有设计灵活性、易于改性、化学稳定性和快速的组织渗透等优点。
Banerjee等[13]设计了一种新型DNA二十面体,可以由环鸟苷二磷酸(Cyclic guanosine diphosphate,cdGMP)外刺激,从中线劈裂成两部分,释放里面装载的分子货物。设计的该cdGMP刺激响应型DNA二十面体,是通过在传统的二十面体的连接处中引入cdGMP的核酸适配体实现的。cdGMP是细菌里的一种二级信使(内生性分子)可以调控信号传导进程,与细菌的生命形式及代谢形式息息相关。当cdGMP存在时,cdGMP与适配体结合引起适配体构象变化,触发链置换导致DNA二十面体解离成两半,使得内部装载的货物释放出来。该研究用荧光左旋糖苷作为模式装载物,因此可以用荧光检测装载货物的释放情况。这种适配体嵌入的二十面体,能通过改变适配体类型与多种生理分泌型分子信号相结合,在不同的生理环境中实现空间或时间可控的货物释放,对于体内可控分子递送具有一定的指导意义。
3 脱氧核酶功能核酸介导的纳米机器这类功能核酸纳米机器都有脱氧核酶的参与,脱氧核酶(DNAzyme)是一种能特异结合并切割RNA或DNA分子的功能核酸DNA,具有高效的催化降解能力。DNAzyme具有容易制备,对于化学降解和酶降解不敏感等优点[14-15]。8-17DNAzyme和10-23DNAzyme[16]以及它们的变体是研究最多以及应用最广泛的两类DNAzyme。DNAzyme有类似于酶的催化活性[17],在金属离子的作用下可以对底物链的rA位点切割,底物链断裂,通过荧光标记的荧光信号或者是产生电化学信号的改变对靶标物质的含量进行检测。
近年来,基于脱氧核酶的功能核酸纳米机器的研究越来越多,该类纳米机器种类也丰富多样。有结合链置换反应形成双链后将DNAzyme酶链释放使其结合底物链,从而使得机器运转,Peng等[18]基于此构建了一种检测细胞内miRNA的纳米机器,其原理是首先将脱氧核酶运动系统构建在金纳米粒子(Au nanoparticles,AuNP)上,AuNP被数百个底物链和几十个DNAzyme分子官能化,每个分子都被一个锁定链沉默。在细胞内部,目标miRNA与锁定链杂交,并通过链置换反应从DNAzyme释放锁链。解锁的DNAzyme随后与其底物杂交。二价金属辅因子激活裂解底物的DNAzyme,产生两个DNA片段F1、F2。其中含有FAM的F1片段从AuNP表面释放,恢复由AuNP先前淬灭的荧光。同时,DNAzyme从F2片段解离,随后与下一个底物链杂交,从而实现了从一个底物链到下一个底物链的电机行走。通过测量荧光增加,可以实时地对DNA马达的细胞内操作进行成像。另外,荧光增加与细胞中目标miRNA链的量成比例,使得能够原位放大地检测活细胞中的miRNA。Wu等[19]也基于类似的原理实现了功能核酸纳米机器检测体内miRNA。
还有类似双抗夹心介导的脱氧核酶纳米机器,Chen等[20]将脱氧核酶连接上配体L1,AuNP上连接有荧光探针链和第二配体L2,当加入靶标物质后,靶标物质与两个配体结合将脱氧核酶加载到AuNP轨道上,诱导DNAzyme与其底物之间的杂交。在Mg2+的存在下,DNAzyme被活化以切割底物,从AuNP释放F。释放的F可以发荧光,可以实时监控电机的运行情况。
此外,还有将脱氧核酶锁定在发卡结构中的纳米机器,Yang等[21]构建了此纳米机器用于在活细胞中对miRNA进行扩增成像。它由AuNP和发卡锁定的脱氧核酶链组成。在没有靶miRNA时,发夹锁定的脱氧核酶链通过分子内杂交形成发夹结构,这样就抑制了脱氧核酶链的催化活性,并且通过AuNP淬灭荧光。然而,在靶标存在下,靶标—探针杂交可打开发夹并在催化核心中形成活性二级结构以产生“活性”DNAzyme,然后在Mg2+的辅助下切割自身链。切割的两个较短的DNA片段与目标分离。结果显示,荧光团从AuNP中释放出来,并且荧光增强。同时,靶标也被释放并结合另一个发夹锁定的脱氧核酶链以驱动另一个循环。以这种方式,目标回收扩增导致显著的信号增强,因此具有较高的检测灵敏度。
4 霍利迪功能核酸介导的纳米机器2006年,Buranachai等[22]构建了一种节拍器型功能核酸纳米机器,该节拍器是由4条单链DNA组成,形成一个四路连接点(霍利迪连接点)[23],两条额外的单链突出部分能够彼此形成碱基对。在存在二价金属离子时,霍利迪连接处折叠成紧凑的构象——ⅠsoⅠ构象①和ⅠsoⅡ构象③④,分子通过中间开放结构②实现两个紧凑构象之间的转变,黏性末端的碱基配对降低了结构④的自由能,迫使纳米节拍器保持更长的IsoII构象。二价金属离子(如Mg2+)的存在对构象的转变至关重要,并且这种随机节拍器的滴答速率取决于离子浓度。另外,可以通过一组基于DNA的开关(去活化剂/活化剂)来可逆的停止/重新激活黏性末端。去活化剂竞争性地结合到螺旋末端的单链突出端上,使黏性末端沉默。这种结合为活化剂结合留下悬突柄,并且随后通过三股分支迁移移除去活化剂。在这种节拍器中,单链突出部分分别用荧光团和淬灭剂功能化,荧光共振能量转移(Fluorescence resonance energy transfer,FRET)供体和受体分别连接到两个螺旋末端,根据空间距离不同显示不同频率的FRET以此表征该纳米机器的运转。
5 基于纳米材料的功能核酸纳米机器 5.1 基于非金属纳米材料的功能核酸纳米机器 5.1.1 基于碳纳米材料的功能核酸纳米机器碳纳米管是一种具有特殊结构的一维量子材料,有单壁碳纳米管(Single-wall carbon nanotubes,SWNTs)和多壁碳纳米管(Multi-wall carbon nanotubes,MWN-Ts),相比较而言MWNTs具有较大的纵横比[24],直径较大[25]。功能核酸与碳纳米管主要以两种方式结合,一是单链DNA(ssDNA)通过碱基芳环与碳纳米管侧壁之间的π-π电子相互作用吸附到碳纳米管上[26],也可能是通过范德华力、疏水相互作用、静电作用等综合的结果[27],故碳纳米管只吸附单链,对双链的作用较弱;二是将碳纳米管功能化通过静电相互作用结合。通过筛选寡核苷酸文库,Zheng等[28-29]已经证明,单链DNA的特定序列可以自组装成单个碳纳米管周围的螺旋结构。2009年,Zhao等[30]首先提出了由单壁碳纳米管诱导的DNA纳米机器,它可以在生理pH下检测人端粒i-motif DNA的形成。他们将人类端粒G-四联体作为DNA马达固定在金表面上,DNA马达和其互补的人端粒i-motif DNA之间的可逆杂交可以通过SWNT调节而不改变溶液pH。多壁碳纳米管通过氧化作用,易形成可电离的羧基,羧基在水溶液中带负电荷,会通过静电作用吸附带正电荷的纳米金[31]。冯永成等[32]将多壁碳纳米管氧化使其表面带有羧基基团,再通过多步化学反应使羧基转化为巯基,加入HAuCl4后,在模板上通过甲醛的还原生成金纳米粒子,最后在模板的引导下连成金纳米线。
除碳纳米管外,二维单原子结构的氧化石墨烯(Graphene oxide,GO)的应用也较广泛。单链DNA可以通过共价键结合作用和π-π电子堆积物理吸附在氧化石墨烯表面。此外,氧化石墨烯具有比较高的荧光淬灭效应。Dong等[33]通过将氧化石墨烯距离依赖性荧光淬灭与等温链置换聚合酶反应(Isothermal chain displacement polymerase reaction,ISDPR)相结合来提高检测miRNA的灵敏度。在缺乏特异性靶标的情况下,ssDNA和GO之间的相互作用较强,以及基于FRET的GO机制的高荧光淬灭效率,使得用荧光染料标记的ssDNA显示最小的背景荧光。当特定靶标存在时,底物链识别靶标形成双链结构,由于DNA-miRNA双链螺旋与GO之间的相互作用较弱,因此观察到强烈的荧光。
5.1.2 基于硅纳米材料的功能核酸纳米机器介孔二氧化硅纳米粒子(Mesoporous silica nanoparticles,MSNs)是一种新型的无机纳米粒子,在药物递送系统被广泛应用,其优势在于MSNs有较大的比表面积(600-1 000 m2/g)和比孔容(0.6-1.0 cm3/g),允许较高的载药量;而且具有良好的生物相容性,所以MSNs不仅可以作为将不溶于水的药物分子整合到细胞中的载体,还可以保护它们不被破坏,可应用于临床诊断和治疗;另外,MSNs表面有丰富的硅羟基,可进行化学修饰使其表面功能化,以满足不同的生物学需求[34-35]。MSNs易富集于肝脏和脾脏,是一种有潜力的肝靶向载体。Gu等[36]在MSNs外表面链接聚乙二醇(Polyethylene glycol,PEG)分子,然后将D-半乳糖胺分子共价结合到MSNs- PEG上,其中PEG增加了MSNs在体循环中的停留时间,D-半乳糖胺是靶向肝癌细胞表面脱唾液酸蛋白受体。MSNs内表面封装阿霉素抗癌药物,负载药物以pH依赖性方式释放,在pH5.5和6.5时比在pH 7.4时释放得更快。
5.2 基于金属纳米材料的功能核酸纳米机器 5.2.1 金纳米粒子介导的纳米机器AuNPs合成方式简单,稳定性好,抗氧化能力强,能使用合适的配体提供高比表面积,对人体无害[37],且具有良好的生物相容性,能提供一个类似生物分子本体环境的微环境,较好的保持生物组分的活性[38]。金纳米粒子大多是用氯金酸和还原剂(通常柠檬酸钠盐或硼氢化物)反应制得,纳米金颗粒比较容易同巯基结合形成很强的Au-S共价键[39],将带有各种活性基团的巯基化合物通过共价键结合在金纳米表面,还可通过静电吸附作用将氨基非共价结合到金纳米上,形成的探针可用于生物体系的检测。金纳米粒子起信号增强和放大的作用,提高了生物传感器的灵敏度。
AuNPs能够高效的淬灭染料分子的荧光,所以当带有荧光基团的探针结合在金纳米颗粒上,其荧光被淬灭,无荧光信号输出,当用酶或其他物质切割探针,使得荧光基团从金纳米颗粒上释放,则发出荧光。AuNPs常与脱氧核酶等一起运用于功能核酸纳米机器,下文有详细阐述。
5.2.2 基于Fe3O4磁纳米粒子的纳米机器磁纳米粒子(Magnetic nanoparticles,MNPS)具有异常的磁学性质:超顺磁性、高矫顽力、高磁化率和低居里温度[40]等特性,其中超顺磁性Fe3O4纳米粒子由于其具有粒径小、毒性低、磁响应性强等优点,被视为最佳的磁性纳米材料[41],广泛应用于生物医学领域。Bacon等[42]开发了一种用于细胞凋亡信号的磁性开关,他们在MNPs表面修饰死亡受体4(Death receptor 4,DR4)单克隆抗体,可以特异性结合DLD-1人结直肠腺癌上皮细胞表面的死亡因子。在磁场开关处于On模式时施加磁场,在磁力作用下诱导死亡因子聚集,促进细胞凋亡,并且成功诱导了斑马鱼的细胞凋亡,导致形态发生明显变化。
Fe3O4有其独特的磁学特性,但由于其比表面积较高,具有强烈的聚集倾向,所以通过表面包覆或分子修饰可降低表面能,调节磁纳米粒子的生物相容性和反应特性[43]。同时,金具有良好的化学稳定性和生物相容性及特殊的光谱性质,且易表面修饰,故在Fe3O4表面修饰Au以提高纳米颗粒的化学稳定性,这种具有金包裹层的核壳结构能减少内核的氧化和腐蚀,金壳的等离子体共振性质还能用于光热治疗[44-45]。
5.2.3 基于金属有机骨架的纳米机器金属-有机骨架(Metal-organic frameworks,MOFs)也称为配位聚合物或配位网络,是一类由金属离子或簇与有机连接基团在相对温和的条件下自组装形成的混合材料[46-48]。MOFs属于一种新兴的结晶分子功能材料,具有很多特性,其中包括超高的孔隙率、优异的结构可调性、巨大的内部表面积、结构多样性、高的化学稳定性和强大的热稳定性等[47]。MOFs的结构也可以从一维(One-dimensional,1D)、二维(Two-dimensional,2D)到三维(Three-dimensional,3D)[48]。目前,MOFs已被广泛应用于化工、医药等领域,其中包括均相催化、气体储存与分离、作为药物递送载体及生物成像等。
Kahn等[49]进一步推进了MOFs与功能核酸相结合的检测技术的发展。他们首次将刺激响应性DNA作为加帽单元固定在MOFs的表面来控制MOFs的加载和卸载。他们应用4,4',4''-苯-1,3,5-三-苯甲酸(4,4',4''-benzene-1,3,5-tri-benzoic acid,BTB)、氨基对苯二甲酸这两种有机配体和羧酸锌簇为原料反应生成MOFs,并利用酰胺键将单链DNA修饰在MOFs表面分别设计了3种pH和K+刺激响应性DNA功能化MOFs。第一种是pH刺激响应性系统,通过将pH在5.5和7.4之间进行切换使富含C碱基的一段DNA序列在C-四链体和无规则卷曲结构之间进行变换来实现MOFs孔中货物分子的可控释放。第二种同样是pH刺激响应性系统,通过调控pH形成三螺旋DNA来实现MOFs的卸载。第三种则是K+刺激响应性系统,通过控制反应液中K+和螯合剂的浓度使一段富含G碱基的DNA序列在K+依赖性G-四链体结构和无规则卷曲结构之间进行变换来实现MOFs孔中货物分子的可控释放。
6 基于链置换的功能核酸纳米机器核酸单双链有明显的不同,单链自由度高、柔性强,其构象可以自由转变,而双链是刚性结构,在温和的条件下,单链DNA会选择体系中与其互补性最强的其他单链分子组成双链,因此通过控制双链的形成或破坏就可以实现纳米机器的驱动[50]。
第一批核酸纳米机器之一——镊子就是链置换反应介导的核酸纳米机器。2000年,Yurke等[51]构建了镊子这一核酸纳米机器,该纳米机器由3条DNA单链A、B和C组成,其中A链含有两个18碱基序列区域,分别与B、C链的末端通过沃森-克里克氢键结合成双链。通过加入单链DNA与镊子特定相互作用来驱动纳米机器的运转。以在A链两端修饰荧光基团和淬灭基团表征镊子的“开”“关”状态。当加入燃料链,其与镊子的B、C链的游离碱基配对结合,使镊子处于关闭状态,当加入与燃料链完全互补的反燃料链后,通过链置换反应与燃料链形成稳定的双螺旋结构,从而将燃料链从镊子上移下来,镊子恢复打开状态。2004年,Chen等[52]将脱氧核酶引入了纳米镊子中,DNA马达由两条单链组成,其中一条链含有能切割RNA的10-23DNAzyme,燃料链是DNAzyme的底物,当加入燃料链后其与DNAzyme链结合使得镊子打开,当有金属离子存在时,DNAzyme切割底物,镊子又回到关闭状态。
2004年,Shin等[53]构建的DNA步行者(Wal-ker),也是链置换反应介导的核酸纳米机器,两条部分互补的核酸链作为walker,A1链作为连接者将walker锚定在轨道(track)的特定单链上,再加入与A1链互补的D1链通过链置换反应产生双链废料并释放,然后可加入下一个连接链使walker锚定在track的另一个单链上,以此往复可实现walker在track上的行走,该纳米机器类似于镊子,以DNA为燃料,以链杂合能作为驱动力。
7 基于点击反应的功能核酸纳米机器点击化学是在温和条件下以简便、快速、可靠和高效率反应将两个活性伴侣偶联起来的最通用和模块化的方法之一[54]。点击化学已成为共价连接分子的最常用和最可靠的方法之一,已经运用于纳米材料的化学[55]、化学生物学、药物输送和药物化学[56-57]等学科中。点击化学最大的魅力是可能产生新颖的结构,点击反应主要有4种类型:环加成反应,特别是1,3-偶极环加成反应,也包括杂环Diels-Alder反应;亲核开环反应,特别是张力杂环的亲电试剂开环;非醇醛的羰基化学;碳碳多键的加成反应。其中铜(Ⅰ)催化叠氮化物和末端乙炔形成1,2,3-三唑是一个特别强大的连接反应,因为它具有高度的可靠性,完整的特异性和反应物的生物相容性。三唑产品不仅仅是被动连接器,它们很容易通过氢键和偶极相互作用与生物靶标相关联。Ge等[58]根据一价铜离子催化点击化学反应以及DNAzyme的催化作用,并利用点击化学反应连接劈裂DNAzyme实现了对铜离子的可视化定量检测。Ni等[59]通过点击化学反应,将DNA与聚乳酸(Polylactide,PLA)连接形成DNA-PLA结合物,然后自组装成两亲性DNA-PLA胶束;接下来,使用缀合的DNA作为启动子,通过原位滚环转录(Rolling circle transcription,RCT)在DNA-PLA胶束上合成多短发卡RNA(Poly-short hairpin RNA,poly-shRNA),产生聚乳酸@多短发卡RNA微流(PLA @ poly-shRNA microflowers);最后,使用生物相容性和多功能聚(乙二醇)转接多肽(Multifunctional poly(Ethylene glycol)-grafted polypeptides,PPT-g-PEG)将微绒毛静电凝结成纳米颗粒。这些PLA @ poly-shRNA @ PPT-g-PEG纳米粒子被有效地递送到多药耐药蛋白(Multidrug resistance protein,MDR)乳腺癌细胞中,并在异种移植肿瘤中积累,导致MDR1沉默,细胞内阿霉素(Doxorubicin,Dox)积累,增强了细胞凋亡和肿瘤治疗功效。
8 基于三螺旋核酸的功能核酸纳米机器三螺旋核酸(Triplex nucleic acids,TNAs)是在经典的沃森-克里克(Waston-Crick)氢键形成的双链核酸基础上,第三条寡核苷酸链以非经典的胡斯特(Hoogsteen)氢键嵌入到双链大沟中形成的超分子核酸组装体[60]。
2014年,Amodio等[61]研究出一种pH响应的以链置换反应为基础的TNAs纳米机器,在OH-诱导下,以胞嘧啶-鸟嘌呤(Guanine,G)*胞嘧啶-(C-G*C)为主要序列组成的三螺旋结构中的Hoogsteen键断裂形成双螺旋结构,加入侵入链(Invading strand,IS)发生链置换、产生游离的三螺旋第三链、进而发生后续的链置换反应。利用标记在DNA链上的荧光供体基团与荧光受体基团表征纳米机器的运转。
2017年,Ranallo等[62]设计了一种模块化的TNAs纳米机器。该纳米机器由特异性抗体驱动,利用胸腺嘧啶-腺嘌呤(Adenine,A)*胸腺嘧啶-(T-A*T)、C-G*C的三链核酸碱基互补配对规则,使用夹钳状结构的黑色核酸链特异性识别蓝色核酸链(DNA Cargo),形成三链核酸纳米机器,并且在夹钳状核酸链的两侧末端共价偶联一对抗体。当抗体特异性与纳米机器上的抗原结合,会驱动三链核酸纳米机器的构象变化,先打开亚稳态的Hoogsteen氢键、再打开不稳定的Watson-Crick氢键,进而释放DNA Cargo。他们在DNA Cargo两侧分别标记荧光基团和淬灭基团,通过荧光强度的差异表征抗体驱动的三链核酸纳米机器的构象变化。该纳米机器能够快速、通用、可逆及快速的携带并释放以单链核酸为模型的分子货物,在药物递送与释放,现场快速检测和细胞内成像等应用领域具有巨大的应用潜力。
9 基于pH响应的功能核酸纳米机器核酸四链体结构除上文中提到的G-四链体,还有C-四链体(i-motif),它是由富C核酸序列中的两个胞嘧啶C通过结合一个质子形成3个氢键作为一层而交叉堆叠起来的[63-64]。i-motif的四螺旋结构只有在弱酸性条件下能维持,在中性或碱性条件下四螺旋结构会解开形成单链。Liu等[65]利用i-motif响应pH的性质设计了一种纳米机器,该纳米机器就是一段富C序列,通过在该链两端标记荧光基团和淬灭基团来表征该纳米机器的运作状态。在弱酸性(pH < 6.3)条件下该单链DNA折叠成i-motif结构,链的两端相互靠近,荧光淬灭,此时纳米机器呈关闭状态。当向溶液中加入碱使溶液pH达到8.0左右,i-motif结构不能维持,解开呈单链结构,链两端远离,荧光恢复,纳米机器呈打开状态。该过程是可逆的,再加入酸,又可形成i-motif结构,如此循环往复,通过不断加入酸碱促使纳米机器的运转。
Mao等[66]设计出利用pH诱导包裹释放小分子的纳米机器。富C的单链DNA修饰在金纳米表面上形成单层膜,此时填充密度较低,允许小分子自由扩散,当加入酸使pH4.5时,形成i-motif四螺旋结构,由于四链DNA空间位阻大于单链,此时该膜不允许小分子渗透,实现小分子的包裹,当再加入碱使pH4.5时i-motif结构被转化为单链,小分子得以释放。
10 基于光诱导的功能核酸纳米机器大多数纳米机器需要分子燃料驱动,典型的是需要互补的DNA链作为燃料通过链置换反应来驱动,这样会产生废弃的DNA双链,在机器重复操作时溶液中废弃的双链持续堆积必定会影响机器运作效率。另外,还面临着“环境问题”,所以使用清洁能源来驱动已经成为必然,而光就是其中之一,一些光响应分子(如螺吡喃、二芳基乙烯、芪和偶氮苯等)可通过几何形状的变化将光能转化为机械能。
Liu等[67]研究了光驱动i-motif DNA马达运转。他们将含有DNA X,孔雀石绿甲醇碱(Malachite green carbinol base,MGCB)和十六烷基三甲基溴化铵(Cetyl trimethyl ammonium bromide,CTAB)的初始溶液配制成微酸性,这有助于DNA X形成i-motif结构,在302 nm紫外光的存在下,MGCB释放出氢氧根离子(OH-)导致pH值的增加,以及显示出明显的颜色变化,所以i-motif结构将变形为去质子化的无规则卷曲结构。光线关闭后,孔雀石绿(Malachite green,MG)阳离子会与OH-结合成MGCB进行循环,溶液pH值相应降低,并且DNA X再次切换回i-motif构象。因此,可以通过交替打开和关闭紫外线来循环DNA X的构象转换。2008年,Liang等[68]报道了一种利用光诱导来控制纳米机器的开关,他们改进了控制纳米镊子开关的燃料链,在燃料链的碱基之间修饰一定数量的偶氮苯,偶氮苯是一种光敏基团,在可见光下呈反式构象,在紫外光下呈顺式构象,通过切换不同的光使构象改变,导致碱基发生扭转,氢键被破坏,燃料链从镊子上脱离。所以使用紫外光照射(λ= 330-350 nm)将镊子光开关切换至开路状态,并且在可见光(λ= 440-460 nm)下将光镊切换至闭合状态。这种控制是非接触的,且不需要添加另外的寡核苷酸作为燃料。
11 功能核酸纳米机器药物靶向递送Sun等[69]开发了一种生物感应的茧状抗癌药物输送系统,由嵌入了酸敏脱氧核糖核酸酶Ⅰ(DNAase Ⅰ)纳米胶囊(Nanocapsule,NCa)的脱氧核酶可降解DNA纳米纤维(Nanoclew,NCl)组成,用于靶向癌症治疗(图 3-A)。NCl由通过滚环扩增(Rolling circle amplification,RCA)合成的长链单链DNA组装而成。将多个GC配对序列整合到NCl中以增强抗癌药物多柔比星(Doxorubicin,DOX)的负载能力。同时,带负电的DNAase Ⅰ被包封在带正电荷的酸可降解聚合物纳米凝胶中,以便通过静电相互作用将DNase Ⅰ修饰到NCl中。在酸性环境中,DNase Ⅰ的活性通过NCa的聚合物壳的酸触发脱落而活化,导致NCl的茧样自我降解并促进DOX的释放以增强治疗功效。
Mou等[70]构建了一种自组装含氟尿苷的DNA多面体用于药物靶向递送以治疗癌症(图 3-A)。氟尿苷(Fluorouridine,F)是一种核苷类似物治疗剂,它的结构和天然的胸腺嘧啶(Thymine,T)脱氧核糖核苷的结构非常相似,所以通过常规固相合成将F整合到DNA链中,然后将这些链组装成DNA四面体、十二面体和巴基球,具有确定的载药比以及可调的大小和形态。作为一种新型的药物输送系统,这些含有药物的DNA多面体可以理想地模拟特洛伊木马,将化疗药物输送到肿瘤细胞中并与癌症作斗争。体外和体内结果表明,具有巴基球结构的DNA特洛伊木马具有优于游离药物和其他制剂的抗癌能力。通过精确控制纳米载体的载药量和结构,DNA特洛伊木马可能在抗癌治疗中发挥重要作用,并在纳米医学领域表现出巨大的潜力。
2006年,Rothemund等[71]将长链单链DNA分子折叠成“笑脸”、“五角星”等复杂的二维形状(图 3-C),该研究创建了“DNA折纸术”,为后续在其上修饰更多功能基团,实现在生物医药领域的广泛应用奠定了基础。2018年,Li等[72]利用DNA折纸术构建出一种DNA纳米机器人,可靶向运输凝血酶到肿瘤细胞处,从而能够阻塞肿瘤处血管,阻碍对于肿瘤的营养和氧气的供应,从而诱导肿瘤细胞死亡(图 3-D)。他们首先构建出一种DNA自组装的长方形折纸片,然后将凝血酶固定到折纸片表面,再在折纸片两端连接核仁素适配体使得长方形折纸片能够自动折叠为管状,从而形成了内部携带有凝血酶的DNA纳米机器人。当该机器人被运送至肿瘤细胞处接触到肿瘤细胞特异性表达的核仁素时便会再次自动打开,释放凝血酶,在凝血酶的作用下促使肿瘤细胞处血管堵塞从而杀死肿瘤细胞。
12 功能核酸纳米机器生物成像Yuan等[73]报道了一种针对生物成像和光动力疗法的特定适体引导的G-四链体DNA纳米机器,并且它能够对癌细胞进行选择性识别和成像,可控制和有效地激活光敏剂,改善治疗效果(图 3-E)。他们将富含鸟嘌呤的DNA片段与适体连接形成双功能DNA序列,称为G4适体。G4适体不仅加载光敏剂,而且特异性识别目标细胞。将G4适体与上转换纳米颗粒(Upconversion nanoparticles,UCNP)生物偶联,因此将光敏剂5,10,15,20-四-(1-甲基-4-吡啶基)-21H,23H-卟吩(5,10,15,20-tetrakis-(1-methyl-4-pyridyl)-21H,23H-porphine,TMPyP4)置于UCNP附近的位置,用于UCNP和TMPyP4之间的能量转移。当纳米机器被递送到癌细胞中,UCNP就被近红外光(Near-infrared light,NIR)激发,发射可见光以使癌细胞成像,并且反过来激活TMPyP4,使得最终产生足够的活性氧簇(Reactive oxygen species,ROS)以有效地杀死癌细胞。
Liu等[74]将基于聚乙烯亚胺(Polyethyleneimine,PEI)钝化增强荧光的碳点纳米载体用于生物成像,他们采用一步微波辅助热解甘油和支化PEI25k混合物制备了PEI官能化碳点(CD-PEI),其中碳纳米粒子的形成和表面钝化同时完成(图 3-F)。在这个混合的C点中,PEI分子在该系统中起到两个关键作用——作为富含氮的化合物来钝化表面以增强荧光,并作为聚电解质来浓缩DNA。该CD-PEI被证明是水溶性的并且依靠激发波长发出稳定的明亮的多色荧光。CD-PEI的DNA缩合能力和细胞毒性可以通过热解时间来调节,可能是由于在形成碳点期间PEI的某种程度的破坏。相对于对照PEI25k,在合适的热解时间获得的CD-PEI表现出较低的毒性,较高或相当的质粒DNA在COS-7细胞和HepG2细胞中的基因表达。CD-PEI内化到细胞中,在不同的激发波长下显示出可调谐的荧光发射,表明CD-PEI在基因递送和生物成像中的潜在应用。
13 总结与展望目前基于G-四链体功能核酸介导的、适配子功能核酸介导的、脱氧核酶介导的、霍利迪结功能核酸介导的、基于非金属、金属材料的、链置换的、点击反应的、三螺旋核酸的、pH响应的及光诱导的功能核酸纳米机器有很多,但是这些纳米机器存在很多不足,如链置换反应产生废弃的双链,影响机器的效率和寿命;脱氧核酶介导的需要体外进行金属离子的补充,所需操作时间过长,不适合在实际应用中;pH响应的需要不断加入酸碱,产生的盐经多次循环也会影响机器效率;遇到活性生物大分子时缺少程序性的响应模块,无法进行类似于基因回路机制的胞内调控,并且DNA纳米元件在胞内动态环境下进行组装、折叠效率较低,扩散效率以及杂交率与体外环境相比也大大降低。
功能核酸纳米机器处于刚刚起步阶段,随着科技的进步与发展功能核酸纳米机器将会有更广阔的应用前景,其未来发展趋势:(1)复合型生物纳米机器的开发,功能核酸纳米机器与其他生物纳米机器的功能组件的联合使用,以期达到更高效的、友好的、简洁的效果。(2)胞内、体内驱动可控纳米机器的开发,一是克服体内复杂环境,二是由细胞内物质提供驱动力[75],实现纳米机器智能化控制,实时监测控制生物反应进程。(3)一体化、多元化功能核酸纳米机器的开发,一体化设计以解决不同反应组件散落于细胞内由于时空差异而造成运行效率低的问题[76],多元化驱动可使功能核酸纳米机器同时发挥多重作用,丰富功能核酸纳米机器的运动模式;更高效持久的执行复杂生物任务。(4)搭载功能核酸的非核酸纳米材料的纳米毒性风险评估,安全无毒副作用的剂量是我们开展体内实验的前提,将重点评估靶向纳米材料在体内局部组织及器官的高浓度富集所带来的风险,复合纳米材料的体内协同毒性,以及缓释纳米材料的慢性毒性。
| [1] |
Alberti P, Mergny JL. DNA duplex-quadruplex exchange as the basis for a nanomolecular machine[J]. Proc Natl Acad Sci USA, 2003, 100(4): 1569-1573. DOI:10.1073/pnas.0335459100 |
| [2] |
Benenson Y, Gil B, Ben-Dor U, et al. An autonomous molecular computer for logical control of gene expression[J]. Nature, 2004, 429(6990): 423-429. DOI:10.1038/nature02551 |
| [3] |
Teller C, Willner I. Functional nucleic acid nanostructures and DNA machines[J]. Current Opinion in Biotechnology, 2010, 21(4): 376-391. DOI:10.1016/j.copbio.2010.06.001 |
| [4] |
Gopaul DN, Guo F, Duyne GDV. Structure of the Holliday junction intermediate in Cre- loxP, site-specific recombination[J]. Embo Journal, 2014, 17(14): 4175-4187. |
| [5] |
Mills M, Lacroix L, Arimondo PB, et al. Unusual DNA conformations:implications for telomeres[J]. Current Medicinal Chemistry Anticancer Agents, 2002, 2(5): 627-644. DOI:10.2174/1568011023353877 |
| [6] |
And JJL, Tan W. A Single DNA Molecule Nanomotor[J]. Nano Lett, 2015, 2(4): 315-318. |
| [7] |
Alberti P, Mergny JL. DNA duplex-quadruplex exchange as the basis for a nanomolecular machine[J]. Proc Natl Acad Sci USA, 2003, 100(4): 1569-1573. DOI:10.1073/pnas.0335459100 |
| [8] |
Hou X, Guo W, Xia F, et al. A biomimetic potassium responsive nanochannel:G-quadruplex DNA conformational switching in a synthetic nanopore[J]. J Am Chem Soc, 2009, 131(22): 7800-7805. DOI:10.1021/ja901574c |
| [9] |
Wu ZS, Chen CR, Shen GL, et al. Reversible electronic nanoswitch based on DNA G-quadruplex conformation:a platform for single-step, reagentless potassium detection[J]. Biomaterials, 2008, 29(17): 2689-2696. DOI:10.1016/j.biomaterials.2008.02.024 |
| [10] |
谢海燕, 陈薛钗, 邓玉林. 核酸适配体及其在化学领域的相关应用[J]. 化学进展, 2007, 19(6): 1026-1033. DOI:10.3321/j.issn:1005-281X.2007.06.018 |
| [11] |
Zheng D, Seferos DS, Giljohann DA, et al. Aptamer nano-flares for molecular detection in living cells[J]. Nano Lett, 2009, 9(9): 3258-3261. DOI:10.1021/nl901517b |
| [12] |
Ellington AD, Szostak JW. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-822. DOI:10.1038/346818a0 |
| [13] |
Banerjee A, Bhatia D, Saminathan A, et al. Controlled release of encapsulated cargo from a DNA icosahedron using a chemical trigger[J]. Angew Chem, 2013, 52(27): 6854-6857. DOI:10.1002/anie.201302759 |
| [14] |
Niazov T, Pavlov V, Xiao Y, et al. DNAzyme-functionalized au nanoparticles for the amplified detection of DNA or telomerase activity[J]. Nano Lett, 2004, 4(9): 1683-1687. DOI:10.1021/nl0491428 |
| [15] |
And JL, Lu Y. A DNAzyme catalytic beacon sensor for paramagnetic Cu2+ Ions in aqueous solution with high sensitivity and selectivity[J]. J Am Chem Soc, 2007, 129(32): 9838-9839. DOI:10.1021/ja0717358 |
| [16] |
Santoro SW, Joyce GF. A general purpose RNA-cleaving DNA enzyme[J]. Proc Natl Acad Sci USA, 1997, 94(9): 4262-4266. DOI:10.1073/pnas.94.9.4262 |
| [17] |
胡春玲, 吴继魁. 基于脱氧核酶的重金属离子荧光生物传感器的研究进展[J]. 化学通报, 2013, 76(11): 1011-1015. |
| [18] |
Peng H, Li XF, Zhang H, et al. A microRNA-initiated DNAzyme motor operating in living cells[J]. Nature Communications, 2017, 8: 14378-14390. DOI:10.1038/ncomms14378 |
| [19] |
Wu Y, Huang J, Yang X, et al. Gold nanoparticle loaded split-DNAzyme-probe for amplified miRNA detection in living cells[J]. Anal Chem, 2017, 89(16): 8377-8383. DOI:10.1021/acs.analchem.7b01632 |
| [20] |
Chen J, Zuehlke A, Deng B, et al. A target-triggered DNAzyme motor enabling homogeneous, amplified detection of proteins[J]. Anal Chem, 2017, 89(23): 12888-12895. DOI:10.1021/acs.analchem.7b03529 |
| [21] |
Yang Y, Huang J, Yang X, et al. Gold nanoparticle based hairpin-locked-DNAzyme probe for amplified miRNA imaging in living cells[J]. Anal Chem, 2017, 89(11): 5850-5856. DOI:10.1021/acs.analchem.7b00174 |
| [22] |
Buranachai C, Mckinney SA, Ha T. Single molecule nanometronome[J]. Nano Lett, 2006, 6(3): 496-500. DOI:10.1021/nl052492p |
| [23] |
Liu Y, West SC. Happy Hollidays:40th anniversary of the Holliday junction[J]. Nature Reviews Molecular Cell Biology, 2004, 5(11): 937-944. DOI:10.1038/nrm1502 |
| [24] |
White CT, Todorov TN. Carbon nanotubes as long ballistic conductors[J]. Nature, 1998, 393(393): 240-242. |
| [25] |
Saito R, Fujita M, Dresselhaus G, et al. Electronic structure of chiral graphene tubules[J]. Applied Physics Letters, 1992, 60(18): 2204-2206. DOI:10.1063/1.107080 |
| [26] |
Zheng M, Jagota A, Semke ED, et al. DNA-assisted dispersion and separation of carbon nanotubes[J]. Nature Materials, 2003, 2(5): 338-342. DOI:10.1038/nmat877 |
| [27] |
Manohar S, Tang T, Jagota A. Structure of homopolymer DNA-CNT hybrids[J]. Journal of Physical Chemistry C, 2007, 111(48): 17835-17845. DOI:10.1021/jp071316x |
| [28] |
Zheng M, Jagota A, Semke ED, et al. DNA-assisted dispersion and separation of carbon nanotubes[J]. Nature Materials, 2003, 2(5): 338-342. DOI:10.1038/nmat877 |
| [29] |
Zheng M, Jagota, Walls DJ. Structure-based carbon nanotube sorting by sequence-dependent DNA assembly[J]. Science, 2003, 302(5650): 1545-1548. DOI:10.1126/science.1091911 |
| [30] |
Zhao C, Song Y, Ren J, et al. A DNA nanomachine induced by single-walled carbon nanotubes on gold surface[J]. Biomaterials, 2009, 30(9): 1739-1745. DOI:10.1016/j.biomaterials.2008.12.034 |
| [31] |
Kim B, Sigmund WM. Functionalized multiwall carbon nanotube/gold nanoparticle composites[J]. Langmuir the Acs Journal of Surfaces and Colloids, 2004, 20(19): 8239-8242. DOI:10.1021/la049424n |
| [32] |
冯永成, 董守安, 唐春. 一维金纳米线的自组装研究[J]. 贵金属, 2007, 28(4): 1-5. DOI:10.3969/j.issn.1004-0676.2007.04.001 |
| [33] |
Dong H, Jing Z, Ju H, et al. Highly sensitive multiple microRNA detection based on fluorescence quenching of graphene oxide and isothermal strand-displacement polymerase reaction[J]. Anal Chem, 2012, 84(10): 4587-4593. DOI:10.1021/ac300721u |
| [34] |
Mamaeva V, Sahlgren C, Lindén M. Mesoporous silica nanoparticles in medicine—recent advances[J]. Advanced Drug Delivery Reviews, 2013, 65(5): 689-702. DOI:10.1016/j.addr.2012.07.018 |
| [35] |
唐玥, 柯学. 介孔二氧化硅纳米粒子药物递送系统研究进展[J]. 中国药科大学学报, 2012, 43(6): 567-572. |
| [36] |
Gu J, Su S, Zhu M, et al. Targeted doxorubicin delivery to liver cancer cells by PEGylated mesoporous silica nanoparticles with a pH-dependent release profile[J]. Microporous and Mesoporous Materials, 2012, 161(5): 160-167. |
| [37] |
Connor EE, Mwamuka J, Gole A, et al. Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity[J]. Small, 2005, 1(3): 325-327. DOI:10.1002/(ISSN)1613-6829 |
| [38] |
付佩玉.基于纳米金放大的生物传感器及DNA分子机器的研究[D].青岛: 青岛科技大学, 2011.
|
| [39] |
Daniel MC, Astruc D. Gold nanoparticles:assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology[J]. Cheminform, 2004, 35(16): 293-346. |
| [40] |
吴伟, 贺全国, 陈洪. 磁性纳米粒子在生物传感器中的应用研究进展[J]. 化学通报, 2007, 70(4): 277-285. DOI:10.3969/j.issn.0441-3776.2007.04.006 |
| [41] |
李春梅.金纳米与磁纳米颗粒及其复合物的生物传感和细胞成像研究[D].重庆: 西南大学, 2013.
|
| [42] |
Bacon HE, Jr LE, Trimpi HD. A magnetic switch for the control of cell death signalling in in vitro and in vivo systems[J]. Nature Materials, 2012, 11(12): 1038-1043. DOI:10.1038/nmat3430 |
| [43] |
李玉宝. 纳米生物医药材料[M]. 北京: 化学工业出版社, 2004.
|
| [44] |
Ma Y, Liang X, Tong S, et al. Gold nanoshell nanomicelles for potential magnetic resonance imaging, light-triggered drug release, and photothermal therapy[J]. Adv Funct Mater, 2013, 23(7): 815-822. DOI:10.1002/adfm.v23.7 |
| [45] |
Fan Z, Shelton M, Singh AK, et al. Multifunctional plasmonic shell-magnetic core nanoparticles for targeted diagnostics, isolation, and photothermal destruction of tumor cells[J]. ACS Nano, 2012, 6(2): 1065-1073. DOI:10.1021/nn2045246 |
| [46] |
Chen L, Zheng H, Zhu X, et al. Metal-organic frameworks-based biosensor for sequence-specific recognition of double-stranded DNA[J]. Analyst, 2013, 138(12): 3490-3493. DOI:10.1039/c3an00426k |
| [47] |
Lei J, Qian R, Ling P, et al. Design and sensing applications of metal-organic framework composites[J]. TrAC Trends in Anal Chem, 2014, 58: 71-78. DOI:10.1016/j.trac.2014.02.012 |
| [48] |
Han Q, Zhang L, He C, et al. Metal-organic frameworks with phosphotungstate incorporated for hydrolytic cleavage of a DNA-model phosphodiester[J]. Inorg Chem, 2012, 51(9): 5118-5127. DOI:10.1021/ic202685e |
| [49] |
Kahn JS, Freage L, Enkin N, et al. Stimuli-responsive DNA-functionalized metal-organic frameworks(MOFs)[J]. Adv Mater, 2017, 29(6): 1602782. DOI:10.1002/adma.201602782 |
| [50] |
杨洋, 柳华杰, 刘冬生. DNA纳米机器[J]. 化学进展, 2008, 20(2): 197-207. |
| [51] |
Yurke B, Turberfield AJ, Jr MA, et al. A DNA-fuelled molecular machine made of DNA[J]. Nature, 2000, 406(6796): 605-608. DOI:10.1038/35020524 |
| [52] |
Chen Y, Wang M, Mao C. An autonomous DNA nanomotor powered by a DNA enzyme[J]. Angew Chem, 2004, 43(27): 3554-3557. DOI:10.1002/(ISSN)1521-3773 |
| [53] |
Shin JS, Pierce NA. A synthetic DNA walker for molecular transport[J]. J Am Chem Soc, 2004, 126(35): 10834-10835. DOI:10.1021/ja047543j |
| [54] |
Kolb HC, Finn MG, Sharpless KB. Click chemistry:diverse chemical function from a few good reactions[J]. Angew Chem, 2001, 32(35): 2004-2021. |
| [55] |
Binder WH, Sachsenhofer R. 'Click' chemistry in polymer and material science:an update[J]. Macromolecular Rapid Communications, 2010, 29(12-13): 952-981. |
| [56] |
Hou J, Liu X, Shen J, et al. The impact of click chemistry in medicinal chemistry[J]. Expert Opinion on Drug Discovery, 2012, 7(6): 489-501. DOI:10.1517/17460441.2012.682725 |
| [57] |
Kolb HC, Sharpless KB. The growing impact of click chemistry on drug discovery[J]. Drug Discovery Today, 2003, 8(24): 1128-1137. DOI:10.1016/S1359-6446(03)02933-7 |
| [58] |
Ge C, Luo Q, Wang D, et al. Colorimetric detection of copper(Ⅱ)ion using click chemistry and hemin/G-quadruplex horseradish peroxidase-mimicking DNAzyme[J]. Anal Chem, 2014, 86(13): 6387-6392. DOI:10.1021/ac501739a |
| [59] |
Ni Q, Zhang F, Zhang Y, et al. In situ shRNA synthesis on DNA-polylactide nanoparticles to treat multidrug resistant breast cancer[J]. Adv Mater, 2018, 30(10). DOI:10.1002/adma.201705737 |
| [60] |
Felsenfeld G, Davies DR, Rich A. Formation of a 3-stranded polynucleotide molecule[J]. J Am Chem Soc, 1957, 79(8): 2023-2024. DOI:10.1021/ja01565a074 |
| [61] |
Amodio A, Zhao B, Porchetta A, et al. Rational design of pH-controlled DNA strand displacement[J]. J Am Chem Soc, 2014, 136(47): 16469-16472. DOI:10.1021/ja508213d |
| [62] |
Ranallo S, Prévosttremblay C, Idili A, et al. Antibody-powered nucleic acid release using a DNA-based nanomachine[J]. Nature Communications, 2017, 8: 15150-15158. DOI:10.1038/ncomms15150 |
| [63] |
Mills M, Lacroix L, Arimondo PB, et al. Unusual DNA conformations:implications for telomeres[J]. Current Medicinal Chemistry Anticancer Agents, 2002, 2(5): 627-644. DOI:10.2174/1568011023353877 |
| [64] |
杨洋, 刘冬生. 质子驱动的核酸纳米机器[J]. 生命科学, 2008, 20(3): 358-363. DOI:10.3969/j.issn.1004-0374.2008.03.010 |
| [65] |
Liu D, Balasubramanian S. A proton-fuelled DNA nanomachine[J]. Angew Chem Int Ed Engl, 2003, 42(46): 5734-5736. DOI:10.1002/(ISSN)1521-3773 |
| [66] |
Mao Y, Liu D, Wang S, et al. Alternating-electric-field-enhanced reversible switching of DNA nanocontainers with pH[J]. Nucleic Acids Res, 2007, 35(5): e33. DOI:10.1093/nar/gkl1161 |
| [67] |
Liu H, Yun X, Li F, et al. Light-driven conformational switch of i-motif DNA[J]. Angew Chem, 2007, 46(14): 2515-2517. DOI:10.1002/(ISSN)1521-3773 |
| [68] |
Liang X, Nishioka H, Takenaka N, et al. A DNA nanomachine powered by light irradiation[J]. Chembiochem, 2008, 9(5): 702-705. DOI:10.1002/(ISSN)1439-7633 |
| [69] |
Sun W, Jiang T, Lu Y, et al. Cocoon-like self-degradable DNA nanoclew for anticancer drug delivery[J]. J Am Chem Soc, 2014, 136(42): 14722-14725. DOI:10.1021/ja5088024 |
| [70] |
Mou Q, Ma Y, Pan G, et al. DNA trojan horses:the self-assembled floxuridine-containing DNA polyhedra for cancer therapy[J]. Angew Chem, 2017, 129(41): 12528-12532. |
| [71] |
Rothemund PW. Folding DNA to create nanoscale shapes and patterns[J]. Nature, 2006, 440(7082): 297-302. DOI:10.1038/nature04586 |
| [72] |
Li S, Jiang Q, Liu S, et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo[J]. Nature Biotechnology, 2018, 36(3): 258-264. DOI:10.1038/nbt.4071 |
| [73] |
Yuan Q, Wu Y, Wang J, et al. Targeted bioimaging and photodynamic therapy nanoplatform using an aptamer-guided G-quadruplex DNA carrier and near-infrared light[J]. Angew Chem, 2013, 125(52): 14215-14219. DOI:10.1002/ange.201305707 |
| [74] |
Liu C, Zhang P, Zhai X, et al. Nano-carrier for gene delivery and bioimaging based on carbon dots with PEI-passivation enhanced fluorescence[J]. Biomaterials, 2012, 33(13): 3604-3613. DOI:10.1016/j.biomaterials.2012.01.052 |
| [75] |
Liang CP, Ma PQ, Liu H, et al. Rational engineering of dynamic, entropy-driven DNA nanomachine for intracellular microRNA imaging[J]. Angew Chem, 2017, 56(31): 9077-9081. DOI:10.1002/anie.201704147 |
| [76] |
Ma PQ, Liang CP, Zhang HH, et al. A highly integrated DNA nanomachine operating in living cells powered by an endogenous stimulus[J]. Chem Sci, 2018, 9: 3299-3304. DOI:10.1039/C8SC00049B |






