近些年来,动物产品质量和安全成为公众关注问题,其中动物产品掺假是一个严重的问题,一些商家为赚取利润,常使用便宜劣质的马肉、猪肉、鸭肉、鸡肉甚至鼠肉来代替高品质牛羊肉,如欧洲出现的马肉丑闻和一些以禽肉代替牛羊肉的掺假案例。由于掺假肉品可能含有导致发生过敏反应的动物源性成分,而且某些肉品对于特定的宗教被视为禁忌,因此动物产品掺假问题已经给人民健康、文化和宗教信仰带来很大风险。
不同动物源产品的外观本身具有一定相似性,而且经过一定的工艺处理,难以从肉眼上进行鉴定。目前动物源性成分鉴定主要采取分子生物学方法进行,检测方法包括核酸探针法,PCR及实时荧光PCR法。由于线粒体DNA(mt DNA)种属特异性较强,可以对动物进行种属鉴定,目前多数核酸检测方法针对mt DNA,这些mt DNA包括细胞色素b(Cyt b),18S核糖体DNA,12S rDNA以及细胞色素C氧化酶亚单位I基因等[1-3],目前发布的动物源性成分检测的国家标准均针对线粒体DNA[4]。但目前也建立了一些针对动物基因组相对保守且能进行种属鉴定的区域进行检测的方法,这些基因包括卫星DNA,生长激素基因,白细胞介素2前体基因等[5-7]。在定量检测动物物种成分时,还需选择一个基因拷贝数相对固定的内参基因,便于比例计算和校正误差,一般选择在哺乳动物和禽类间保守的序列,这些序列包括线粒体DNA,生长激素基因,beta肌动蛋白以及肌肉生长抑制素基因等[2-3]。
由于基于核酸扩增的检测方法灵敏度都很高,而不同种动物产品在生产、加工和处置过程中,难免出现肉品间相互交叉污染,因此不能单纯依据定性基因检测结果作出掺假的判断结论。欧盟发布的2013/99/EU规则,规定如果特定肉产品中含有 > 1%的其它肉品成分认为是掺假。因此为避免上述假阳性结果的出现,在检测一些动物产品时,有必要对动物源性成分进行定量[8]。采用荧光PCR对线粒体和核内染色体DNA和线粒体DNA进行定量检测的方法均有报道[1-7]。但未见在对样品和标准品充分前处理的基础上进行动物源性成分定量检测的报道。
考虑到不同样品可能含水量不同,直接提取DNA检测可能造成较大误差,因此本研究中,以牛肉作为检测目标,通过将检测样品冻干、粉碎,并制备一系列具有不同含量被检目标成分的标准品肉粉,同时分别提取DNA,应用建立的哺乳动物和禽通用型、牛源性成分实时定量荧光PCR检测方法,对动物产品中牛源性成分进行检测,以期实现对肉品中牛源成分的精准检测。
1 材料与方法 1.1 材料 1.1.1 样品常见肉类包括鸡肉、牛肉、马肉、绵羊肉、山羊肉、猪肉、狗肉、鱼肉及兔肉,本实验室保存。
1.1.2 主要试剂血液/组织/细胞基因组提取试剂盒(DP304),购自天根生化科技有限公司;Ex HS Taq DNA聚合酶、dNTP等购自TaKaRa公司。核酸纯化柱及套管,购自上海生工。
1.1.3 主要设备LightCycler 480,Roche公司;微量核酸浓度测定仪Nano quant,TECAN公司;冻干机,SIM公司。
1.2 方法 1.2.1 引物和探针的合成合成以下3套引物探针,其中牛源引物探针针对卫星Ⅳ DNA[1],哺乳动物和禽通用型引物探针针对肌肉生长抑制素基因(内对照)[2],引物探针名称、序列及靶基因见表 1。
将各种动物肉类去除脂肪、筋膜后与收集样品于冻干机中冷冻干燥24 h以上,于粉碎机中充分粉碎后制成粉末。以鸡肉为掺入基质,配制含100%、50%、25%、10%、1%及0.1%牛源成分的冻干肉粉作为定量标准品,同时分别配制含15%,8%和1%的牛源成分的冻干肉粉进行定量方法验证测试。精确称量上述标准品和样品冻干粉25 mg于1.5 mL离心管中,按照试剂盒说明书提取冻干粉基因组DNA,洗脱DNA于100 μL无核酸酶的纯化水中,保存于-80℃。
1.2.3 DNA浓度测定与稀释测定前,取2 μLDNA溶液使用Nano quant分别测定260 nm及280 nm之吸光度值(OD)。计算DNA浓度和纯度,其比值应介于1.7-2.0之间,根据测定结果将各个DNA样品稀释至20 ng/μL。
1.2.4 荧光定量PCR反应条件的优化于ROCHE480设备进行反应体系优化,对反应参数,各种成分的浓度进行优化,建立检测牛源以及通用型双重反应体系,其中通用型检测通道作为内对照。体系优化后,使用4%的琼脂糖凝胶对阳性(牛肉DNA为模板)和阴性(植物DNA为模板)PCR产物进行电泳检测,观察特异性反应条带。
1.2.5 灵敏度试验应用建立的双重反应体系对含100%、50%、25%、10%、1%及0.1%牛源成分的冻干肉粉进行检测,以验证方法的灵敏度。
1.2.6 特异性试验应用建立的双重反应体系对常见肉类包括鸡肉、牛肉、马肉、绵羊肉、山羊肉、猪肉、狗肉、鱼肉及兔肉进行检测,以验证方法的特异性。
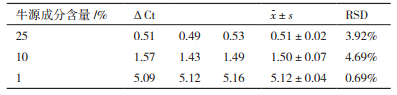
1.2.7 重复性试验通过对25%、10%和1%共3个含不同浓度牛源成分冻干粉进行3次重复检测,通过计算△Ct标准差(SD)和相对标准差(RSD)来确定方法的可重复性。
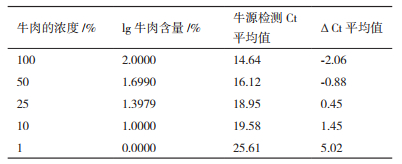
1.2.8 荧光定量PCR方法的定量检测标准曲线建立和应用为评估定量方法的实用性和特异性以及方法的实用性,应用定量标准品和自制的3份牛源成分含量分别为15%、8%和1%(编号为B15,B8和B1)的模拟样品及6份送检牛肉样品(S1-S6)提取的DNA进行上机检测,每个DNA样品上样5 μL(即DNA总量100 ng),同时设水对照和阴性对照,每个标准品和检测样品核酸设3个重复。求取各组Ct值的平均值,将各浓度标准品的检测Ct值平均值减去内部对照基因Ct值平均值后所得之数值△Ct为纵轴,以含不同浓度牛源成分标准品浓度的对数值为横轴,进行线性回归分析并制作标准曲线,计算回归系数(R2)和PCR扩增效率[9]。然后利用标准曲线对各个样品进行定量,通过计算样品的标准差和相对标准差来评价检测结果的准确性。
2 结果 2.1 荧光定量PCR反应条件的优化经优化确立反应体系:每个反应体系均包含1×Ex HS PCR Buffer,200 nmol/L dNTP,0.5 μmol/L的牛源上下游引物,0.4 μmol/L的通用型上下游引物,0.25 μmol/L的牛源检测探针以及0.2 μmol/L的通用检测探针。
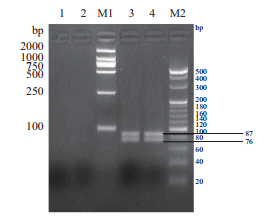
反应参数为95℃ /3 min;94℃/15 s,60℃/35 s,35个循环,每个循环60℃时分别收集FAM和VIC通道荧光信号。对(牛肉DNA为模板)和阴性(植物DNA为模板)PCR产物进行电泳,阳性PCR产物可以观察到大小分别约为87 bp和76 bp的特异性条带,见图 1。
|
| 图 1 双重荧光PCR产物琼脂糖凝胶电泳结果 1,2:植物DNA;3,4:牛肉DNA;M1:DL2000分子量标准;M2:20 bp ladder分子量标准 |
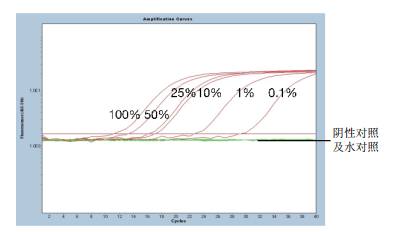
应用建立的双重反应体系可以检出牛源成分含量为0.1%的冻干肉粉(图 2),表明方法的灵敏度可以满足要求。
|
| 图 2 双重荧光PCR方法检测牛源成分的灵敏度试验结果 |
应用检测牛源性成分以及通用型反应体系对常见肉类进行检测,结果显示建立的双重检测方法与其他肉类无交叉反应。
2.4 重复性试验结果重复性试验结果见表 2,相对标准偏差小于5%,表明方法的重复性可以满足要求。
对制备的含牛源成分的冻干肉粉定量标准品检测结果见图 3。检测结果经计算后进行线性回归,相关数据及获得的方程图形见图 4和表 3。回归的相关系数R2为0.966,PCR反应效率(E)=(10-1/k-1)×100%=93.6%,表明建立的方法扩增效率较高。

|
| 图 3 含100%、50%、25%、10%及1%牛源成分的冻干肉粉定量标准品检测结果 |
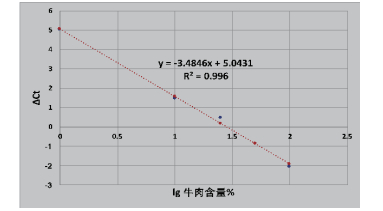
|
| 图 4 标准品线性回归方程图形 |
3份含不同牛源成分的自制模拟样品和6份送检牛肉样品的检测结果见表 4,本方法检测的结果与自制模拟样品的已知值非常吻合,而且对于送检的6份牛肉样品,计算牛肉含量为99.55%-100.18%。所有检测结果的RSD均小于5%。
由于基因扩增的检测方法灵敏度都很高,因此定性检测结果不能排除不同种动物产品在生产、储存及运输过程中的微量污染问题。因此本研究以牛肉产品为目标,参考相关文献,选取牛卫星Ⅳ DNA和哺乳动物和禽保守的肌肉生长抑制素基因(内对照)作为检测目标[1-2],建立了双重荧光定量PCR检测方法,实现了动物产品中牛源成分的定量检测。经对自制模拟样品和送检牛肉样品进行检测,取得满意结果。由于不同来源动物制品制作过程和储运条件的不同,因此含水量不同,为提高定量方法的准确性并尽量减少误差,本研究采用了在前处理过程中先将样品进行冷冻干燥并充分粉碎,同时制备出含有不同牛肉成分的标准冻干粉,使用分析天平准确取样来消除样品间的差异。此外,在进行DNA提取时,不同来源样品提出的DNA的量也可能存在差异,因此需要在扩增前测定其含量和纯度,并在测量后调整DNA浓度至同一水平,这样可很大限度减少上样误差。另外,为保证检测Ct的一致性,每次检测都应将标准品和检测样品DNA同时上机,通过标准品的回归标准曲线来对样品中动物源性成分进行定量。以前的研究中,虽有采用荧光PCR对动物源成分进行定量检测的方法,但这些报道均未具体描述对样品和标准品的前处理过程,只是对DNA的浓度进行定量。本研究则以制备的不同百分含量的牛肉粉作为标准品,同时将被检样品冻干粉碎,提取DNA绘制标准曲线实现牛源成分的定量,对模拟样品和送检牛肉的检测结果显示,比较准确的实现了模拟样品和送检牛肉中牛源成分的定量。
有研究表明肌肉生长抑制素基因在哺乳动物和禽细胞中的拷贝数比较固定[2]。为监控核酸扩增中的误差,本研究使用了肌肉生长抑制素基因作为内对照,有效校正了扩增过程中产生的误差,取得满意效果。可以进一步应用本研究的思路开展其他动物源成分的定量检测。由于本研究所检测的样品均为生的动物产品,DNA基本未被破坏,因此效果较好。有研究表明深加工的熟制动物产品如阿胶等,其DNA破坏比较严重[10]。本研究也发现同样的问题,对于这样的动物产品,本研究建立的定量方法可能并不适用,需要针对其他类型靶标(如某种相关的蛋白分子)研究定量检测方法。本研究仅是对模拟混合牛肉和送检牛肉进行了检测,样品均为生鲜肉,距离作为标准方法还有一定距离,进一步扩大检测样品类型,特别是增加一些非深加工的熟肉制品,其他类型组织来验证方法对有效性将是下一步的研究目标。此外,牛肉脂肪含量相对较低,DNA分布比较均匀,可能也是取得满意结果的原因之一,对于脂肪含量高且分布不均匀的动物源性成分能否采用本检测方法的策略也需要进一步研究确认。
4 结论选取牛卫星Ⅳ DNA和肌肉生长抑制素基因(内对照)的作为检测目标,建立了双重荧光定量PCR检测方法,并使用含100%、50%、25%、10%、1%及0.1%牛源成分的冻干肉粉作为定量标准品,对自制混合肉品和送检肉品中牛源成分进行了定量检测,取得预期结果。
| [1] |
Jonker KM, Tilburg JJ, Hagele GH, et al. Species identification in meat products using real-time PCR[J]. Food Additives and Contaminants, 2008, 25: 527-533. DOI:10.1080/02652030701584041 |
| [2] |
Ren YF, Li X, Liu YM, et al. A novel quantitative real-time PCR method for identification and quantification of mammalian and poultry species in foods[J]. Food Control, 2017, 76: 42-51. DOI:10.1016/j.foodcont.2017.01.003 |
| [3] |
Brodmann PD, Moor D. Sensitive and semi-quantitative TaqManTM real-time polymerase chain reaction systems for the detection of beef(Bos taurus)and the detection of the family Mammalia in food and feed[J]. Meat Science, 2003, 65: 599-607. DOI:10.1016/S0309-1740(02)00253-X |
| [4] |
GB/T 21103-2007.动物源性饲料中哺乳动物源性成分定性检测方法实时荧光PCR方法[S].中国国家标准. 2017.
|
| [5] |
Ines L, Jutta Z, Almuth S, et al. Development and design of a 'ready-to-use' reaction plate for a PCR-based simultaneous detection of animal species used in foods[J]. Int J Food Sci Technol, 2007, 42(1): 9-17. DOI:10.1111/ifs.2007.42.issue-1 |
| [6] |
Koppel R, Daniels M, Felderer N, et al. Multiplex real-time PCR for the detection and quantification of DNA from duck, goose, chicken, Turkey and pork[J]. Eur Food Res Technol, 2013, 2: 1093-1098. |
| [7] |
Koppel R, Zimmerli F, Breitenmoser A. Heptaplex real-time PCR for the detection and quantification of DNA from beef, pork, chicken, Turkey, horse meat, sheep(mutton)and goat[J]. Eur Food Res Technol, 2009, 230(1): 125-133. DOI:10.1007/s00217-009-1154-5 |
| [8] |
Ballin NZ, Vogensen FK, Karlsson AH. Species determination. Can we detect and quantify meat adulteration?[J]. Meat Science, 2009, 83: 165-174. DOI:10.1016/j.meatsci.2009.06.003 |
| [9] |
林露, 严维凌, 朱祖琪, 等. 实时荧光PCR技术快速检测混合肉制品中牛肉含量[J]. 中国食品学报, 2016(3): 152-159. |
| [10] |
陈志宣, 龚国利, 钱云开. 阿胶DNA提取方法优化[J]. 中国实验方剂学杂志, 2014, 20(21): 13-16. |