2. 发酵工程教育部重点实验室(湖北工业大学),武汉 430068;
3. 工业发酵湖北省协同创新中心,武汉 430068;
4. 河南农业大学,郑州 450002
2. Key Laboratory of Fermentation Engineering of Ministry of Education(Hubei University of Technology), Wuhan 430068;
3. Hubei Collaborative Innovation Center for Industrial Fermentation, Wuhan 430068;
4. Henan Agricultural University, Zhengzhou 450002
卡他莫拉菌(Moraxella catarrhalis,M. catarrh-alis)属革兰氏阴性、兼性厌氧双球菌,是慢性肺病患者中引起下呼吸道感染的重要病原体[1]。该菌不仅引起儿童中耳炎(Otitis media,OM),还引起成年人慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD),甚至会导致急性加重感染患者死亡[1-2]。目前已分离出可产生β-內酯胺酶的M. catarrhalis临床菌株,该菌的抗生素耐药性更令人恐慌[3-4]。由于M. catarrhalis引起的临床症状与其他呼吸道病原体感染类似,因此精确的诊断、对症用药是临床治疗的重要环节。目前,M. catarrhalis感染的诊断方法主要有血清学检测法、核酸检测法[5]和病原体培养检测法[6],但都存在检测时间长、操作步骤复杂、成本较高等缺陷,因此寻找快速、简便且准确的检测方法具有重要意义。
本实验选定M. catarrhalis中具有种属特异性和保守性的表面抗原蛋白UspA1[7-8],通过生物信息学预测UspA1蛋白胞外结构域单一线性表位,制备UspA1Line-KLH复合蛋白及重组蛋白UspA1-His多克隆抗体,经纯化后分别用于胶体金的标记及检测线的包被,采用柠檬酸三钠还原法制备40 nm胶体金颗粒,建立卡他莫拉菌胶体金试纸条检测方法,旨在为快速检测呼吸道病原菌提供检测方法。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒本实验中所有病原菌株均购自美国菌种保藏中心(ATCC),重组质粒pET-28a(+)-uspa1,感受态细胞E.coli Rosetta(DE3)均由本实验室保存。
1.1.2 实验动物免疫用新西兰大白兔由湖北省疾控中心提供。
1.1.3 主要试剂及耗材Ni SepharoseTM6 Fast Flow,Sephadex G25(10/350)购自GE healthcare公司;Protein At Beads 4FF,PabPur Sulfolink Beads购自Smart公司;弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司;硝酸纤维素膜(CN140)购自Sartorius公司;玻璃纤维(CB08)、聚酯纤维(DL42)、吸水纸(CH37K)和PVC板购自上海良信技术有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、氯金酸(HAuCl4·3H2O)和柠檬酸三钠购自国药集团;辣根过氧化物酶(HRP)标记的羊抗兔IgG购自武汉博士德生物工程有限公司;牛血清白蛋白(BSA)购自BioFroxx公司;羧基水溶性量子点(12-18 nm)购自武汉珈源量子点技术开发有限责任公司。
1.1.4 生物信息学分析UspA1蛋白表面可及性预测及线性表位预测均由武汉百意欣生物技术有限公司提供技术服务。
1.2 方法 1.2.1 UspA1蛋白胞外结构域单一线性表位的预测及合成利用ABCpred软件,对UspA1蛋白进行生物信息学结构分析,选定672-685位(GenBank序列号AAF36416.1)的14个氨基酸组成的短肽NTDRIAKNKAEADA(此序列命名为UspA1Line)作为制备兔抗UspA1蛋白抗体的线性抗原表位,将UspA1Line的N端添加一个半胱氨酸后,用多肽自动合成仪合成多肽并纯化,纯化后的多肽与载体蛋白KLH偶联,形成UspA1Line-KLH复合蛋白。
1.2.2 重组蛋白UspA1-His的诱导表达及纯化参照文献[9]方法,诱导表达UspA1-His重组蛋白,并用GE公司的His Trap亲和层析柱,按照说明书方法得到纯化的UspA1-His重组蛋白,进行SDS-PAGE检测。
1.2.3 动物免疫实验参照文献[9]方法对新西兰大白兔进行免疫。UspA1-His重组蛋白和UspA1Line-KLH复合蛋白的首次免疫计量均为1 mg/只,加强免疫计量均为0.5 mg/只。将效价符合要求的新西兰大白兔经颈动脉采血,分离血清,-80℃冻存备用。
1.2.4 UspA1-His重组蛋白多克隆抗体的纯化采用GE公司的rProtein A亲和层析柱,按照其说明书收集洗脱液,用磷酸盐缓冲体系超滤浓缩,得到UspA1-His抗体(AbUspA1-His)。超微量分光光度计测浓度定量,分装冻干,-80℃储存备用。
1.2.5 UspA1Line-KLH复合蛋白多克隆抗体的纯化参照UspA1-His重组蛋白多克隆抗体的纯化步骤得到除盐后的UspA1Line-KLH复合蛋白抗体。
采用SMART公司的PabPur Sulfolink Beads多肽亲和层析柱,按照其说明书偶联肽链UspA1Line,得到UspA1Line多肽亲和层析柱。加入除盐后的UspA1Line-KLH复合蛋白抗体,按照说明书纯化抗体,得到高纯度的UspA1Line抗体(AbUspA1Line),超微量分光光度计测浓度定量,分装冻干,-80℃储存备用。
1.2.6 多克隆抗体效价及特异性检测采用间接ELISA法测定抗体效价[9],测定AbUspA1-His和AbUspA1Line对M. catarrhalis的识别能力。根据450 nm处吸光值(OD450)判断结果。判定方法:S/N=(待检OD450)/(阴性对照OD450),S/N > 2.1为阳性。
利用直接免疫荧光法鉴定AbUspA1-His和AbU-spA1Line对M. catarrhalis抗原的识别能力。按说明书方法用可溶性羧基量子点标记AbUspA1-His和AbUspA1Line。以标记抗体作为特异性荧光抗体标记M. catarrhalis。将标记好的菌液固定在载玻片上,滴加Hoechst 33342染料染核。用激光共聚焦显微镜观察M. catarrhalis菌体与量子点标记抗体的结合情况。
1.2.7 胶体金标记免疫层析试纸条的制备采用柠檬酸钠还原法[10]制备40 nm胶体金。取1 mL制备好的胶体金加2 µL的0.2 mol/L K2CO3调pH,1 mL胶体金标记4 µg AbUspA1Line,标记好后离心重悬至100 µL,以0.3 µg/cm的量喷涂于玻璃纤维膜上,37℃鼓风干燥箱放置1 h以上。
将上述制备的AbUspA1-His和羊抗兔IgG用磷酸盐缓冲液调整至终浓度分别为2.0 mg/mL、0.5 mg/mL。将AbUspA1-His装以1.0 μL/cm的量在硝酸纤维素膜上划线,形成检测线;将稀释好的羊抗兔IgG以1.0 μL/cm的量在硝酸纤维素膜上划线作为质控线,其与检测线间距为0.5 cm。硝酸纤维素膜37℃真空干燥12 h以上,制得检测层,4℃密封干燥保存。
按照图 1对检测卡进行组装后(结合处均交接2 mm),用斩切机将试纸切割成4 mm的试纸条,与干燥剂一同封装在铝箔袋内保存。

|
| 图 1 胶体金检测卡组装图 |
将待检样品溶于生理盐水,取150 µL滴在样品垫上进行层析,检测结果以10 min为准。若质控线(C线)和检测线(T线)均显色,则检测结果判定为阳性;若C线显色,T线不显色,则检测结果判定为阴性;若均不显色,或只有T线显色,则说明试纸已失效,结果无效。
1.2.9 试纸条的性能测定特异性检测:用试纸条分别检测M. catarrhalis(ATCC 49619)、肺炎链球菌S. pneumoniae(ATCC 25238)、肺炎支原体M. Pneumonia(ATCC 15531)、流感嗜血杆菌H. influenzae(ATCC 9007)、嗜肺军团菌L. pneumophila(ATCC 33152)等呼吸道常见病原菌稀释液(10 mmol/L PBS将菌体浓度稀释至1×108 CFU/mL),鉴定试纸条的特异性。
灵敏性测试:将M. catarrhalis用10 mmol/L PBS分别稀释至1×109、1×108、1×107、1×106、1×105及1×104 CFU/mL,观察阳性结果的最低菌浓度。
短期稳定性测试:将同一批次的试纸条置于55℃储存,每2 d用阳性样本进行检测,同时将该批次的试纸条进行3次冷冻到复融的循环,用阳性样本进行检测。每个样品检测3次以观察稳定性和重复性。
稳定性和重复性测试:将3个不同批次的试纸条置于24℃储存6个月,每30 d用阳性样本和阴性样本进行检测,且每个样本检测3次以观察稳定性和重复性。
2 结果 2.1 重组蛋白UspA1-His的诱导表达及纯化重组质粒pET-28a(+)-uspa1转化至E.coli Rosetta(DE3)后,37℃经IPTG过夜诱导表达,将收集的菌体超声破碎,取上清和沉淀进行SDS-PAGE电泳。由图 2可知,在约24 kD处有明显的条带,大小与预期相符,诱导表达成功,目的蛋白以可溶的形式存在在上清中。
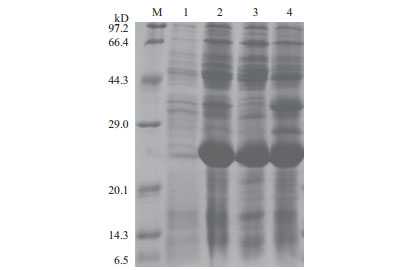
|
| 图 2 重组蛋白的SDS-PAGE分析 M:Marker;1:表达前;2:表达后;3:超破上清;4:超破沉淀 |
重组蛋白经镍柱亲和纯化,收集洗脱峰。由图 3可知,含40 mmol/L咪唑和含100 mmol/L咪唑的洗脱液可将目标蛋白洗脱且纯度达90%以上。经超滤管浓缩,洗去咪唑后,测定浓度为0.56 mg/mL,总量超过7.8 mg。
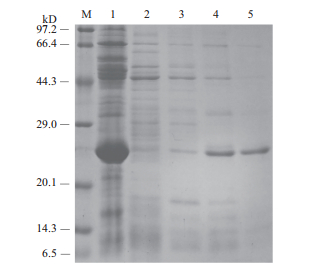
|
| 图 3 亲和纯化产物的SDS-PAGE分析 M:Protein marker;1:穿透液;2:10 mmol/L咪唑;3:20 mmol/L咪唑;4:40 mmol/L咪唑;5:100 mmol/L咪唑 |
采用间接ELISA法测定抗体的效价。在1:512 000稀释度下,AbUspA1Line和AbUspA1-His的S/N值为13.529、11.838,数值均大于2.1,抗体滴度均达到1:512 000(图 4)。
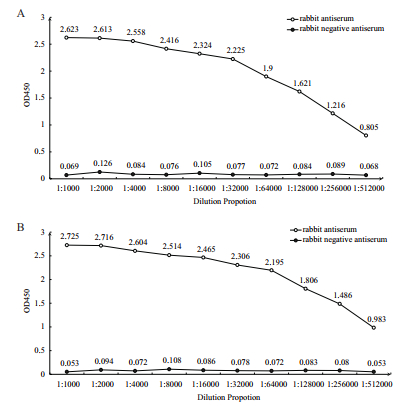
|
| 图 4 间接ELISA法测定抗体效价 A:UspA1Line复合蛋白抗血清滴度;B:UspA1-His重组蛋白抗血清滴度 |
用激光共聚焦显微镜观察到羧基量子点标记的抗体可特异性识别M. catarrhalis(图 5)。
|
| 图 5 免疫荧光法测抗体特异性 图中蓝色为M. catarrhalis菌体;红色为羧基量子点标记的抗体 |
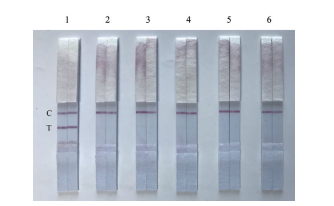
检测M. catarrhalis的试纸条,C线和T线均显色,结果为阳性;阴性对照及其他呼吸道常见病原菌(如肺炎链球菌、肺炎支原体、流感嗜血杆菌、嗜肺军团菌)检测结果(图 6)均为阴性,说明制备的M. catarrhalis检测试纸条特异性较高。
|
| 图 6 卡他莫拉菌胶体金免疫层析试纸条的特异性检测 C:质控线;T:检测线;1:M. catarrhalis;2:S. pneumoniae;3:M. Pneumonia;4:H. influenzae;5:L. pneumophila;6:阴性对照 |
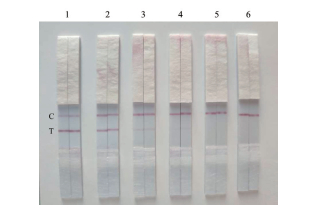
结果(图 7)表明,制备的试纸条可检测菌浓度为1×106 CFU/mL的M. catarrhalis稀释液。
|
| 图 7 卡他莫拉菌胶体金免疫层析试纸条的灵敏性检测 C:质控线;T:检测线;1:1×109 CFU/mL;2:1×108 CFU/mL;3:1×107 CFU/mL;4:1×106 CFU/mL;5:1×105 CFU/mL;6:1×104 CFU/mL |
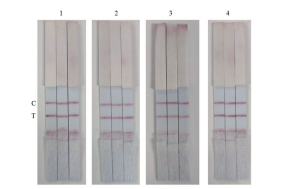
结果(图 8)表明,55℃储存4 d试纸条的灵敏性与新制备的试纸条相比无差别,储存6 d后检测线显色变浅。经3次冷冻到复融循环的试纸条与新制备的试纸条检测无差别。
|
| 图 8 卡他莫拉菌胶体金免疫层析试纸条的短期稳定性检测 C:质控线;T:检测线;1:2 d;2:4 d;3:6 d;4:冷冻复融 |
将试纸条在24℃储存6个月后,其特异性和灵敏性与新制备的试纸条相比无差别,且平行实验结果稳定。
3 讨论M. catarrhalis作为引起儿童中耳炎和成人慢性肺阻塞疾病的重要病原菌,它不仅单独致病,同时会与其他病原微生物共同作用,导致病情的加重及交叉感染[11-13]。由于M. catarrhalis会产生β-内酰胺酶,所以其对β-内酰胺抗生素敏感的细菌如肺炎链球菌等提供保护,使得患者严重感染并加大治疗难度[14-15]。据统计,在美国,每年治疗OM的成本约3-5亿美元,而每年治疗COPD的成本为约3万美元/人,快速诊断和精确用药尤为重要[16]。目前临床诊断M. catarrhalis感染的“金标准”为病原体培养检测法[17]。但是检测时间过长,不能及时指导治疗,导致患者病情加重或出现过度用药的情况。聚合酶链反应(PCR)技术虽可检测卡他莫拉菌,但灵敏度极高,易出现假阳性,不能作为感染诊断依据[18-19]。因此,寻找检测快速、操作简单、特异性高的检测方法具有重要意义。
本研究以M. catarrhalis标准菌株为研究对象,经结构生物学分析迅速找到了UspA1蛋白上14个氨基酸组成的M. catarrhalis表面抗原的单一线性抗原表位,偶联KLH后免疫新西兰兔子,得到抗血清。通过Protein A亲和层析和多肽亲和层析两步来纯化抗体,提高了多克隆抗体的特异性,使之达到了接近单克隆抗体的效果。将其作为金标抗体与胶体金颗粒结合,特异性识别菌体表面UspA1蛋白胞外结构域中线性抗原决定簇,用识别菌体不同表面表位的AbUspA1-His捕获菌体,形成双抗体夹心,使T线出现肉眼可见的颜色反应,无假阳性且与其他呼吸道常见病原菌无交叉反应,可检测呼吸道感染病人呼吸道内是否存在M. catarrhalis大量增殖。
本研究建立的双抗夹心免疫层析法可在10 min内得到准确结果,相较于其他传统检测M. catarrhalis的方法,具有快速、简便、特异、灵敏的特点,不需要专业人员的培训和昂贵的仪器设备,尤其适用于医院对吸道感染病人的实时诊断。由于呼吸道感染常伴随多种细菌合并感染[20],该方法不受其他病原菌的干扰,可为之后的呼吸道病原菌快速的检测提供参考。
4 结论本研究经结构生物学分析迅速找到了M. catarrhalis特异性表面蛋白UspA1上由14个氨基酸组成的单一线性抗原表位,偶联KLH后免疫新西兰兔子,得到抗血清。通过Protein A亲和层析和多肽亲和层析两步纯化抗体,得到特异性识别菌体表面UspA1蛋白胞外结构域中线性抗原决定簇的抗体AbUspA1Line,用识别菌体不同表面表位的AbUspA1-His捕获菌体,形成双抗体夹心,成功研制出可快速检测卡他莫拉菌的胶体金试纸。
| [1] |
Karalus R, Campagnari A. Moraxella catarrhalis:a review of an important human mucosal pathogen[J]. Microbes & Infection, 2000, 2(5): 547-559. |
| [2] |
Murphy TF, Brauer AL, Johnson A, et al. A cation-binding surface protein as a vaccine antigen to prevent Moraxella catarrhalis otitis media and infections in chronic obstructive pulmonary disease[J]. Clinical & Vaccine Immunology, 2017, 24(9): e00130-17. |
| [3] |
Klugman KP. The clinical relevance of in-vitro resistance to penicil-lin, ampicillin, amoxycillin and alternative agents, for the treatment of community-acquired pneumonia caused by Streptococcus pneumo-niae, Haemophilus influenzae and Moraxella catarrhalis[J]. J Antimicrob Chemother, 1996, 38(Suppl A): 133-140. DOI:10.1093/jac/38.suppl_A.133 |
| [4] |
Daoud A, Abuekteish F, Masaadeh H. Neonatal meningitis due to Moraxella catarrhalis and review of the literature[J]. Annals of Tropical Paediatrics, 1996, 16(3): 199-201. DOI:10.1080/02724936.1996.11747826 |
| [5] |
Sheikh AF, Ahmadi K, Nikakhlagh S. Detection of Streptococcus pneumoniae and Moraxella catarrhalis in patients with paranasal chronic sinusitis by polymerase chain reaction method[J]. Journal of the Chinese Medical Association, 2016, 79(8): 440-444. DOI:10.1016/j.jcma.2016.03.002 |
| [6] |
孙慧明, 周卫芳, 季伟, 等. 苏州地区下呼吸道感染住院患儿卡他莫拉菌感染与气候因素相关性研究[J]. 临床儿科杂志, 2014, 32(6): 524-527. DOI:10.3969/j.issn.1000-3606.2014.06.006 |
| [7] |
Klingman KL, Murphy TF. Purification and characterization of a high-molecular-weight outer membrane protein of Moraxella(Branhamella)catarrhalis[J]. Infect Immun, 1994, 62(4): 1150-1155. |
| [8] |
Ren D, Pichichero ME. Vaccine targets against Moraxella catarrhalis[J]. Expert Opin Ther Targets, 2015, 20(1): 19-33. |
| [9] |
王辉, 杨波, 赵可胜, 等. 卡他莫拉菌UspA1蛋白多克隆抗体的制备及鉴定[J]. 生物工程学报, 2018, 34(1): 102-109. |
| [10] |
Hayat MA. Academic Press[M]. Colloidal gold: principles, methods, and applications, 1989.
|
| [11] |
Domenech A, Puig C, Martí S, et al. Infectious etiology of acute exacerbations in severe COPD patients[J]. Journal of Infection, 2013, 67(6): 516-523. DOI:10.1016/j.jinf.2013.09.003 |
| [12] |
Elizabeth BM, Novotny LA, Jurcisek JA, et al. Respiratory syncytial virus promotes Moraxella catarrhalis-induced ascending experimental otitis media[J]. PLoS One, 2012, 7(6): e40088. DOI:10.1371/journal.pone.0040088 |
| [13] |
Wark PAB, Melinda T, Heather P, et al. Viral and bacterial infection in acute asthma and chronic obstructive pulmonary disease increases the risk of readmission[J]. Respirology, 2013, 18(6): 996-1002. DOI:10.1111/resp.12099 |
| [14] |
Perez AC, Pang B, King LB, et al. Residence of Streptococcus pneumoniae and Moraxella catarrhalis within polymicrobial biofilm promotes antibiotic resistance and bacterial persistence in vivo[J]. Pathogens & Disease, 2014, 70(3): 280-288. |
| [15] |
Schaar V, Riesbeck K. Moraxella catarrhalis outer membrane vesicles carry β-lactamase and promote survival of Streptococcus pneumoniae and Haemophilus influenzae by inactivating amoxicillin[J]. Antimicrobial Agents & Chemotherapy, 2011, 55(8): 3845-3853. |
| [16] |
Perez AC, Murphy TF. A Moraxella catarrhalis vaccine to protect against otitis media and exacerbations of COPD:an update on current progress and challenges[J]. Hum Vaccin Immunother, 2017, 13(10): 2322-2331. DOI:10.1080/21645515.2017.1356951 |
| [17] |
杨晓华, 王桂兰, 汪伟山, 等. 儿童呼吸道卡他莫拉菌感染状况及耐药性和耐药基因的研究[J]. 国外医药抗生素分册, 2017, 38(2): 72-75. DOI:10.3969/j.issn.1001-8751.2017.02.007 |
| [18] |
徐晓刚, 李光辉. 卡他莫拉菌感染研究进展[J]. 中国感染与化疗杂志, 2003, 3(2): 121-124. DOI:10.3321/j.issn:1009-7708.2003.02.021 |
| [19] |
Liu Y, Xu H, Xu Z, et al. High-Level Macrolide-resistant moraxella catarrhalis and development of an allele-specific PCR assay for detection of 23S rRNA gene A2330T mutation:a three-year study at a Chinese tertiary hospital[J]. Microbial Drug Resistance, 2015, 21(5): 507-511. DOI:10.1089/mdr.2014.0217 |
| [20] |
Zhang Y, Zhang F, Wang H, et al. Antimicrobial susceptibility of Streptococcus pneumoniae, Haemophilus influenzae and Moraxella catarrhalis isolated from community-acquired respiratory tract infe-ctions in China:Results from the CARTIPS Antimicrobial Surve-illance Program[J]. J Glob Antimicrob Resist, 2016, 5: 36-41. DOI:10.1016/j.jgar.2016.03.002 |




