2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism (Food Safety), Ministry of Agriculture, Beijing 100083
介孔二氧化硅纳米粒子(Mesoporous silica nanoparticles,MSNs)是一种表面多孔的无机纳米粒子。其具有很多特性,包括:粒子和孔的大小、粒子形状、多孔结构的可调节性,可进行表面修饰,良好的生物相容性,以及大的表面积和孔体积。MSNs有多种形状,可为圆形、杆形或蠕虫形等,但圆形的MSNs目前研究的相对较广[1]。可通过在MSNs介孔中封装上不同的客体分子。例如,信号分子、药物和基因,表面修饰上不同的基团来实现各种功能的转变。
功能核酸(Functional nucleic acids,FNA)可以分为天然和人工合成两种,天然的FNA包括核酶、核糖开关等,人工合成FNA包括适配体、核酶、脱氧核酶及G-四链体等[2]。FNA不仅具有催化功能,也能够与配体结合[3],其中适配体可特异性的识别非靶核酸物质[4]。
功能核酸检测技术是目前主流的检测技术之一,而纳米材料与功能核酸相结合的检测技术更是检测技术发展的一个趋势。现在,MSNs与FNA相结合主要应用在医药领域作为抗癌药物或基因的递送载体实现药物或基因的靶向运输。而将这两者制成生物传感器运用到检测技术领域主要是通过在MSNs表面修饰上化学基团,将FNA共价结合或静电吸附在MSNs表面作为封端剂,FNA在外界物理、化学等因素的刺激下改变构像或从MSNs表面脱离实现介孔中客体分子的可控释放,进一步转化为荧光信号、电信号等达到检测的目的。
目前,有相关综述论述了MSN的合成、药物递送、基因递送及其相关应用等[1, 5]。本文将着重综述近几年来介孔二氧化硅介导的功能核酸检测技术,旨为进一步探究该项检测技术奠定基础。
1 介孔二氧化硅纳米粒子的基本属性、制备及应用 1.1 介孔二氧化硅纳米粒子的基本属性MSNs是一种表面多孔的无机纳米粒子,其粒径在几十到几百纳米之间不等,孔洞直径一般为几纳米。MSNs粒子以及介孔表面均带有负电荷[6]。Keasberry等[5]在以MSNs为载体向细胞内递送核酸时指出,可以通过将一些带正电荷的末端基团修饰在MSNs表面或在其表面结合带有末端氨基的小分子或脂类使MSNs表面带正电荷,易于与带负电荷的核酸结合。除此之外,MSNs还具有良好的表面化学特性,这使得其表面易于被聚阳离子修饰[7],如在MSNs表面修饰碳硅烷树突状分子作为寡核苷酸链的递送载体[8]。另外,MSNs表面也易被官能化,如形成MSN-NH2、MSN-COOH[9]、MSN-N3和MSN-Cl[10]等。
1.2 介孔二氧化硅纳米粒子的制备方法 1.2.1 一般介孔二氧化硅纳米粒子的制备制备MSNs的方法有多种,目前应用最广泛的是溶胶-凝胶法[1, 9, 11]。Wu等[12]指出,性能优良的MSNs应具有以下几个特性:一是能够稳定悬浮于溶液中;二是具有可控的孔径;三是粒径均匀且孔洞体积大。一个MSNs悬浮良好的溶液可以应用到光谱技术中并大大减少光的散射,通过精确调节孔径大小可选择性的装载生物聚合物。此外,控制MSNs颗粒大小可以精确定量需要携带的货物,而孔体积大(即纳米粒子壁相对较薄)的MSNs则更易被生物降解。另外,他们还介绍了用改进Stober法来合成MSNs,这种方法制备的MSNs具有统一的粒子大小。Tang等[1]在概述MSNs的制备方法时指出MSNs的孔洞的大小和形状主要取决于表面活性剂模板的性质;可以通过调整二氧化硅前体物质和表面活性剂的比例,使用碱性催化剂控制pH值以及添加共溶剂和有机溶胀剂来调控粒子的大小和形状,粒子可为圆形、棒形和蠕虫形等。对于制备中空MSNs,一般为双模板法;同时,Tang等也提出了如软模板法、自我模板法等新的MSNs的制备方法。
1.2.2 磁性介孔二氧化硅复合纳米粒子的制备2017年,Bazmandegan-Shamili等[13]制备了具有较强的吸附能力的磁性介孔二氧化硅(Magnetic mesoporous silica,MMS)并将其应用于杀虫剂的固相微萃取。在制备MMS过程中,作者在Fe3O4表面覆盖一层SiO2,以此复合粒子作为核,再利用传统的溶胶-凝胶法在核的外面包裹一层介孔二氧化硅就形成了所需的MMS。Lu等[14]采用湿化学法合成氨化的磁性介孔二氧化硅纳米粒子,此纳米粒子的中心同样是Fe3O4。在合成过程中需要利用正硅酸乙酯(Tetraethyl orthosilicate,TEOS)和3-氨基丙基三乙氧基硅烷(3-aminopropyltrie-thoxysialane,APTES)的水解和缩合。Snoussi等[15]则借助于超声波化学合成了一种核/双壳结构的纳米复合材料:Fe3O4@NH2-mesoporous silica@Polypyrrole/Pd。
虽然不同的研究者在制备MSNs的过程中存在一定的差异,但都离不开表面活性剂作为结构导向剂,且大多数为CTAB,少数为P123。此外,TEOS常被用来作为MSNs的前体物质。
1.3 介孔二氧化硅纳米粒子常见的应用领域目前,MSNs已经被科学家应用到各个方面。其中,应用最广泛的则是将MCM-41,MCM-48和SBA-15这3种类型的MSNs作为药物和基因的递送载体,研发可控药物释放系统,用于疾病治疗[1]。2012年,Li等[6]在研究纳米机器用于癌症治疗时,研制出了一种光控介孔药物释放系统,这种系统是基于偶氮苯修饰的核酸控制。偶氮苯的异构化可以诱导互补DNA杂交和去杂交,从而控制MSNs孔门的开闭;在可见光波长下,偶氮苯为反式结构,DNA杂交,孔处于关闭状态,药物被截留,紫外光波长下,偶氮苯为顺式结构,DNA去杂交,孔打开,药物得到释放。Bertucci等[16]利用MSNs联合递送替莫唑胺(抗癌药物)和抗miR221的聚精氨酸-肽核酸(R8-PNA)诱导耐药神经胶质瘤细胞的凋亡,R8-PNA通过静电相互作用固定在MSNs表面。另外,Li等[17]将连接有咪唑树枝大分子的介孔二氧化硅纳米粒子用于阿霉素和生存素shRNA表达质粒的共同递送,协同治疗癌症。Li等[18]则利用叶酸功能化的磁性介孔二氧化硅纳米粒子实现药物和核酸的共递送以增强抗肿瘤功效。该纳米复合粒子具有叶酸受体靶向和磁性靶向的双靶向功能,通过叶酸受体介导的途径进入细胞,能够同时递送阿霉素和VEGF shRNA。
此外,Zhang等[19]用聚乙烯亚胺修饰MSNs表面,使其表面氨基化,通过静电吸引将pDNA固定在MSNs表面从而实现基因的递送用于疾病治疗。Chen等[9]使用DNA作为一种基于生物分子的质子响应帽系统用于MSNs,设计出了一种PH刺激智能响应性门控释放机制。Pu等[20]构建出了第一个基于MSNs和DNA的键盘锁系统,基于逻辑控制,他们使用DNA链置换来触发包埋在MSNs孔中的客体分子的释放。也有研究者利用核酸适配体封盖的MSNs构建了一种新型、简便及免标记的肌红蛋白定量检测方法,检出限为1.1 nmol/L,低于临床医学诊断临界值(5 nmol/L)[21]。
2 介孔二氧化硅纳米粒子上修饰功能核酸的方法各种功能核酸与MSNs的结合方式也存在差异。如:C四联体(具有胞嘧啶碱基序列的四链DNA结构)通过酰胺键与MSNs进行连接[9],单链DNA也可以通过酰胺键等共价键固定在MSNs表面[11, 22]。Li等[17]先用氰酰对MSNs进行表面修饰,然后将带有氨基的单链DNA(ssDNA)与氰酰基结合,通过酰胺键将ssDNA固定在MSNs表面。Li等[6]对MSNs在水溶液中吸附DNA的机理进行研究时发现,DNA与硅表面结合的驱动力主要有3部分:一是静电屏蔽效应;二是脱水作用;三是分子间氢键,并且DNA是单层吸附于MSNs的表面。此外,增加盐的浓度和降低PH值可以促进DNA吸附在MSNs表面。另外,也可以通过静电吸附作用将寡核苷酸链固定在MSNs表面[23-24]。
3 介孔二氧化硅-功能核酸荧光生物传感器在将MSNs和FNA结合运用到荧光生物传感器的过程中,大部分科学家偏向于利用FNA作为封端剂,将荧光剂封装在介孔中,当靶物质出现时,可与MSNs表面的FNA结合使孔打开释放出荧光剂,通过测定溶液的荧光强度进一步确定靶物质的含量。Climent等[23]利用MSNs介导的功能核酸检测技术实现了对支原体的检测。他们将MCM-41作为载体,用3-氨丙基三乙氧基硅烷(APTES)对其进行表面修饰,因氨丙基在中性水中带有部分正电荷,带有负电荷的寡核苷酸链可以与其发生相互作用从而固定在MCM-41表面使孔处于关闭状态,将若丹明B荧光染料截留在孔内。当支原体基因组DNA出现时,寡核苷酸链与其互补配对,从MCM-41表面脱离,孔打开,若丹明B染料得以释放。通过测定溶液的荧光强度实现对于支原体基因组的定量检测。该检测技术与聚合酶链式反应(Polymerase chain reaction,PCR)具有相似的选择性,但更简单、高效、成本更低,可避免PCR信号放大过程中由于错误复制而导致对结果的干扰。Wang等[25]首次制备出了表面连接有序核酸聚集体(Orderly nucleic acid aggregates,ONAAs)的MSNs(ONAAs-PCMSN),并基于利用ONAAs-PCMSN的非破坏性扩增策略开发出了用于miRNA检测和活细胞中荧光亮点的原位成像技术。该检测方法可以通过荧光共振能量转移(Fluorescence resonance energy transfer,FRET)有效地将信号放大(图 1)。该方法测得的荧光强度与miRNA浓度的对数具有很好的线性关系,检测线低,特异性高,有好的可重复性。这也为特异核酸序列的检测提供了一个新的检测方法。Borsa等[26]通过二氧化硅磁纳米颗粒-MSN/寡核苷酸缀合物联用来检测血液样品中的金黄色葡萄球菌。此外,Chen等[27]首次利用点击化学(即Cu(Ⅰ)催化炔-叠氮环加成反应)技术将含有凝血酶适配体的双链DNA(dsDNA)固定在装载了荧光剂FITC的MSNs表面,设计了一种刺激响应性荧光生物传感器用于血清中凝血酶的检测。这种利用点击化学反应的加盖过程几乎实现了FITC的零泄漏。
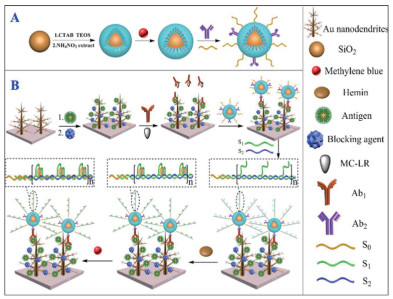
4 介孔二氧化硅-功能核酸电化学生物传感器在介孔二氧化硅介导的功能核酸电化学生物传感器的应用中,虽然检测方法有所不同,但研究者基本都采用具有电活性的亚甲基蓝(Methylene blue,MB)作为信号分子来监测被检物质的浓度变化。如Liu等[28]基于G-四链体DNA功能化的MSNs和亚甲基蓝作为信号分子开发了电化学生物传感器测定DNA甲基转移酶活性。其中G-四链体DNA作为锁控制MB的释放。DNA甲基转移酶含量越多、活性越高,释放的MB信号分子越多;信号分子的含量可转化为相应的电流信号进行显示。该方法具有选择性高、方便、成本低以及快速等优点,除可用于检测DNA甲基转移酶的活性外也可用于筛选DNA甲基转移酶抑制剂。Gan等[29]设计了一种基于G-四链体/氯高铁血红素功能化的并嵌入MB的MSN的多重放大无酶电化学免疫传感器用于检测微囊藻毒素-LR(MC-LR)。随着溶液中MC-LR浓度的升高,电化学信号逐渐降低(图 2)。该方法的检测限是0.3 ng/L,相较于Zhao等[30]的检测方法灵敏度有所提高但设计更加复杂。
2017年,Wang等[31]利用富含胸腺嘧啶(T)的ssDNA来封盖MSNs制成电化学传感器用于检测谷胱甘肽(GSH)。其中,固定在MSNs表面的ssDNA在加入Hg2+之后通过T-Hg2+-T错配形成双链结构的DNA/T-Hg2+-T复合物将电活性的MB封在介孔中,当靶物质GSH出现时,通过竞争性位移反应形成GSH-Hg2+,双链结构DNA转变为单链,孔打开,释放MB,利用正十二烷醇修饰的SPE电极转变为电流信号,以此来检测GSH的含量变化。
5 介孔二氧化硅-功能核酸化学发光生物传感器对于介孔二氧化硅-功能核酸生物传感器,化学发光生物传感器的制备研究较少,而可视化生物传感器还未见报道。2016年,Chen等[32]设计了基于刺激响应MSNs的化学发光生物传感器用于可卡因的检测。研究者将可卡因核酸适配体作为封端剂,葡萄糖作为客体分子封装在MSNs介孔中,当靶物质可卡因出现时与适配体结合,适配体从单链结构转变为茎状结构,孔打开,葡萄糖分子释放出来,在葡萄糖氧化酶作用下与溶液中溶解的O2反应生成H2O2,H2O2进一步与溶液中鲁米诺发生氧化反应实现化学发光。根据化学发光的信号强弱来判断可卡因的含量。该传感器检测限为1.43 μM,相较于之前报道过的一些方法,该方法具有更高的灵敏度。
6 介孔二氧化硅-金属纳米粒子功能核酸生物传感器目前,有很多科学家将金属纳米粒子应用到介孔二氧化硅-功能核酸生物传感器中作为封端材料或催化剂等。Chen等[11]设计出了一种PH驱动的响应控制释放DNA纳米开关,其中一条DNA链与Au-NPs相结合,作为MSNs封端剂,控制孔中货物分子的释放。碱性条件下,两条DNA链形成双螺旋结构,孔被Au-NPs堵住,货物分子被截留在孔内,酸性环境下,结合有Au-NPs的ssDNA形成四链体结构,DNA双螺旋结构解开,孔打开,货物分子得到释放。此纳米开关具有良好的封闭效果,且该系统灵敏、快速、能够实现精确控制。Wang等[24]利用铂纳米粒子(Pt-NPs)可催化无色的四甲基联苯胺(Tetramethylbenzidine,TMB)氧化生成蓝色的氧化TMB(oxTMB)的特性,将Pt-NPs与MSNs相结合来无标记检测DNA。Pt-NPs在MSNs的中心通过介孔与外界相通,寡核苷酸链通过静电作用吸附在Pt@mSiO2表面将孔堵住,当靶DNA链出现时,Pt@mSiO2表面的寡核苷酸链与其互补配对从Pt@mSiO2表面脱离,孔打开,溶液中的TMB进入孔中与Pt-NPs接触触发氧化反应变为蓝色的oxTMB。可以通过检测溶液中oxTMB的吸光度来实现靶DNA的定量测定。该方法免去了标记DNA过程的繁琐,并具有良好的单碱基对错配鉴别能力,但是线性范围较窄,而且为了使Pt@mSiO2表面吸附的核酸链饱和,核酸的浓度必须达到Pt@mSiO2浓度的60倍左右。
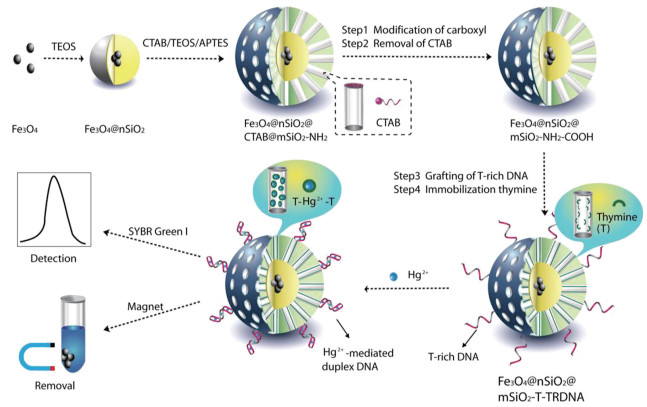
7 磁性介孔二氧化硅-功能核酸生物传感器在磁性介孔二氧化硅纳米粒子(MMSNs)的制备中,一般采用Fe3O4作为磁性核形成复合纳米粒子。利用MMSNs的强趋磁性可以实现该纳米粒子简便、快速的富集。例如,He等[33]将Fe3O4外面包裹一层无孔二氧化硅作为核,再在其外面覆盖一层介孔二氧化硅形成一种核-壳结构的纳米粒子(Fe3O4@nSiO2@mSiO2),然后在这种纳米粒子外表面修饰上富含T核苷酸的ssDNA,孔内表面修饰上大量T核苷酸形成复合纳米粒子(Fe3O4@nSiO2@mSiO2-T-TRDNA)。研究者利用该种纳米粒子构建荧光生物传感器以检测和去除样品中的Hg2+(图 3)。
Xiong等[34]设计合成了一种适配体固定化的磁性介孔二氧化硅-金纳米粒子复合物用于人类血清中胰岛素的检测。通过固定在孔内Au-NPs上的适配体来捕获胰岛素,将胰岛素包裹在介孔中,然后利用纳米复合物的强趋磁性进行富集,分离出胰岛素,再利用基质辅助激光解吸/电离飞行时间质谱(Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)来检测溶液中胰岛素的含量。该方法成功降低了复杂介质中背景信号的干扰,并且具有较高的选择性和灵敏度。最近,Lu等[14]基于MMSNs设计出了一种可控响应性释放MB+的电化学传感器用于检测端粒酶活性并可用于筛选端粒酶抑制剂。该MMSNs也属于核-壳结构,磁核/介孔壳即Fe3O4/SiO2。利用MMSNs磁性可以更加方便的将制备的DNA-MMSN-MB+从溶液中分离出来同时减少在分离过程中使DNA分子门打开造成相应背景信号增强对结果的干扰,提高灵敏度。
8 介孔二氧化硅-功能核酸介导的药物靶向运输MSNs作为药物递送载体用于靶向治疗癌症的研究有很多,介孔二氧化硅-功能核酸介导的药物靶向运输同样得到了许多研究者的关注。Wang等[35]通过静电吸引力将ssDNA固定在经叶酸(FA)修饰的MSNs表面作为门控,将阿霉素(DOX,抗癌药物)封装在介孔中。由于癌细胞表面的FA受体过表达,DNA/MSN/FA/DOX系统可以经过FA受体介导进入癌细胞实现药物的靶向运输,但需要与ATP介导的滚环扩增合成物经FA受体介导共同进入癌细胞,才能实现药物释放。隗予荣等[36]设计了一种靶向可控释放的药物运载体系,该体系中将介孔二氧化硅包裹在稀土上转换纳米颗粒表面,再在介孔二氧化硅表面修饰上可特异性识别人急性淋巴白血病细胞上PTK7蛋白的核酸适配体用于药物的靶向运输。Pascual等[37]将MUC1适配体(MUC1是一种乳腺癌细胞表面过表达的蛋白质)作为MSNs介孔的封盖物质实现药物的可控释放,该研究者用APTES修饰MSNs使其表面带有氨丙基,通过静电相互作用与氢键连接从而将适配体固定在MSNs表面,在适配体的作用下实现药物的靶向运输。
9 介孔二氧化硅用于生物成像研究者将MSNs应用于生物成像时,会在MSNs中参杂特定的金属离子,利用金属离子的荧光特性或核磁共振效应等实现生物成像。Freitas等[38]设计了一种表面修饰有铜离子的多功能介孔二氧化硅。他们在MSNs表面修饰了APTES,然后利用酰胺键进一步将DTPA螯合物固定在MSNs上,铜离子通过与DTPA反应引入到MSNs表面。铜离子可在核反应堆中活化为放射性同位素64Cu为进一步将该复合纳米粒子用于PET成像提供了基础。Hsiao等[39]同样设计出了一种多功能MSNs,可在靶向癌症治疗中实现双核磁共振和荧光成像,用于成像指导性癌症治疗,研究者将镧系金属离子中的Eu3+和Gd3+参杂在MSNs中。其中,Eu3+可以发射强烈的红色荧光;而Gd3+具有顺磁性官能团,高磁通量和较长的自旋晶格弛豫时间(T1),这使得Gd3+能够核磁共振成像增强光致荧光的敏感性进一步增强Eu3+的红色发光。
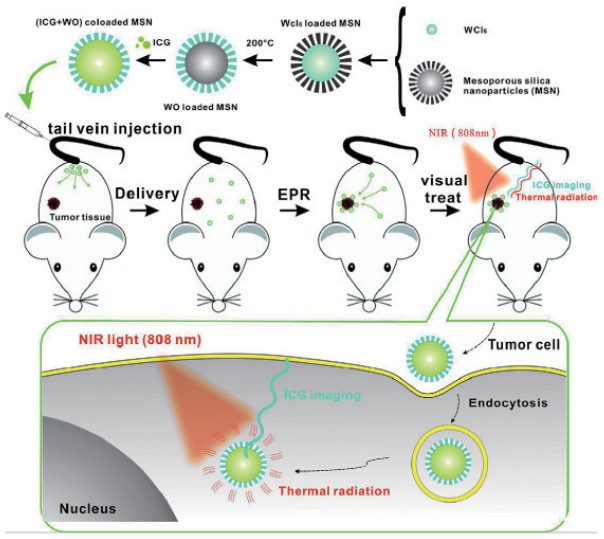
此外,Shi等[40]以MSNs为结构框架构建了一种新型近红外荧光纳米粒子(mSiO2@Gd3Ga5O12:Cr3+,Nd3+)作为多功能纳米平台用于多模式成像和癌症治疗。在该纳米粒子中含有Cr3+、Nd3+和Gd3+,其中,Cr3+在254 nm紫外光激发下在近红外Ⅰ区745 nm处可持续发光,Nd3+在808 nm波长激发下在近红外Ⅱ区1 067 nm处可持续发光,并且Gd3+具有优异的核磁共振效应,从而实现了多模式成像。此外该纳米粒子的持续发光信噪比高,在体内成像持续时间长。Wang等[41]将ICG和W18O49共同封装在MSNs中构建了一种直径约200 nm的荧光载体(ICG+WO)@MSN)并将该载体用于光热疗法的实时跟踪(图 4)。用波长为808 nm的近红外光照射该粒子时,(ICG+WO)@MSN中的WO可将吸收的近红外光转化为热杀死癌细胞,而ICG可发射荧光有利于体内实时成像。(ICG+WO)@MSN的构建用于ICG成像引导的光热疗法,可以精确杀死癌细胞,为癌症治疗提供了良好平台。另外,An等[42]也成功设计出了一种具有靶向化学-光热疗法和肿瘤PA/CT成像双功能的新型纳米探针(GMS/DOX@SLB-FA)。
10 介孔二氧化硅的基因毒性已有研究者对MSNs的基因毒性进行研究,发现MSNs具有一定的毒性,但与其他无机纳米材料相比较,毒性相对较低。Quanan等[43]在对MSNs在人胚肾293(HEK293)细胞中的遗传毒性进行探究时发现:MSNs可以抑制或促进某些人类基因的表达,其中一些基因可能在细胞转移中起重要作用;MSNs会引起HEK293细胞形态学改变和DNA降解;但在EGFR或KRAS基因中并未发现突变,实验中所用染色体3、7和17也并未检测到变化,HER2,EGFR或TERC基因也没有出现扩增。这些研究结果表明暴露于MSNs对正常人类细胞具有遗传毒性,特别是会改变一些重要基因的表达,这种遗传毒性可能会导致细胞功能障碍和某些良性疾病,但未证明暴露于MSNs会诱导与致癌相关的严重基因毒性,例如DNA突变或染色体变化等。2016年,Niu等[44]研究了MSNs的形状依赖性基因毒性并建立了一个纳米粒子高通量筛选方法。他们得出球形和杆形MSNs都具有细胞毒性,且杆形相较于球形作用效果更严重。此外,与修复精通型细胞相比,MSNs在修复缺陷型细胞中会诱导产生氧化损伤和更大数量的有丝分裂的染色体畸变。
11 展望目前,MSNs与FNAs相结合应用的方式主要是两种,一是FNA固定在被修饰MSNs表面作为封端剂,控制孔中客体分子进出;二是FNA作为客体封装在MSN的介孔中进行应用。其中,将FNA固定在MSNs表面进行应用的研究相对较多,而第二种方式相对较少,这可能会成为未来的研究趋势。虽然,MSNs具有一定的毒性,但相较于其他的纳米材料毒性相对较低,如果能较好地控制MSNs的量,毒性还是能够得到很好的控制。但要利用MSNs在人体内发挥作用,其毒性还有待进一步研究。此外,目前MSNs与FNA相结合的应用研究基本都存在线性范围较窄等缺点,这是今后开发介孔二氧化硅介导的功能核酸检测技术需要克服的关键问题之一。
Li等[6]科学家研制出的光控释放系统具有很多显著的优点,首先运动和构像容易控制;此外对于远程控制能力,辐照是一个准确且简单的方法;并且它是一种清洁能源,可以反复快速应用而不会损失效率。Knežević等[45]对大孔介孔二氧化硅(LPMSN)在生物分子运输方面的应用进行了总结,说道LPMSN对于大的药物分子,蛋白质或核酸进入或离开孔隙系统的传质、扩散和渗透能力比较小孔隙的MSNs更有优势;并且在大分子吸附解吸过程中不会改变LPMSN的活性。
MSNs合成灵活、可规模化生产且成本低,是未来工业化生产的一个独特优势[1]。此外,利用磁性介孔二氧化硅的趋磁性能够实现被检物质简便、快速的富集和分离。在实际应用中,如果能将大孔磁性介孔二氧化硅与功能核酸相结合设计一种光响应性可控释放系统用于生物传感器的构建,并用来检测生物活性物质、环境污染物等,相信这种介孔二氧化硅介导的功能核酸检测技术会有很广泛的应用前景。
| [1] |
Tang F, Li L, Chen D. Mesoporous silica nanoparticles:synthesis, biocompatibility and drug delivery[J]. Adv Mater, 2012, 43(20): 1504-1534. |
| [2] |
Zhan S, Wu Y, Wang L, et al. A mini-review on functional nucleic acids-based heavy metal ion detection[J]. Biosensors & Bioelectronics, 2016, 86: 353-368. |
| [3] |
Liu J, Cao Z, Lu Y. Functional nucleic acid sensors[J]. Chem Rev, 2009, 109(5): 1948-1998. DOI:10.1021/cr030183i |
| [4] |
Abi A, Mohammadpour Z, Zuo X, et al. Nucleic Acid-based electrochemical nanobiosensors[J]. Biosensors & Bioelectronics, 2018, 102: 479-489. |
| [5] |
Keasberry NA, Yapp CW, Idris A. Mesoporous silica nanoparticles as a carrier platform for intracellular delivery of nucleic acids[J]. Biochemistry, 2017, 82(6): 655-662. |
| [6] |
Li X, Zhang J, Gu H. Study on the adsorption mechanism of dna with mesoporous silica nanoparticles in aqueous solution[J]. Langmuir, 2012, 28(5): 2827-2834. DOI:10.1021/la204443j |
| [7] |
Bhattarai SR, Muthuswamy E, Wani A, et al. Enhanced gene and siRNA delivery by polycation-modified mesoporous silica nanoparticles loaded with chloroquine[J]. Pharmaceutical Research, 2010, 27(12): 2556-2568. DOI:10.1007/s11095-010-0245-0 |
| [8] |
Martínez Á, Fuentespaniagua E, Baeza A, et al. Mesoporous silica nanoparticles decorated with carbosilane dendrons as new non-viral oligonucleotide delivery carriers[J]. Chemistry, 2015, 21(44): 15651-1566. DOI:10.1002/chem.v21.44 |
| [9] |
Chen C, Pu F, Huang Z, et al. Stimuli-responsive controlled-release system using quadruplex DNA-capped silica nanocontainers[J]. Nucleic Acids Res, 2011, 39(4): 1638-1644. DOI:10.1093/nar/gkq893 |
| [10] |
赵应香.基于核酸适配体封堵介孔二氧化硅的ATP响应控制释放研究[D].长沙: 湖南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10532-1014119904.htm
|
| [11] |
Chen L, Di J, Cao C, et al. A pH-driven DNA nanoswitch for responsive controlled release[J]. Chem Commun, 2011, 47(10): 2850-2852. DOI:10.1039/c0cc04765a |
| [12] |
Wu SH, Mou CY, Lin HP. Synthesis of mesoporous silica nanoparticles[J]. Chem Soc Rev, 2013, 42(9): 3862-3875. DOI:10.1039/c3cs35405a |
| [13] |
Bazmandegan-Shamili A, Shabani AMH, Dadfarnia S, et al. Preparation of magnetic mesoporous silica composite for the solid-phase microextraction of diazinon and malathion before their determination by high-performance liquid chromatography[J]. Journal of Separation Science, 2017, 40(8): 1731-1738. DOI:10.1002/jssc.v40.8 |
| [14] |
Lu M. Bioresponsive-controlled release of methylene blue from magnetic mesoporous silica from the electrochemical detection of telomerase activity[J]. Analyst, 2017, 142(18): 3477-3483. DOI:10.1039/C7AN01127J |
| [15] |
Snoussi Y, Bastide S, Abderrabba M, et al. Sonochemical synthesis of Fe3O4@NH2-mesoporous silica@Polypyrrole/Pd:A core/double shell nanocomposite for catalytic applications[J]. Ultrasonics Sonochemistry, 2018, 41: 551-561. DOI:10.1016/j.ultsonch.2017.10.021 |
| [16] |
Bertucci A, Prasetyanto EA, Septiadi D, et al. Combined delivery of temozolomide and anti-miR221 PNA using mesoporous silica nanoparticles induces apoptosis in resistant glioma cells[J]. Small, 2015, 11(42): 5687-5695. DOI:10.1002/smll.v11.42 |
| [17] |
Li Z, Zhang L, Tang C, et al. Co-delivery of doxorubicin and survivin shRNA-expressing plasmid via microenvironment-responsive dendritic mesoporous silica nanoparticles for synergistic cancer therapy[J]. Pharmaceutical Research, 2017, 34(12): 2829-2841. DOI:10.1007/s11095-017-2264-6 |
| [18] |
Li T, Shen X, Geng Y, et al. Folate-functionalized magnetic-mesoporous silica nanoparticles for drug/gene codelivery to potentiate the antitumor efficacy[J]. ACS Appl Mater Interfaces, 2016, 8(22): 13748-13758. DOI:10.1021/acsami.6b02963 |
| [19] |
Zhang X, Zhang J, Quan G, et al. The Serum-resistant transfection evaluation and long-term stability of gene delivery dry powder based on mesoporous silica nanoparticles and polyethyleneimine by freezing-drying[J]. AAPS PharmSciTech, 2017, 18(5): 1536-1543. DOI:10.1208/s12249-016-0617-9 |
| [20] |
Pu F, Liu Z, Ren J, et al. Nucleic acid-mesoporous silica nanoparticle conjugates for keypad lock security operation[J]. Chem Commun, 2013, 49(23): 2305-2307. DOI:10.1039/c3cc38883b |
| [21] |
高蕾, 王青, 羊小海, 等. 核酸适配体封盖的介孔二氧化硅纳米颗粒用于肌红蛋白的检测[J]. 高等学校化学学报, 2017, 38(2): 187-192. |
| [22] |
Castillo RR, Baeza A, Vallet-Regí M. Recent applications of the combination of mesoporous silica nanoparticles with nucleic acids:development of bioresponsive devices, carriers and sensors[J]. Biomaterials Science, 2017, 5(3): 353-377. DOI:10.1039/C6BM00872K |
| [23] |
Climent E, Marcos MD, Rurack K. Selective, highly sensitive, and rapid detection of genomic DNA by using gated materials:Mycoplasma detection[J]. Angew Chem Int Ed Engl, 2013, 52(34): 8938-8942. DOI:10.1002/anie.201302954 |
| [24] |
Wang Z, Yang X, Feng J, et al. Label-free detection of DNA by combining gated mesoporous silica and catalytic signal amplification of platinum nanoparticles[J]. Analyst, 2014, 139(23): 6088. DOI:10.1039/C4AN01539H |
| [25] |
Wang Y, Yu Z, Zhang Z, et al. Orderly nucleic acid aggregates by electrostatic self-assembly in single cells for miRNA detection and visualizing[J]. Analyst, 2016, 141(10): 2861-2864. DOI:10.1039/C6AN00160B |
| [26] |
Borsa BA, Tuna BG, Hernandez FJ, et al. Staphylococcus aureus, detection in blood samples by silica nanoparticle-oligonucleotides conjugates[J]. Biosensors & Bioelectronics, 2016, 86: 27-32. |
| [27] |
Chen Z, Sun M, Luo F, et al. Stimulus-response click chemistry based aptamer-functionalized mesoporous silica nanoparticles for fluorescence detection of thrombin[J]. Talanta, 2018, 178: 563-568. DOI:10.1016/j.talanta.2017.09.043 |
| [28] |
Liu P, Pang J, Yin H, et al. G-quadruplex functionalized nano mesoporous silica for assay of the DNA methyltransferase activity[J]. Anal Chim Acta, 2015, 879: 34-40. DOI:10.1016/j.aca.2015.04.023 |
| [29] |
Gan C, Wang B, Huang J, et al. Multiple amplified enzyme-free electrochemical immunosensor based on G-quadruplex/hemin functionalized mesoporous silica with redox-active intercalators for microcystin-LR detection[J]. Biosens Bioelectron, 2017, 98: 126-133. DOI:10.1016/j.bios.2017.06.038 |
| [30] |
Zhao C, Hu R, Liu T, et al. A non-enzymatic electrochemical immunosensor for microcystin-LR rapid detection based on Ag@ MSN nanoparticles[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2016, 490: 336-342. |
| [31] |
Wang Y, Jiang L, Chu L, et al. Electrochemical detection of glutathione by using thymine-rich DNA-gated switch functionalized mesoporous silica nanoparticles[J]. Biosensors & Bioelectronics, 2017, 87: 459-465. |
| [32] |
Chen Z, Tan Y, Xu K, et al. Stimulus-response mesoporous silica nanoparticle-based chemiluminescence biosensor for cocaine determination[J]. Biosens Bioelectron, 2016, 75: 8-14. DOI:10.1016/j.bios.2015.08.006 |
| [33] |
He D, He X, Wang K, et al. Regenerable multifunctional mesoporous silica nanocomposites for simultaneous detection and removal of mercury (Ⅱ)[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2013, 29(19): 5896-5904. |
| [34] |
Xiong Y, Deng C, Zhang X, et al. Designed synthesis of aptamer-immobilized magnetic mesoporous silica/Au nanocomposites for highly selective enrichment and detection of insulin[J]. ACS Appl Mater Interfaces, 2015, 7(16): 8451-8456. DOI:10.1021/acsami.5b00515 |
| [35] |
Wang Y, Shang X, Liu J, et al. ATP mediated rolling circle amplification and opening DNA-gate for drug delivery to cell[J]. Talanta, 2018, 176: 652-658. DOI:10.1016/j.talanta.2017.08.087 |
| [36] |
隗予荣.基于核酸适配体功能化的近红外光响应性纳米材料在生物医学及分析检测中的应用[D].武汉: 湖北大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10512-1016169769.htm
|
| [37] |
Pascual L, Cerqueira-Coutinho C, García-Fernández A, et al. MUC1 aptamer-capped mesoporous silica nanoparticles for controlled drug delivery and radio-imaging applications[J]. Nanomedicine, 2017, 13(8): 2495-2505. DOI:10.1016/j.nano.2017.08.006 |
| [38] |
Freitas LBDO, Corgosinho LDM, Santos VMD, et al. Multifunctional mesoporous silica nanoparticles for cancer-targeted, controlled drug delivery and imaging[J]. Microporous & Mesoporous Materials, 2017, 242: 271-283. |
| [39] |
Hsiao SM, Peng BY, Tseng YS, et al. Preparation and characterization of multifunctional mesoporous silica nanoparticles for dual magnetic resonance and fluorescence imaging in targeted cancer therapy[J]. Microporous and Mesoporous Materials, 2017, 250: 210-220. DOI:10.1016/j.micromeso.2017.04.050 |
| [40] |
Shi J, Sun X, Zheng S, et al. A new near-infrared persistent luminescence nanoparticle as a multifunctional nanoplatform for multimodal imaging and cancer therapy[J]. Biomaterials, 2018, 152: 15-23. DOI:10.1016/j.biomaterials.2017.10.032 |
| [41] |
Wang HQ, Hu PF, Zheng Y, et al. Construction of ICG encapsulated W18O49@MSN as a fluorescence carrier for real-time tracked photothermal therapy[J]. Mater Sci Eng C Mater Biol Appl, 2017, 80: 102-109. DOI:10.1016/j.msec.2017.05.131 |
| [42] |
An J, Yang XQ, Cheng K, et al. In vivo CT/Photoacoustic imaging and NIR-Triggered chemo-photothermal combined therapy based on a gold nanostar, mesoporous silica and thermo-sensitive liposomes composited nanoprobe[J]. ACS Appl Mater Interfaces, 2017, 9: 41748-41759. DOI:10.1021/acsami.7b15296 |
| [43] |
Quanan Z, Hanfeng X, Shengqin Z, et al. Genotoxicity of mesoporous silica nanoparticles in human embryonic kidney 293 cells[J]. Drug Testing & Analysis, 2015, 7(9): 787-796. |
| [44] |
Niu M, Zhong H, Shao H, et al. Shape-dependent genotoxicity of mesoporous silica nanoparticles and cellular mechanisms[J]. Journal of Nanoscience and Nanotechnology, 2016, 16(3): 2313-2318. DOI:10.1166/jnn.2016.10928 |
| [45] |
Knežević NŽ, Durand JO. Large pore mesoporous silica nanomaterials for application in delivery of biomolecules[J]. Nanoscale, 2015, 7(6): 2199-2209. DOI:10.1039/C4NR06114D |