2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism (Food Safety), Ministry of Agriculture, Beijing 100083
金属-有机骨架(Metal-organic frameworks,MOFs)也称为配位聚合物(Coordination polymers,CPs)或配位网络,是一类由金属离子或簇与有机连接基团在相对温和的条件下自组装形成的混合材料[1-3]。胺、羧酸、硝酸盐、磺酸盐和磷酸盐等是最为常用的有机配体,其中,阴离子羧酸盐与金属离子的结合性更高[4]。MOFs属于一种新兴的结晶分子功能材料,特性包括:超高的孔隙率,优异的结构可调性,巨大的内部表面积,结构多样性,高的化学稳定性和强大的热稳定性等[5-6]。MOFs的结构可以从一维(1D)、二维(2D)到三维(3D)[7]。MOFs中的有机配体通常含有共轭π-电子系统,允许通过π-π相互作用与单链DNA(ssDNA)结合,这种机制类似于氧化石墨烯(GO)和生物分子之间的相互作用[8]。如今,MOFs已被广泛应用于化工、医药等各个领域,其中包括均相催化、气体储存与分离、作为药物递送载体、生物成像等。
功能核酸(Functional nucleic acids,FNA)分为天然和人工合成两种,其中,天然FNA包括核酶、核糖开关等,人工合成FNA包括脱氧核酶、核酶、适配体及G-四链体等[9]。FNA除了具有催化功能外,也能够与适配体进行有效结合[10],其中适配体可特异性的识别非靶核酸物质[11]。
到目前为止,虽然已有将MOFs应用于检测领域的相关报道,但将MOFs与FNA相结合的检测技术却相对较少,且主要集中在荧光生物传感器和电化学生物传感器这两大类,其他类型的生物传感器包括比色生物传感器,化学发光传感器等鲜有报道。在荧光生物传感器中,研究者主要应用MOFs的荧光淬灭特性;而在电化学生物传感器中,MOFs一般具有固定FNA和信号放大双重功能。基于MOFs如此多优异的特性和FNA灵活多样的特点,MOFs介导的功能核酸检测技术具有广阔的应用潜能。
1 金属-有机骨架的基本特性及特点 1.1 金属-有机骨架的基本属性MOFs作为一种配位聚合物具有很多特点。其大小从几十纳米到几十微米不等,结构多样,可以从1D、2D到3D,但大部分为2D和3D结构,形状也可为链状、片状、网络状、立方体、双锥形等[7, 12-14]。许多MOFs对染料标记的单链DNA(ssDNA)表现出明显的荧光淬灭能力[2]。Wang等[15]在将染料标记的DNA与MOFs进行结合并对MOFs的荧光淬灭特性进行研究时指出,在适配体传感器中,纳米MOFs(Nanoscale MOFs,NMOFs)的表面性质对带电染料分子的荧光变化起着重要的作用。带正电荷和负电荷的NMOFs对于带负电荷的羧基荧光素(FAM)标记的双链DNA(dsDNA)表现出完全相反的荧光猝灭性质;相反,它们对带正电荷的四甲基若丹明标记的dsDNA的影响可以忽略。MOFs的修饰能力较强,Lei等[6]指出,MOFs需要一些额外的功能才能实现特定的分子识别,并总结了3种不同的方法来更容易地修饰MOFs并赋予它们特定的功能:一是修改MOFs框架中的特定有机配体或掺杂金属离子;二是后合成修饰,其中具有官能团的有机配体可用于随后的化学嫁接;三是将功能性分子和纳米粒子包埋在框架内,其复合物具有用于分子识别和信号转导的多功能性。最近,Mejia-Ariza等[16]开发了利用共价或非共价相互作用对MOFs(MIL-88A)进行表面官能化的通用方法。其中一种是通过使用3-叠氮基-7-羟基香豆素在炔基官能化的MIL-88A表面利用CuI催化的点击反应实现共价官能化得到了香豆素-MIL-88A。而另一种则是利用链霉亲和素介导的非共价链霉亲和素-生物素相互作用将生物素-肽核酸(Peptide nucleic acids,PNA)与生物素官能化的MIL-88A连接起来,这使得ssDNA可以与PNA形成双链从而选择性的结合到MOFs表面。
除了上述性质外,部分MOFs还具有发光特性[17]和催化性[18]。2011年,Ranocchiari等[18]对MOFs催化剂类型进行了归类:骨架上具有活性位点的催化剂、包封了活性物质的催化剂以及通过后合成修饰连接了活性位点的催化剂。对于MOFs的热稳定性和化学稳定性,Colombo等[19]使用新的三角形三吡唑分子1,3,5-三(1H-吡唑-4-基)苯(H3BTP)与过渡金属醋酸盐构建了M3(BTP)2型(M=Co,Ni,Cu,Zn)微孔骨架,均表现出优异的热稳定性和化学稳定性,尤其是Ni3(BTP)2。
1.2 金属-有机骨架的制备方法制备MOFs的方法有多种,目前最常用的制备方法是溶剂热或水热法。但大多数研究者在制备过程中一般都将二甲基甲酰胺(DMF)作为形成MOFs反应的基质,用对苯二甲酸或氨基对苯二甲酸与含有金属离子的硝酸盐或氯化盐作为反应底物来制备所需要的MOFs或氨基官能化MOFs。
Morris等[20]利用溶剂热法合成了粒径大小分别为540、19和14 nm的3种MOFs(UiO-66-N3),并通过在合成过程中改变乙酸的量来调整晶体的大小。Mondal等[21]利用镧系金属元素镝通过水热法构建了一种Dy-MOFs。2016年,Giménez-Marquès等[22]综述了对NMOFs的合成方法。他们指出在水/溶剂热合成法中控制NMOFs尺寸大小的首要参数是温度、反应时间、pH和化学计量比。利用微波和超声波辅助合成可以加快MOFs的结晶过程。而机械化学法是一种自上而下的方法,包括将大型的MOFs晶体合成后再机械研磨。在微乳液合成法中,反胶束技术使用了微乳液,使两种不混溶的液体在乳化剂或表面活性剂的存在下成为热力学稳定的分散体;这些微乳液可被看作是纳米结构的化学反应器,将MOFs的合成限制在纳米尺度内。
1.3 金属-有机骨架的晶体结构表征研究者在进行实验之前,一般先对MOFs的晶体结构进行分析。MOFs的化学组成可通过X射线能量色散谱和X射线光电子能谱进行测定[23]。通过单晶X射线衍射分析可以精确计算MOFs的晶格参数得到其晶体结构,再辅助粉末X射线衍射、紫外-可见吸收光谱以及荧光光谱等进一步确定其空间及化学结构;红外光谱(Infrared spectrum,IR)可用来分析MOFs中含有的官能团,热重分析则用于测定其稳定性[24]。胶体稳定性可以通过动态光散射进行测量[20]。BET表面积分析则可确定MOFs的表面面积和孔径分布情况[25]。
1.4 金属-有机骨架常见的应用领域MOFs目前的应用较为广泛:催化、气体储存与分离、作为药物递送载体及生物成像等。
1.4.1 金属-有机骨架用于生物成像现在,MOFs也逐渐被研究者用于生物成像以实现癌症治疗,但基本都采用纳米级MOFs。Wang等[2]指出如果MOFs晶体的尺寸缩小到纳米尺寸,形成的NMOFs可以用作体内成像剂。而且,NMOFs本质上是可生物降解的,使得在预定任务完成后可以快速降解和清除。Foucault-Collet等[26]构建了一个独特的近红外光谱(Near-infrared spectroscopy,NIR)发射纳米级MOFs(nano-Yb-PVDC-3),其中掺入了高密度的镧系阳离子Yb3+和衍生自亚苯基的敏化剂亚苯基亚乙烯基二羧酸酯(PVDC)。nano-Yb-PVDC-3可以进入到活细胞中进行NIR成像。Cai等[27]在NMOFs(MIL-100(Fe))表面结合透明质酸(HA),孔中加载有机荧光燃料吲哚菁绿(ICG),构建了一个多功能纳米平台MOF@HA@ICG NPs用于多模式成像引导的癌症治疗(图 1)。这种MOF@HA@ICG NPs显示出低细胞毒性,高ICG负载能力和靶向MCF-7细胞/移植肿瘤的能力。使用MOF@HA@ICG NPs实现了荧光成像、光声成像和T2加权核磁共振成像(Magnetic resonance imaging,MRI)共同引导的光热疗法,在体外能显著诱导MCF-7细胞死亡并能有效地抑制体内MCF-7肿瘤的生长。Ryu等[28]则将试卤灵和若丹明6G分别加载在NMOFs:MOF-801和UiO-67的孔中用于FL83B(人类肝细胞)和HepG2(人类肝细胞癌)的荧光成像。Wang等[23]在NMOFs(UiO-66)存在下,通过多组分Passerini反应将NIR染料蓝色素(Cy),邻硝基苯甲醛和1,6-二异氰酸酯聚合得到MOFs@聚合物复合材料UiO-66@CyP。这种方法将其他含有功能性羧基,醛和异氰基的治疗剂或成像剂整合到MOFs上,使得UiO-66@CyP复合物具有强烈的NIR吸收,可用于体外和体内的荧光成像引导的光热癌治疗。最近,Qin等[29]利用两性羧酸盐配体制备和结构鉴定了两种水稳定性的MOFs,这两种MOFs都表现出良好的r1弛豫率和T1加权成像,能够实现高分辨率MRI,且对人体的胚胎肾细胞系毒性非常低。
1.4.2 金属-有机骨架用于催化、气体吸附、药物递送等Han等[7]选择路易斯酸性的Ln3+和Zn2+离子作为连接体,4,4'-联吡啶-N,N'-二氧化物(dpdo)作为较长的间隔配体构建了MOFs,并选择多元磷钨酸作为客体,经一步水热法组装了5种从1D到3D的稳健的POM/MOFs材料用于催化DNA模型双(对硝基苯基)磷酸(BNPP)中磷酸二酯键的水解,并且这5种聚合物都具有高的催化活性。Li等[30]采用“一锅法”自组装制备了两种具有过氧化物酶催化活性的卟啉@MOFs型(CuTNPP@MOF,MnTNPP@MOF)催化剂,这种催化剂加强了单独CuTNPP的催化性能,并使原本不具有催化性能的MnTNPP具有一定的催化能力。Zhang等[17]用一种新的配体1,4-二(1-甲基-5,6-二羧基苯并咪唑)苯(H4L)制备了两种MOFs,这两种MOFs均具有强烈的CO2吸附能力,可用于捕获填埋气中CO2分子。Ghorbani-Kalhor等[31]设计了一种磁性MOFs纳米复合材料用于婴幼儿食品中Cd2+、Zn2+和Pb2+的测定。He等[32]将顺铂前体药物通过封装加载到NMOFs(UiO)孔洞中,而沉默RNA(silencing RNA,siRNA)则通过与NMOFs表面上的金属位点配位固定到MOFs上形成siRNA/UiO-Cis复合物实现药物和基因的共递送。
2 金属-有机骨架结合功能核酸的方法及其介导的生物传感器将FNA固定在MOFs上的方式有共价相互作用和非共价相互作用。Guo等[8]将MOFs(MIL-101)用于DNA高灵敏检测时使MIL-101通过π-π堆积和静电相互作用与探针DNA相结合。在MOFs结构中,有机配体通常都含有共轭π-电子系统,可以利用π-π相互作用与ssDNA进行结合,这种结合机制类似于GO和生物分子之间的相互作用。Zhu等[33]则将荧光探针DNA通过核酸碱基与MOFs(Cu(H2dtoa))之间的疏水相互作用以及π-π堆积相互作用固定在MOFs上。Zhang等[34]利用氨基官能化的MOFs作为DNA检测的荧光传感平台时,ssDNA除了通过π-π堆积与MOFs进行连接外,ssDNA中的芳香族核苷酸碱基还能够与NH2之间形成氢键,此氢键的形成加强了该传感平台对碱基错配的DNA序列的识别能力,提高了检测灵敏度。Mondal等[21]在对MOFs与小牛胸腺DNA(CT-DNA)之间的相互作用进行探究时指出,该MOFs配体结构中的芳香环与CT-DNA沟的螺旋圈匹配紧密,并且在Tris-HCl缓冲液中,配体的芳香环通过在DNA沟槽中与DNA形成范德瓦尔斯接触或氢键而发生相互作用。Song等[35]基于MOFs(MnDMS)纳米片结合杂交链式反应(Hybridization chain reaction,HCR)进行细胞间DNA和microRNA(miRNA)传感时指出,核酸碱基与MnDMS表面之间的范德华力将发卡探针DNA固定在纳米片上。此外,还可以通过点击化学的方法将ssDNA固定在MOFs表面[12]。2014年,Morris等[20]在用寡核苷酸对MOFs的表面进行共价官能化时,利用点击反应将二苄基环辛炔官能化的DNA固定在修饰有叠氮化物的MOFs表面形成第一个MOF纳米颗粒-核酸缀合物。
2.1 金属-有机骨架功能核酸荧光生物传感器由于大多数的MOFs具有内在荧光淬灭能力,能将DNA探针上标记的荧光基团淬灭[13]。因此,许多研究者将MOFs与功能核酸结合运用到荧光生物传感器中对DNA、RNA以及其他生物分子或金属离子等进行荧光信号检测。2013年,Zhu等[33]首次提出将MOFs作为传感平台用于生物分子的检测,其检测原理如图 2所示。研究者以Cu2+为配位中心,以二硫代草酰胺为桥连配体合成了一种2D结构的MOFs(N,N’-双(2-羟乙基)二硫代草酰胺铜(Ⅱ)[Cu(H2dtoa)]),并将连接有FAM的荧光探针DNA通过核酸碱基与Cu(H2dtoa)之间的疏水相互作用和π-堆积相互作用固定在MOFs上,由于Cu(H2dtoa)的光致电子转移(Photoelectron transfer,PET)荧光淬灭机制使FAM的荧光淬灭;当靶物质出现时与MOFs上的探针DNA结合,使得连接有FAM的探针DNA从MOFs上脱离到溶液中,FAM恢复荧光,通过测定溶液的荧光强度实现对HIV DNA和凝血酶(TB)高灵敏和高选择性的定量测定。同年,其团队Wei等[5]同样将连接有H5N1抗原的荧光探针DNA(FAM-DNA)与MOFs(H2dtoaCu)非共价结合构建了荧光生物传感器用于人类血清中H5N1抗体的检测,此种方法避免了荧光恢复过程中ssDNA的杂交步骤,简化了实验过程,检测限为1.6×10-9 mol/L。随后,其团队Chen等[1]又将基于MOFs(H2dtoaCu)的荧光生物传感器用于dsDNA特异性序列的识别。Ye等[13]也基于该荧光传感原理首次将MOFs用于多重DNA检测。Tian等[36]基于Fe-MOFs纳米棒(MIL-88B)构建传感平台用于DNA检测时,首次证明了金属中心和有机连接体的协同作用可以大大提高整体荧光传感特性。且在实验过程中,整个“混合和检测”过程只需要4 min,检测限是10 pmol/L,几乎是同类传感器中最低的。
在2014年,Guo等[8]将MOFs(MIL-101)作为荧光各向异性(Fluorescence anisotropy,FA)扩增平台,根据荧光基团的各向异性与其旋转弛豫时间成正比,而旋转弛豫时间又取决于其分子体积;较小的分子旋转得更快,FA值较小,而较大的分子由于它们限制旋转运动而具有较大的FA值的原理,通过FA值的变化来对HIV-1 DNA进行检测。其中,MIL-101与含有FAM的探针DNA结合,FAM的FA值较大;当靶标DNA出现时,与探针DNA杂交从MIL-101上脱离,FAM的FA值变小。Fang等[37]同样将MIL-101作为低背景信号和FA放大平台,设计了双模式DNA“INHIBIT”逻辑门,用于Hg2+和I-检测,检测限分别为10.5、8.66 nmol/L和13、17.4 nmol/L,相对较低。
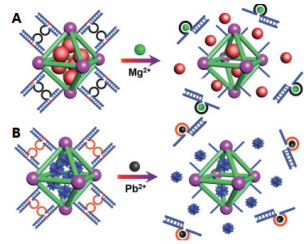
最近,Weng等[38]使用Eu3+@Bio-MOF-1和FAM标记的ssDNA(FAM-ssDNA)构建了一种新的荧光传感器用于检测Cu2+和S2-。通过调节Eu3+@Bio-MOF-1和FAM-ssDNA的比例,获得了一种FAM和Eu3+能同时发光的杂化材料。当Cu2+存在时可以使FAM发光淬灭,而Eu3+的发光强度增强,随后加入S2-,随着S2-浓度的升高,Eu3+的发光强度又逐渐降低。Chen等[12]构建了两种刺激响应性核酸功能化NMOFs作为抗癌药物或荧光探针的载体。其中,第二种是金属离子(Mg2+或Pb2+)响应的NMOFs系统,该系统原理如图 3所示。金属离子依赖性脱氧核酶作用的DNA序列作为锁定单元,在各自的金属离子存在的情况下,核酸锁定单元被解离,导致加载的货物分子释放。当NMOFs孔内加载的是荧光染料时,可通过溶液的荧光强度来判断金属离子的含量,这为金属离子的检测提供了一种通用方法。此外,可在NMOFs系统中通过同时加载不同的荧光染料和分别使用不同金属离子解锁的核酸作为锁定单元,从而实现金属离子的多重分析。He等[39]则基于MOFs(MIL-101)平台,将定向酶促水解增进的荧光扩增策略用于TB和氧四环素的定量测定。不久前,Xie等[40]基于两性羧酸盐配体设计了一种3D水溶性Cu-MOFs作为传感平台,并分别采用FAM和5(6)-羧基罗丹明,三乙基铵盐两种荧光基团标记的ssDNA作为探针,实现了对登革热和塞卡病毒RNA序列的同步荧光检测,检测限分别为184和121 pmol/L。
2.2 金属-有机骨架功能核酸电化学生物传感器研究者在将MOFs与功能核酸结合运用到电化学生物传感器中来检测各种物质时,为了提高灵敏度,往往会采用一些信号放大策略来增强检测信号,例如:级联催化反应、切口酶辅助信号扩增、循环链置换DNA聚合(Circular strand-replacement DNA polymerization,CSRP)等。
2015年,Ling等[41]采用一锅封装法将铁-卟啉封装在MOFs中形成FeTCPP@MOF使MOFs具有催化性,在H2O2存在下可催化邻苯二胺(O-PD)转化为2,2'-二氨基偶氮苯(O-PDox);并利用发卡DNA的变构设计了一种电化学传感器用于DNA的检测,检测范围跨越了6个数量级,检测限为0.48 fmol/L。在同年,Ling和其团队[42]又利用链酶亲和素功能化的锆-卟啉MOFs(PCN-222@SA)和三螺旋分子开关的电催化作用用于信号转导研发了一种电化学DNA传感器。如图 4,该传感器中加入了核酸外切酶Ⅲ用于DNA循环扩增,检测范围又增大了一个数量级,检测限降低到0.29 fmol/L。
2017年,Zhou等[43]基于葡萄糖氧化酶(GOx)驱动的级联催化放大,用Pt纳米粒子(PtNPs)、CEA适配体(Apt2)、氯高铁血红素和GOx功能化的Cu-MOFs(Pt@CuMOFs-hGq-GOx),提出了一种灵敏度高的蛋白质(癌胚抗原,CEA作为测试模型)电化学阻抗传感器。在实验中加载到Pt@CuMOFs上的Apt2与氯高铁血红素结合形成具有类过氧化物酶活性的氯高铁血红素@G-四链体(hGq)。通过靶标CEA和CEA适配体(Apt1(固定在电极上)和Apt2)的三明治式反应,将获得的Pt@CuMOFs-hGq-GOx作为信号转导探针(STPs)捕获到修饰电极界面。当引入3,3-二氨基联苯胺(DAB)和葡萄糖时,GOx引发级联反应,催化葡萄糖氧化,原位生成H2O2;同时,Pt@CuMOFs和hGq作为协同过氧化物催化剂,伴随着DAB的显著氧化过程和非导电不溶性沉淀物(IPs)的形成,促进了生成的H2O2的分解。因此,所得到的传感界面中的电子转移被有效阻止,并且电化学阻抗信号(EIS)被有效放大。通过EIS来定量测定CEA的含量。Yang等[44]利用一个改进的靶标触发的切口酶信号放大策略作为信号增强剂并结合PtPd纳米粒子修饰的电活性钴金属有机骨架(Co-MOFs/PtPdNPs)作为氧化还原介体获得了一个灵敏的电化学TB生物传感器,线性范围是1 pmol/L-30 nmol/L,检测限为0.32 pmol/L。Xu等[45]将富含G(鸟嘌呤核糖核苷酸)的铅离子特异性适配体作为Pb2+识别探针,用AgPt纳米颗粒装饰的MOFs(MIL-101(Fe))作为电化学探针和信号增强剂构建了无酶、无标记的电化学传感器来检测Pb2+含量。在此之前,其团队Shen等[46-47]也分别基于Cu-MOFs和Ce-MOFs构建了两种电化学传感器来检测脂多糖的含量,检测限分别为0.33和3.3 fg/mL。
Chen等[48]首次把携带不同金属离子(Pb2+和Cd2+)的纳米规模的MOFs作为电化学信标用于卡那霉素和氯霉素这两种抗生素的同时检测,检测限分别为0.16 pmol/L和0.19 pmol/L,比酶联免疫吸附测定(Enzyme linked immune sorbent assay,ELISA)低了3-4个数量级。可以通过改变系统中的适配体,将该检测方法扩展到同时检测食品安全中的其他小型有机污染物。随后,Chen及其团队[49]又基于NMOFs并结合了CSRP靶标触发的放大策略同时检测氯霉素和氧四环素。
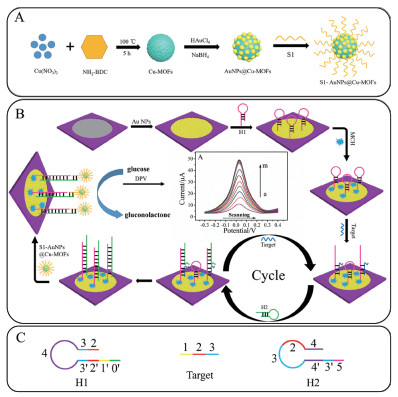
最近,Zhang等[50]将金纳米粒子@Fe-MIL-88NH2(AuNPs@Fe-MOFs)作为平台,铂纳米颗粒负载的二氧化铈(CeO2)官能化的羧基富勒烯(c-C60)(c-C60/CeO2/PtNPs)用于信号扩增设计了一种电化学传感器实现了人类血清中CYP2C19*2等位基因的精确定量测定。Wang等[51]通过链置换反应和MOFs构建了一种超灵敏电化学纸基生物传感器测miRNA含量,该纸基传感器的构建和检测原理如图 5。他们则在Cu-MOFs的表面修饰了一层AuNPs,然后又固定了DNA链(S1)形成S1-AuNPs@Cu-MOFs复合物。其中AuNPs@Cu-MOFs不仅用作固定S1的纳米载体,还用作信号报告的电活性材料,而且还作为催化剂用于氧化葡萄糖,实现信号的放大。该方法的检测限是0.35 fmol/L,具有较高的灵敏度。
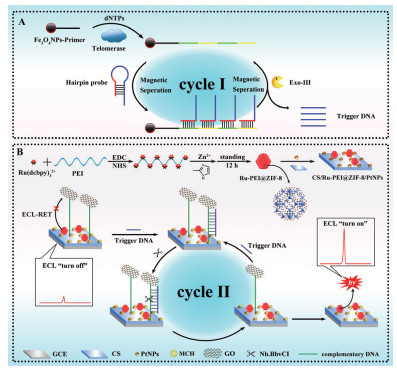
2.3 金属-有机骨架功能核酸其他类型生物传感器目前,大部分研究者都将金属-有机骨架与功能核酸应用到荧光和电化学生物传感器中,而在其他类型生物传感器中的应用相对较少。2015年,Liu等[52]将AuNPs通过静电自组装固定在MOFs(Fe-MIL-88)表面形成Au@Fe-MIL-88复合物开发出一种无标记的比色法来检测DNA。AuNPs的加入加强了单独Fe-MIL-88的过氧化物酶催化活性。其检测原理是探针DNA通过π-堆叠相互作用覆盖在Au@Fe-MIL-88表面,降低Au@Fe-MIL-88的催化活性,当靶标ssDNA出现时与探针DNA杂交使探针DNA从Au@Fe-MIL-88表面脱离,从而使Au@Fe-MIL-88催化活性恢复,在H2O2存在的情况下可以催化无色的3,3’,5,5’-四甲基联苯胺(TMB)氧化形成蓝色的氧化TMB(oxTMB),通过测定溶液在650 nm处的吸光度来定量测定靶标ssDNA,检测限为11.4 nmol/L。最近,Xiong等[53]提出了一种超灵敏的“off-on”电化学发光(Electrochemiluminescence,ECL)生物传感器(图 6)。该传感器通过使用自增强钌聚乙烯亚胺(Ru-PEI)复合物掺杂的沸石咪唑酯骨架-8(Ru-PEI @ ZIF-8)作为有效ECL指示剂并借助酶辅助的DNA循环扩增策略来测定端粒酶活性,并可用于抗癌药物的筛选。
3 展望目前研究者将MOFs与FNA相结合应用到检测技术领域主要集中在荧光生物传感器和电化学生物传感器这两大类,对其他类型生物传感器的研究相对较少,这可成为未来研究的一个方向。另外,基于MOFs-FNA荧光生物传感器的检测原理比较单一,基本都利用MOFs的荧光淬灭特性实现对靶物质的定量检测,未来的研究可以拓宽MOFs-FNA荧光生物传感器的广度。
MOFs作为一种无机-有机复合材料,科学家若想将其应用于生物体内,需要对MOFs在体内的毒性进行充分的研究。2013年,Baati等[54]首次报道了对具有不同结构、组成和疏水性的三种高剂量的多孔Fe(Ⅲ)NMOFs在体内的急性毒性进行评价,结果表示所有研究参数(血清学、酶学和组织学等)都与低急性毒性效应一致,且表明NMOFs可被肝脏和脾脏迅速隔离,然后进一步生物降解为NMOFs的组成成分Fe和羧酸配体,最后在尿或粪便中无需代谢直接排除。随后,Tamames等[55]指出,MOFs在体内的生物分布和清除取决于其性质。因此,他们使用J774和HeLa这两种细胞系研究了一系列基准MOFs纳米颗粒的细胞毒性,发现这些NMOFs均表现出低细胞毒性,与其它商业化的纳米颗粒系统相当,其中铁羧酸盐类NMOFs相较于锌咪唑类毒性更低,对J774细胞的毒性值要高于HeLa细胞。虽然根据这些研究成果不能说明MOFs的毒性低,其在体内的毒性还需进一步探究,但部分NMOFs已被研究者确定为低毒;并且NMOFs已被研究者应用于生物成像领域。因此,可以借鉴MOFs-FNA生物传感器的检测原理,将具备生物成像功能的NMOFs与FNA进行有效结合,并应用于生物体内的实时监测。
此外,MOFs生产效率高,省时省力,可大批量生产,在实际应用中具有突出优势[56]。MOFs介导的功能核酸检测技术具有广阔的应用前景。
| [1] |
Chen L, Zheng H, Zhu X, et al. Metal-organic frameworks-based biosensor for sequence-specific recognition of double-stranded DNA[J]. Analyst, 2013, 138(12): 3490-3493. DOI:10.1039/c3an00426k |
| [2] |
Wang HS. Metal-organic frameworks for biosensing and bioimaging applications[J]. Coordination Chemistry Reviews, 2017, 349: 139-155. DOI:10.1016/j.ccr.2017.08.015 |
| [3] |
Yang B, Shen M, Liu J, et al. Post-synthetic modification nanoscale metal-organic frameworks for targeted drug delivery in cancer cells[J]. Pharmaceutical research, 2017, 34(11): 2440-2450. DOI:10.1007/s11095-017-2253-9 |
| [4] |
谷娜, 李恒, 赵远. 金属有机骨架材料固定生物大分子的研究进展[J]. 中国材料进展, 2017, 36(11): 833-838. |
| [5] |
Wei X, Zheng L, Luo F, et al. Fluorescence biosensor for the H55N1 antibody based on a metal-organic framework platform[J]. Journal of Materials Chemistry B, 2013, 1(13): 1812-1817. DOI:10.1039/c3tb00501a |
| [6] |
Lei J, Qian R, Ling P, et al. Design and sensing applications of metal-organic framework composites[J]. TrAC Trends in Anal Chem, 2014, 58: 71-78. DOI:10.1016/j.trac.2014.02.012 |
| [7] |
Han Q, Zhang L, et al. Metal-organic frameworks with phosphotung-state incorporated for hydrolytic cleavage of a DNA-model phosphodiester[J]. Inorg Chem, 2012, 51(9): 5118-5127. DOI:10.1021/ic202685e |
| [8] |
Guo JF, Li CM, Hu XL, et al. Metal-organic framework MIL-101 enhanced fluorescence anisotropy for sensitive detection of DNA[J]. RSC Advances, 2014, 4(18): 9379-9382. DOI:10.1039/C3RA47389A |
| [9] |
Zhan S, Wu Y, Wang L, et al. A mini-review on functional nucleic acids-based heavy metal ion detection[J]. Biosensors & Bioelectronics, 2016, 86: 353-368. |
| [10] |
Liu J, Cao Z, Lu Y. Functional nucleic acid sensors[J]. Chem Rev, 2009, 109(5): 1948-98. DOI:10.1021/cr030183i |
| [11] |
Abi A, Mohammadpour Z, Zuo X, et al. Nucleic Acid-Based Electrochemical Nanobiosensors[J]. Biosensors & Bioelectronics, 2017, 102: 479. |
| [12] |
Chen WH, Yu X, Cecconello A, et al. Stimuli-responsive nucleic acid-functionalized metal-organic framework nanoparticles using pH-and metal-ion-dependent DNAzymes as locks[J]. Chem Sci, 2017, 8(8): 5769-5780. DOI:10.1039/C7SC01765K |
| [13] |
Ye T, Liu Y, Luo M, et al. Metal-organic framework-based molecular beacons for multiplexed DNA detection by synchronous fluorescence analysis[J]. Analyst, 2014, 139(7): 1721-1725. DOI:10.1039/c3an02077k |
| [14] |
Zhao HQ, Qiu GH, Liang Z, et al. A zinc (Ⅱ) -based two-dimensional MOF for sensitive and selective sensing of HIV-1 ds-DNA sequences[J]. Anal Chim Acta, 2016, 922: 55-63. DOI:10.1016/j.aca.2016.03.054 |
| [15] |
Wang HS, Liu HL, Wang K, et al. Insight into the unique fluorescence quenching property of metal-organic frameworks upon DNA binding[J]. Anal Chem, 2017, 89(21): 11366-11371. DOI:10.1021/acs.analchem.7b02256 |
| [16] |
Mejia-Ariza R, Rosselli J, Breukers C, et al. DNA detection by flow cytometry using PNA-modified metal-organic framework particles[J]. Chemistry, 2017, 23(17): 4180-4186. DOI:10.1002/chem.v23.17 |
| [17] |
Zhang F, et al. Two metal-organic frameworks based on a flexible benzimidazole carboxylic acid ligand:selective gas sorption and luminescence[J]. Dalton Trans, 2017, 46(43): 15118-15123. DOI:10.1039/C7DT03363J |
| [18] |
Ranocchiari M, van Bokhoven JA. Catalysis by metal-organic frameworks:fundamentals and opportunities[J]. Physical Chemistry Chemical Physics, 2011, 13(14): 6388-6396. DOI:10.1039/c0cp02394a |
| [19] |
Colombo V, Galli S, Choi HJ, et al. High thermal and chemical stability in pyrazolate-bridged metal-organic frameworks with exposed metal sites[J]. Chem Sci, 2011, 2(7): 1311-1319. DOI:10.1039/c1sc00136a |
| [20] |
Morris W, Briley WE, Auyeung E, et al. Nucleic acid-metal organic framework (MOF) nanoparticle conjugates[J]. J Am Chem Soc, 2014, 136(20): 7261-7264. DOI:10.1021/ja503215w |
| [21] |
Mondal B, Sen B, Zangrando E, et al. A dysprosium-based metal-organic framework:Synthesis, characterization, crystal structure and interaction with calf thymus-DNA and bovine serum albumin[J]. J Chem Sci, 2014, 126(4): 1115-1124. DOI:10.1007/s12039-014-0627-7 |
| [22] |
Giménez-Marqués M, Hidalgo T, Serre C, et al. Nanostructured metal-organic frameworks and their bio-related applications[J]. Coordination Chemistry Reviews, 2016, 307: 342-360. DOI:10.1016/j.ccr.2015.08.008 |
| [23] |
Wang W, Wang L, Liu S, et al. Metal-organic frameworks@polymer composites containing cyanines for near-infrared fluorescence imaging and photothermal tumor therapy[J]. Bioconjugate Chemistry, 2017, 28(11): 2784-2793. DOI:10.1021/acs.bioconjchem.7b00508 |
| [24] |
Xiao YF, Wang TT, Zeng H. Synthesis, crystal structure and optical property of two zinc metal organic frameworks constructed from isonicotinic acid[J]. Journal of Molecular Structure, 2014, 1074: 330-338. DOI:10.1016/j.molstruc.2014.06.018 |
| [25] |
Chowdhuri AR, Laha D, Chandra S, et al. Synthesis of multifunctional upconversion NMOFs for targeted antitumor drug delivery and imaging in triple negative breast cancer cells[J]. Chemical Engineering Journal, 2017, 319: 200-211. DOI:10.1016/j.cej.2017.03.008 |
| [26] |
Foucault-Collet A, Gogick KA, et al. Lanthanide near infrared ima-ging in living cells with Yb3+ nano metal organic frameworks[J]. Proc Natl Acad Sci, 2013, 110(43): 17199-17204. DOI:10.1073/pnas.1305910110 |
| [27] |
Cai W, et al. Engineering phototheranostic nanoscale metal-organic frameworks for multimodal imaging-guided cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9(3): 2040-2051. DOI:10.1021/acsami.6b11579 |
| [28] |
Ryu UJ, Yoo J, Kwon W, et al. Tailoring nanocrystalline metal-organic frameworks as fluorescent dye carriers for bioimaging[J]. Inorg Chem, 2017, 56(21): 12859-12865. DOI:10.1021/acs.inorgchem.7b01684 |
| [29] |
Qin L, Sun ZY, Cheng K, et al. Zwitterionic manganese and gadolinium metal-organic frameworks as efficient contrast agents for in vivo magnetic resonance imaging[J]. ACS Appl Mater Interfaces, 2017, 9(47): 41378-41386. DOI:10.1021/acsami.7b09608 |
| [30] |
Li C, Qiu W, Long W, et al. Synthesis of porphyrin@ MOFs type catalysts through "one-pot" self-assembly[J]. Journal of Molecular Catalysis A:Chemical, 2014, 393: 166-170. DOI:10.1016/j.molcata.2014.05.023 |
| [31] |
Ghorbani-Kalhor E, Hosseinzadeh-Khanmiri R, et al. Synthesis and application of a novel magnetic metal-organic framework nanocom-posite for determination of Cd, Pb, and Zn in baby food samples[J]. Canadian Journal of Chemistry, 2014, 93(5): 518-525. |
| [32] |
He C, Lu K, Liu D, et al. Nanoscale metal-organic frameworks for the co-delivery of cisplatin and pooled siRNAs to enhance therapeutic efficacy in drug-resistant ovarian cancer cells[J]. J Am Chem Soc, 2014, 136(14): 5181-5184. DOI:10.1021/ja4098862 |
| [33] |
Zhu X, Zheng H, Wei X, et al. Metal-organic framework (MOF) :a novel sensing platform for biomolecules[J]. Chem Commun, 2013, 49(13): 1276-1278. DOI:10.1039/c2cc36661d |
| [34] |
Zhang HT, Zhang JW, Huang G, et al. An amine-functionalized metal-organic framework as a sensing platform for DNA detection[J]. Chem Commun, 2014, 50(81): 12069-12072. DOI:10.1039/C4CC05571C |
| [35] |
Song WJ. Intracellular DNA and microRNA sensing based on metal-organic framework nanosheets with enzyme-free signal amplification[J]. Talanta, 2017, 170: 74-80. DOI:10.1016/j.talanta.2017.02.040 |
| [36] |
Tian J, Liu Q, Shi J, et al. Rapid, sensitive, and selective fluorescent DNA detection using iron-based metal-organic framework nanorods:Synergies of the metal center and organic linker[J]. Biosens Bioelectron, 2015, 71: 1-6. DOI:10.1016/j.bios.2015.04.009 |
| [37] |
Fang JM, Gao PF, Hu XL, et al. A dual model logic gate for mercury and iodide ions sensing based on metal-organic framework MIL-101[J]. RSC Advances, 2014, 4(70): 37349-37352. DOI:10.1039/C4RA04500A |
| [38] |
Weng H, Yan B. A Eu (Ⅲ) doped metal-organic framework conjugated with fluorescein-labeled single-stranded DNA for detection of Cu (Ⅱ) and sulfide[J]. Anal Chim Acta, 2017, 988: 89-95. DOI:10.1016/j.aca.2017.07.061 |
| [39] |
He J, Li G, Hu Y. Aptamer-involved fluorescence amplification strategy facilitated by directional enzymatic hydrolysis for bioassays based on a metal-organic framework platform:Highly selective and sensitive determination of thrombin and oxytetracycline[J]. Microchimica Acta, 2017, 184(7): 2365-2373. DOI:10.1007/s00604-017-2263-7 |
| [40] |
Xie BP, Qiu GH, Hu PP, et al. Simultaneous detection of Dengue and Zika virus RNA sequences with a three-dimensional Cu-based zwitterionic metal-organic framework, comparison of single and synchronous fluorescence analysis[J]. Sensors and Actuators B:Chemical, 2018, 254: 1133-1140. DOI:10.1016/j.snb.2017.06.085 |
| [41] |
Ling P, Lei J, Zhang L, et al. Porphyrin-encapsulated metal-organic frameworks as mimetic catalysts for electrochemical DNA sensing via allosteric switch of hairpin DNA[J]. Anal Chem, 2015, 87(7): 3957-3963. DOI:10.1021/acs.analchem.5b00001 |
| [42] |
Ling P, Lei J, Ju H. Porphyrinic metal-organic framework as electrochemical probe for DNA sensing via triple-helix molecular switch[J]. Biosens Bioelectron, 2015, 71: 373-379. DOI:10.1016/j.bios.2015.04.046 |
| [43] |
Zhou X, Guo S, Gao J, et al. Glucose oxidase-initiated cascade catalysis for sensitive impedimetric aptasensor based on metal-organic frameworks functionalized with Pt nanoparticles and hemin/G-quadruplex as mimicking peroxidases[J]. Biosens Bioelectron, 2017, 98: 83-90. DOI:10.1016/j.bios.2017.06.039 |
| [44] |
Yang X, Lv J, Yang Z, et al. A Sensitive electrochemical aptasensor for thrombin detection based on electroactive co-based metal-organic frameworks with target-triggering NESA strategy[J]. Anal Chem, 2017, 89(21): 11636-11640. DOI:10.1021/acs.analchem.7b03056 |
| [45] |
Xu W, Zhou X, et al. Label-free and enzyme-free strategy for sensi-tive electrochemical lead aptasensor by using metal-organic frame-works loaded with AgPt nanoparticles as signal probes and electro-catalytic enhancers[J]. Electrochimica Acta, 2017, 251: 25-31. DOI:10.1016/j.electacta.2017.08.046 |
| [46] |
Shen WJ, Zhuo Y, Chai Y Q, et al. Ce-based metal-organic frameworks and DNAzyme-assisted recycling as dual signal amplifiers for sensitive electrochemical detection of lipopolysaccharide[J]. Biosens Bioelectron, 2016, 83: 287-292. DOI:10.1016/j.bios.2016.04.060 |
| [47] |
Shen WJ, Zhuo Y, Chai YQ, et al. Cu-based metal-organic frameworks as a catalyst to construct a ratiometric electrochemical aptasensor for sensitive lipopolysaccharide detection[J]. Anal Chem, 2015, 87(22): 11345-11352. DOI:10.1021/acs.analchem.5b02694 |
| [48] |
Chen M, Gan N, Zhou Y, et al. A novel aptamer-metal ions-nanoscale MOF based electrochemical biocodes for multiple antibiotics detection and signal amplification[J]. Sensors and Actuators B:Chemical, 2017, 242: 1201-1209. DOI:10.1016/j.snb.2016.08.185 |
| [49] |
Chen M, Gan N, et al. An electrochemical aptasensor for multiplex antibiotics detection using Y-shaped DNA-based metal ions encoded probes with NMOF substrate and CSRP target-triggered amplification strategy[J]. Anal Chim Acta, 2017, 968: 30-39. DOI:10.1016/j.aca.2017.03.024 |
| [50] |
Zhang C, He J, Zhang Y, et al. Cerium dioxide-doped carboxyl fullerene as novel nanoprobe and catalyst in electrochemical biosensor for amperometric detection of the CYP2C19* 2 allele in human serum[J]. Biosens Bioelectron, 2018, 102: 94-100. DOI:10.1016/j.bios.2017.11.014 |
| [51] |
Wang H, Jian Y, Kong Q, et al. Ultrasensitive electrochemical paper-based biosensor for microRNA via strand displacement reaction and metal-organic frameworks[J]. Sensors and Actuators B:Chemical, 2018, 257: 561-569. DOI:10.1016/j.snb.2017.10.188 |
| [52] |
Liu YL, Fu WL, Li CM, et al. Gold nanoparticles immobilized on metal-organic frameworks with enhanced catalytic performance for DNA detection[J]. Anal Chim Acta, 2015, 861: 55-61. DOI:10.1016/j.aca.2014.12.032 |
| [53] |
Xiong C, Liang W, Zheng Y, et al. Ultrasensitive assay for telomerase activity via self-enhanced electrochemiluminescent ruthenium complex doped metal-organic frameworks with high emission efficiency[J]. Anal Chem, 2017, 89(5): 3222-3227. DOI:10.1021/acs.analchem.7b00259 |
| [54] |
Baati T, Njim L, Neffati F, et al. In depth analysis of the in vivo toxicity of nanoparticles of porous iron (Ⅲ) metal-organic frameworks[J]. Chem Sci, 2013, 4(4): 1597-1607. DOI:10.1039/c3sc22116d |
| [55] |
Tamames-Tabar C, Cunha D, Imbuluzqueta E, et al. Cytotoxicity of nanoscaled metal-organic frameworks[J]. Journal of Materials Chemistry B, 2014, 2(3): 262-271. DOI:10.1039/C3TB20832J |
| [56] |
Wu LL, Wang Z, Zhao SN, et al. A Metal-organic framework/DNA hybrid system as a novel fluorescent biosensor for mercury (ii) ion detection[J]. Chemistry, 2016, 22(2): 477-480. DOI:10.1002/chem.201503335 |