2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism (Food Safety), Ministry of Agriculture, Beijing 100083
镁元素是人体内必不可少的矿物质元素之一[1]。它是神经肌肉兴奋性和细胞通透性的重要激活剂。相较与其他二价金属离子,Mg2+在细胞内含量最高,在细胞增殖和凋亡过程中也有很重要作用,Mg2+在临床医学,营养学和生理学中的应用已经引起人们的广泛关注[2-3]。目前发展成熟的仪器检测方法用于检测Mg2+,具有灵敏度高、快速、取样量少等特点。虽然这种方法已经形成了一系列的检测标准,但是仍然存在着仪器设备复杂、价格昂贵等缺点。基于功能核酸的生物传感器,作为一种开发的新型检测技术,具有序列易修饰、特异性高、稳定性高、成本较低和操作简单等优势。
功能核酸是具有特异性识别靶标物质和催化功能的核酸序列。功能核酸按照其组成核酸可分为功能型DNA和功能型RNA,按照其功能可分成能与特定目标相结合的核酸适体、具有催化活性的核酶(RNAzyme)和脱氧核酸(DNAzyme)。由于功能核酸的独特功能,越来越多的研究者将这一特性运用于检测分析的领域。现阶段,DNAzyme是作为Mg2+最主要的功能核酸生物传感器。RNAzyme由于在特异性方面还有待提高,目前还未筛选出适用于检测的Mg2+依赖性RNAzyme。同时比较RNAzyme和DNAzyme,DNAzyme具有容易制备,对于化学降解和酶降解不敏感等优点。DNAzyme的筛选方法是体外筛选,现在还没有体内筛选的Mg2+依赖性DNAzyme[4]。8-17 DNAzyme和10-23 DNAzyme以及它们的变体是研究最多以及应用最广泛的两种DNAzyme。DNAzyme有类似于酶的催化活性[5],在Mg2+的作用下可以对底物DNA链的rA位点切割,DNA链断裂,通过标记荧光基团产生的荧光信号或者是电化学信号的改变对Mg2+或者靶标物质的量进行检测。基于功能核酸的Mg2+生物传感器检测技术已经成功运用于食品和生物医学方面。本文将介绍Mg2+功能核酸介导的生物传感器的研究进展。
1 Mg2+与核酸作用规律及作用方式Mg2+与核酸的结合主要是通过Mg2+与磷酸根和碳基位结合形成金属离子-核酸复合结构[6]。Mg2+与核酸碱基作用有单配位和双配位这两种类型(图 1)。与尿嘧啶和胸腺嘧啶结合是单配位,二者配合方式的Mg2+-O4键长度接近,U1-Mg2+和T1-Mg2+中Mg2+-O4-C的亲和力值分别为140.9和108.9 kcal/mol。与胞嘧啶通过N4和O2的双配位结合最为稳定,亲和力值为187.1 kcal/mol。在腺嘌呤中,Mg2+主要是与N3和N9的双配位,亲和力值为188.5 kcal/mol。而在鸟嘌呤中,结合方式均为双配位[7]。镁离子核酶切割机制主要是RNA底物链通过沃森-克里克(Watson-Crick)方式与酶链结合,并在位于不成对的嘌呤和配对的嘧啶残基之间进行特异性切割[4]。
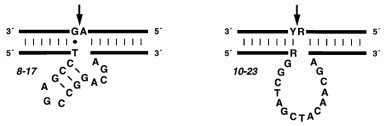
2 Mg2+的DNAzyme筛选方法DNAzyme性质比较稳定,制备方法较为简单,可以通过SELEX体外筛选方法来获得对RNA特异性切割的DNAzyme。SELEX技术的基本原理是体外化学合成一个单链寡核苷酸库,用它与靶物质混合,混合液中存在靶物质与核酸的复合物,洗掉未与靶物质结合的核酸,分离与靶物质结合的核酸分子,以此核酸分子为模板进行PCR扩增,进行下一轮的筛选过程。通过重复的筛选与扩增,一些与靶物质不结合或与靶物质有低亲和力、中亲和力的DNA或RNA分子被洗,具有高亲和力的DNA从随机文库中被分离出来。进行DNA序列的广泛搜索,在寻找最符合标准的分子需要满足以下几个条件:(1)在模拟生理条件下测试多次切割RNA的能力;(2)通过碱基配对识别RNA的能力;(3)改变底物识别区的序列对其他RNA底物泛素化;(4)催化效率达到或者超过RNAzyme不超过50个脱氧核苷酸组成为优[4]。最早通过SELEX体外筛选法筛出的Mg2+ DNAzyme是8-17 DNAzyme和10-23 DNAzyme(图 2)。两者都是有特定碱基构成的催化结构域与两侧底物特异性脱氧核苷酸识别结构域组成,由于分别是第8和第10个循环中第17与第23个克隆产物因此得名8-17与10-23。针对不同靶标序列,通过设计特异性的结合区域,在Mg2+存在情况下实现对靶标的定点切割。
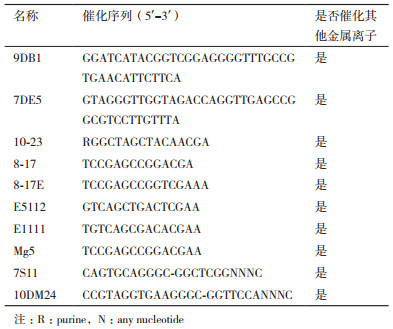
再之后的研究中又筛选出7S11 DNAzyme、Mg5 DNAzyme、9DB1 DNAzyme、10DM24 DNAzyme等Mg2+依赖性的脱氧核酶(表 1)[8]。
Mg2+脱氧核酶介导的生物传感器可以与传统PCR扩增技术相结合,通过扩增技术实现信号的放大作用,可以有效的提高检测限以及准确度。Breaker等[9]通过PCR选择性扩增出DNAzyme,它具有催化切割RNA的功能。Mg2+作为辅因子,探究了不同盐浓度、温度以及识别域碱基种类对于Mg2+依赖性DNAzyme活性影响。Zhou等[10]从含有50个随机核苷酸的DNA文库中,分离并通过两步PCR扩增在血清中的切割序列。经深度测序分析,文库中80%是8-17 DNAzyme的变体17EV1,17EV1是Mg2+依赖性脱氧核酶,能在血清中发生切割反应(图 3)。
4 Mg2+核酸恒温扩增生物传感器检测技术等温核酸扩增技术是一类新型的核酸分析技术,与传统PCR相比,等温核酸扩增技术摆脱了对热循环仪器的需求,并且针对靶标序列的扩增具有耗时短、反应灵敏、特异性高等优点[11]。Mg2+ DNAzyme与恒温扩增结合缩短了检测时长,为实现现场快检奠定了基础。
4.1 滚环扩增技术(Rolling circle amplification,RCA)滚环扩增技术是继变温扩增技术后发展的一种恒温扩增核酸的技术。以环状DNA为模板,通过一个短的DNA引物(与部分环状模板互补),在酶催化下将dNTPs转变成单链DNA,此单链DNA包含成百上千个重复的模板互补片段。Kong等[12]基于RCA的原理,用Mg2+特异性DNAzyme检测人类8-oxoguanine DNA glycosylase(hOGG1)的活性。探针P1被8-oxoG修饰并插入了Mg2+特异性DNAzyme的反义序列,和探针P2部分互补。加入hOGG1后,蛋白质沿dsDNA移动以寻找8-oxoG。当蛋白质遇到氧化损伤的鸟嘌呤时,它与8-oxoG特异性结合,将oxoG从DNA中剪出,并将其消化。通过hOGG1的AP裂解酶将杂交的dsDNA分成两部分,产生较短的互补dsDNA和新的5'磷酸化挂锁探针,加入探针P3后挂锁探针的两个末段的位置接近。在Phi29聚合酶和dNTPs存在下,RCA反应生成大量Mg2+特异性DNAzyme。DNAzyme循环切割底物,F和Q分离,荧光信号显著增强(图 4),此方法检测限为0.001 U/mL。
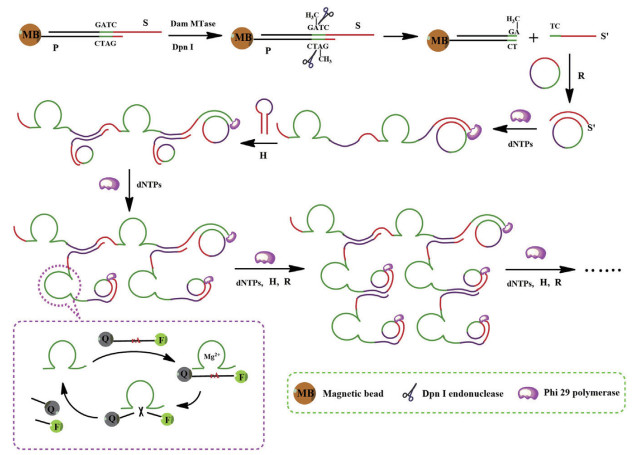
Song等[13]建立了基于分枝滚环扩增(RCA)技术对DNA甲基化进行检测的方法。分枝滚环扩增反应的原理涉及3个主要过程:(1)Dam MTase和DpnⅠ酶联合反应;(2)分枝RCA;(3)荧光检测。在第一步中,DNA链1和2(S和P)的杂交引入50-GATC-30的回文序列,其作为反应底物并被催化为甲基化的双链DNA(50-G-mA-TC-30),由Dam MTase在S-adenosylmethionine的存在下进行。甲基化的双链DNA通过识别位点被Dpn Ⅰ切割。在甲基化/裂解反应之后,新产生的ssDNA作为信号引物与环状模板结合并在DNA聚合酶Klenow片段存在下启动RCA反应,产生长重复圆形探针序列。此外,引入了发夹DNA,其作为分枝RCA的关键元件。环状DNA包含3个功能序列(红色,即识别序列为ssDNA;紫色,RCA的树枝状分支元素的互补序列;和绿色,Mg2+特异性DNAzyme的识别序列)。发夹DNA由茎区组成,包括ssDNA(S’)序列(与环状DNA互补)和环状区域,该环状区域与环状DNA的紫色相同。在这些条件下,发夹的红色序列被阻塞在不活跃的结构中。在ssDNA(S’)和聚合酶/ dNTP存在的情况下,RCA由环状DNA模板触发,导致这个过程重复发生。重复的紫色序列与具有发夹结构的单链环互补。这种杂交导致发夹的打开,释放与环形DNA模板结合的ssDNA的游离序列,触发分枝RCA的发生。环状模板DNA的主要识别区是由Mg2+特异性DNAzyme序列组成的分枝RCA链。最终DNAzyme的大量形成触发底物的切割,通过产生显著放大的荧光信号对Dam MTase进行分析(图 5)。其检测限达到0.36 U/mL,反应时间为2 h。
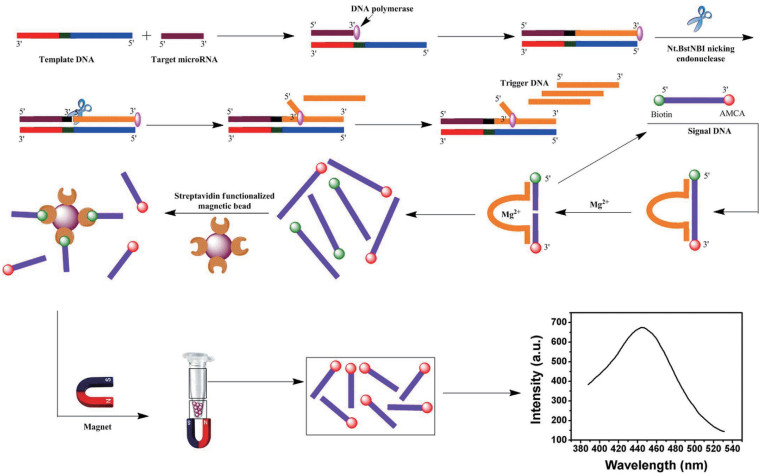
4.2 链置换扩增反应Yin等[14]运用链置换扩增反应检测microRNA。当microRNA-21存在时,用DNA聚合酶诱导的链置换扩增反应可以产生一定量的触发DNA,触发DNA可以与用生物素和AMCA染料标记的信号DNA进一步杂交。引入Mg2+后,触发DNA可形成DNAzyme切割信号DNA。磁珠分离后,含有AMCA染料的DNA片段可以产生荧光信号,其检测限为0.27 fmol/L(图 6)。
4.3 环介导恒温扩增技术环介导恒温扩增(LAMP)是由Notomi等[15]发明的恒温扩增技术。LAMP的原理主要分为扩增启动、循环扩增和延伸循环3个步骤。这项技术的优势是可在等温条件下实现扩增、扩增效率高、对目的序列具有高选择性和扩增产物的检测方法多样。Su等[16]设计了特异性引物来靶向S. scitamineum的Pep1基因,采用单因素实验方法和设计正交实验,筛选了循环介导等温扩增(LAMP)反应体系的3个重要组分Mg2+,引物和Bst DNA聚合酶的最适浓度。建立了适用于S. scitamineum检测的LAMP系统。灵敏度高于常规PCR检测的100倍。这种新型LAMP系统不仅为甘蔗黑穗病监测提供了技术支持,也为其他植物病原体的相似检测技术的发展提供了良好的条件。
5 G4介导的Mg2+功能核酸生物传感器检测技术DNA G-四联体是由单个富含鸟嘌呤的序列或由两个(二聚体)或四个(四聚体)分开的链结合形成的四链DNA结构,为二级结构DNA(图 7)。与其他DNA二级结构相比较,G-四联体的结构特征是它具有更大的方形芳香表面,由4个鸟嘌呤通过氢键形成的[17]。

|
| 图 7 G-四联体的不同结构 |
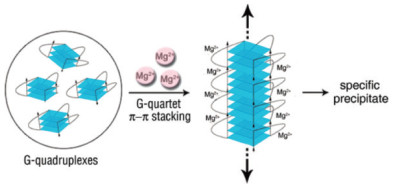
Lin等[17]将Mg2+DNAzyme与G-四联体结合形成复杂空间结构,Mg2+作用下引导G-四联体形成产生输出信号。G-quadruplex DNA的积累是通过G-quartet的π-π堆积形成的,Mg2+的作用是通过Mg-O配位键的形成结合配位化合物来中和DNA磷酸骨架的负电荷。因此,DNA可以充分接近,从而更容易发生π-π堆积(图 8)。
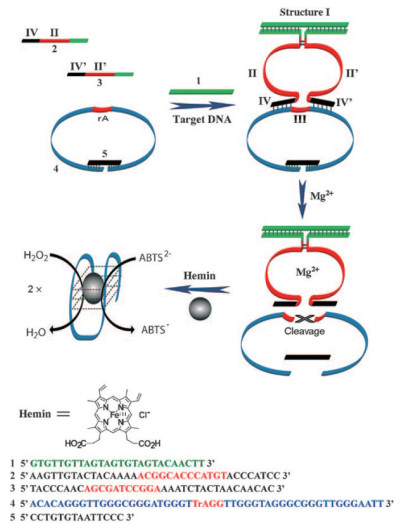
Elbaz等[18]通过核酸结构的协同自组装来活化DNAzyme级联,作为构建自组装核酸来分析靶标DNA和DNA扩增感应的方法。构建自组装核酸来分析靶标DNA。核酸2、3与靶标物质两段互补。核酸4被序列5阻塞成一个准圆形结构。在靶标DNA存在时,它们自组装形成超分子结构。序列2、3与靶标DNA杂交可以协同使序列2、3与4的双链体结构稳定。当Mg2+存在时,发生切割反应。序列4、5连接处遇热不稳定,所以产生两条单链核酸(图 9)。加入氯化血红素使之解离成两个辣根过氧化物酶模拟的DNAzyme,催化H2O2氧化ABTS2-形成有色的ABTS-。
6 纳米材料介导的Mg2+功能核酸生物传感器检测技术近年来,纳米技术以及纳米材料发展迅速,尤其是纳米材料与其他材料的联用。纳米材料与生物传感器联用,可以增加生物活性的固定量、表面活性位点,提供良好的反应环境,加快电子传递过程,缩短信号的响应时间,从而使生物传感器的灵敏度、检测范围、重复性得到明显的增强。同时纳米技术多领域的交叉融合,还能拓宽生物传感器的应用范围[19-20]。
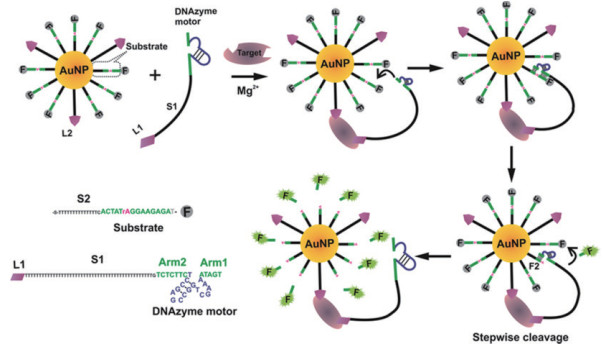
6.1 金纳米粒子Chen等[21]构建DNA马达用于检测蛋白质(图 10)。DNA马达由Mg2+依赖性DNAzyme,AuNP和底物3部分组成。AuNP作为支架构成底物分子的三维轨道,底物的高密度增强了DNAzyme在三维轨道的移动。当加入靶蛋白质并和配体结合后,激活了马达系统。再加入Mg2+,发生了切割反应。荧光基团释放,根据荧光的变化来检测蛋白质的量。同时DNAzyme分离并与另一个底物杂交。此方法实现了DNAzyme沿AuNP的自主移动,对凝血酶的检测限达到5 pmol/L,检测时间为120 min。
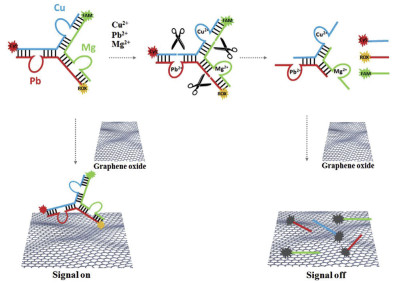
6.2 碳基纳米材料Yun等[22]设计了一个基于DNAzyme的分枝连接结构,用来同时检测Mg2+、Cu2+和Pb2+(图 11)。所有的DNA序列都由不同DNAzyme的E-DNA链和S-DNA链组成,将3个不同的荧光基团分别标记在E-DNA的末段。3个DNA序列之间部分存在互补关系,使之相互杂交形成分枝连接结构。没有靶标金属离子时,主要通过dsDNA与氧化石墨烯连接,分枝连接结构的DNAzyme荧光信号较强。在靶标金属离子存在时,S-DNA的rA位点被切割,被切割的S-DNA片段被释放,与氧化石墨烯通过π-π堆积的形式结合,荧光信号显著淬灭。这种方法能同时检测3种金属离子,检测时间25 min,且Mg2+检测限达到200 nmol/L。DNAzyme和氧化石墨烯结合具有很好的水溶性,生物相容性以及优异的荧光淬灭能力。
6.3 硅基纳米材料Balogh等[23]研究了使用DNAzyme封装的介孔二氧化硅纳米粒子合成点击化学产物。Cy3-DBCO(DBCO =二苯并环辛基)和Cy5-N3作为反应物,分别封装在含Mg2+依赖性DNAzyme和Zn2+依赖性DNAzyme的MP SiO2纳米粒子。在Mg2+和Zn2+作为触发剂的情况下,纳米粒子被解锁,Cy3-DBCO和Cy5-N3从容器中释放出来,形成点击产物Cy3-Cy5。根据荧光变化进行测定(图 12)。
6.4 生物纳米材料Jin等[24]提出了一种基于DNA纳米花(DNFs)的新型可生物降解的癌症治疗系统,用于靶向双基因沉默的方法。通过复制滚环扩增模板构建治疗系统,以产生具有细胞靶向和双重基因沉默能力的长单链DNA。DNFs的结构在酸性pH下崩解,由共组装的焦磷酸镁分解产生的Mg2+作为DNAzyme的辅因子,并增加其识别和切割靶mRNA的能力。体外和体内研究表明,多功能DNFs有望用于靶向癌细胞识别,基因沉默,诱导凋亡和抑制肿瘤生长。考虑到该治疗平台的治疗效果和生物相容性的增强,可能对癌症的临床治疗具有重要意义。
7 Mg2+功能核酸电化学生物传感器检测技术基于电化学检测的DNA电化学生物传感器是从20世纪90年代发展起来的一种新的传感器技术。它的基本结构包括一个能固定DNA探针的电极和一个换能器。这种传感器具有简单、快速、无毒、成本低、灵敏度高和可用于活体检测等优势[25]。
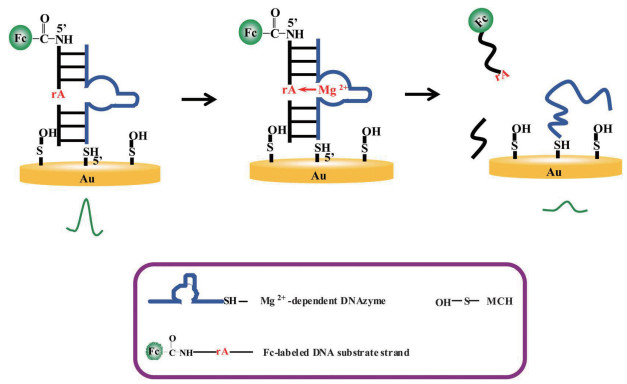
Gao等[26]已经开发了基于Mg2+的DNAzyme的电化学生物传感器,可用于检测血液中的Mg2+含量(图 13)。将5’端有硫醇的Mg2+特异性DNAzyme通过thiol-Au相互作用固定在金电极上,5’端由结合二茂铁(Fc)的DNA底物链通过与DNAzyme杂交连接到金电极。在没有Mg2+的情况下,表现出二茂铁的电流;当Mg2+存在时,结合二茂铁的DNA底物链被DNAzyme切割成两段并远离电极,电流减少,电流随Mg2+浓度增加而减少。这种传感器有很高的特异性,能免受其他二价金属离子的干扰,其检测限达到0.05 mmol/L。
8 Mg2+功能核酸在食品中三聚氰胺的应用Wang等[27]基于三聚氰胺(Melamine)结合触发的三链体形成和Mg2+依赖性DNAzyme,提出了一种新的DNAzyme调控机制,用于三聚氰胺的识别(图 14)。在底物链的两端修饰荧光基团和淬灭基团,在发夹环加入两个poly(dT)片段,用于特异性结合Mg2+。发夹环的结构域扩大,但DNAzyme的活性结构未形成。然后通过碱基配对,再将有AP位点的poly(dA)引入。加入的poly(dA)因为亲和力不足,所以不能形成稳定的三链体。当Melamine加入位于poly(dA)的AP位点,通过T-melamine-T连接到核碱基上。DNAzyme的活性结构恢复,在Mg2+的催化作用下发生切割反应,产生荧光信号。
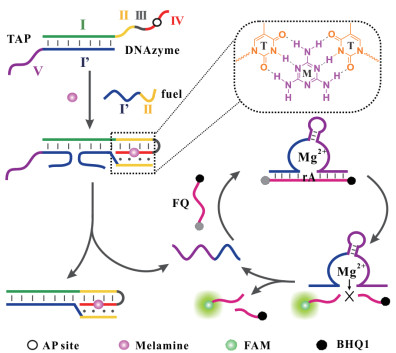
除此之外,Liu等[28]也开发了一种新型荧光生物传感检测方法(图 15)。TAP由4个结构域组成,其中结构域Ⅰ的碱基序列与DNAzyme互补。TAP与DNAzyme杂交抑制以抑制催化活性,在三聚氰胺存在下,3个结构域可通过胸腺嘧啶和三聚氰胺之间的氢键作用将三聚氰胺结合到AP位点形成三链DNA结构。同时,三链结构的形成使得Fuel链接近TAP-DNAzyme复合物,启动链置换反应输出复合物和游离DNAzyme。游离的DNAzyme与Mg2+特异性结合催化切割反应,荧光基团和淬灭基团分离,产生显著的荧光信号。在最佳条件下,三聚氰胺的检测限在0.9 nmol/L。
9 Mg2+功能核酸在生物医学中的应用 9.1 检测血清中的Mg2+血清中的Mg2+浓度为1.1 mmol/L,在细胞中是1.6 mmol/L。Zhou等[10]对8-17E进行体外筛选,分离并扩增可以在血清中发生切割反应的DNA序列,筛选出8-17EV1和8-17EV2。它在未稀释的人体血清中的检测限为1.1 mmol/L,检测时间为20 min。
9.2 生物成像Yang等[29]开发了基于AuNP的发夹锁定的DNA探针,来感知活细胞的miRNA的技术。它是由AuNP和发夹锁定的DNAzyme组成。在靶标miRNA不存在时,发夹锁定的DNAzyme链通过分子内杂交形成发夹结构,限制DNAzyme的催化活性,荧光被AuNP淬灭。当靶标miRNA存在时,靶标和探针杂交能打开发夹,形成活性二级结构,在Mg2+的辅助下进行切割反应。切割的片段分离,荧光基团被释放荧光显著增强。同时,靶标也会被释放连接到下一个DNAzyme开始另一个循环。这种方法的检测限达到25 pmol/L。
9.3 生物医学中的其他研究Romanova等[30]分析Mg2+在粘质沙雷氏菌核酸酶对RNA的消化活性的作用机制,发现这种机制与DNA酶上的金属作用机制相似,并且Mg2+的加入既影响酶与底物复合物的产物解离速率,也影响酶与底物的结合。Binase具有选择性的抗肿瘤作用,可诱导肺癌A549细胞凋亡。它是一种核酸内切酶,可以裂解相邻核苷酸的苷酸的3'-脒基残基和5'-OH残基之间的磷酸二酯键,在催化反应的第一阶段形成相应的中间体2',3'-cGMP。加入Mg2+可以提高形成2',3'-cGMP的水平。在细胞内,有助于肺癌A549细胞的凋亡[32]。
Wei等[32]通过充分利用PLA,MNAzyme和基于GNPs的比色法,成功设计了蛋白质测定方法(图 16)。该方法由PDGF-BB,聚T间隔物,短茎序列和部分MNAzyme的适体组成。同时linker序列被设计为包含MNAzyme的底物序列,可以被切割成两个片段然后释放。在靶标缺失的情况下,由于熔解温度低(Tm < 25 ℃),两个短茎序列在室温下不能杂交。在靶蛋白存在的情况下,通过两种探针同步识别一种PDGF-BB然后依次催化切割,生成的碎片不能将GNP-1与GNP-2交联。因此仍为红色,检测限为1 pg/mL。该方法具有更高的成本效益和热稳定性,且可以扩展用于检测具有两个或更多配体的其他分析物的通用方法。
Zhang等[33]将荧光染料亚甲基蓝(MB)通过Mg2+依赖性DNAzyme封装在介孔二氧化硅(MSN)的孔中。在Mg2+存在下,发生特异性切割,MB从孔内释放出来。这种方法对于未来纳米材料释放药物具有重要的借鉴意义。
10 结语综上所述,Mg2+功能核酸的生物传感检测技术具有高效、稳定等特点,可以把金属检测的问题转化为核酸的问题,利用核酸来解决问题。同时功能核酸的生物传感技术为检测Mg2+提供了新的思路。Mg2+依赖性DNAzyme涉及到多个方面,还需要开展更多的研究。目前主要存在的问题在于3个方面,首先Mg2+相比于其他二价金属离子,DNAzyme不具有突出的特异性;其次是这项技术的检测限低于传统方法的检测限;最后是成功的实际应用较少。所以在未来的研究中,需要对已知的DNAzyme序列近一步优化或者是另外筛选出特异性更好的DNAzyme,有望在食品方面对更多的物质进行检测,在生物医学方面发现更多的作用来促进疾病的治疗。现阶段,纳米材料因为五大效应受到越来越广泛的关注。在未来,将纳米材料和Mg2+功能核酸的生物传感检测技术相结合,可以使其灵敏度、检测限和响应范围等性能指标得到更大的提升。
| [1] |
Pechlaner M, Sigel RKO. Characterization of metal ion-nucleic acids interactions in solution[J]. Metal Ions in Life Sciences, 2012, 10(10): 1-42. |
| [2] |
Shaul O. Magnesium transport and function in plants:the tip of the iceberg[J]. Biometals, 2002, 15(3): 309-323. |
| [3] |
Saris NEL, Mervaala E, Karppanen H. Magnesium-an update on physiological clinical and analytical aspects[J]. Clin Chim Acta, 2000, 294(1-2): 1-26. DOI:10.1016/S0009-8981(99)00258-2 |
| [4] |
Santoro SW, Joyce GF. A general purpose RNA-cleaving DNA enzyme[J]. Proc Natl Acad Sci USA, 1997, 94(9): 4262. DOI:10.1073/pnas.94.9.4262 |
| [5] |
胡春玲, 吴继魁. 基于脱氧核酶的重金属离子荧光生物传感器的研究进展[J]. 化学通报, 2013, 76(11): 1011-1015. |
| [6] |
Leonarski F, D'Ascenzo L, Auffinger P. Mg2+ ions:do they bind to nucleobase nitrogens?[J]. Nucleic Acids Research, 2016, 45(2): 987-1004. |
| [7] |
Russo N, Toscano MA, Grand A. Gas-phase absolute Ca2+ and Mg2+ affinity for nucleic acids bases. A Theoretical Determination[J]. Journal of Physical Chemistry A, 2003, 107(51): 11533-11538. DOI:10.1021/jp0358681 |
| [8] |
Silverman SK, Baum DA. Use of deoxyribozymes in RNA research[J]. Methods Enzymol, 2009, 469: 95-117. DOI:10.1016/S0076-6879(09)69005-4 |
| [9] |
Breaker RR, Joyce GF. A DNA enzyme with Mg2+-dependent RNA phosphoesterase activity[J]. Chemistry & Biology, 1995, 2(10): 655. |
| [10] |
Zhou W, Zhang Y, Ding J, et al. In vitro selection in serum:RNA-cleaving DNAzymes for measuring Ca2+ and Mg2+[J]. ACS Sensors, 2016, 1(5): 600-606. DOI:10.1021/acssensors.5b00306 |
| [11] |
Gill P, Ghaemi A. Nucleic acid isothermal amplification technologies:a review[J]. Nucleosides Nucleotides Nucleic Acids, 2008, 27(3): 224-243. DOI:10.1080/15257770701845204 |
| [12] |
Kong XJ, Wu S, Ge Y, et al. "Light-up" sensing of human 8-oxogu-anine DNA glycosylase activity by target-induced autocatalytic DNAzyme-generated rolling circle amplification[J]. Biosensors & Bioelectronics, 2016, 79: 679-684. |
| [13] |
Song W, Luan Y, Guo X, et al. Sensitive detection of DNA methyltransferase using the dendritic rolling circle amplification-induced fluorescence[J]. Anal Chim Acta, 2016, 956: 57-62. |
| [14] |
Yin HS, Li BC, Zhou YL, et al. Signal-on fluorescence biosensor for microRNA-21 detection based on DNA strand displacement reaction and Mg2+-dependent DNAzyme cleavage[J]. Biosensors & Bioelectronics, 2017, 96: 106. |
| [15] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [16] |
Su Y, Yang Y, Peng Q, et al. Development and application of a rapid and visual loop-mediated isothermal amplification for the detection of Sporisorium scitamineum in sugarcane[J]. Sci Rep, 2016, 6: 23994. DOI:10.1038/srep23994 |
| [17] |
Lin J, Yan YY, Ou TM, et al. Effective detection and separation method for G-Quadruplex DNA based on its specific precipitation with Mg2+[J]. Biomacromolecules, 2010, 11(12): 3384-3389. DOI:10.1021/bm100862k |
| [18] |
Elbaz J, Moshe M, Shlyahovsky B, et al. Cooperative multicompo-nent self-assembly of nucleic acids structures for the activation of DNAzyme cascades:a paradigm for DNA sensors and aptasensors[J]. Chemistry, 2010, 15(14): 3411-3418. |
| [19] |
欧阳瑞镯. 聚焦2011年度中国期刊基于功能纳米材料的生物传感器的研究进展[J]. 分析化学, 2012, 40(12): 1938-1944. |
| [20] |
陈钰, 刘仲明, 王捷. 纳米材料在生物传感器中的应用[J]. 医疗卫生装备, 2009, 30(6): 31-33. DOI:10.3969/j.issn.1003-8868.2009.06.012 |
| [21] |
Chen J, Zuehlke A, Deng B, et al. A target-triggered DNAzyme motor enabling homogeneous, amplified detection of proteins[J]. Anal Chem, 2017, 89(23). |
| [22] |
Yun W, Wu H, Liu X, et al. Simultaneous fluorescent detection of multiple metal ions based on the DNAzymes and graphene oxide[J]. Anal Chim Acta, 2017, 986: 115. DOI:10.1016/j.aca.2017.07.015 |
| [23] |
Balogh D, Aleman Garcia MA, Albada HB, et al. Programmed synthesis by stimuli-responsive DNAzyme-modified mesoporous SiO2 nanoparticles[J]. Angew Chem, 2015, 127(40): 11818-11822. DOI:10.1002/ange.201501777 |
| [24] |
Jin Y, Li Z, Liu H, et al. Biodegradable, multifunctional DNAzyme nanoflowers for enhanced cancer therapy[J]. Npg Asia Materials, 2017, 9(3): e365. DOI:10.1038/am.2017.34 |
| [25] |
张爱春, 周存. DNA电化学生物传感器的研究进展[J]. 天津工业大学学报, 2010, 29(3): 66-70. DOI:10.3969/j.issn.1671-024X.2010.03.016 |
| [26] |
Gao X, Huang H, Niu S, et al. Determination of magnesium ion in serum samples by a DNAzyme-based electrochemical biosensor[J]. Analytical Methods, 2012, 4(4): 947-952. DOI:10.1039/c2ay05846d |
| [27] |
Wang Y, Zhang J, Zhu L, et al. Activation of Mg2+-dependent DNAzymes based on AP site-containing triplex for specific melamine recognition[J]. The Analyst, 2015, 140(22): 7508. DOI:10.1039/C5AN01515D |
| [28] |
Liu X, Xu N, Gai P, et al. Triplex DNA formation-mediated strand displacement reaction for highly sensitive fluorescent detection of melamine[J]. Talanta, 2018, 185: 352-358. DOI:10.1016/j.talanta.2018.03.094 |
| [29] |
Yang Y, Huang J, Yang X, et al. Gold nanoparticle based hairpin-locked-DNAzyme probe for amplified miRNA imaging in living cells[J]. Anal Chem, 2017, 89(11): 5850-5856. DOI:10.1021/acs.analchem.7b00174 |
| [30] |
Romanova J, Gubskaya V, Nuretdinov I, et al. Analysis of the mechanism of Mg 2+, action on the RNase activity of Serratia marcescens, endonuclease[J]. Bionanoscience, 2016, 7(2): 1-8. |
| [31] |
Sokurenko Y, Kolpakov A, Ilinskaya O. Mg2+, Enhances the formation of 2', 3'-cGMP, an intermediate of RNA cleavage by Binase[J]. Bionanoscience, 2017, 7(1): 1-3. DOI:10.1007/s12668-017-0396-0 |
| [32] |
Wei L, Wang X, Wu D, et al. Proximity ligation-induced assembly of DNAzymes for simple and cost-effective colourimetric detection of proteins with high sensitivity[J]. Chem Commun, 2016, 52(32): 5633-5636. DOI:10.1039/C6CC00205F |
| [33] |
Zhang Z, Balogh D, Wang F, et al. Smart mesoporous SiO2 nanoparticles for the DNAzyme-induced multiplexed release of substrates[J]. J Am Chem Soc, 2013, 135(5): 1934. DOI:10.1021/ja311385y |