2. 西北农林科技大学生命科学学院,杨凌 712100
2. College of Life Science, Northwest A & F University, Yangling 712100
植物细胞悬浮培养(Cell suspension culture)是一种疏松易脆的愈伤组织在摇动的液体培养基里培养单细胞及小细胞团的培养系统,是植物细胞生长的微生物化[1]。目前植物细胞悬浮培养体系的建立已经涉及多个物种,例如甘草[2]、红花[3]。同样,植物悬浮细胞涉及的研究方向也很多,如次生代谢物的产生[4]、柑橘胚性悬浮系的遗传转化[5]、烟草悬浮细胞的程序性死亡[6]等。
葡萄是世界性经济类果树作物之一,截至2015年,国际葡萄与葡萄酒组织(OIV)调查数据显示全球葡萄种植面积为753.4万hm2。2000年以来,我国在葡萄鲜食品种以及抗病、耐贮运、无核主要育种方向上作了许多研究和贡献[7]。悬浮细胞由于其分散性好,细胞形状及细胞团大小大致相同,且生长迅速,因而被广泛用于细胞学、生物化学、发育生物学及分子生物学的研究。悬浮细胞培养已成为植物生物技术中最有用的研究手段之一[8]。因此,在研究葡萄的某些功能的时候也与细胞培养技术结合起来,如在葡萄悬浮细胞中加入环糊精等物质可以增加胞外反式-白藜芦醇的含量[9-10],茉莉酸甲酯引起的葡萄悬浮细胞死亡及多重防御系统反应[11-13],BTH诱导葡萄悬浮细胞防卫反应从而影响细胞蔗糖代谢[14]。研究葡萄基因功能时常用的分子生物学手段是植物转基因技术,可以通过体胚或者器官发生再生途径进行遗传转化研究[15],同时国外也有很多研究利用葡萄悬浮系进行葡萄的遗传转化和植株再生。CRISPR/Cas9基因组编辑在霞多丽悬浮细胞中介导的高效定向突变[16]。利用超声波辅助农杆菌介导转化方法(SAAT)对葡萄悬浮细胞的遗传转化的影响[17]。在葡萄转基因细胞系中加入甲基化环糊精/环糊精和茉莉酸甲酯引起胞外反式-白藜芦醇(t-R)的积累高于野生型细胞系[18-19]。
本研究以无核白和黑比诺葡萄茎段、叶片和叶柄为研究对象,以MS作为基本培养基,对葡萄疏松型愈伤组织诱导条件进行了筛选,从而诱导适合建立葡萄悬浮细胞的疏松愈伤组织;以B5和MS作为基本培养基,筛选合适的基本培养基、植物生长调节剂配比及浓度建立及优化葡萄细胞悬浮培养体系,为利用葡萄悬浮体系进行遗传转化的研究提供技术支持。
1 材料与方法 1.1 材料欧洲葡萄‘无核白’、‘黑比诺’的无菌外植体。
1.2 方法 1.2.1 葡萄愈伤组织的诱导及继代利用实验室前期建立的无核白和黑比诺无菌苗,在无菌操作下将其叶片剪成1 cm×1 cm左右的正方形,茎和叶柄分别切成1 cm左右的小段,然后分别接种于MS附加2.0 mg/L NAA和0.3 mg/L 6-BA或0.2 mg/L NAA和2 mg/L 6-BA的诱导培养基。每瓶培养基中4个外植体,每种类型的培养基接种20瓶。接种后观察并记录愈伤组织的状态。诱导成功的葡萄愈伤组织可在诱导培养基上每月继代一次,继代3次以上,达到稳定状态,用于后续实验。
所有诱导愈伤组织的MS培养基均添加30 g/L蔗糖,7 g/L琼脂,且pH为5.8,外植体接种后于25℃、12 h光照的培养室下进行愈伤组织诱导。
1.2.2 葡萄细胞悬浮系的建立悬浮细胞的建立方法参考文献[17],选取连续继代数次且稳定的质地疏松的淡黄色葡萄愈伤组织8-10 g,放入装有40 mL液体培养基的100 mL三角瓶中,25℃、黑暗、110 r/min振荡培养。于两周后,弃去大的组织团块及细胞团,将含有单细胞和小细胞团的上层培养基一起转移到无菌空三角瓶中继续振荡培养。一周后向粘稠的、对数期的细胞按照(3-5): 1的新旧培养基体积比加入新的培养基,继续振荡培养,直至得到一定数量的均一稳定的细胞悬浮培养物。
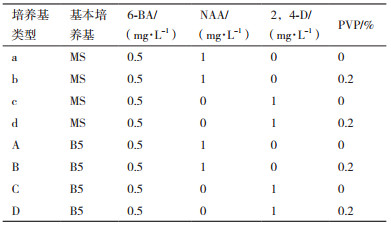
1.2.3 葡萄细胞悬浮系培养条件的优化利用疏松型葡萄愈伤组织进行悬浮细胞的培养,根据表 1中提到的基本培养基类型(MS和B5)、植物生长调节剂配比及浓度、是否添加PVP来进行培养条件的优化筛选,于25℃、黑暗下、110 r/min震荡培养,观察并记录葡萄悬浮细胞的状态。
所有用于葡萄细胞悬浮培养的培养基中添加30 g/L蔗糖,pH为5.8。
1.2.4 培养时间对葡萄悬浮细胞生长的影响葡萄悬浮细胞经过25℃、黑暗、110 r/min振荡培养一段时间后,处于稳定期。此时进行悬浮细胞系的继代培养,每隔3 d将葡萄细胞悬浮液摇匀后取5 mL真空抽滤,称其鲜重,共取9个时期的细胞测量,每个时期鲜重测量进行3次重复,计算葡萄悬浮细胞的增长量。
细胞增长量=每升收获量-每升接种量
1.2.5 细胞活力测定细胞活力测定参考刘华[20],具体操作如下:以TTC测细胞活力时,每隔3 d取葡萄悬浮培养细胞,抽滤。取抽滤后的悬浮细胞600 mg测定细胞活力,每200 mg为一个重复。在试管中加入200 mg葡萄悬浮细胞,并加入2.5 mL 0.4% TTC溶液和2.5 mL pH 7.0的磷酸缓冲液混匀,静置于25℃暗处13-16 h,细胞变红,之后用蒸馏水洗涤细胞3次。然后加入5 mL 95%乙醇,于60℃水浴30 min,并于室温下至细胞无色。取上清液,于485 nm处测量吸光值(Abs)。
1.2.6 葡萄悬浮细胞显微观察按照1.2.5中提到的方法进行TTC染色,静置于25℃,黑暗13-16 h,细胞变红。将染色细胞摇匀后,取适量染色后的悬浮细胞滴到载玻片中央,然后盖上盖玻片,避免产生气泡,在光学显微镜(BX-51,奥林巴斯,日本)下观察不同培养时期葡萄悬浮细胞的染色程度及形态结构并照相。
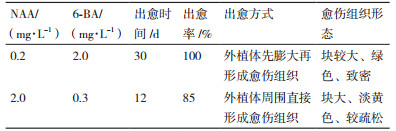
2 结果 2.1 NAA和6-BA及其浓度对葡萄疏松愈伤组织诱导的影响通过比较2种植物生长调节剂NAA和6-BA不同浓度配比的MS培养基诱导无核白茎段的愈伤组织效果(表 2),选出适合诱导疏松愈伤组织的NAA和6-BA浓度。其中添加0.2 mg/L NAA和2 mg/L 6-BA的MS培养基出愈时间为30 d,诱导率高达100%(图 1-C),但诱导出的愈伤组织呈绿色,块较硬,为致密型细胞不容易分散,不适合悬浮细胞系的建立;添加2 mg/L NAA和0.3 mg/L 6-BA的MS培养基时,出愈时间为12 d,虽然诱导率只有85%,但诱导出的愈伤组织呈淡黄色、质地疏松,适合悬浮细胞系的建立(图 1-D-E)。

|
| 图 1 愈伤组织诱导过程 A、B:起始诱导愈伤组织的葡萄叶片和茎段;C、D:诱导40 d的两种类型愈伤组织;E:继代3次以上稳定均一的疏松型愈伤组织;F:愈伤组织诱导环境 |
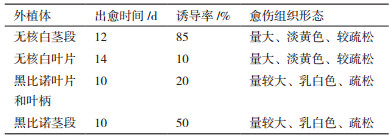
选用上述2.0 mg/L NAA和0.3 mg/L 6-BA的MS培养基,以无核白和黑比诺葡萄的叶片、叶柄和茎段为材料,研究不同葡萄品种及不同外植体对疏松型愈伤组织诱导的影响。其中黑比诺葡萄的愈伤组织的出愈时间为10 d,略早于无核白。2个葡萄品种的茎段诱导率高于叶片,其中无核白茎段诱导率为85%,叶片仅为10%;同时2个葡萄品种诱导的愈伤组织状态也不同,无核白诱导出色泽淡黄色、量大且较疏松的愈伤组织,而黑比诺诱导的愈伤组织状态为乳白色、量小于无核白,而质地更为疏松。
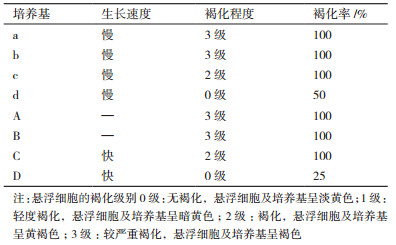
选用不同的基本培养基MS、B5,植物生长调节剂NAA、2,4-D、6-BA,及是否添加PVP来进行葡萄悬浮细胞系的建立及培养条件优化。共有8种液体培养基(表 1)用于建立葡萄悬浮细胞系,从细胞生长速度、褐化程度以及褐化率3个方面(表 4)进行优化筛选,发现无核白葡萄疏松愈伤组织在MS培养基中建立悬浮系的速度比B5培养基慢。植物生长调节剂NAA与6-BA组合下的悬浮细胞系与2,4-D和6-BA组合相比,细胞更容易褐化,且NAA与6-BA组合下的悬浮细胞褐化率为100%。同时,培养基中0.2% PVP的加入可以减缓甚至避免细胞及培养基褐化。因此,在D型优化培养基中建立的悬浮细胞系的细胞呈淡黄色,生长速度快,褐化程度低,适合进行继代和繁殖,所以选择以B5为基本培养基,1 mg/L 2,4-D、0.5 mg/L 6-BA、0.2% PVP的D型优化培养基条件下进行葡萄悬浮细胞系的建立。
葡萄悬浮细胞培养中细胞生长曲线呈S形(图 2)。葡萄悬浮细胞的起始接种量为17 g/L,在细胞接种初期0-6 d会经过一个生长延迟期,细胞增长缓慢;第6天开始进入对数生长期,第6-18天,细胞迅速增殖,第21-24天进入稳定期,其中第21天细胞增长量达到最大值634.8 g/L为接种时的3.7倍。
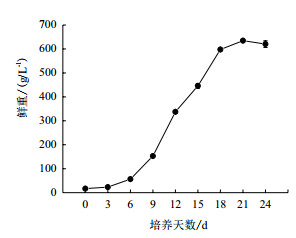
|
| 图 2 葡萄悬浮细胞鲜重增长曲线 |
图 3显示了葡萄悬浮细胞系在24 d的培养周期中细胞活力的变化情况。葡萄悬浮细胞在培养初期0-3 d的细胞活力对应的OD值在0.5以下,且活力没有太大变化;随着培养时间的延长,培养3-9 d的细胞活力不断上升,第9天时细胞活力OD值达到最大,细胞活力最强;培养9-24 d的悬浮细胞随着培养时间增加,细胞活力不断下降。
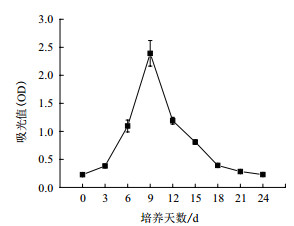
|
| 图 3 葡萄悬浮细胞系细胞活力变化曲线 |
不同培养时期的葡萄悬浮细胞经过TTC染色(图 4)后,发现细胞的染色变红程度与图 3的吸光值相对应。图 4-A显示了未染色悬浮细胞的光学显微结构,培养3 d和18 d的悬浮细胞经TTC染色后,细胞呈现浅红色(图 4-B,E);细胞培养9 d的细胞活力最强,染色后呈现紫红色(图 4-D);而到培养后期(24 d),细胞经TTC染色后,染色程度较浅(图 4-F)。
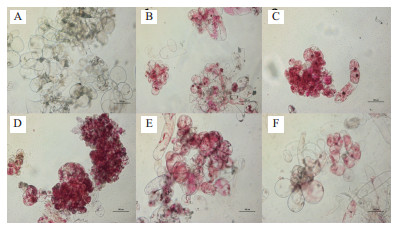
|
| 图 4 葡萄悬浮细胞染色前与不同时期染色后的显微观察 A:未染色细胞;B:培养3d的悬浮细胞经TTC染色后显微观察效果;C:染色培养6 d的悬浮细胞经TTC染色后显微观察效果;D:染色培养9 d的悬浮细胞经TTC染色后显微观察效果;E:染色培养18 d的悬浮细胞经TTC染色后显微观察效果;F:染色培养24 d的悬浮细胞经TTC染色后显微观察效果 |
同时葡萄悬浮细胞的光学显微结构表明,随着培养时间的延长,细胞形成中央液泡,细胞液内容物增多。
3 讨论疏松型的愈伤组织是植物细胞悬浮体系建立的关键因素。而生长素与细胞分裂素的浓度配比影响到植物愈伤组织状态的变化,用于葡萄愈伤组织诱导的生长素主要有NAA、IBA和2,4-D,细胞分裂素主要有6-BA、KT。但用于葡萄疏松型愈伤组织诱导的这两种激素所占的比例不固定,例如:巨峰葡萄果皮为0.1 mg/L NAA+ 0.2 mg/L KT[21];福建野生葡萄为2.0 mg/L BA + 0.2 mg/L NAA[22];巨峰葡萄叶柄和茎段为0.5 mg/L 6-BA + 0.1 mg/L IBA和1.0 mg/L 6-BA + 0.2 mg/L IBA[23]。为了筛选出适合葡萄疏松型愈伤组织诱导的植物生长调节剂配比及浓度,选用了两种植物生长调节剂配比及浓度,一种是高生长素,另一种是高细胞分裂素。结果发现生长素NAA浓度高时,诱导出淡黄色且疏松的愈伤组织;细胞分裂素6-BA浓度高时,诱导出绿色紧密的愈伤组织。可看出不同的葡萄品种或葡萄不同组织部位诱导愈伤组织的状态对植物生长调节剂配比要求不同。在愈伤组织继代方面,范丽华等[22]和崔兴华等[23]认为愈伤组织的诱导和继代培养基不同,在继代培养基中将生长素换成了2,4-D,本实验将葡萄愈伤组织诱导培养基的NAA换成2,4-D,发现愈伤组织的状态变成软绵型,但在诱导培养基上直接进行继代的愈伤组织正常生长。
无核白和黑比诺葡萄的疏松型愈伤组织进行葡萄悬浮细胞建立时,分别选用了两种基本培养基MS和B5,通过观察和记录,发现与MS相比,B5建立的葡萄悬浮细胞系的生长速度更快。但有文献[11]表明MS培养基可成功建立葡萄细胞悬浮体系,说明葡萄细胞悬浮系建立与培养基之外的其他因素有关。用于葡萄细胞悬浮系培养的生长素,选用了NAA和2,4-D,在无核白葡萄细胞悬浮体系中发现含有0.2% PVP的NAA培养基建立的悬浮细胞出现褐化,而2,4-D则正常。这表明2,4-D更适合用于无核白葡萄悬浮细胞系的建立。在相同条件下,黑比诺葡萄悬浮细胞仍会出现不同程度的褐化。因此本实验成功建立了无核白葡萄悬浮细胞系。
选用相同的诱导培养基进行葡萄疏松型愈伤组织的诱导,黑比诺葡萄起始诱导速度较快,之后生长速度较慢,而无核白生长速度一直较快,同时两个葡萄品种的愈伤组织状态也有差异;在同等条件下建立两个葡萄品种悬浮细胞系,无核白细胞系成功建立,而黑比诺细胞系褐化,这些可能与品种本身特性有关。两个葡萄品种的愈伤组织颜色和疏松程度的不同,可能是材料本身含有的色素、激素及其他代谢物质不同导致;葡萄细胞培养时,不同程度的褐化,可能与品种本身所含有的酚类物质有关,有研究表明同一葡萄品种不同器官间、不同葡萄品种间酚类物质含量有差异[24];杜晓映[25]建立的黑比诺和赤霞珠葡萄悬浮系比巨峰葡萄细胞更易褐化,本研究中黑比诺细胞系的褐化程度同样高于无核白,可能因为黑比诺属于酿酒品种,无核白属于鲜食及制干品种,这两个品种存在一定差异。因此,进行葡萄愈伤组织诱导及悬浮细胞系的建立时,不仅要考虑外界环境、培养基成分和植物生长调节剂种类及比例的影响,还要考虑品种和材料本身的差异,从而建立适合不同葡萄品种的细胞培养体系。
无核白葡萄悬浮细胞培养中细胞生长曲线呈S形。继代初期时,需要一定的适应力,细胞会进入一个0-6 d的生长延迟期;细胞经过适应后,在第6天时进入一个快速生长对数期,细胞鲜重大量增加;随着培养天数的增加,细胞不断增值,营养物质逐渐消耗殆尽;继而细胞生长进入稳定期(18-24 d),最终停止生长、褐化或死亡。因此需要通过定期继代来维持悬浮细胞系的生长和稳定。
葡萄悬浮系细胞活力越强,其遗传转化效率越高。本实验采用TTC染色法测定葡萄悬浮细胞的细胞活力,TTC法反映的是脱氢酶活性,其活力大小反映线粒体中有氧呼吸的强度[26]。TTC染色细胞颜色越红,对应吸光值越大,其细胞活力越强[20]。葡萄悬浮细胞活力曲线表明在培养3-9 d时,细胞活力不断增强,第9天时细胞活力最强;9-18 d时,细胞活力不断下降。在细胞培养的生长对数期6-18 d时,细胞数量大量增加,但细胞活力在9-18 d时间段,却不断下降,这可能是由于继代时初始细胞量较多,在生长对数期细胞鲜重急剧增加,细胞密度变大,细胞之间相互竞争营养,继而细胞活力受到一定的影响,导致细胞活力下降。选择细胞活力最强且细胞鲜重较多的对数期7-9 d的细胞进行转化,这样转化效率较高。
4 结论本研究以无核白和黑比诺葡萄茎段为材料,以添加2 mg/L NAA和0.3 mg/L 6-BA的MS培养基为诱导培养基,能快速诱导疏松型愈伤组织及继代培养。以添加1 mg/L 2,4-D、0.5 mg/L 6-BA和0.2% PVP的B5液体培养基为优化培养基,能快速建立适合无核白葡萄细胞培养的悬浮体系。细胞增长和细胞活力曲线表明处于对数期7-9 d的细胞,细胞活力最强,适合进行葡萄悬浮细胞遗传转化,效率较高。
| [1] |
孙敬三, 朱至清. 植物细胞工程实验技术[M]. 北京: 化学工业出版社, 2005, 21.
|
| [2] |
包金龙. 甘草细胞悬浮培养系的建立与悬浮细胞中活性成分分析[D]. 包头: 内蒙古科技大学, 2010.
|
| [3] |
郭丹丹, 刘飞, 涂燕华, 等. 红花悬浮细胞体系的建立及其化学成分的UPLC-Q-TOF/MS分析[J]. 中草药, 2016, 47(24): 4439-4444. DOI:10.7501/j.issn.0253-2670.2016.24.024 |
| [4] |
Cai Z, Kastell A, Knorr D, et al. Exudation:an expanding technique for continuous production and release of secondary metabolites from plant cell suspension and hairy root cultures[J]. Plant Cell Reports, 2012, 31(3): 461-477. DOI:10.1007/s00299-011-1165-0 |
| [5] |
Dutt M, Grosser JW. An embryogenic suspension cell culture system for Agrobacterium-mediated transformation of citrus[J]. Plant Cell Reports, 2010, 29(11): 1251-1260. DOI:10.1007/s00299-010-0910-0 |
| [6] |
Jiao J, Zhou B, Zhu X, et al. Fusaric acid induction of programmed cell death modulated through nitric oxide signalling in tobacco suspension cells[J]. Planta, 2013, 238(4): 727-737. DOI:10.1007/s00425-013-1928-7 |
| [7] |
姜建福, 孙海生, 刘崇怀, 等. 2000年以来中国葡萄育种研究进展[J]. 中外葡萄与葡萄酒, 2010, 34(3): 60-65. DOI:10.3969/j.issn.1004-7360.2010.03.018 |
| [8] |
杨帆, 赵君, 张之为, 等. 植物悬浮细胞的研究进展[J]. 生命科学研究, 2010, 14(3): 257-262. |
| [9] |
Almagro L, Belchí NS, Martínez MA, et al. Enhanced extracellular production of trans-resveratrol in Vitis vinifera, suspension cultured cells by using cyclodextrins and coronatine[J]. Plant Physiology & Biochemistry, 2015, 97: 361-367. |
| [10] |
Belchínavarro S, Almagro L, Lijavetzky D, et al. Enhanced extracellular production of trans-resveratrol in Vitis vinifera suspension cultured cells by using cyclodextrins and methyljasmonate[J]. Plant Cell Reports. |
| [11] |
Chang X, Seo M, Takebayashi Y, et al. Jasmonates are induced by the PAMP flg22 but not the cell death-inducing elicitor Harpin in Vitis rupestris[J]. Protoplasma, 2016, 254(1): 1-13. |
| [12] |
Repka V, Fischerová I, Šilhárová K. Methyl jasmonate is a potent elicitor of multiple defense responses in grapevine leaves and cell-suspension cultures[J]. Biologia Plantarum, 2004, 48(2): 273-283. DOI:10.1023/B:BIOP.0000033456.27521.e5 |
| [13] |
Repka V, Čarná M, Pavlovkin J. Methyl jasmonate-induced cell death in grapevine requires both lipoxygenase activity and functional octadecanoid biosynthetic pathway[J]. Biologia, 2013, 68(5): 896-903. |
| [14] |
汪开拓, 郑永华, 狄华涛, 等. BTH处理诱导葡萄悬浮细胞防卫反应对其蔗糖代谢的影响[J]. 果树学报, 2014, 31(1): 66-71. |
| [15] |
谢晓青. 葡萄特异种质的繁殖保存和利用[D]. 杨陵: 西北农林科技大学, 2016.
|
| [16] |
Chong R, Liu X, Zhan Z, et al. CRISPR/Cas9-mediated efficient targeted mutagenesis in Chardonnay(Vitis vinifera L.)[J]. Sci Rep, 2016, 6: 32289. DOI:10.1038/srep32289 |
| [17] |
Chu M, Quiñonero C, Akdemir H, et al. Agrobacterium-mediated transformation of Vitis Cv. Monastrell suspension-cultured cells:Determination of critical parameters[J]. Biotechnology Progress, 2016, 32(2): 725-734. |
| [18] |
Martínez MA, Morante CJ, Ramírez EK, et al. A reliable protocol for the stable transformation of non-embryogenic cells cultures of grapevine(Vitis vinifera L.) and Taxus x media[J]. Journal of Biological Methods, 2015, 2(2): 21. DOI:10.14440/jbm.2015.51 |
| [19] |
Chu M, Pedreño MA, Alburquerque N, et al. A new strategy to enhance the biosynthesis of trans-resveratrol by overexpressing stilbene synthase gene in elicited Vitis vinifera cell cultures[J]. Plant Physiology & Biochemistry, 2017, 113: 141-148. |
| [20] |
刘华, 梅兴国. TTC法测定红豆杉细胞活力[J]. 植物生理学通讯, 2001, 37(6): 537-539. |
| [21] |
杜晓映, 张振文, 夏惠, 等. 葡萄悬浮细胞系的建立[J]. 西北农林科技大学学报:自然科学版, 2009, 37(1): 199-204. |
| [22] |
范丽华, 赖呈纯, 谢鸿根, 等. 福建野生葡萄松散型愈伤组织的诱导及其继代保持[J]. 福建农业学报, 2012, 27(7): 711-716. DOI:10.3969/j.issn.1008-0384.2012.07.010 |
| [23] |
崔兴华, 李兴林, 周鑫, 等. 葡萄松散型愈伤组织的培养及其白藜芦醇含量的测定[J]. 西北农林科技大学学报:自然科学版, 2009, 37(5): 161-165. |
| [24] |
汪成东, 侍朋宝, 张振文. 葡萄器官酚类物质的含量研究[J]. 农业工程学报, 2004, 20(z1): 94-96. DOI:10.3321/j.issn:1002-6819.2004.z1.022 |
| [25] |
杜晓映. 葡萄细胞的悬浮培养及诱导子对悬浮细胞多酚产量影响的研究[D]. 杨陵: 西北农林科技大学, 2008.
|
| [26] |
刘华. 悬浮培养红豆杉细胞活力及存活率与生长周期的关系[J]. 生物学杂志, 2002, 18(1): 19-20. DOI:10.3969/j.issn.2095-1736.2002.01.007 |