2. 河南省生物工程技术研究中心,郑州 450001;
3. 生物标志物定量检测河南省工程实验室,郑州 450001
2. Henan Bioengineering Technology Research Center, Zhengzhou 450001;
3. Henan Engineering Laboratory for Biomarker Quantitative Detection, Zhengzhou 450001
人体中胱抑素C是半胱氨酸蛋白酶抑制剂家族中的一个类型[1],研究表明,人体血液及尿液中胱抑素C含量几乎不受饮食的影响,但当肾小球过滤功能减退时,胱抑素C在血中的含量升高[2]。血清(浆)胱抑素C水平测定,可反映出肾小球滤过功能的状况,将其作为临床检测指标优于血清(浆)尿素、肌酸、肌酐和Ccr等测定方法[3-6],检测胱抑素C可灵敏的反映肾小球的滤过功能,在评价由糖尿病、急性肾功能衰竭、高血压、类风湿性关节炎等原因引起的早期肾损害方面起着重要的作用,可替代血清肌酐评估急性肾功能衰竭(ARF)、儿童肾病患者的GFR检测标志物、在肾移植中急、慢性排斥反应及免疫抑制药物的毒性观察指标、肿瘤向外浸润和转移及类风湿性关节炎引起的肾脏受累[7-12]。
胱抑素C的临床检测主要采用免疫学方法[13],包括荧光免疫测定法、酶联免疫吸附测定法、颗粒增强透射免疫比浊法[14]。这些方法均利用了胱抑素C和其抗体特异性反应的原理,其建立的基础是获得质量较高的胱抑素C配对抗体,检测试剂的质量与抗体质量密切相关[15-16]。因此,本研究通过制备针对胱抑素C不同区域抗原决定簇的配对抗体,建立更加特异和灵敏的胱抑素C检测技术方法。
1 材料与方法 1.1 材料 1.1.1 试剂MES、碳二亚胺(EDC),上海生工生物工程有限公司;牛血清白蛋白(BSA),天津正江现代生物技术公司;弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA),Sigma公司;HT、HAT,Gibco;小鼠IgG、ELISA检测用试剂、化学发光检测用试剂,河南省生物工程技术研究中心;胱抑素C高值血清,由郑州大学第一附属医院提供。
1.1.2 仪器设备摇床,SHIPING,SHP-100B;离心机,长沙湘仪离心机仪器有限公司,H1850R;酶标仪,MK 3,Thermo;pH计,雷磁,PHS-3E;化学发光免疫分析仪,厦门天众达生物科技有限公司,ECLIA-ⅡS;超微量蛋白检测仪,北京凯奥科技有限公司,K 5500;超净工作台,吴江市金晓空调净化有限公司,SW-CJ-1F;CO2培养箱,Thermo,BB150;倒置显微镜,奥特光学,BDS400。
1.1.3 实验动物6-8周龄的健康雌性小鼠由河南省生物工程技术研究中心提供。
1.2 方法 1.2.1 免疫原制备(1) 免疫原设计:根据GenBank中NM_000099. 2序列所编码的胱抑素C蛋白采用DNAS2.0分析蛋白的抗原表位,筛选出以下5段优势表位多肽进行人工合成。C1:1-15 aa;C2:37-49 aa;C3:56-61 aa;C4:85-91 aa;C5:108-110 aa。多肽由上海生工合成。
(2) 多肽偶联:用MES缓冲液(0.1 mol/L,pH 6.5)将Cys C多肽配制成终浓度为10 mg/mL的溶液,将EDC活化剂配制成10 mg/mL。取配制好的5种Cys C多肽各1 mg、鼠IgG 4 mg、EDC 3 mg于1.5 mL离心管中,混合均匀,放入25℃摇床中,震荡偶联12 h。然后用0.02 mol/L pH7.4的磷酸缓冲盐溶液(Phosphate buffer saline,PBS)作为透析液进行透析做免疫小鼠用。取配制好的5种Cys C多肽各1 mg、BSA 4 mg、EDC 3 mg于1.5 mL离心管中,混合均匀,放入25℃摇床中,震荡偶联12 h。用0.02 mol/L pH7.4的PBS作为透析液进行透析做检测抗原用。
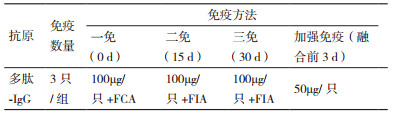
1.2.2 抗原免疫将C1、C2、C3、C4、C5五种多肽的鼠IgG偶联物分别加入佐剂进行免疫。取15只出生后6-8周的健康雌性小鼠,3只一组共5组,采用腹腔注射方式按照表 1的免疫方法进行免疫。二免结束时,取小鼠尾血制备血清,使用间接ELISA法测定其抗体效价,三免疫结束时同样获得血清测定,若其中的抗体效价高于1: 104结束免疫。
按常规操作制备杂交瘤[17-18]。采用相应的BSA偶联多肽作为包被,包被浓度为200 ng/孔,羊抗鼠IgG酶标浓度1: 2 000。
采用ELISA竞争法对融合细胞上清进行测定。(1)包被板制备:用包被液分别将5种BSA偶联多肽稀释至2 μg/mL,100 µL/孔4℃过夜包被,包被结束后弃包被液,用洗液洗板1次,在不脱落纤维的布上拍干。加入封闭液150 µL/孔,37℃封闭2 h,4℃干燥存放。(2)竞争法检测:分别加入稀释后的融合细胞上清100 µL/孔、稀释后的融合细胞上清和含0.6 µg/mL胱抑素C的血清各50 µL、稀释后的融合细胞上清和含15.3 µg/mL胱抑素C的血清各50 µL,加入对照,做好标记,粘贴封板膜,37℃孵育30 min。弃上清,洗板5次拍干,每孔加100 µL用酶标稀释液1:2 000稀释的兔抗鼠-IgG酶标抗体,粘贴封板膜,37℃孵育30 min。弃上清洗板5次拍干,每孔分别加入底物A液50 µL、底物B液50 µL,用微型振荡器震荡混合均匀孔内液体,粘贴封板膜、37℃孵育20 min。每孔加入终止液50 µL终止反应,用酶标仪在450 nm、630 nm双波长下检测结果。
1.2.4 抗体制备及配对筛选用常规方法制备腹水[17-18],采用辛酸硫酸铵沉淀法对抗体进行纯化,用经典过碘酸钠对抗体进行标记后稀释调整为终浓度2 mg/mL。
从医院取得胱抑素C高值血清,用博奥赛斯(天津)生物科技有限公司生产的胱抑素C(CysC)定量检测试剂盒(化学发光法),反复进行标定,制备胱抑素C含量为20 000 ng/mL的高值室内参考品,用5%BSA稀释制备出一套胱抑素C线性参考品(50-20 000 ng/mL)。
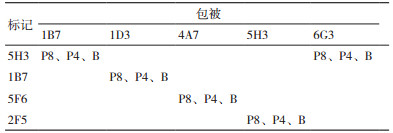
挑取10株竞争抑制效果佳的单抗,用双抗体夹心酶联免疫检测方法对各个单克隆抗体和HRP标记抗体进行配对筛选。抗体包被量为200 ng/孔,4℃过夜包被,采用5%BSA进行封闭,37℃封闭2 h。HRP标记抗体稀释倍数为1: 20 000,利用制备的胱抑素C质控品(P8 10 000 ng/mL)进行初步筛选。
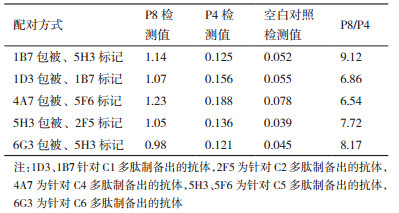
据初筛结果对发生阳性反应的单克隆抗体进一步进行筛选。每组配对组合的抗体包被量、标记量、反应模式与抗体配对初筛一致,样本采用胱抑素C质控品P8 10 000 ng/mL、P4 500 ng/mL,并保留一孔空白对照,空白对照为等量的样品稀释液(表 2)。
用间接ELISA法测定抗体亲和反应曲线,取Cys-C抗原按每孔400、200、100、50 ng包被酶标板,将1B7、5H3单抗每株做倍比稀释加入酶标孔,做间接ELISA,测定每孔OD值。以抗体浓度的对数为横坐标,以OD值为纵坐标,每种抗体得出4条反应曲线,以每条曲线上部趋于平坦段的OD值作为100%,在曲线上查出50% OD值相对应的抗体浓度[19-21]。代入Ka=(n-1)/2(n[Ab']t-[Ab]t),计算单克隆抗体的亲和常数Ka。[Ab']t、[Ab]t表示抗原浓度为[Ag']t和[Ag]t时50%OD对应的抗体浓度;n为抗原浓度[Ag']t和[Ag]t间的稀释倍数。
1.2.6 化学发光检测体系建立将筛选出的胱抑素C配对包被抗体和HRP酶标记抗体,通过棋盘滴定实验,确定最佳抗体包被量和酶标抗体稀释倍数,建立化学发光检测体系。
用包被缓冲液将胱抑素C抗体稀释至2 μg/mL,按100 µL/孔加入微孔板中,4℃包被过夜。除去孔内液体,洗板一次拍干,按150 µL/孔加入封闭液,37℃封闭2 h,去除孔内液体,拍板后烘干。加入100 µL线性参考品,37℃温浴30 min,去除孔内液体,洗板5次拍干。将酶标抗体1: 5 000稀释后100 µL/孔加样,37℃反应30 min,洗板5次拍干。每孔分别加入发光底物A液50 µL,发光底物B液50 µL,用微型振荡器震荡,使孔内液体混合均匀,避光反应5 min,立即放入化学发光检测仪进行检测,分析实验结果。
1.2.7 化学发光法分析性能检测(1) 线性范围和最低检测限:采用挑选好的配对抗体按建立的化学发光检测体系检测自制参考品,用Log(X)-Logit(Y)数学模型进行线性回归处理。
用5%BSA作为零浓度校准品检测,重复测定10次,得出10次测量结果,计算其平均值(M)和标准差(SD),得出M+2SD,根据零浓度校准品和相邻校准品之间的浓度结果进行两点回归拟合得出一次方程,将M+2SD的结果代入上述方程中,求出对应的浓度值,即为最低检测限。
(2) 精密度:用自制的化学发光检测方法检测15 000 ng/mL、1 000 ng/mL、100 ng/mL的胱抑素C参考品各10孔,计算变异系数(CV%),为批内精密性。用不同批次包被板重复3次实验,计算各浓度检测30次的变异系数(CV%),为批间精密性。
(3) 准确度:采用回收率确定准确度,将高值胱抑素C血清(20 000 ng/mL)用5%BSA稀释获得理论浓度为15 000、1 000、100 ng/mL的样品,检测发光值,根据线性参考品绘制的标准曲线,计算实际浓度,回收率=实际浓度/理论浓度×100%。
(4) 方法学比对:取50份临床血清经过乳胶免疫比浊法测定过的血清,用本研究建立的化学发光法进行检测。以自建系统检测结果为纵坐标,以临床检测值为横坐标,建立相关线性分析。
2 结果 2.1 抗原免疫及杂交瘤制备C1、C2、C3、C4、C5五种多肽的鼠IgG偶联物免疫后获得血清效果大于1: 104的小鼠分别制备杂交瘤,用竞争法筛选阳性融合细胞,共获得可与天然胱抑素C蛋白反应的单抗39株(表 3)。
腹水制备采用常规方法,抗体纯化采用辛酸硫酸铵沉淀法,所纯化抗体纯度均高于95%。
2.3 抗体配对按初筛结果选择可发生阳性反应的5对组合抗体进行进一步筛选。抗体配对结果如表 4,选择P8/P4比值最高者作为最优抗体组合,即选择1B7包被、5H3标记作为后续建立检测方法的配对抗体。
对1B7和5H3杂交瘤细胞株产生的抗体进行亲和常数的测定,分别为3.2×1011M-1和4.3×1011M-1。抗体亲和力高,适用于定量检测试剂的研发。
2.5 化学发光法分析性能检测(1) 线性范围和最低检测限:自建Cys C检测系统线性范围为50-20 000 ng/mL,标准曲线回归为一程为Y=1.088X + 3.821 8(r=0.995 6)。5% BSA重复检测10次,计算平均值和标准差,确定最低检出限为3 ng/mL。
(2) 精密度:15 000 ng/mL血清批内精密性为2.19%,批间精密性为3.23%;1000ng/mL血清检测批内精密性为4.84%,批间精密性为5.03%;100ng/mL血清检测批内精密性为6.83%,批间精密性为7.03%。
(3) 回收率:检测理论浓度为15 000 ng/mL、1 000 ng/mL、100 ng/mL的样品,根据检测结果计算实际浓度,如表 5,回收率均在85%-115%范围内,符合化学发光检测试剂盒性能要求。
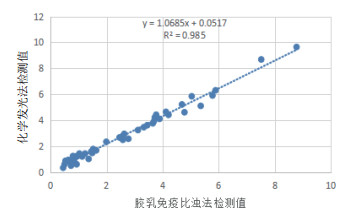
(4) 方法学比对:用1B7包被、5H3标记建立的化学发光检测法与免疫比浊法对50份临床样本的检测数据建立相关性曲线。如图 1所示,相关性方程为y=1.068 5x+0.051 7,相关系数R2为0.985,两者相关性良好。
|
| 图 1 本方法与市售胶乳免疫比浊法检测试剂盒对比结果 |
血清(浆)胱抑素C水平测定,是一种可反映肾小球滤过功能的较理想指标,临床上采用血清中胱抑素C的含量作为检测早期肾损伤的指标之一,临床实验室对胱抑素C的检测主要采用免疫学方法进行检测,其中化学发光法以其线性范围宽、灵敏度高成为免疫学检测方法的一个重要发展方向。由于免疫学检测方法针对的是抗原抗体反应,所以抗体的质量成为决定检测试剂质量的重要因素。
常规的单抗筛选采用包被抗原检测,很多抗原为基因工程抗原或多肽,并不能完全等同于天然的胱抑素C蛋白,因此,筛选出来的抗体并不能保证可以和天然蛋白反应。为解决这一问题,我们采用包被抗原,在检测体系中加入胱抑素C定值人血清,采用竞争抑制法对抗体鉴定、对初步筛选的抗体配对、对其进行了初步分析性能评估,建立了线性范围为50-20 000 ng/mL、最低检测限为3 ng/mL的化学发光胱抑素C检测方法,比起现有试剂,50-20 000 ng/mL的检测范围更宽,灵敏度也更高。本研究为后续优选出更适合化学发光法的配对抗体,为该类试剂质量提升提供了核心物质。
4 结论本实验以合成胱抑素C多肽为抗原免疫小鼠,采用杂交瘤技术制备单克隆抗体,以人胱抑素C天然血清为样本通过酶联免疫竞争抑制法筛选获得胱抑素C单抗细胞39株。优选出配对抗体建立了化学发光检测胱抑素C的方法。
| [1] |
Xu Y, et al. Cystatin C is a disease-associated protein subject to mul-tiple regulation[J]. Immunol Cell Biol, 2015, 93(5): 442-451. DOI:10.1038/icb.2014.121 |
| [2] |
Odutayo A, Cherney D. Cystatin C and acute changes in glomerular filtration rate[J]. Clin Nephrol, 2012, 78(1): 64-75. |
| [3] |
Andersen TB. Estimating renal function in children:a new GFR-model based on serum cystatin C and body cell mass[J]. Dan Med J, 2012, 59(7): B4486. |
| [4] |
袁俊蓉. 胱抑素C、肌酐和尿素氮在肾脏损害中的诊断价值[J]. 中外医学研究, 2017, 15(18): 47-48. |
| [5] |
李萍, 冷峰, 徐维家. 改良MDRD公式、血清肌酐、胱抑素C、β2微球蛋白及甲状旁腺素在慢性肾病早期诊断中的临床应用[J]. 国际检验医学杂志, 2013(22): 3013-3014, 3016. DOI:10.3969/j.issn.1673-4130.2013.22.032 |
| [6] |
王建霞. 血清胱抑素C在糖尿病肾功能检测中的临床意义[J]. 河南医学研究, 2017, 26(18): 3395-3396. DOI:10.3969/j.issn.1004-437X.2017.18.085 |
| [7] |
Ravn B, Prowle JR, Mårtensson J, et al. Superiority of SerumCystatin C over creatinine in prediction of long-term prognosis at discharge from ICU[J]. Crit Care Med, 2017, 45(9): e932-e940. DOI:10.1097/CCM.0000000000002537 |
| [8] |
魏丽丽, 徐新娟, 等. 血清胱抑素C在高血压患者肾功能评价中的应用[J]. 中华高血压杂志, 2014(1): 79-81. |
| [9] |
霍燕微. 血清胱抑素C对小儿急性肾功能衰竭的诊断价值[J]. 中国医药科学, 2015(04): 185-187. |
| [10] |
黄秀红, 陈聪, 等. 血清胱抑素C水平对类风湿性关节炎患者早期肾损害的临床价值[J]. 河北医学, 2011(3): 294-296. DOI:10.3969/j.issn.1006-6233.2011.03.004 |
| [11] |
杜婧, 魏枫. 胱抑素C在多种肾脏疾病中的应用及研究进展[J]. 国际检验医学杂志, 2014(21): 2927-2928. DOI:10.3969/j.issn.1673-4130.2014.21.028 |
| [12] |
崔逸峰, 宋瑞鹏, 郭晓, 等. CST1基因在肿瘤中的研究进展[J]. 实用肿瘤学杂志, 2017, 31(04): 359-362. |
| [13] |
王云龙, 唐艳秋, 陈兴业. 免疫诊断试剂实用技术[M]. 北京: 海洋出版社, 2009, 132-135.
|
| [14] |
叶余辉. 胱抑素C及其检测方法的研究进展[J]. 中国医药指南, 2014(29): 55-56. |
| [15] |
朱薇, 王静, 王丽娜, 等. 免疫比浊法测定的胱抑素C试剂盒性能验证和评价[J]. 检验医学与临床, 2017, 14(20): 2975-2976, 2979. DOI:10.3969/j.issn.1672-9455.2017.20.001 |
| [16] |
Perlenfein TJ, Murphy RM. Expression, purification, and characterization of human cystatin C monomers and oligomers[J]. Protein Expr Purif, 2016, 117: 35-43. DOI:10.1016/j.pep.2015.09.023 |
| [17] |
陈特. 人胱抑素C可溶性表达、多克隆抗体制备及检测方法的建立[D]. 重庆: 重庆医科大学, 2012.
|
| [18] |
陈婷梅. 人胱抑素C抗体制备和检测方法建立及其方法学评价[D]. 重庆: 重庆医科大学, 2007.
|
| [19] |
郑大勇, 罗荣城, 韩焕兴. 非竞争性ELISA法测定人源抗HBsAg Fab功能性亲和常数[J]. 解放军医学杂志, 2004(2): 110-112, 119. DOI:10.3321/j.issn:0577-7402.2004.02.007 |
| [20] |
徐杨, 杜惠芬, 连晓雯, 等. 抗人胱蛋白酶抑制剂C单克隆抗体的制备及鉴定[J]. 中国卫生检验杂志, 2016, 26(17): 2436-2438. |
| [21] |
万文徽. 单克隆抗体亲和常数的测定[J]. 细胞与分子免疫学杂志, 1993(2): 72-75. DOI:10.3321/j.issn:1007-8738.1993.02.027 |