2. 吉林省人参基因资源开发与利用工程研究中心,长春 130118
2. Research Center For Ginseng Genetic Resources Development and Utilization, Changchun 130118
在众多膜转运蛋白家族中,主要协同转蛋白超家族(Major facilitaor superfamily,MFS)是一个非常古老且多样化的超家族,也是目前已知最大的膜转运蛋白家族之一。所谓膜转运蛋白(膜运输蛋白)就是承担着物质能量在膜上交换的重责。根据膜转运的转运方式,膜转运蛋白可分为主动转运蛋白和被动转运蛋白。两者之间的差别在于被动转运蛋白是顺物质浓度梯度或电化学梯度穿透膜的运输,不需要能量供应;而主动转运蛋白在物质转运过程中需要能量供应。根据所需能量的来源不同,主动转运蛋白可分为原发性主动转运蛋白和继发性主动转运蛋白,前者在转运过程中由ATP直接水解供能,后者由主动转运中物质在膜内外浓度差造成的高势能提供能量(如MFS转运蛋白超家族)。根据物质转运的方向不同,主动转运蛋白又可分为同向转运蛋白和逆向转运蛋白。在以往的基因组测序数据和大量的生物化学、分子遗传学调查分析中,发现MFS转运蛋白超家族几乎存在于所有生物中,占微生物基因组内编码的溶质转运蛋白的近半数,在高等生物体内也相当普遍。因此,人们致力于MFS转运蛋白的结构解析,探究其转运机制,并发现多种生理功能,以期为人类的生产生活作出重要的贡献。
1 MFS超家族的发展1993年,Marger等[1]利用计算机系统的统计分析方法,考察糖有机酸和药物分子(如大肠杆菌和肺炎链球菌中的四环素等)同向反向的氨基酸序列发现,糖转运蛋白、药物抗性蛋白、磷酸酯/磷酸反向转运蛋白、三羧酸循环中间体协助转运蛋白和寡糖-H+共转运蛋白这5种不同的家族源自共同的祖先,利用这些数据构建系统进化树,确定了集群和集群成员之间的同源性,结果显示有超过50种蛋白家族被定义其中,这些蛋白被命名为主要协同转运蛋白超家族。
自1993年被发现以来,人们利用信息技术等统计分析手段逐渐发现了更多的MFS家族成员[2-3],先后由12个家族扩展到34个家族、74个家族再到82个家族。随着研究的深入,根据转运蛋白分类数据库(Transporter classification database,TCDB)[4-5]显示,截至2017年MFS超家族已经有95个家族(表 1),包括超过一百万个序列成员,其长度大都分布在400-600个氨基酸残基之间。
MFS转运蛋白利用目标底物的电化学梯度来驱动运输,有如下转运方式:
单一转运:底物分子(转出)⇌底物分子(转入);
同向转运蛋白:底物分子(转出)+H+/Na+(转出)⇌底物分子(转入)+ H+/Na+(转入);
反向转运蛋白:底物分子A(H+/溶质,转出)+底物分子B(转入)⇌底物分子A(H+/溶质,转入)+底物分子B(转出)。
起初,人们认为MFS超家族只是在糖的转运上发挥功能[6],而后研究发现,超家族中每一个家族成员都运输着一组不同的相关化合物,其转运底物除了单糖、多元醇,还能特异性转运药物分子、神经递质、三羧酸循环代谢物、磷酸化糖酵解中间产物、氨基酸、肽、铁载体(外排)、铁-铁载体(吸收)、核苷、有机阴离子和无机阴离子等,这些发现说明MFS超家族功能的多样化。
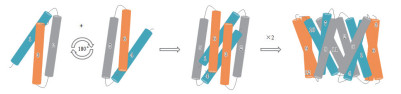
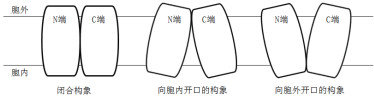
2 MFS超家族的结构解析目前,膜转运蛋白序列的系统发育分析在进化途径、运输系统、蛋白结构域等方面陆续产生报道。这些报道表明,即使具有相似拓扑结构的转运蛋白家族,在进化的时间和途径上也是相互独立的。研究表明,拥有不同功能的转运蛋白可能有着不同的折叠方式。在众多转运家族中,MFS转运蛋白超家族拥有其独特的折叠方式,被研究人员命名为“MFS折叠(MFS fold)”[7]。组成蛋白质的多肽链是由N端到C端,科研人员经过近几年解析出的蛋白构象总结,发现在MFS转运蛋白超家族中,有的N端和C端结构域呈闭合构象,有的则同在胞外或胞内一侧,由于N端和C端相隔较近而展现出蛋白朝胞内或胞外张开的构象[8-9](图 1)。经过科研人员在MFS转运蛋白序列的系统发育分析及转运蛋白结构解析,发现MFS超家族蛋白整个家族的序列分析在进化上可能是由3个跨膜螺旋(Transmembrane helical segments,TMHs)经过重复事件构成的,以“3+3”反向重复的进化模式[10]分别构成了具有6个跨膜α-螺旋的N端结构域和6个跨膜α-螺旋的C端结构域,即N端的TM1-3及其反向重复的TM4-6和C端的TM7-9及其反向重复的TM10-12(图 2)[11]。两个结构域彼此在序列上缺乏相似性,但在蛋白结构上相互对称,并共同构成了具有12个跨膜α-螺旋的构象,也就是MFS转运蛋白超家族的蛋白结构中经典的12个跨膜螺旋单位[12]。
|
| 图 1 MFS转运蛋白的三种构象 |
在很早以前,人们推测MFS转运蛋白家族成员中都有着共同的基础结构,即12个跨膜螺旋,但对于这个推测一直没有直接证据来证明。2001年,Heymann等[13]对产甲酸草酸杆菌(Oxalobacter formigenes)中草酸盐转运蛋白家族(Oxalate transporter,OxlT)的二维晶体进行了电子晶体学分析,确定了这种膜转运蛋白的结构,他们在6Å分辨率下发现每个单体分子都存在12个跨膜螺旋,并在投影密度图中发现每个分子都显示出一个空腔,并认为这个空腔与基质运输途径相关联。次年,Hirai等[14]再一次突破,在6.5Å分辨率下解析了OxlT的三维结构,发现OxlT的12个螺旋排列在中心腔周围,且被分为了3组,呈现非常对称的结构,认为MFS转运蛋白的二级结构为3个螺旋的四次重复,为这种转运蛋白能够进行双向底物转运提供了分子层面的证据。2003年,Abramson等[15]首次报道了3.5Å高分辨率的乳糖质子转运蛋白(Lactose permease,LacY)的X射线晶体结构,LacY具有N端和C端两个结构域,每个结构域具有6个跨膜螺旋,呈现对称分布,并向细胞质一侧开放其内部的亲水腔体,揭示了腔体中糖的结合位点,鉴定了在底物识别和质子易位中起主要作用的残基。同年Huang等[16]在3.3Å高分辨率下同样发现了甘油-3-磷酸盐/磷酸反向转运蛋白(Glycerol-3-phosphate transporter,GlpT),它能运输甘油-3-磷酸进入细胞质和无机磷酸盐进入细胞周质,N端和C端同样发现呈现对称构象。LacY和GlpT构象的探索阐明了MFS蛋白家族的整体结构,并提出了MFS运输机制的最初模型。2010年,Dang等[17]报告了在3.1Å分辨率下岩藻糖质子同向转运蛋白(L-fucose/proton symporter,FucP)呈现向细胞外侧开口的构象。除此之外,Newstead等[18]提出小肽转运体(Peptide transporter,PepTSo)晶体结构,采用3.6Å高分辨率揭示了该构象的封闭状态,将肽结合位点定位在中央亲水腔内。2013年,Pedersen等[19]在2.9Å分辨率下发现磷酸盐转运蛋白(Piriformospora indica phosphate Transporter,PiPT)蛋白结构也同为封闭状态,该结构表明质子和磷酸盐的出口途径,它也是真核生物中第一个结构被解析的MFS转运蛋白。在人类中,葡萄糖转运蛋白(Glucose transporter type 1,GLUT1)是第一个被解析出来的MFS转运蛋白,它可以催化葡萄糖向红细胞中扩散并为机体提供葡萄糖。Deng等[20]探究了3.2Å分辨率下的GLUT1的晶体结构发现,其同样具有典型的MFS转运蛋白家族12跨膜螺旋结构,且呈现向内开放的构象。
然而,一些MFS转运蛋白除了具有典型的12跨膜螺旋构象之外,在C端结构域和N端结构域之间还插着两个TM螺旋,形成了14个跨膜螺旋。由于插入的两个TM螺旋在序列上是不保守的,因此人们在以前认为这两个螺旋是没有必要的[21]。Zhao等[22]发现大肠杆菌中的二肽转运蛋白(Escherichia coli YbgH,EcYbgH)也是一个经典12跨膜螺旋构象加两个TM螺旋的插入(HA和HB),但插入的HA和HB对于转运蛋白内部构象的运输活动很重要。
相比于其他转运蛋白家族,MFS转运蛋白超家族在探究历史上是一个相对年轻的超家族,人们致力于探究膜上转运蛋白的结构,揭示转运机制,以期开发出多效而有益的作用。但是,由于膜上转运蛋白的疏水性,使其很难脱离原生环境并在体外进行研究,高度的不稳定性限制了科研人员探究的脚步。Harris等[23]利用远-紫外圆二色谱(far-UV circular dichroism,CD)评估了MFS超家族转运蛋白,发现它们即使拥有相同的折叠,其化学及热稳定性仍是不相同的。同时他们还比较了PepTso、LacY、GalP、GlpT和XylE五种不同的MFS转运蛋白,以及LacY突变体LacY-C154G的稳定性,并将以上这些蛋白分为敏感类别(urea-sensitive)和耐尿素(uera-resistant)两大类别。
即使晶体结构的探索如此困难,但在国内外科研人员不懈的努力下,由最初MFS家族成员中低分辨率的蛋白晶体结构的解析来印证人们以往对MFS转运蛋白结构的推测,再到后来的高分辨率解析并探索其转运机制,MFS转运蛋白结构的解析不断地带给人们惊喜。至今,包括原核和真核生物在内,已有超过20个独特的MFS转运蛋白的高分辨率晶体结构被解析出来,为探究MFS转运蛋白的底物结合及其转运机制奠定了结构基础和提供了理论依据。
3 MFS超家族的转运机制目前普遍认为,MFS转运蛋白在运输方式上采用了“摇杆开关”的转运方式,这是一种经典的交替开放模型。当底物分子向细胞内转运时,MFS转运蛋白会打开胞外一侧,并同时闭合其对面,即胞内一侧,而后底物分子与底物结合位点相结合,引起蛋白构象交替开放变化,即原本关闭的胞内一侧打开的同时,关闭开放的胞外一侧,致使底物分子顺利运送至细胞内;反之亦然。
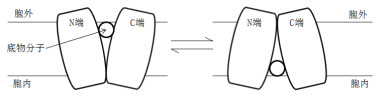
最初,人们通过研究LacY转运蛋白构象,认为,MFS转运蛋白仅存在向胞内开口和向胞外开口两种构象,即在运动中仅呈现一端开口另一端随之闭合的刚体运动(图 3)。但刘裕峰等[24]通过加速算法发现,MFS超家族中的岩藻糖转运蛋白FucP在发生构象变化时经历了一个两端闭合的构象,其中有3个跨膜螺旋在运动时发生旋转运动,其余的螺旋发生侧向运动,这表示FucP转运蛋白在发生构象变化时并不是完全的刚体运动,这种运动方式与前文所述的LacY转运蛋白所具有的向胞内开口和向胞外开口这两种构象的刚体运动完全不同[25]。此外,研究人员还发现FucP上的第135位谷氨酸(E135)参与质子的传递并影响底物转运的速率,且氢键的断裂可能促使蛋白构象的转变,后续研究均有证实[20, 22]。但在整个转运过程中,不发生底物分子的转变,仅是转运蛋白构象上的变化,且底物分子始终不会同时暴露在膜的两侧[11]。
|
| 图 3 转运蛋白的刚体运动 |
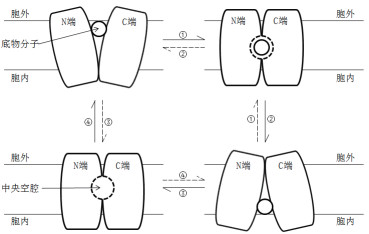
近几年通过蛋白构象的研究发现,MFS转运蛋白除了两端的构象,通常还包括一个中央空腔,人们推测这可能是蛋白的底物结合位点。MFS转运蛋白在广义上的转运反应就是底物分子在膜内外的运入及运出,底物分子与蛋白质通常都是特异性结合,从阴离子到肽再到单糖、药物分子等。MFS转运蛋白超家族中的转运蛋白几乎都以其转运底物命名,排列在中央亲水腔内的特定侧链很大程度上决定了底物的特异性。例如,通过研究PepTSo转运蛋白的晶体结构发现,内部存在中央亲水腔,并将肽结合位点定位在腔中。同样,GlpT的底物易位孔位于中心,并封闭至细胞周质,封闭端含有两个精氨酸,包含底物结合位点。研究发现,在底物结合后,该蛋白质将采取更紧凑的构象[16],这一点也同样证实了MFS转运蛋白的非刚体运动,也直接说明了底物特异性或反应环境内的状态(图 4)。
|
| 图 4 MFS转运蛋白的转运机制简图 |
如今,MFS转运蛋白超家族的蛋白结构及其转运机制已经得到诸多解析,同时,发现了一些MFS转运蛋白在人类、真菌和植物中的诸多生理作用。人类中具有多种MFS转运蛋白,在溶质载体和非典型性溶质载体(Solute carriers,SLCs)中,两者具有相似的序列及进化起源[26],在MFS转运蛋白领域研究的越来越广泛[27-29]。目前在溶质载体中有SLC2、SLC15等16个家族包含MFS转运蛋白[30],除此之外,有MFSD1、MFSD2A、SV2A、SVOP、SNPS1和UNC93A等28个MFS类型的非典型性溶质载体,Perland等将它们分为15个家族(AMTF1-15),并以AMTF命名法代替了SLC命名法[31]。由此可见,MFS转运蛋白超家族在人类生理学研究上占据着重要的地位,尤其在许多疾病的防治上发挥着重要功能,主要用于药物的运输及耐药性。例如,缺乏GLUT1转运蛋白会导致大脑萎缩、发育迟缓等葡萄糖缺乏病症[32]。此外,Deng和Yan等[20]还发现GLUT1在癌细胞的新陈代谢上也发挥着重要的功能,该发现为治疗癌症提供了可能性。另外,成年小鼠的脑中MFS转运蛋白的位置显示出丰富的神经元蛋白染色,说明MFS转运蛋白与神经性退行性疾病也息息相关[31, 33]。植物柑橘类链格孢病原菌中的AaMFS19突变体受Yap1、Skn7和MAP激酶的调控,能增加对铜离子、2-氯-5-羟基吡啶(CHP)和2,3,5-三碘苯甲酸(TIBA)等的敏感性,且研究表明AaMFS19能显示出不同的化学物质抗性[34]。另外,还有一些MFS转运蛋白具有如调节细胞酸碱平衡、维持机体维生素C浓度、促进抗癌和消炎药物吸收和调控机体内锌离子稳态等作用,为糖尿病、疲劳综合征、脑叶酸缺乏症、心血管疾病及癌症等人类疾病的防治提供了依据[35]。除此之外,MFS转运蛋白在植物中也占据着相当重要的地位,如植物磷转运蛋白,介导根系对磷元素的吸收和转运,维持植物中磷元素稳态等[36]。
5 展望就目前看来,MFS转运蛋白超家族的成员仍在不断的增加,人们对MFS的研究越来越深入,从而也带来了许多的思考。对于MFS转运蛋白的结构来说,除了现在人们所认可的经典12个跨膜螺旋外,还陆续发现了具有14个跨膜螺旋结构和24个跨膜螺旋结构的蛋白,这提示我们在这个超家族领域中,可否存在不为人们所知的其他数量的跨膜螺旋结构,但从系统发育上看,它们拥有共同的祖先,都是由3个跨膜螺旋反向复制而演化过来的。现今,人们较多利用膜蛋白结晶方法和冷冻电子显微镜技术等手段,陆续解析出更多的高分辨率晶体结构,为探究MFS转运蛋白的转运机制提供更多基础结构。除了C、N两端的结构域,已发现的中央疏水腔与转运机制是否还具有其他关联性。在以往的研究中,对于植物来说,一些转运蛋白是否能促进一些药用植物产生有效的次级代谢产物或赋予植物各种抗性及耐受性等。除此之外,MFS超家族有许多蛋白还与疾病相关,这为各类疾病提供了药物靶点,人们能否利用这些药物靶点,通过控制底物的运输或基因的表达来防治相关疾病。而直接与人类相关的人源MFS转运蛋白,将在药理及医学研究上被发掘出更多、更广泛的作用。
| [1] |
Marger MD, Saier MH. A major superfamily of transmembrane facilitators that catalyse uniport, symport and antiport[J]. Trends in Biochemical Bciences, 1993, 18(1): 13-20. DOI:10.1016/0968-0004(93)90081-W |
| [2] |
Pao SS, Paulsen IT, Saier MH. Major facilitator superfamily[J]. Microbiology And Molecular Biology Reviews, 1998, 62(1): 1-34. |
| [3] |
Saier Jr MH, Beatty JT, Goffeau A, et al. The major facilitator superfamily[J]. J Mol Microbiol Biotechnol, 1999, 2: 257-279. |
| [4] |
Saier Jr MH, Tran CV, Barabote RD. TCDB: The transporter classification database for membrane transport protein analyses and information[J]. Nucleic Acids Research, 2006, 34(suppl 1): 181-186. |
| [5] |
Saier Jr MH, Reddy VS, et al. The transporter classifi-cation database[J]. Nucleic Acids Res, 2013, 42(D1): 251-258. |
| [6] |
Henderson PJF, Maiden MCJ. Homologous sugar transport proteins in Escherichia coli and their relatives in both prokaryotes and eukaryotes[J]. Philos Trans R Soc Lond B Biol Sci, 1990, 326(1236): 391-410. DOI:10.1098/rstb.1990.0020 |
| [7] |
Boudker O, Verdon G. Structural perspectives on secondary active transporters[J]. Trends Pharmacol Sci, 2010, 31(9): 418-426. DOI:10.1016/j.tips.2010.06.004 |
| [8] |
Yan N. Structural advances for the major facilitator superfamily(MFS)transporters[J]. Trends Biochem Sci, 2013, 38(3): 151-159. DOI:10.1016/j.tibs.2013.01.003 |
| [9] |
Yan N. Structural biology of the major facilitator superfamily transporters[J]. Annu Rev Biophys, 2015, 44: 257-283. DOI:10.1146/annurev-biophys-060414-033901 |
| [10] |
邓东, 颜宁. MFS超家族转运蛋白结构基础及转运机制[J]. 科学通报, 2015, 60(8): 720-728. |
| [11] |
Shi Y. Common folds and transport mechanisms of secondary active transporters[J]. Annu Rev Biophys, 2013, 42: 51-72. DOI:10.1146/annurev-biophys-083012-130429 |
| [12] |
Reddy VS, Shlykov MA, et al. The major facilitator superfamily(MFS)revisited[J]. FEBS J, 2012, 279(11): 2022-2035. DOI:10.1111/j.1742-4658.2012.08588.x |
| [13] |
Heymann JAW, Sarker R, Hirai T, et al. Projection structure and molecular architecture of OxlT, a bacterial membrane transporter[J]. EMBO J, 2001, 20(16): 4408-4413. DOI:10.1093/emboj/20.16.4408 |
| [14] |
Hirai T, Heymann JA, et al. Three-dimensional structure of a bacterial oxalate transporter[J]. Nat Struct Biol, 2002, 9(8): 597. |
| [15] |
Abramson J, Smirnova I, Kasho V, et al. Structure and mechanism of the lactose permease of Escherichia coli[J]. Science, 2003, 301(5633): 610-615. DOI:10.1126/science.1088196 |
| [16] |
Huang Y, Lemieux MJ, Song J, et al. Structure and mechanism of the glycerol-3-phosphate transporter from Escherichia coli[J]. Science, 2003, 301(5633): 616-620. DOI:10.1126/science.1087619 |
| [17] |
Dang S, Sun L, Huang Y, et al. Structure of a fucose transporter in an outward-open conformation[J]. Nature, 2010, 467(7316): 734-738. DOI:10.1038/nature09406 |
| [18] |
Newstead S, Drew D, et al. Crystal structure of a prokaryotic homologue of the mammalian oligopeptide-proton symporters, PepT1 and PepT2[J]. EMBO J, 2011, 30(2): 417-426. DOI:10.1038/emboj.2010.309 |
| [19] |
Pedersen BP, Kumar H, Waight AB, et al. Crystal structure of a eukaryotic phosphate transporter[J]. Nature, 2013, 496(7446): 533-536. DOI:10.1038/nature12042 |
| [20] |
Deng D, Xu C, Sun P, et al. Crystal structure of the human glucose transporter GLUT1[J]. Nature, 2014, 510(7503): 121-125. DOI:10.1038/nature13306 |
| [21] |
Daniel H, Spanier B, Kottra G, et al. From bacteria to man: archaic proton-dependent peptide transporters at work[J]. Physiology, 2006, 21(2): 93-102. DOI:10.1152/physiol.00054.2005 |
| [22] |
Zhao Y, Mao G, Liu M, et al. Crystal structure of the E. coli peptide transporter YbgH[J]. Structure, 2014, 22(8): 1152-1160. DOI:10.1016/j.str.2014.06.008 |
| [23] |
Harris NJ, Findlay HE, Sanders MR, et al. Comparative stability of major facilitator superfamily transport proteins[J]. European Biophysics Journal, 2017, 46(7): 655-663. DOI:10.1007/s00249-017-1197-7 |
| [24] |
刘裕峰, 孙林峰, 龚海鹏. 运用加速算法研究岩藻糖转运蛋白FucP的转运机理[J]. 2013.
|
| [25] |
Smirnova IN, Kasho V, Kaback HR. Protonation and sugar binding to LacY[J]. Proc Natl Acad Sci, 2008, 105(26): 8896-8901. DOI:10.1073/pnas.0803577105 |
| [26] |
Emelie P, Emilia L, Eriksson MM, et al. The putative SLC transporters Mfsd5 and Mfsd11 are abundantly expressed in the mouse brain and have a potential role in energy homeostasis[J]. PLoS One, 2016, 11(6): e0156912. DOI:10.1371/journal.pone.0156912 |
| [27] |
Nguyen LN, Ma D, Shui G, et al. Mfsd2a is a transporter for the essential omega-3 fatty acid docosahexaenoic acid[J]. Nature, 2014, 509(7501): 503. DOI:10.1038/nature13241 |
| [28] |
Perland E, Hellsten SV, Schweizer N, et al. Structural prediction of two novel human atypical SLC transporters, MFSD4A and MFSD9, and their neuroanatomical distribution in mice[J]. PLoS One, 2017, 12(10). |
| [29] |
Damme M, Brandenstein L, Fehr S, et al. Gene disruption of Mfsd8, in mice provides the first animal model for CLN7 disease[J]. Neurobiology of Disease, 2014, 65(5): 12-24. |
| [30] |
Perland E, Fredriksson R. Classification systems of secondary active transporters[J]. Trends Pharmacol Sci, 2017, 3: 305. |
| [31] |
Perland E, Bagchi S, Klaesson A, et al. Characteristics of 29 novel atypical solute carriers of major facilitator superfamily type: evolutionary conservation, predicted structure and neuronal co-expression[J]. Open Biology, 2017, 7(9): pii 170142. DOI:10.1098/rsob.170142 |
| [32] |
Pascual JM, Wang D, Lecumberri B, et al. GLUT1 deficiency and other glucose transporter diseases[J]. European Journal of Endocrinology, 2004, 150(5): 627-33. DOI:10.1530/eje.0.1500627 |
| [33] |
Aldahmesh MA, Alhassnan ZN, Aldosari M, et al. Neuronal ceroid lipofuscinosis caused by MFSD8 mutations: a common theme emerging[J]. Neurogenetics, 2009, 10(4): 307. DOI:10.1007/s10048-009-0185-1 |
| [34] |
Chen LH, Tsai HC, Yu PL, et al. A major facilitator superfamily transporter-mediated resistance to oxidative stress and fungicides requires Yap1, Skn7, and MAP kinases in the citrus fungal pathogen Alternaria alternata[J]. PLoS One, 2017, 12(1): e0169103. DOI:10.1371/journal.pone.0169103 |
| [35] |
王月, 徐冰红, 刘虎, 等. 溶质转运蛋白超家族的功能及结构研究进展[J]. 现代生物医学进展, 2017, 17(24): 4775-4783. |
| [36] |
孙传范, 肖凯, 韩胜芳, 等. 植物吸收和转运磷素的分子机理研究进展[J]. 中国农业科技导报, 2011, 13(2): 17-24. |