2. 广西高校干细胞与医药生物技术重点实验室,桂林 541004;
3. 广西师范大学生物医学研究中心,桂林 541004
2. Guangxi Universities Key Laboratory of Stem cell and Biopharmaceutical Technology, Guilin 541004;
3. Research Center for Biomedical Sciences Guangxi Normal University, Guilin 541004
衰老常伴随着相关性疾病的发生,包括各组织、器官疾病如恶性肿瘤、动脉粥样硬化、组织/器官纤维化等[1]。因此,延缓衰老进程中免疫系统的“老化”是重要的研究方向。造血干细胞是所有免疫细胞和血细胞的源泉,是机体免疫监控的发出者。HSCs经分化,形成MPPs,经再分化形成共同淋巴系祖细胞(Common lymphocyte progenitors cells,CLPs)和共同髓系祖细胞(Common myeloid progenitor cells,CMPs),前者经一系列的分化形成B淋巴细胞、T淋巴细胞,NK细胞,形成获得性免疫系统的细胞组分;后者继续分化为GMPs和MEPs(Megakaryocyte/erythroid progenitor cells,巨核细胞/红细胞祖细胞),GMPs经一系列的分化形成先天免疫系统的细胞组分(粒细胞,巨噬细胞等)[2-3]。然而,当外伤感染,肿瘤等病理情况下,GMPs的子细胞会停留在未成熟的状态,该组分的细胞被称之为“髓源性抑制细胞(Myeloid-derived suppressor cells,MDSCs)”[4]。MDSCs能抑制T细胞的活化与增殖,是细胞免疫失能的“原凶”[5]。因此,本研究从免疫的源头出发,分析HSCs及其下游造血祖细胞的发育情况,以诠释衰老进程中免疫系统“老化”,逐渐失能,致使更多伴随衰老进程疾病发生的原因。本研究将为衰老进程中机体免疫下降提供参考。
1 材料与方法 1.1 材料 1.1.1 实验动物本实验使用C57BL/6j小鼠,购于湖南斯莱克景达实验动物有限公司,维持于广西师范大学实验室动物中心。选择8周(青年小鼠)、1年(中年)、2年(老年)的健康雄鼠用于实验。
1.1.2 实验试剂和耗材红细胞裂解液(Solarbio),胎牛血清、DMEM basic(Gibco),Fixation/Permeabi-lization buffer、7-AAD、Anti-Mouse CD34-PE、Anti-Mouse Lin-FITC、Anti-Mouse CD127-PerCP Cy5.5、Anti-Mouse CD117-APC eFlour 780、Anti-Mouse Sca-1-PE-Cy7、Anti-Mouse CD16/32-APC、Anti-Mouse Gr-1-PE、Anti-Mouse CD11b-APC、Anti-Mouse B220-FITC、Anti-Mouse/Human Ki67-PE、Anti-Mouse CD127-PerCP-Cy5.5(eBioscience),70ul细胞筛网(BD)。
1.1.3 实验仪器流式细胞分析仪(BD FACSVe-rse),冷冻离心机Labofuge 400 R、超纯净去离子水组合系统Nanopure(Thermo Scientific)。
1.2 方法 1.2.1 小鼠骨髓细胞(Bone marrow cells,BMs)的提取断颈处死小鼠,将小鼠浸泡于75%酒精20 s;取其股骨和胫骨,并剪去骨两端;用吸取DMEM完全培养液(含1%双抗,10% FBS)的注射器吹出骨髓组织;随后用移液枪将骨髓吹打成单细胞悬液,并收集于离心管中。经离心(4℃,1 200 r/min,5 min,下同)后,加入红细胞裂解液裂解2 min,之后加入PBS稀释终止裂解并经离心后弃上清,加入PBS重悬细胞,经过滤后用70 μm细胞筛过滤,经计数后待用。
1.2.2 小鼠造血细胞丰度分析分别取青年、中年、老年小鼠骨髓2×106细胞,经离心后与特定抗体组合(各取1test抗体经混合后再稀释100倍)混合均匀,将细胞置于4℃避光孵育30 min。孵育结束后洗涤细胞,加人1.5 mL PBS用于流式分析。同时准备空白对照组细胞和孵育单独抗体的细胞,分别用于流式细胞仪电压和补偿调节。
1.2.3 小鼠造血干/祖细胞活化与周期分析细胞经1.2.2行抗体孵育,用Fixation/Permeabilization buffer进步固定渗透(按该试剂盒说明书上执行)。经渗透结束后经离心,去上清,加入稀释100倍的Ki-67,避光、4℃孵育30 min(活化分析)。或加入500 μL PBS,重悬细胞,再加入5 μL7-AAD后常温避光孵育15 min(细胞周期分析),用于流式细胞分析其Ki67+细胞或细胞周期时相分布。
1.2.4 数据分析与处理流式数据用Flowjo7.6上分析;所得整理数据在prism软件上行Two-way ANOVA分析或t检验。
2 结果 2.1 小鼠衰老进程中HSPCs丰度发生特征性变化为分析随年龄增长小鼠HSPCs的丰度变化,分别从老年、中年和青年C57BL/6j小鼠中提取骨髓细胞,标记荧光偶联抗体,行流式细胞术分析。结果发现在衰老进程中造血干/祖细胞丰度发生特征性变化(图 1)。青年小鼠、中年小鼠、老年小鼠骨髓细胞中HSCs、MPPs的丰度随着年龄的增加逐渐升高(HSCs:0.009±0.002%VS 0.019±0.005%VS 0.061±0.013%;MPPs:0.238±0.016% VS 0.301±0.011% VS 0.332±0.023%,P < 0.05)。与之相似的先天免疫细胞的祖细胞GMPs随着年龄的增加其在骨髓细胞中的比例也逐渐升高(0.608±0.106% VS 1.023±0.125% VS 1.330±0.089%,P < 0.05)。但处于MPPs和GMPs之间的CMPs随着年龄的增加反而逐渐降低(0.583±0.103% VS 0.388±0.052% VS 0.227±0.032%,P < 0.05)。巨核细胞/红细胞祖细胞随小鼠年龄增加未表现出明显的变化。随着小鼠年龄增长,其造血干/祖细胞发生的特征变化提示HSCs可能逐渐被活化,细胞得以增殖累积,且偏向髓系细胞分化。
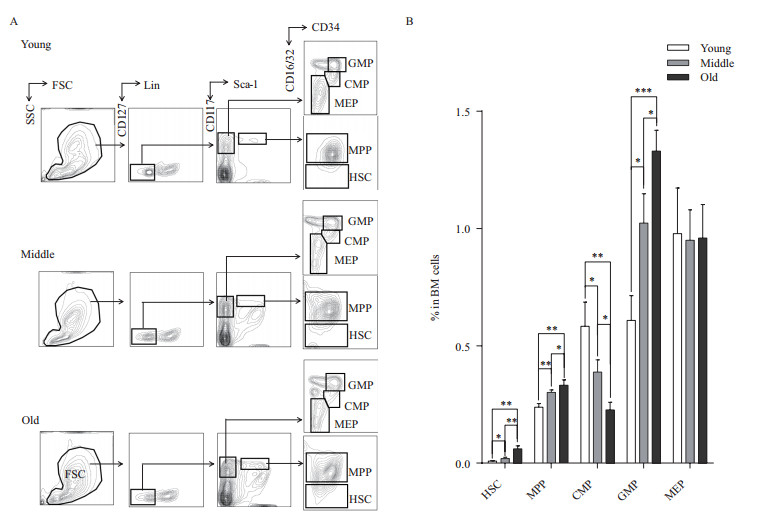
|
| 图 1 青年、中年和老年小鼠骨髓细胞中造血干/祖细胞的丰度分析 A:不同年龄小鼠骨髓细胞中HSPCs的丰度分析代表性流式分析图;B:不同年龄小鼠骨髓细胞中HSPCs的丰度数据统计柱型图(数据统计为3次以上独立实验,* P<0.05,** P<0.01,*** P<0.001。HSC:Lin-Sca-1+CD117+CD127-CD16/32-,MPP:Lin-Sca- 1+CD117+CD127-CD16/32+,CMP:Lin-Sca-1-CD117+CD127-CD34-CD16/32-,GMP:Lin-Sca-1-CD117+CD127-CD34+CD16/32+,MEP:Lin-Sca-1-CD117+CD127-CD34-CD16/32-) |
为分析小鼠骨髓HSPCs增殖活性是否改变,首先分析了HSCs的激活情况;其次分析了造血干/祖细胞是否加速细胞分裂;利用Ki67和7-AAD检测不同年龄阶段的小鼠HSCs退出静息和HSPCs进入细胞周期的情况。结果显示,小鼠随着年龄的增加,HSCs退出G0期(Ki67+)的细胞增多。相比青年小鼠,老年小鼠HSCs更多被活化(老年:青年=0.096±0.020% VS 0.018±0.003%),进入细胞周期(图 2-A)。与之相一致的是,随着小鼠年龄的增加,HSCs进入分裂期(S/G2/M)的频率增加(图 2-B)。小鼠骨髓造血祖细胞随着年龄增长,细胞周期时相同样的发生显著性改变。与细胞丰度检测结果一致,MPPs、GMPs随年龄增加进入分裂期的细胞比例也增加,细胞分裂活跃。CMPs在中、老年小鼠骨髓中分裂期的细胞减少。MEPs分裂期的细胞比例在小鼠衰老进程中并未发生明显改变。以上结果揭示了随着小鼠年龄的增长,其部分HSCs被活化,经过快速分裂和细胞增殖,细胞得以累积;同时细胞加速分化形成下游细胞,并偏向髓系祖细胞分化。
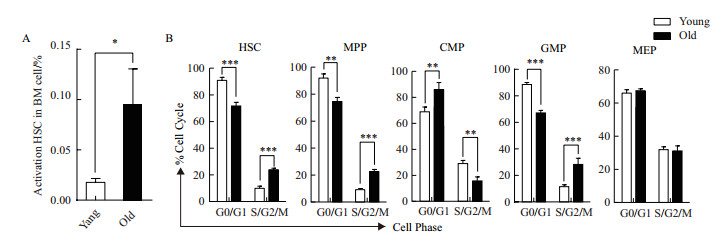
|
| 图 2 衰老进程中小鼠HSPCs细胞活化与周期时相分布 A:小鼠骨髓细胞中活化的HSCs的细胞丰度分析统计柱形图;B:造血干/祖细胞细胞周期时相分布柱形图(数据统计为3次以上独立实验,* P<0.05,** P<0.01,*** P<0.001) |
为进一步验证在衰老进程中小鼠骨髓HSPCs是偏向髓系方向分化的,本研究利用流式细胞术检测了骨髓中免疫细胞产生情况(因T细胞成熟于胸腺,故未进行T细胞含量的分析)。结果(图 3)表明,老年小鼠骨髓中B淋巴细胞(B220+)明显减少(老年:青年=8.14±1.84% VS 20.72±2.22%,图 3-A)。同时,老年小鼠骨髓中髓源性抑制细胞(Gr-1+CD11b+)比例显著高于青年小鼠中的髓源性抑制细胞(55.90±5.47% VS 32.4±1.42%,图 3-B)。该结果证明了衰老进程中,小鼠HSCs偏向髓系方向分化,且免疫抑制细胞群在积累。
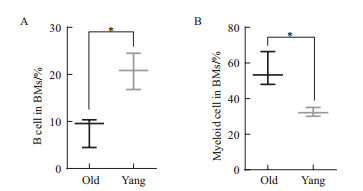
|
| 图 3 衰老进程中小鼠骨髓中免疫细胞的丰度分析 A:小鼠骨髓中B细胞的丰度分析统计柱形图;B:小鼠骨髓中髓源性抑制细胞的丰度分析统计柱形图(数据统计为3次以上独立实验,* P<0.05) |
包括癌症在内的许多人类疾病的发病率会随着年龄的增加而提高[6],这些疾病增加的原因之一是免疫系统“老化”。造血干细胞作为免疫系统的发出者,是衰老进程中免疫下降、免疫细胞失衡的根本原因。为此检测造血干/祖细胞在衰老进程中的细胞丰度、活化、增殖情况,并初步分析了免疫细胞的组分变化。据研究结果得出如下结论:(1)在衰老进程中HSPCs丰度增加,细胞增殖活跃;(2)HSCs的分化偏向髓系抑制细胞,产生大量GMPs和经典的髓源性抑制细胞。衰老与肿瘤、应急等病理情况有着相似的HSPCs丰度变化特征。在肿瘤进程中,HSCs大量激活与扩增,并促进下游MPPs、GMP积累,髓源性抑制细胞也积累,促进免疫抑制[7];在感染状态下,HSCs同样得到活化,髓系细胞增殖加速[8-9]。揭示了HSC活化、髓系扩增是衰老和应急状态下的一个共同特征。
HSCs的偏向分化在HSCs自我更新中就得以发展。Weksberg等[10]发现侧群细胞(Side population,SP)CD150+或LSK(Lin-Sca-1+CD117+)CD150+的造血干细胞亚群在老年(80week)小鼠中明显高于青年小鼠(8week),该群细胞经体内分化主要向髓系细胞分化,提示了该亚群的HSCs的偏髓系分化源于HSCs本身的髓系偏向。其他的研究也表明,表型LKS CD34-Flt3-的HSCs CD150上调表达,随着年龄的增长,该亚群细胞在整个老年HSCs池中的占有支配地位。该HSCs亚群移植重建后的造血发生了骨髓细胞偏倚[11-12]。基于这些结果与研究结论为本研究中髓系细胞偏向分化给予佐证。
本研究组的前期研究提出了早期造血祖细胞(主要是GMP)具有免疫抑制功能[7]。然而在衰老进程中,HSCs的活化和扩增,以及MPP的扩增的最终目的可能是为GMP及更下游的髓系细胞的积累“服务”(基于在衰老进程中造血细胞的偏髓系分化发育)。积累的髓系细胞明显为免疫抑制奠定了细胞基础,以致衰老伴随着高频率疾病的发生。本研究虽然未提供免疫抑制的直接证据,但正常来源GMPs和MDSCs同样有着免疫抑制功能,这在本研究组之前的工作中已经得到证实。另外,在衰老进程中CD8+ T细胞增殖能力减弱,未成熟的T细胞大量积累[13]。以上足以证明髓系抑制细胞在T细胞的增殖与活化中可能发挥着重要的抑制作用。
近年来HSLs经典的分化通路受到冲击。Adolfsson[14]提出MPPs直接分化形成GMPs和MEPs,没有CMPs的存在。同样地,在人类HSCs中也得到了相同的结果[15]。本研究中CMPs的丰度会随着衰老进程和肿瘤发生[7]而细胞比例下降,与髓系扩增虽然相矛盾,但这一现象可能为Adolfsson J提出分化通路提供参考。
衰老免疫主要问题之一是免疫细胞失衡,因此针对免疫细胞失衡可开展如下工作:着重从免疫细胞的源头——HSCs上解决髓系偏向分化的问题,促进免疫细胞平衡发育;提高老年机体免疫器官功能作用,防范如老年胸腺等器官的衰竭,提高老年机体获得性免疫细胞的再生能力;促进髓系细胞成熟发育,减少未成熟细胞、髓系抑制细胞的积累。
4 结论本研究发现在小鼠骨髓细胞中HSCs和MPPs、GMPs的丰度随着年龄的增加而显著升高,细胞分裂能力增强。GMP及其下游的髓系抑制细胞积累。结果揭示了在衰老进程中HSCs被活化,增殖并偏向髓系抑制细胞分化与积累,抑制机体免疫功能。
| [1] |
付小明, 花芳, 胡卓伟. 细胞衰老与衰老相关性疾病[J]. 生理科学进展, 2012, 43(5): 376-380. DOI:10.3969/j.issn.0559-7765.2012.05.014 |
| [2] |
Osawa M, Hanada K, Hamada H, et al. Long-term lymphohematopo-ietic reconstitution by a single CD34-low/negative hematopoietic stem cell[J]. Science, 1996, 273(5272): 242-245. DOI:10.1126/science.273.5272.242 |
| [3] |
Majeti R, Park CY. Weissman IL. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood[J]. Cell Stem Cell, 2007, 1(6): 635-645. DOI:10.1016/j.stem.2007.10.001 |
| [4] |
Kusmartsev S, Gabrilovich DI. Immature myeloid cells and cancer-associated immune suppression[J]. Cancer Immunol Immunother, 2002, 51(6): 293-298. DOI:10.1007/s00262-002-0280-8 |
| [5] |
Bronte V, Serafini P, De Santo C, et al. IL-4-induced arginase 1 suppresses alloreactive T cells in tumor-bearing mice[J]. J Immunol, 2003, 170(1): 270-278. DOI:10.4049/jimmunol.170.1.270 |
| [6] |
DePinho RA. The age of cancer[J]. Nature, 2000, 408(6809): 248-254. DOI:10.1038/35041694 |
| [7] |
Pu S, Qin B, He H, et al. Identification of early myeloid progenitors as immunosuppressive cells[J]. Sci Rep, 2016, 6: 23115. DOI:10.1038/srep23115 |
| [8] |
Burberry A, Zeng MY, et al. Infection mobilizes hematopoietic stem cells through cooperative NOD-like receptor and toll-like receptor signaling[J]. Cell Host Microbe, 2014, 6: 779-791. |
| [9] |
Nagai Y, Garrett KP, Ohta S, et al. Toll-like receptors on hematopoietic progenitor cells stimulate innate immune system replenishment[J]. Immunity, 2006, 24: 801-812. DOI:10.1016/j.immuni.2006.04.008 |
| [10] |
Weksberg DC, Chambers SM, et al. CD150- side population cells represent a functionally distinct population of long-term hematopoietic stem cells[J]. Blood, 2008, 4: 2444-2451. |
| [11] |
Beerman I, Bhattacharya D, Zandi S, et al. Functionally distinct hematopoietic stem cells modulate hematopoietic lineage potential during aging by a mechanism of clonal expansion[J]. Proc Natl Acad Sci USA, 2010, 107(12): 5465-5470. DOI:10.1073/pnas.1000834107 |
| [12] |
Larisa VK, Kristin F, Feng X, et al. Inflamm-aging of hematopoiesis, hematopoietic stem cells, and the bone marrow microenvironment[J]. Front Immunol, 2016, 5: 502. |
| [13] |
Akbar AN, Fletcher JM. Memory T cell homeostasis and senescence during aging[J]. Curr Opin Immunol, 2005, 17(5): 480-485. DOI:10.1016/j.coi.2005.07.019 |
| [14] |
Adolfsson J, Månsson R, Buza-Vidas N, et al. Identification of Flt3+ lympho-myeloid stem cells lacking erythro-megakaryocytic potential a revised road map for adult blood lineage commitment[J]. Cell, 2005, 121(2): 295-306. DOI:10.1016/j.cell.2005.02.013 |
| [15] |
Notta F, Zandi S, Takayama N, et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny[J]. Science, 2016, 351(6269): aab2116. DOI:10.1126/science.aab2116 |




