2. 中国科学院动物研究所,北京100101
2. Institute of Zoology, Chinese Academy of Science, Beijing 100101
人尿源干细胞(Human urine-derived stem cells,hUSCs)是人尿液中具有良好增殖活性和多向分化能力的成体干细胞,约占尿液中存活细胞的0.2%,具有间充质干细胞的各种生物学特性[1]。hUSCs具有来源广泛、取材安全、操作简单、成本低、自我更新和多向分化能力强等优点,是再生医学理想的种子细胞来源[2]。目前细胞治疗和组织工程处于快速发展期,人们已经开始探索利用hUSCs来实现疾病治疗、组织再生或器官重建,例如利用hUSCs进行个体化的肾遗传疾病的治疗[3]、hUSCs与β-TCP结合可以应用于骨再生[4]、通过激活信号通路的Wnt/β-catenin诱导hUSCs为成骨细胞[5]、移植过表达血管内皮生长因子的自体hUSCs重建泌尿生殖器[6]等。除了人尿源干细胞本身有多种用途,hUSCs还可以重编程为高质量的诱导多能干细胞(Induced pluripotent stem cells,iPSCs),给iPSCs的临床应用带来光明前景[7]。2012年,研究人员利用逆转录病毒成功将hUSCs重编程为iPSCs,并经克隆形态、AP染色、SSEA-4表达和三胚层分化等验证其为高质量的iPSCs[8]。采用逆转录病毒实现重编程得到的iPSCs安全性低,应用临床风险大,因此研究人员努力探索如何通过非整合的方法实现hUSCs重编程为iPSCs。2017年,美国科学家成功利用仙台病毒的非整合方法实现了尿源干细胞的重编程,得到了克隆形态良好、细胞核型正常和多能性标志物高表达的iPSCs,使hUSCs的应用价值得到提升。
人尿液中存活的细胞可分为终末分化的细胞、未完全分化的祖细胞和未分化的干细胞,其中未分化的干细胞就是人尿源干细胞[9]。早在1972年,Sutherland和Bain[10]在Nature上首次报道新生儿尿液中脱落细胞的成功培养,这些在尿液中分离和培养的细胞主要来自于肾单元、输尿管、膀胱和尿道等脱落的上皮细胞[11]。1991年,研究人员发现不仅仅是在新生儿的尿液中,在泌尿系统疾病的患者尿液中也可以培养出有增殖活性的祖细胞[12]。2008年,Zhang等[13]首次采用富含EGF的角质细胞无血清培养基和胚胎纤维母细胞培养基的等比例混合液从人尿液中分离培养出干细胞,命名为人尿源干细胞,此类细胞贴壁生长,具有克隆性,可表达多数间充质干细胞和外周细胞标志物,具备多向分化潜能,经数代培养仍可保持核型稳定和无成瘤性等。有研究将人尿源干细胞和脂肪干细胞的第三代、第五代和第七代分别进行比较,得出hUSCs具有更高的增殖能力、更强的集落形成能力、更高的干细胞标记物表达和更高的抑制免疫细胞活化效率[14]。
对于hUSCs的来源,科研人员进行了深入探究。Bharadwaj等[15]研究发现hUSCs无法在骨髓间充质细胞培养体系生长,且不表达尿道上皮细胞标志物,说明hUSCs不是肾小管或尿道上皮漏出的细胞。该课题组还发现在接受男性供者肾移植的女性受者hUSCs中存在Y染色体,并高表达肾系标志物(包括CD224、CD13、NR3C2、Pax2和Pax8)以及肾脏层上皮细胞和壁层上皮细胞特异性标志物(包括CD146和podocin),但不表达肾小管上皮细胞、输尿管上皮细胞和尿道上皮细胞标志物[1]。这项结果表明hUSCs来自于肾脏,但具体来源于肾脏的哪个部位还有待研究。有文章总结了肾脱落在尿液中的细胞,主要包括足细胞、近端小管上皮细胞、肾脏干细胞和细胞外囊泡[2]。不少研究表明hUSCs具有很强的增殖能力和多向分化能力,可作为组织工程中种子细胞的新来源[13, 16-17]。当前hUSCs的培养方法还不完善,得到的尿源干细胞纯度和质量相差很大,因此对尿源干细胞的培养和鉴定需要进行更多探索。本研究通过简便高效的方法分离培养人尿源干细胞,通过生长曲线测定和表面标志物检测来鉴定hUSCs的质量和纯度。由于hUSCs在组织工程和再生医学上具有重大潜能,所以加深对hUSCs的认识,建立简便高效的hUSCs分离和鉴定体系具有重要意义。
1 材料与方法 1.1 材料经中国科学院动物研究所伦理委员会批准,收集人的尿液用于分离培养人尿源干细胞。三名青年志愿者自愿签订《知情同意书》,主动捐献尿液用于尿液干细胞的分离和培养。
主要试剂:DPBS、FBS、DMEM/F12、Trypsin-EDTA、Defined trypsin inhibitor和Pen/Strep购自Gibco公司;肾上皮细胞生长培养基(REGM)和REGM Bullet kit购自Lonza公司;Human CD34、CD45、CD44、CD73、CD90、CD34/CD90-isotype、CD45-isotype、CD44-isotype和CD73-isotype抗体购自BD Pharmingen公司;Amphotericin B购自上海翊圣生物有限公司;成骨诱导培养基和成脂诱导培养基购自无锡菩禾生物医药技术有限公司。
主要设备:ESCO classII BSC超净工作台(Airs-tream公司)、SERIES Ⅱ WATER JACKET CO2 Incu-bator(Thermo Fisher公司)、cence湘仪离心机(湖南湘仪离心机仪器有限公司)、Olympus倒置显微镜(Olympus公司)、FACSAriaII流式细胞仪(BD公司)。主要耗材:收集瓶,细胞培养皿,离心管和移液管等。
1.2 方法 1.2.1 尿液收集首先,建议志愿者在收集尿液前2 h喝水。接着,紫外照射收集室30 min。向志愿者说明尿液收集的方法和注意事项,排好顺序,自行依次用对应的收集瓶进行收集。前段尿液约20 mL舍弃,收集中间段尿液,最后的少量尿液也舍弃。将收集瓶移入超净台中,用移液管将收集瓶中的尿液分装到50 mL离心管,每管50 mL。先400×g离心6 min,接着用20 mL PBS洗一遍,最后向每个离心管中加入3 mL Primary medium,轻轻重悬细胞。
1.2.2 培养基的配制Primary medium是在DMEM/F12基础培养基中加入10% FPS、100 units/ mL penicillin、100 µg/mL streptomycin、the REGM SingleQuot kit supplements和2.5 µg/mL amphotericin B。RE medium是在RE基础培养基中加入REGM Bullet kit。
1.2.3 尿源干细胞的原代培养用3 mL Primary medium重悬细胞后,取铺有0.1%明胶的12孔板培养细胞。培养4 d时,用RE medium进行全量换液。用RE medium培养,每2 d换一次液。培养12 d时,细胞约长满整个孔面积。
1.2.4 尿源干细胞的传代培养待细胞长满整个孔面积,进行细胞传代。首先用PBS洗一遍,接着用胰酶消化3 min,其次用1x Defined Trypsin inhibit终止消化,收集细胞并计数,铺过0.1%明胶的六孔板每孔接种1×105个hUSCs,标记为P1,置于37℃培养箱中培养。如上所述传于六孔板中,标记为P2。待P2细胞长满后,消化和收集细胞并计数,按每皿6×105个hUSCs传入100 mm皿中,标记为P3,之后用100 mm皿继续培养至第八代。
1.2.5 尿源干细胞的生长曲线在铺过明胶的24孔板孔中分别加入1 mL RE medium,接着分别接种1 000个P2代hUSCs,每2 d换一次液。培养2 d后,收集两个孔的细胞,一起用血球计数板计数,测得细胞数的一半为2 d的细胞数目。在培养4 d、6 d、8 d、10 d后,同理测出相应的细胞数目。然后对P6代hUSCs进行生长曲线测定,分别测出在培养2 d、4 d、6 d、8 d、10 d后对应的细胞数目。最后,重复两次hUSCs的生长曲线测定实验。整理3次实验结果,用GraphPad Prism软件做折线图。
1.2.6 尿源干细胞的核型鉴定将P6代hUSCs培养48 h后,用含有秋水仙素终浓度为0.05 μg/mL的培养液处理10 h。首先消化收集hUSCs,用现配的0.075 mol/L KCl重悬细胞,置于37oC处理30 min。接着用现配且4oC预冷的固定液(冰醋酸:甲醇=1:3)室温固定30 min。然后用4oC预冷的固定液再重复固定两次。接着取出在-20oC预冷的干净载玻片,用200 µL移液枪悬于1.5 m高度进行滴片,并室温晾干。再用吉姆萨染液进行染色,染色30 min后漂洗并晾干。最后,用显微镜观察和拍照。
1.2.7 尿源干细胞的流式分析收集P2代hUSCs,用PBS洗3遍后,再用PBS重悬细胞并计数,调整细胞浓度为1×107 cells/mL。取18个无菌无酶的1.5 mL EP管,各加入100 μL细胞悬液,分别加入相应的单克隆抗体CD34-isotype,CD34,CD45-isotype,CD45,CD34-isotype+CD45-isotype,CD34+CD45,CD90-isotype,CD90,CD44-isotype,CD44,CD73-isotype,CD73,CD90-isotype +CD44-isotype,CD90+CD44,CD90-isotype + CD73-isotype,CD90 + CD73,CD90-isotype +CD44-isotype +CD73-isotype和CD90+CD44+CD73。充分混匀后,避光孵育30 min。用PBS洗3遍,加入250 μL PBS重悬细胞,过滤网后用流式仪进行检测。同理,对P6代hUSCs进行流式检测。用flowjo进行数据分析。
1.2.8 尿源干细胞的成骨分化取P6代hUSCs,按照1×105 cells/cm2接种于铺过明胶的六孔板中,每孔加入2 mL RE medium,37℃,5% CO2培养。待细胞融合度达到约80%,弃去培养基,并小心沿壁加入37℃预热的成骨诱导培养基。每隔3 d更换成骨诱导培养基。诱导15 d后,弃去诱导液,PBS冲洗3遍,4%多聚甲醛室温固定30 min。弃去多聚甲醛,PBS洗涤3遍,用0.1%的茜素红溶液染色5 min,PBS洗涤3遍,显微镜下观察结果并拍摄照片。
1.2.9 尿源干细胞的成脂分化取P6代hUSCs,按照1×105 cells/cm2接种在铺过明胶的六孔板中,每孔加入2 mL RE medium,37℃,5% CO2培养。待细胞融合度达到约80%,弃去培养基,并小心沿壁加入37℃预热的成脂诱导培养基A液。诱导2 d后,换37℃预热的成脂诱导培养基B液。诱导1 d后,换A液诱导。A液和B液交替4次后,换B液维持培养至第15 d。诱导15 d后,去掉诱导液,PBS洗涤3遍,4%多聚甲醛室温固定30 min。弃去多聚甲醛,PBS洗涤3遍,经3:2稀释的油红O溶液染色30 min,PBS洗涤3遍,显微镜下观察结果并拍摄照片。
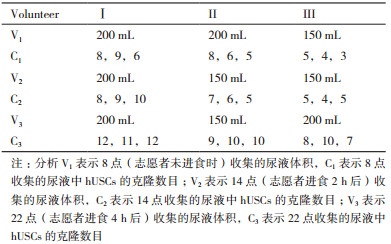
2 结果 2.1 人尿源干细胞的分离在尿液收集时,需尿道口进行酒精消毒。如图 1所示,由于每个人的饮食或体质不同,收集到的尿液颜色有所不同,在50 mL离心管中离心得到的沉淀量不太相同。同一个人的尿液在不同时间收集,离心得到的沉淀也有所不同,有时有较多白色沉淀,有时只有少量絮状沉淀。
|
| 图 1 人尿源干细胞的分离 A:两个收集约200 mL尿液的收集瓶;B:8个装有50 mL尿液的离心管;C:8个装有50 mL细胞悬液的离心管;D:两块培养尿液细胞的12孔板 |
收集了3名志愿者不同时间点的尿液进行尿源干细胞的分离和培养。由表 1可知,Ⅰ号和Ⅱ号青年志愿者的200 mL尿液中含有大约11个尿源干细胞克隆,而Ⅲ号志愿的200 mL尿液中含有大约8个尿源干细胞克隆;3名志愿者都是22点收集的尿液中尿源干细胞克隆数多于8点和14点。因此为了一次性获得更多尿源干细胞,最佳收集尿液的时间是22点左右。
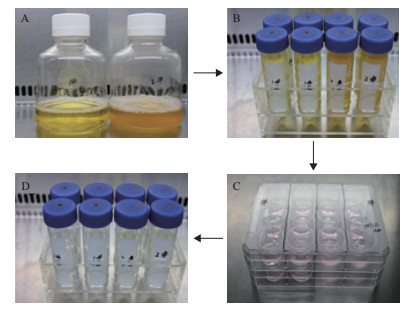
图 2-A表示单个尿源干细胞克隆的生长情况,在倒置光学显微镜下观察培养d2、d5、d8和d11时的尿源干细胞生长状态。尿源干细胞接种约36 h贴壁,呈圆形或梭形,有很好的折光性。4-5 d后可明显看到放射状细胞集落,细胞胞浆丰富,胞核大,核仁清晰。培养约12 d,细胞长满12孔板整个孔面积。在培养尿源干细胞时,观察到尿源干细胞克隆有3种形态,分别是纤维样、鹅卵石样和丝连样。其中纤维样和鹅卵石样尿源干细胞克隆在3名志愿者中都存在,而丝连样尿源干细胞克隆只在一名志愿中存在。如图 2-D所示,丝连样尿源干细胞克隆的细胞之间以丝状相连,并有大量细胞突起生长和分裂。观察这3种形态的尿源干细胞克隆,得知纤维样细胞克隆形态更均一和分裂时间更短。
|
| 图 2 人尿源干细胞的原代培养 A:原代培养hUSC克隆的生长观察;B:原代培养8 d的纤维样克隆;C:原代培养8 d的鹅卵石样克隆;D:原代培养8 d的丝连状克隆 |
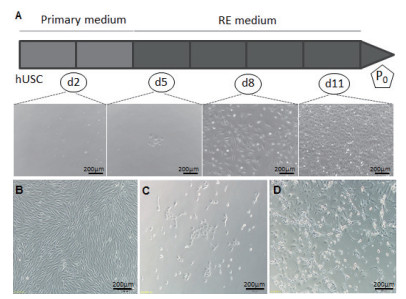
如图 3-A和3-B所示,观察到P2和P6代hUSCs的细胞形态均一、胞膜折光性强、胞浆丰富。比较P2和P6代hUSCs,在传代培养过程中细胞形态未发生改变。取P6代hUSCs进行核型分析,经过吉姆萨染色后,观察到P6代尿源干细胞中依然含有46条染色体,说明传代过程中细胞核型能保持稳定(图 3-C)。
|
| 图 3 人尿源干细胞的传代培养与核型分析 A:P2代人尿源干细胞;B:P6代人尿源干细胞;C:P6代人尿源干细胞的核型 |
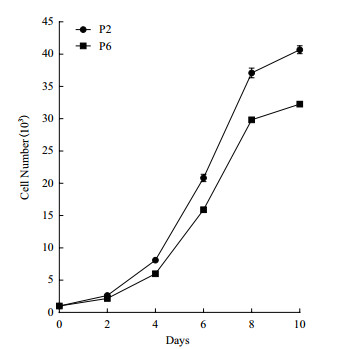
由图 4可知,在接种0-2 d细胞增殖缓慢,说明这段时间hUSCs处于调整期;在2-8 d生长曲线基本为线性,说明这段时间hUSCs处于对数生长期;在8-10 d细胞增殖逐渐变平缓,说明hUSCs处于平台期。比较P2和P6代hUSCs生长曲线,可知P2代hUSCs扩增能力明显大于P6代hUSCs,说明培养过程中hUSCs的质量有所下降。因此,为了更好地进行hUSCs相关研究,建议采用P6代之前的hUSCs进行其它研究。
|
| 图 4 P2和P6代人尿源干细胞的生长曲线 |
尿源干细胞与间充质干细胞的生物学特征非常接近,已有研究表明人尿源干细胞高表达CD44、CD73和CD90这3种标志物,为此我们采用这3种标志物联合检测hUSCs,来判断hUSCs的纯度和质量。若表达这3种标志物的细胞数占总细胞数的百分比很高,说明hUSCs的质量非常好。检测CD44、CD73和CD90这3种标志物的同时,我们也对这群细胞的血系细胞标志物CD34和CD45的表达情况进行了检测,依此来区别于血系细胞。
收集P2代hUSCs,用流式检测人尿源干细胞抗原CD34、CD45、CD44、CD73和CD90的表达量。如图 5所示,CD34和CD45的阳性率分别为0.226%和0.088%,其中共表达CD34和CD45的hUSCs占0.038%,说明培养的hUSCs是非血系细胞。CD44和CD73的阳性率分别为99.60%和99.98%,其中共表达CD73和CD44的hUSCs占99.6%,说明这些hUSCs的纯度和质量都比较好。然后分析CD73和CD44双阳性hUSCs的CD90表达情况,得知所有细胞都表达抗原CD90,由此可知P2代hUSCs的纯度和质量都很好。

|
| 图 5 第二代人尿源干细胞表面标志物的表达 A和B:hUSCs的CD34和CD45表达分析;C、D和E:hUSCs的CD44、CD73和CD90表达分析 |
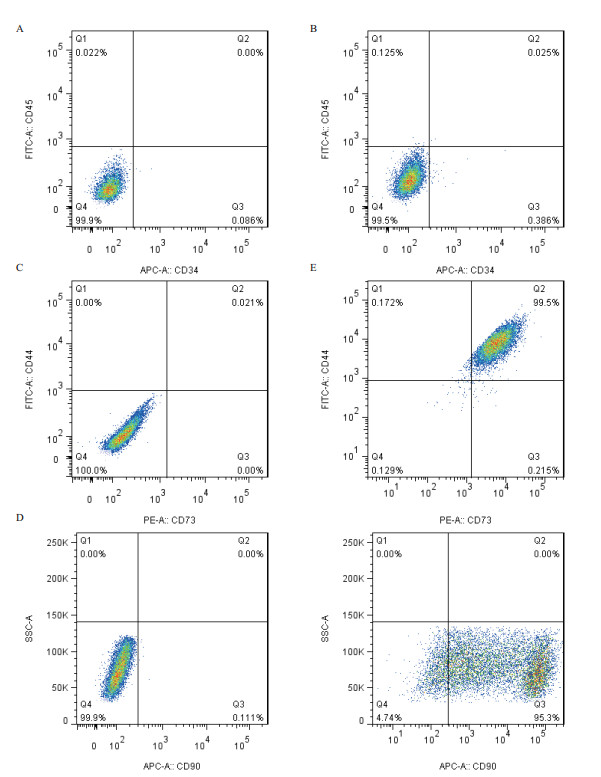
收集P6代hUSCs,用流式检测人尿源干细胞抗原CD34、CD45、CD44、CD73和CD90的表达量。如图 6所示,CD34和CD45的阳性率分别为0.411%和0.150%,其中共表达CD34和CD45的hUSCs占0.025%,说明我们分离到的细胞为非血系细胞。CD44和CD73的阳性率分别为99.67%和99.71%,其中共表达CD73和CD44的hUSCs占99.5%,说明这些hUSCs的纯度和质量都比较好。然后分析CD73和CD44双阳性hUSCs的CD90表达情况,得知在CD73和CD44双阳性hUSCs中有95.3%表达CD90,说明我们的培养系统比较稳定未引起CD90表达的大量丢失。由此可知P6代hUSCs与P2代相比,从CD34、CD45、CD44、CD73和CD90的表达情况综合来看hUSCs的纯度和质量未有显著变化。
|
| 图 6 第六代人尿源干细胞表面标志物的表达 A和B:hUSCs的CD34和CD45表达分析;C、D和E:hUSCs的CD44、CD73和CD90表达分析 |
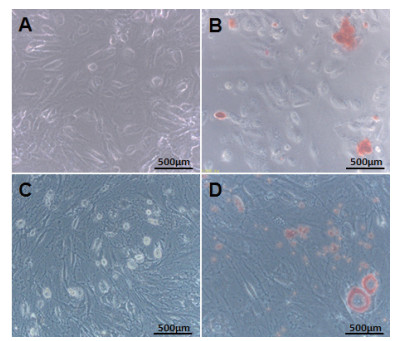
如图 7-A和7-B所示,P6代hUSCs在成骨细胞诱导培养基中诱导15 d后,开始出现钙质结节,用0.1%茜素红染色,矿化结节呈现红色,表明有钙盐形成,说明细胞具有成骨分化的潜能。如图 7-C和7-D所示,P6代hUSCs在成脂细胞诱导培养基中诱导15 d后,少量细胞浆内可见圆形透亮脂滴,油红O染色可见部分细胞内红色脂滴。通过成骨和成脂分化,得知hUSCs具有向骨细胞和脂肪细胞的分化潜能。
|
| 图 7 第六代人尿源干细胞成骨和成脂分化 A:成骨诱导15 d的hUSCs;B:茜素红染色成骨诱导15 d的hUSCs;C:成脂诱导15 d的hUSCs;D:油红O染色成脂诱导15 d的hUSCs |
尿源干细胞是从尿液中分离培养出来的具有良好增殖活性和多向分化能力的成体干细胞,研究表明其特性和间充质干细胞类似[18-20]。由于hUSCs收样方便、操作无创、培养稳定、无致瘤性、自我更新和分化能力强等优点,hUSCs成为了组织工程和再生医学研究领域的新热点,具有广阔的应用前景。人们对于hUSCs的研究尚处于起步阶段,近期有研究表明供体年龄对hUSCs的增殖、衰老和软骨分化能力等有影响,指出儿童尿液分离出的hUSCs克隆数比中年人和老年人多,而且有更强的扩增能力[16]。本研究以青年志愿者的尿液为材料,分离培养人尿源干细胞,并进行分析和鉴定,成功建立了人尿源干细胞的分离和鉴定体系。
对于尿源干细胞的鉴定,主要有3种方法:细胞形态学观察、流式检测表面标志物、成骨成脂等诱导分化。从细胞的生长情况来看,我们分离的尿源干细胞从单细胞培养12 d后,长满12孔板整个孔面积。从细胞形态来看,尿源干细胞克隆具有纤维样、鹅卵石样和丝连样等3种形态,这与许多文章的观察结果相似[8]。从传代培养来看,第六代尿源干细胞的细胞状态依然很好,可作为科学研究良好的种子细胞。从扩增曲线来看,P2和P6代hUSCs的扩增能力有一定差异,说明传代次数的增加,hUSCs的增殖能力有一定下降,因此建议在研究尿道上皮细胞[22]、尿道平滑肌细胞[23]、骨骼肌细胞[1]、神经细胞[24]和内皮细胞[25]等分化时尽量使用前六代hUSCs。目前,在hUSCs的流式分析和鉴定上还没有较好的标准,本文采用阴性标记和阳性标记相结合的方法进行鉴定,并通过hUSCs三种表面标志物CD44、CD73和CD90的表达情况来综合判断分离培养hUSCs的质量和纯度[2, 9, 16]。由流式检测结果得知,在前6代中共表达CD44和CD73的hUSCs阳性率都保持99%以上,但是在传代培养中hUSCs抗原CD90的表达量有所降低,因此我们提出可以以CD90的表达情况作为hUSCs培养过程的监测。
由于hUSCs具有获取简单、可多次获取、来源丰富、无创伤、无伦理问题、生长增殖能力强、自我更新能力高、多向分化能力强、免疫原性低等优点,因此被认为是组织工程良好的种子细胞[26-27]。在不同的诱导方法作用下,hUSCs可以分化为成骨细胞、软骨细胞、脂肪细胞、尿路上皮细胞、平滑肌细胞及神经细胞等多种组织类型的细胞,不但在组织器官修复重建及疾病治疗等领域有良好的应用前景,在药物活性及毒性替代筛选方面也有很大的潜力。虽然hUSCs具有众多优点和重大前景,但要真正走向临床还有很多问题需要解决,例如hUSCs来源的进一步明确、hUSCs质量鉴定标准的确立、hUSCs培养及鉴定方法的优化、hUSC重编程为iPSC效率的提高、选择合适的支架材料、体内长期安全性、分化获得的细胞能否在机体发挥功能、体外重建的器官能否在体内行使功能等,这些都有待于更多的体外实验和体内验证。
4 结论通过收集青年志愿者的尿液来分离培养人尿源干细胞,发现人尿源干细胞克隆有纤维样、鹅卵石样和丝连样等3种形态。前6代hUSCs培养中细胞形态未发生改变,但从生长曲线测定结果可知hUSCs的扩增能力有很大下降。在前6代hUSCs中抗原CD44和CD73的表达量相对稳定,而抗原CD90的表达量有所下降,可根据CD90的表达情况来判断hUSCs的质量。经核型分析,P6代hUSCs的核型保持稳定。经成骨和成脂诱导,P6代hUSCs可分化为骨细胞和脂肪细胞。本研究初步建立了简便高效的hUSCs培养和鉴定体系,为疾病治疗、组织再生和器官重建等提供了可靠的细胞来源。
| [1] |
Bharadwaj S, Liu G, Shi Y, et al. Multipotential differentiation of human urine-derived stem cells:potential for therapeutic applications in urology[J]. Stem Cells, 2013, 319: 1840-1856. |
| [2] |
Zhang D, Wei G, Li P, et al. Urine-derived stem cells:A novel and versatile progenitor source for cell-based therapy and regenerative medicine[J]. Genes Dis, 2014, 11: 8-17. |
| [3] |
Lazzeri E, Ronconi E, Angelotti ML, et al. Human urine-derived renal progenitors for personalized modeling of genetic kidney disorders[J]. J Am Soc Nephrol, 2015, 268: 1961-1974. |
| [4] |
Guan J, Zhang J, Li H, et al. Human urine derived stem cells in combination with β-TCP can be applied for bone regeneration[J]. PLoS One, 2015, 105: e0125253. |
| [5] |
Guan J, Zhang J, Guo S, et al. Human urine-derived stem cells can be induced into osteogenic lineage by silicate bioceramics via activation of the Wnt/β-catenin signaling pathway[J]. Biomaterials, 2015, 55: 1-11. DOI:10.1016/j.biomaterials.2015.03.029 |
| [6] |
Wu S, Wang Z, Bharadwaj S, et al. Implantation of autologous urine derived stem cells expressing vascular endothelial growth factor for potential use in genitourinary reconstruction[J]. J Urol, 2011, 1862: 640-647. |
| [7] |
Afzal MZ, Gartz M, Klyachko EA, et al. Generation of human iPSCs from urine derived cells of a non-affected control subject[J]. Stem Cell Res, 2017, 18: 33-36. DOI:10.1016/j.scr.2016.12.008 |
| [8] |
Zhou T, Benda C, Dunzinger S, et al. Generation of human induced pluripotent stem cells from urine samples[J]. Nat Protoc, 2012, 712: 2080-2089. |
| [9] |
Zhang Y, McNeill E, Tian H, et al. Urine derived cells are a potential source for urological tissue reconstruction[J]. J Urol, 2008, 1805: 2226-2233. |
| [10] |
Sutherland GR, Bain AD. Culture of cells from the urine of newborn children[J]. Nature, 1972, 2395369: 231. |
| [11] |
Dörrenhaus A, Müller JI, Golka K, et al. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system[J]. Arch Toxicol, 2000, 7410: 618-626. |
| [12] |
Racusen LC, Fivush BA, Andersson H, et al. Culture of renal tubular cells from the urine of patients with nephropathic cystinosis[J]. J Am Soc Nephrol, 1991, 18: 1028-1033. |
| [13] |
Oliveira Arcolino F, Tort Piella A, Papadimitriou E, et al. Human urine as a noninvasive source of kidney cells[J]. Stem Cells Int, 2015, 2015: 362562. |
| [14] |
Kang HS, Choi SH, Kim BS, et al. Advanced properties of urine derived stem cells compared to adipose tissue derived stem cells in terms of cell proliferation, immune modulation and multi differentiation[J]. J Korean Med Sci, 2016, 3012: 1764-1776. |
| [15] |
Bharadwaj S, Liu G, Shi Y, et al. Characterization of urine-derived stem cells obtained from upper urinary tract for use in cell-based urological tissue engineering[J]. Tissue Eng Part A, 2011, 1715-16: 2123-2132. |
| [16] |
Qin D, Long T, Deng J, et al. Urine-derived stem cells for potential use in bladder repair[J]. Stem Cell Res Ther, 2014, 53: 69. |
| [17] |
Schosserer M, Reynoso R, Wally V, et al. Urine is a novel source of autologous mesenchymal stem cells for patients with epidermolysis bullosa[J]. BMC Res Notes, 2015, 8: 767. DOI:10.1186/s13104-015-1686-7 |
| [18] |
Delorme B, Charbord P. Culture and characterization of human bone marrow mesenchymal stem cells[J]. Methods Mol Med, 2007, 140: 67-81. DOI:10.1007/978-1-59745-443-8 |
| [19] |
Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease[J]. Nat Rev Immunol, 2008, 89: 726-736. |
| [20] |
Ding DC, Shyu WC, Lin SZ. Mesenchymal stem cells[J]. Cell Transplant, 2011, 201: 5-14. |
| [21] |
Gao P, Han P, Jiang D, et al. Effects of the donor age on proliferation, senescence and osteogenic capacity of human urine-derived stem cells[J]. Cytotechnology, 2017, 695: 751-763. |
| [22] |
Brack AS, Rando TA. Tissue-specific stem cells:lessons from the skeletal muscle satellite cell[J]. Cell Stem Cell, 2012, 105: 504-514. |
| [23] |
Guan J, Niu X, Gong F, et al. Biological characteristics of human Urine derived Stem Cells:potential for cell-based therapy in neurology[J]. Tissue Eng Part A, 2014, 2013-14: 1794-1806. |
| [24] |
Zhang SZ, Ma LX, Qian WJ, et al. Modeling Neurological Disease by rapid conversion of human urine cells into functional neurons[J]. Stem Cells Int, 2016, 2452985. |
| [25] |
Liu G, Wang X, Sun X, et al. The effect of urine-derived stem cells expressing VEGF loaded in collagen hydrogels on myogenesis and innervation following after subcutaneous implantation in nude mice[J]. Biomaterials, 2013, 3434: 8617-8629. |
| [26] |
Chun SY, Kim HT, Lee JS, et al. Characterization of urine-derived cells from upper urinary tract in patients with bladder cancer[J]. Urology, 2012, 795: 1186. e1-7. |
| [27] |
Gao P, Jiang DP, Liu WJ, et al. Urine-derived stem cells, a new source of seed cells for tissue engineering[J]. Curr Stem Cell Res Ther, 2016, 117: 547-553. |