Notch信号通路最初由Morgan和Bridges于1919年通过遗传研究发现,其主要调控细胞的凋亡、增殖和分化等重要生命过程[1]。在哺乳动物中,Notch信号通路有4个受体(Notch1、Notch2、Notch3和Notch4)和5个配体(DLL1、DLL3、DLL4、Jagged1和Jagged2),其中2个配体Jagged1和DLL4在血管生成过程中起到重要作用,特别是DLL4,其主要在内皮细胞表达,从根本上调控肿瘤血管发生和生长[2-3]。
人源DLL4蛋白是Ⅰ型单次跨膜蛋白,由658个氨基酸组成,其胞外区有与Notch受体结合及活化的表皮生成因子(Epidermal growth factor,EGF)样的8个重复序列,1个高度保守的Delta/Serrate/LAG-2(DSL)区域和4个糖基化位点,分子量为57 kD,而胞内区在DLL4与Notch结合之后,会被剪切加工成活性位点,激活下游分子,调节基因的转录[4]。正常情况下,DLL4表达于脉管系统,如发育中的胚胎、成年组织血管新生过程中的动脉、小动脉及毛细血管的内皮细胞上,而静脉内皮细胞、血管平滑肌细胞和处于静止的血管不表达DLL4,病理情况下,可见实体瘤组织中DLL4表达量上调[5-7]。目前,在临床上,DLL4是一种新型肿瘤分子标记物,具有高敏性,可用于肿瘤预后诊断。此外,由于旧靶点抗体疗法耐药性的出现,通过阻断DLL4和Notch受体的结合抑制肿瘤血管的生成,从而达到抗肿瘤治疗效果,已成为一种新的癌症治疗策略。
本研究旨在通过HEK 293F细胞对人源DLL4胞外区蛋白进行瞬时表达,利用Dot blotting、Western blotting和Fortebio大分子互作仪检测DLL4的活性,同时制备兔子多克隆抗体,为下一步研究DLL4蛋白功能、开发临床肿瘤筛查试剂盒以及免疫治疗奠定基础。
1 材料与方法 1.1 材料人源DLL4 cDNA购自于北京义翘神州有限公司,tPA cDNA为本实验室保存,感受态DH5α购自于北京全式金生物技术有限公司。DL15 000 DNA Marker、T4 DNA ligase、生物素化试剂购自于Thermo公司;切胶回收试剂盒购自于Axygen公司;无霉毒素质粒提取试剂盒购自于Omega公司;opti-MEM、LipofectamineTM 2000购自于Invitrogen公司;兔抗人DLL4抗体购自于Abcam公司;PVDF膜购自于Pall公司;ECL发光试剂购自于Millpore公司;SDS-PAGE上样缓冲液、鼠抗His标签一抗、HRP标记的羊抗兔IgG、HRP标记的羊抗鼠IgG购自于康为世纪生物技术有限公司;Bradford蛋白检测试剂盒购自碧云天公司;新生牛血清购自于四季青公司;Histrap层析填料、Equilibration Buffer、Elution Buffer购自于GE公司;链霉亲和素传感器购自于Fortebio公司;基因合成和测序由上海生工公司完成。
1.2 方法 1.2.1 细胞培养HEK293F细胞培养于10 %新生牛血清的opti-MEM培养基中,培养温度为37℃、5% CO2,每3 d传1次代。
1.2.2 质粒构建以人源DLL4 cDNA为模板,PCR扩增DLL4-6His基因,上游引物P1:GTG GAG CAG TCT TCG TTT CGA ACA GCT CCG GCG TCT TCC AGC TGC AGC TG,下游引物P2:GAT CGG ATC CCC TAT CAA TGA TGG TGG TGA TGG TGC GGC AAG CCC ACG GGG AAC TC。以tPA cDNA为模板,扩增tPA信号肽序列,上游引物P3:CCG AGG AAT TCG CCA CCA TGG ATG CAA TGA AGA GAG GGC TC,下游引物P4:CTG CAG CTG CAG CTG GAA GAC GCC GGA GCT GTT CGA AAC GAA GAC TGC TC。以前两步得到的DLL4-6His和tPA为模板,进行搭桥PCR,构建tPA-DLL4-6His基因片段,引物为P2和P3。PCR反应条件:95℃ 5 min;98℃ 10 s,55℃ 15 s、68℃ 21 s,30个循环;68℃ 5 min。
用高保真EcoR I和BamH I分别对tPA-DLL4-6His基因和表达载体pGZX进行双酶切,切胶回收后,T4 DNA ligase,16℃过夜连接。然后,连接产物转化到DH5α感受态中,涂布到含有氨苄青霉素的平板上,培养过夜,次日挑取阳性克隆子并扩大培养,进行酶切鉴定和测序验证。
1.2.3 蛋白表达与纯化转染前1 d,将HEK293F以2×105个/mL的密度铺于6孔板内,使转染时细胞融合率约为80 %,按照lipofectamine 2000转染试剂说明书进行瞬时转染,以无转染的和转染空载体的作为空白对照,转染48 h后进行SDS-PAGE检测。
在层析柱中添加Ni-NTA填料,确保填料无分层无气泡产生,然后用5倍体积的Equilibration Buffer平衡柱子,取1倍体积的蛋白粗样(经10 000×g高速离心预处理)低速上柱,30 min后,加入3倍体积Equilibration Buffer清洗柱子,除去未结合或结合不牢的蛋白,然后用Elution Buffer进行洗脱,收集洗脱液,SDS-PAGE分析。采用Bradford法进行蛋白定量。
1.2.4 Dot blotting和Western blotting取适量蛋白粗样,直接滴加在PVDF膜上,待自然干后,用含5%脱脂奶粉的TBST进行2 h封闭,加入鼠抗His标签一抗,4℃封闭过夜,用TBST洗涤3次,每次10 min,再加入羊抗鼠带HRP的二抗,室温孵育1 h,TBST洗涤3次后,进行ECL发光检测。
取适量蛋白粗样,加入SDS-PAGE上样缓冲液,沸水浴煮沸5 min后,经SDS-PAGE和电转到PVDF膜上,用5%的脱脂奶粉的TBST进行2 h封闭,加入兔抗人DLL4一抗,4℃封闭过夜,用TBST洗涤3次,每次10 min,再加入羊抗兔带HRP的二抗,室温孵育1 h,TBST洗涤3次后,进行ECL发光检测。
1.2.5 亲和力检测将纯化后的DLL4-6His进行生物素化标记,生物素和DLL4-6His的摩尔比为3:1,室温孵育30 min后,进行过夜透析。
亲和力测定采用链霉亲和素传感器(SA Sensor),生物素化的DLL4-6His起始浓度为25 nmol/L,2倍稀释,5个浓度梯度。结合时间600 s,解离时间900 s,通过对照传感器扣除本底信号后,采用1:1结合模型去拟合结合和解离曲线,得到亲和力常数。
1.2.6 多克隆抗体制备选择月龄3个月体重1.5 kg的大耳白兔,饲养于标准动物房内,连续观察3 d,确定情况正常后进行免疫。0.5 mg/只免疫DLL4蛋白,免疫采用弗氏完全佐剂,免疫第1次后,每隔一周进行加强免疫,一共免疫4次,取血,将血清于4℃冰箱过夜析出,离心后取上清,-80℃冰箱保存备用。
1.2.7 抗体效价及特异性检测采用ELISA法检测抗血清效价,步骤如下:将50 µL 0.05 µg/µL DLL4蛋白,加入到96孔板中,37℃孵育1 h,TBST洗涤后,加入200 µL 5%的脱脂奶粉的TBST,封闭2 h,然后每孔加入100 µL一抗,37℃孵育1 h,TBST洗涤后,加入二抗,37℃孵育45 min,洗涤后,加入显影液100 µL,37℃避光孵育10 min,加入终止液,最后读取OD450。
为了进行抗体特异性检测,将DLL4瞬时表达的发酵上清进行纯化,收集样品后,进行SDS-PAGE电泳,并转到PVDF膜上,加入不同稀释度的抗血清,以阴性抗血清作为对照,洗涤后,加入二抗进行孵育,最后ECL发光检测。
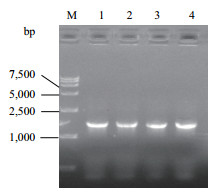
2 结果 2.1 DLL4基因的PCR扩增PCR产物经1%琼脂糖凝胶电泳后,在1.6 kb附近处有1条特异性DNA条带,其长度与tpA-DLL4-6His基因片段长度吻合(图 2)。
|
| 图 2 DLL4基因的核酸电泳图 M:DNA Marker DL 15 000;1-4:PCR产物 |
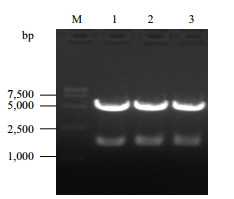
pGZX-DLL4-6His经高保真(减少星号活性)EcoR I和BamH I双酶切后进行1.0%琼脂糖凝胶电泳,电泳图显示出两条DNA条带,大小分别为4.6 kb和1.6 kb(图 3),符合pGZX载体和DLL4基因片段的长度。将测序结果进行Blast比对,与NCBI中的DLL4序列(NM_019074.3)相同,无碱基突变。
|
| 图 3 pGZX-DLL4-6His双酶切验证 M:DNA Marker DL 15000;1-3:pGZX-DLL4-6His双酶切产物 |
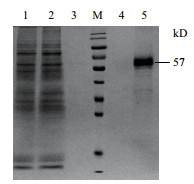
LipofectamineTM 2000介导pGZX-DLL4-6His转染48 h后,离心后收集上清,SDS-PAGE检测,结果表明,被检测的样品在50-70 kD之间有一条较深的条带。随后进行镍柱亲和纯化,收集流穿、清洗和洗脱组分,并进行SDS-PAGE检测,结果如图 4所示,在57 kD处得到一条粗条带,大小符合DLL4-6His的分子量,且纯度达到95%。
|
| 图 4 DLL4-6His蛋白的纯化 M:蛋白Marker;1:DLL4-6His蛋白粗样;2:镍柱流穿组分;3:镍柱清洗组分;4:镍柱洗脱组分1;5:镍柱洗脱组分2 |
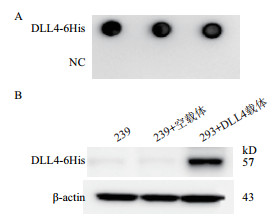
Dot blotting检测结果(图 5-A)显示,发酵上清液中含有带6His标签的蛋白,随后进行Western blotting检测,进一步确定是否为DLL4-6His蛋白。结果如图 5-B所示,在57 kD处出现一条特异性的条带,以上结果说明通过瞬转,可以在293F细胞发酵上清液中获得具有免疫原性的DLL4蛋白。
|
| 图 5 DLL4-6His蛋白Dot blotting和Western blotting检测 |
采用Fortebio公司出产的Octet Red96分子互作仪来检测DLL4是否可以用于抗体的亲和力检测。结果如图 6所示,拟合曲线和实际曲线吻合较好,曲线之间分布均匀,KD值为1.848E-10,R2= 0.999,符合商业化抗体亲和力大小,结果可信。
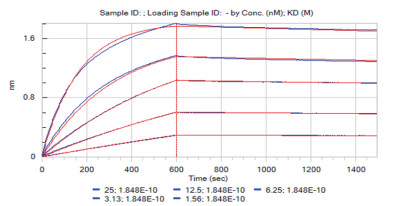
|
| 图 6 DLL4蛋白亲和力检测 |
兔子经过3次免疫后,获得DLL4蛋白抗血清,经ELISA法检测(图 7-A),其效价可达到1:12 800。Western blotting结果(图 7-B)显示不同稀释度的DLL4抗血清出现明显条带,而阴性对照无对应的条带。
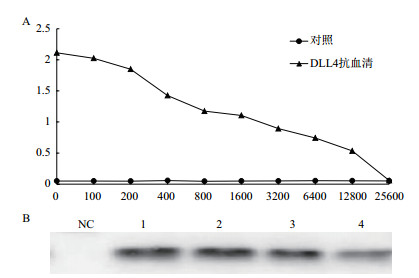
|
| 图 7 DLL4多克隆抗体效价及特异性检测 A:DLL4多克隆抗体效价检测;B:DLL4多克隆抗体特异性检测(NC:阴性血清;B:1:血清稀释800,2:血清稀释1 600倍,3:血清稀释3 200倍,4:血清稀释6 400倍) |
临床数据表明,DLL4蛋白与多种实体瘤的发生、发展和转移具有相关性。在乳腺癌上,DLL4在青年型乳腺癌组织中阳性表达率为73.33%,显著高于中老年型乳腺癌组织的阳性表达率(P < 0.05),且DLL4高表达使青年型乳腺癌相对于中老年型乳腺癌更具有侵袭性[9-11]。在肺鳞癌上,DLL4与肿瘤大小呈正相关(r=0.475,P < 0.05),且在肺鳞癌间质中高表达,提示DLL4可能促进肿瘤的浸润和转移[12],在非小细胞肺癌上,DLL4表达与非小细胞肺癌组织的分化程度和TNM分期存在统计学差异(P < 0.05)[13]。在大肠癌上,DLL4在大肠癌组织中阳性检测率为75%,与癌旁组织的检测率(23.81%)存在显著差异(P < 0.001),且与大肠癌的浸润程度、远端转移及TNM分期有关[14-15]。此外,DLL4还与膀胱尿路上皮癌、胰腺癌、骨肉瘤等恶性肿瘤相关。因此,DLL4作为分子标记物,可用于多种实体瘤的诊断及预后诊断。
近年来,DLL4在临床肿瘤筛查及靶向治疗方面的应用价值逐渐被重视,尤其是在抗血管生成疗法如抗VEGF-A和抗VEGF-2R受体治疗耐药出现后,DLL4逐渐成为了肿瘤靶向治疗的新靶点[16]。目前,国外要比国内较早注意到DLL4的价值,市场上,DLL4相关进口试剂盒占据主要市场,且有研究表明,DLL4双特异性单克隆抗体和纳米抗体都已制备出[17-18]。另外,DLL4在研药物有OncoMed公司的Demcizumab,一种双特异性单克隆抗体,现已通过安全评估阶段;Regeneron公司的Enoticumab,一种人源化的单克隆抗体,作为免疫调节剂,现已进入临床Ⅰ期。而国内,无论是在科研界还是在工业界都进展相对缓慢,抗DLL4靶向治疗仍处于临床前研究,浙江海正药业、百济神州正在加紧研究,旨在加速将这一早期研究成果转化为临床应用,为我国癌症患者提供一种新的治疗希望和途径。
本研究将目的基因DLL4胞外区克隆到真核表达载体pGZX中,并转染到HEK 293F细胞中进行真核表达。tpA信号肽具备分泌信号肽的典型特征,同时含有一个KOZARK增强子,可有效促进异种蛋白分泌,是目前应用最广泛的外源性信号肽之一[19]。前期实验中,对比过lgK信号肽和tpA信号肽,结果表明,tpA信号肽更加有助于DLL4蛋白的分泌表达。HEK 293F细胞是人源化细胞,可以对目的蛋白进行糖基化、磷酸化等翻译后修饰,有助于获得天然构象的蛋白,保持蛋白的生物活性。而带有6His标签,有利于快速的亲和纯化,简化了纯化流程。Dot blotting、Western blotting和大分子互作仪检测结果表明,真核表达出的DLL4-6His蛋白具有免疫原性,且6His标签并不影响DLL4的蛋白活性。叶建斌等[20]通过pCMV-Tag4构建了DLL4真核表达载体,转染到293T细胞中成功地表达出DLL4。与其不同的是,本研究采用HEK 293F细胞为悬浮培养细胞,便于后期进行中大规模的生产,同时带有6His标签,经一步纯化,可以得到纯度为95%的DLL4蛋白,另外,首次利用大分子互作仪进行DLL4生物活性检测,得出具体的数值,使得结论更加可信。通过免疫兔子,成功制备出DLL4多克隆抗体,通过ELISA检测,发现其效价可达到1:12 800倍,Western blotting表明,其具有良好的特异性。
4 结论克隆得到人源DLL4胞外区,构建真核表达载体,获得重组质粒pGZX-DLL4-6His,并成功在HEK 293F细胞中分泌表达,基于亲和纯化得到的DLL4蛋白免疫兔子,制备了多克隆抗体,Western blotting显示该抗体具有较好的特异性。
| [1] |
Morgan TH, Bridges CB. The inheritance of a fluctuating character[J]. Journal of General Physiology, 1919, 16: 639-643. |
| [2] |
Phng LK, Gerhardt H. Angiogenesis:A team effort coordinated by Notch[J]. Developmental Cell, 2009, 162: 196-208. |
| [3] |
Ran QS, Yu YH, Fu XH, et al. Activation of the Notch signaling pathway promotes neurovascular repair after traumatic brain injury[J]. Neural Regeneration Research, 2015, 108: 1258-1264. |
| [4] |
Ikeuchi T, Sisodia SS. The Notch ligands, Delta1 and Jagged2, are substrates for presenilin-dependent "gamma-secretase" cleavage[J]. Journal of Biological Chemistry, 2003, 27810: 7751-7754. |
| [5] |
Bentley K, Gerhardt H, Bates PA. Agent-based simulation of notch-mediated tip cell selection in angiogenic sprout initialisation[J]. Journal of Theoretical Biology, 2008, 2501: 25-36. |
| [6] |
Jubb AM, Turley H, Moeller HC, et al. Expression of delta-like ligand 4Dll4and markers of hypoxia in colon cancer[J]. British Journal of Cancer, 2009, 10110: 1749-1757. |
| [7] |
杨艳萍, 张国珍, 张云艳. DLL4蛋白在恶性肿瘤中的研究进展[J]. 现代肿瘤医学, 2016, 2422: 3687-3690. DOI:10.3969/j.issn.1672-4992.2016.22.047 |
| [8] |
Li Z, Wang J, Zhao C, et al. Acute blockage of Notch signaling by DAPT induces neuroprotection and neurogenesis in the neonatal rat brain after stroke[J]. Translational Stroke Research, 2016, 72: 132-140. |
| [9] |
郎志强, 姜蕾, 吴艳秋, 等. 乳腺癌组织中DLL4、VEGF的表达变化及意义[J]. 山东医药, 2013, 533: 55-57. |
| [10] |
El-Zaemey S, Nagi N, Fritschi L, et al. Breast cancer among Yemeni women using the National Oncology Centre Registry 2004-2010[J]. Cancer Epidemiology, 2012, 363: 249-253. |
| [11] |
Wang Q, Ming YU, Wang G. Effect of RNAi silencing of the DLL4 gene on proliferation of human breast carcinoma cell MCF-7 cells[J]. Journal of Modern Oncology, 2012, 2012: 2476-2479. |
| [12] |
Cao HQ. Correlation between the expression of Notch14 and DLL4 in lung squamous cell carcinoma and microvessel density[J]. China Journal of Clinical Experimental Pathology, 2012, 288: 842-847. |
| [13] |
Xun Y, Hua W, Xu H, et al. Meta-analysis reveals the correlation of Notch signaling with non-small cell lung cancer progression and prognosis[J]. Scientific Reports, 2015, 525: 10338. |
| [14] |
Li JL, Sainson RC, Shi W, et al. Delta-like 4 Notch ligand regulates tumor angiogenesis, improves tumor vascular function, and promotes tumor growth in vivo[J]. Cancer Research, 2007, 6723: 11244. |
| [15] |
He P, Liang J, Shao T, et al. HDAC5 promotes colorectal cancer cell proliferation by up-regulating DLL4 expression[J]. International Journal of Clinical & Experimental Medicine, 2015, 84: 6510-6516. |
| [16] |
王泽根, 解伟, 许卓斌, 等. 重组人Dll4真核载体的构建及其在CHO细胞中的表达[J]. 药物生物技术, 2015, 1: 1-4. |
| [17] |
Lee D, Kim D, Yu BC, et al. Simultaneous blockade of VEGF and Dll4 by HD105, a bispecific antibody, inhibits tumor progression and angiogenesis[J]. Mabs, 2016, 85: 892-904. |
| [18] |
Baharlou R, Tajik N, Habibi-Anbouhi M, et al. Generation and characterization of an anti-delta like ligand-4 Nanobody to induce non-productive angiogenesis[J]. Analytical Biochemistry, 2018, 544: 34-41. DOI:10.1016/j.ab.2017.12.014 |
| [19] |
王甲业, 陈文江, 李妍, 等. 外源性组织型纤溶酶原激活物信号肽突变体增强蛋白质在哺乳细胞中的表达及分泌[J]. 国际免疫学杂志, 2010, 335: 403-405. DOI:10.3760/cma.j.issn.1673-4394.2010.05.018 |
| [20] |
叶建斌, 梁来妹, 陈中标, 等. 人Notch配体DLL4基因的克隆及真核表达[J]. 生物技术, 2015, 3: 223-226. |



