2. 中国食品药品检定研究院实验动物资源研究所模式动物研究室,北京 100050;
3. 百奥赛图基因生物技术有限公司,北京 101111
2. Division of Animal Model Research, Institute for Laboratory Animal Resources, National Institutes for Food and Drug Control, Beijing 100050;
3. Beijing Biocytogen Co. Ltd., Beijing 101111
p53基因作为最为人熟知的抑癌基因,其在肿瘤发生方面的功能已被深入研究[1]。p53基因的突变不仅发生于大量人类肿瘤病例中[2],其功能在动物模型中也不断被研究验证。截至目前,由于技术及成本所限,敲除/点突变/转基因小鼠仍为最广泛的使用模型[3]。然而,遗传修饰的小鼠模型在某些方面并不能较好地模拟人类缺失p53基因的表型。例如,在小鼠中敲除p53基因导致小鼠4-6个月时即有肿瘤发生,肿瘤类型主要为胸腺淋巴瘤[4, 5]。而同样先天性缺失p53基因的李-佛美尼综合症患者的肿瘤谱更为多样,且恶性肉瘤发生率较高[6]。
相较于小鼠,大鼠在模拟人类疾病方面具有更大的优势[7]。虽然在很长一段时间内缺乏用于改造大鼠基因的遗传学工具,但随着近10年分子生物学技术的飞速发展,锌指酶、ENU突变技术及基于胚胎干细胞(Embryonic stem cells,ESC)的同源重组技术被先后用于制作基因敲除大鼠模型[8, 9]。虽然p53基因敲除大鼠可通过ES细胞打靶得到,但在国内仍较难获得。本文基于类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease,TALEN)技术制作了p53基因敲除大鼠。TALEN由一个包含核定位信号的N端结构域、一个包含可识别特定DNA序列的典型串联TALE重复序列的中央结构域,以及一个具有FokI核酸内切酶功能的C端结构域组成,通过DNA识别模块将TALEN蛋白引导至特定DNA序列,在FokI核酸酶的作用下进行切割,切割后形成的双链断裂或直接修复造成随机的碱基插入/缺失,或在有同源臂的目的片段存在条件下发生同源重组,将目的片段整合入基因组。每一个独立的TALEN重复元件包含33-35个氨基酸用于识别特定碱基,通常TALEN元件被设计为能够识别长度为14-20 bp的DNA序列。我们在p53基因外显子2设计TALEN结合位点,通过PCR及测序验证,以高阳性率获得p53基因敲除大鼠模型。进而,我们对构建的p53基因敲除大鼠模型进行了表型分析,目的是研究p53基因敲除后其主要自发性肿瘤类型以及组织特异性病理改变,以期明确该模型是否可用于肿瘤学及基因功能研究。
1 材料与方法 1.1 材料 1.1.1 实验动物及实验环境实验用大鼠均饲养于国家啮齿类实验动物种子中心[SCXK(京)2014-0013],繁育环境为SPF级,实验在清洁级环境中进行,温度(18-26)℃,相对湿度50%-70%,自动光控(12 h明/12 h暗)。饲料购自北京维通利华,经60Co辐照灭菌。饮用水为经高压灭菌的自来水。
本实验在中国食品药品检定研究院实验动物伦理委员会监督下进行。实验人员均持有北京市实验动物从业人员上岗证。实验设计符合“3R”原则,动物饲养管理及实验操作符合《北京市实验动物管理条例》法规的要求,实验结束后实验动物处死方法为安乐死。
1.1.2 试剂TaqDNA聚合酶、DNA连接酶,DNA marker、dNTP、PCR缓冲液、蛋白酶K均购置于由宝生物工程大连有限公司(TaKaRa)。1.5 mL离心管和PCR管及盖购自于Axygen。
1.1.3 仪器PCR仪(ABI公司),核酸琼脂糖凝胶电泳仪(Bio-Rad公司),离心机(美国Thermo Fisher公司),NanoDrop 2000 /2000C超微量紫外可见分光光度计(美国Thermo Fisher公司),电子天平(Sartorius,BSA220ZS型),显微注射仪(Eppendorf公司)。
1.2 方法 1.2.1 胞质注射及胚胎移植SD品系母鼠,于4-6周进行超数排卵。显微注射前3天16:00注射PMSG,前1天16:00注射hCG。随后与同品系公鼠合笼配种,次日清晨检栓。显微注射当日,将有栓母鼠解剖,从输卵管膨大部中取出受精卵,并用透明质酸酶消化为裸卵,将受精卵置于M2培养液滴中37℃,5% CO2培养备用。
显微注射前1天下午挑选出足够量的发情期SD母鼠与结扎公鼠按照1:1比例合笼。显微注射当日晨,取出母鼠查看阴道栓,将见栓的假孕鼠作为0.5天假孕母鼠备用。
冰上解冻TALEN,混合浓度为TALEN left/right 6 ng/μL。并13 000×g离心20 min,吸取上清。用口吸管吸取液体从注射针后端注入尖端,进行显微注射。操作成功的囊胚放入胚胎培养液中,37℃,5% CO2培养,30-60 min后胚胎恢复,随后尽快移植到0.5 dpc假孕母鼠的子宫内。
1.2.2 基因型鉴定及测序仔鼠剪尾后进行蛋白酶K消化并提取基因组DNA。每只鼠尾取100 ng基因组DNA,PCR检测基因型,引物设计针对转基因的编码序列,上游引物为p53 f:5'-TGGCCGACTTCTTGGTTACTTGT-3',下游引物为p53 r:5'-CTCTGAGGCATAGTCAAAGTCCAC-3'。PCR条件为:95℃ 5 min变性;95℃ 30 s;62℃ 30 s,72℃ 60 s,30个循环。将PCR产物送诺赛基因公司进行测序。
1.2.3 解剖及组织学分析对野生型SD大鼠、杂合子P53敲除SD大鼠及纯合子P53敲除SD大鼠进行剖检。腹腔注射4.5%戊巴比妥钠进行麻醉(麻醉剂量为45 mg/kg),从腹腔后大静脉取血完毕后,完全放血处死,然后进行解剖。肉眼观察并摘取以下组织器官:脑、垂体、甲状腺(含甲状旁腺)、颌下腺(含舌下腺)、脊髓(颈胸腰段)、胸腺、胸骨(骨髓)、心脏、主动脉、舌、气管、食道、肺(含支气管)、肝脏、肾脏、肾上腺、脾脏、胰腺、胃、十二指肠、空肠、回肠、盲肠、直肠、结肠、睾丸、附睾、前列腺(腹叶)、卵巢、子宫、阴道、膀胱、坐骨神经、肌肉(大腿骨胳肌)、皮肤、乳腺(仅雌性)、眼球、视神经、肠系膜淋巴结、腹股沟淋巴结及病变部位。睾丸、附睾和眼球用Davidson's液固定,其它脏器用10%中性缓冲福尔马林溶液固定。对固定后组织器官进行取材。所取标本经逐级酒精脱水、二甲苯透明、石蜡包埋、滑动切片机切片(厚约3 μm)、苏木精-伊红(HE)染色、封固后进行光镜镜检。
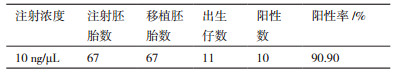
2 结果 2.1 p53基因敲除大鼠构建首先设计一对特异性识别大鼠p53基因外显子2的TALEN蛋白,识别序列分别为5'-CTCGTAGC-TCGAGGGA-3'和5'-GTGTCAAAGGTATTCGTA-3'(图 1)。然后对TALEN进行体外转录,并将TALEN mRNA以10 ng/mL的浓度注射大鼠受精卵并进行胚胎移植(表 1)。共注射受精卵67个,注射后存活并移植67个,得到出生仔鼠11只。
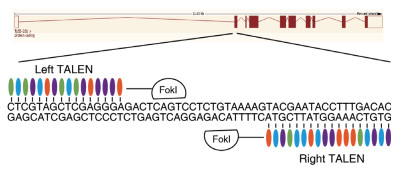
|
| 图 1 p53基因敲除大鼠TALEN结合位点 |
如果TALEN蛋白对靶位点进行了切割,切割位点通常会发生非同源重组修复,导致部分碱基插入或缺失。为了检测切割效率,我们对sgRNA靶位点进行了扩增并测序。在11只仔鼠中,有10只仔鼠的靶位点发生非同源重组修复,选取了其中4只作为首建鼠进行繁育,其基因型见表 2。
由于敲除片段较小,不影响RNA转录,难以通过荧光定量PCR方法检测到敲除大鼠中p53基因表达水平降低;另一方面,p53基因蛋白表达水平一般情形下表达水平较低,市售p53抗体难以通过Western blot检测其表达,除非给予紫外线照射刺激以提高其表达水平,故本文通过分析p53基因敲除大鼠的表型来验证模型构建是否成功。即在6月龄左右,组织病理学检查结果表明p53基因敲除纯合子大鼠的腹腔出现恶性纤维组织肉瘤,肿瘤组织累及肝脏、膀胱、胰腺(表 3)。肿瘤组织在镜下表现为纤维性或梭形细胞交叉排列呈花纹或旋涡状,细胞多形性及含有较大的多核巨细胞,细胞异型性较大,可见核分裂像(图 2)。其他异常包括轻度肾小管上皮细胞变性、坏死,肺泡腔轻度巨噬细胞浸润伴色素沉着,睾丸轻度生精细胞减少。
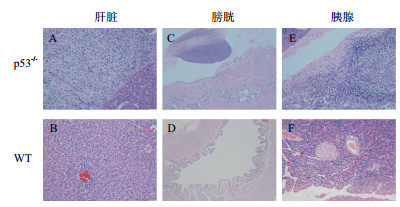
|
| 图 2 恶性纤维组织肉瘤镜检结果 p53-/-表示纯合子p53基因敲除大鼠;WT表示野生型SD大鼠;纯合子p53基因敲除大鼠腹部恶性纤维组织肉瘤累及肝脏(A)、膀胱(C)及胰腺(E),镜下可见纤维性或梭形细胞交叉排列呈花纹或旋涡状,细胞异型性大,可见核分裂像,肿瘤组织内含有较大的多核巨细胞;野生型SD大鼠(WT)的肝脏(B)、膀胱(D)、胰腺(F)镜下均未见异常。其中C、D的放大倍数为40倍,A、B、E、F的放大倍数为200倍 |
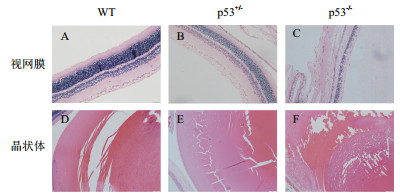
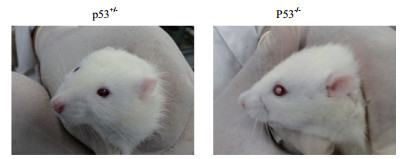
在研究中发现纯合子p53基因敲除大鼠的眼睛中央均可见灰白色云翳状覆盖物,或表现为眼球瘪小,而非常见的球状;眼眶呈扁平状,非常见的圆形。对于纯合子而言,外显率为100%,而同窝野生型SD大鼠及杂合子p53基因敲除大鼠眼睛均未见异常(图 3)。进而对纯合子p53敲除大鼠的眼睛进行了组织病理学检查。镜检(图 4)发现纯合子p53敲除大鼠的视网膜变性(外核层、视杆视锥层、外界膜缺失)及晶状体纤维排列紊乱。
|
| 图 3 纯合子p53基因敲除大鼠眼睛发育异常 p53+/-表示杂合子p53基因敲除大鼠;p53-/-表示纯合子p53基因敲除大鼠。杂合子p53基因敲除大鼠的眼睛未见异常;纯合子p53基因敲除大鼠的眼睛中央可见灰白色云翳状覆盖物 |
本研究使用TALEN高效地构建了p53基因敲除大鼠模型。与文献报道一致,在p53基因敲除大鼠中,恶性纤维组织肉瘤是主要的自发性肿瘤类型[10],而p53基因敲除小鼠则主要发生淋巴瘤[4],这一结果提示肿瘤的发生具有种属特异性,这也说明在已经建立p53基因敲除小鼠情况下,建立p53基因敲除大鼠模型有其特殊意义。表型的种属特异性现象也曾在APC[11],BRCA2[12]和MSH6[13]敲除大鼠中被发现。例如,APC突变大鼠主要发生结肠肿瘤,而APC突变小鼠主要发生小肠肿瘤。这些报道提示相较于p53基因敲除小鼠模型,p53基因敲除大鼠模型可能更为合适用于人类疾病研究。
虽然p53基因敲除大鼠已经通过ENU突变技术及基于胚胎干细胞(ESC)的同源重组技术得到,但基于大鼠胚胎干细胞实现成功同源重组及稳定遗传十分困难,而且通过ENU突变筛选工作量大,概率低,具有一定的环境及操作人员风险。因此,我们采用TALEN特异性切割p53基因第2个外显子,通过非同源重组修复造成小片段插入/缺失,从而造成基因的移码突变,并进一步通过检测肿瘤发生验证模型制作成功,与人类李-佛美尼综合症患者相类似,p53基因敲除大鼠主要发生恶性纤维组织肉瘤。
值得一提的是,除了符合预期的自发性肿瘤发生外,我们还观察到p53基因全部缺失后SD大鼠眼睛出现发育异常,表现为眼眶呈扁圆状,眼球瘪小;眼中央覆盖典型云翳状物质,经过简单观测,该类大鼠视力较弱,行动也较野生型及p53+/-杂合大鼠迟缓。先前的报道主要集中于对p53基因在肿瘤发生中的功能领域,而对其在眼睛发育中的作用报道较少,有报道称在p53基因敲除小鼠模型中表现出遗传背景相关的眼部异常。129/Sv背景的小鼠眼部发育正常,而C57BL/6背景小鼠表现出眼底血管发生异常及视网膜褶皱[14]。此外,在8周龄小鼠中,发现P53蛋白高表达于角膜及结膜上皮细胞的细胞质中及晶状体上皮细胞的细胞核中,而本研究以及先前在小鼠模型上的报道均提示p53基因缺失可导致眼睛发育异常,p53基因缺失造成SD大鼠视网膜及晶状体病变的详细机制还有待进一步研究。
4 结论我们通过TALEN技术高效地构建了p53基因敲除大鼠模型,p53基因敲除纯合子大鼠的腹腔出现恶性纤维组织肉瘤,肿瘤组织累及肝脏、膀胱及胰腺。另外,本文首次在生命科学研究领域广泛使用的SD大鼠品系中发现p53基因缺失可导致眼睛发育异常。我们所构建的p53基因敲除大鼠模型除了可用于研究肿瘤发生机制外,也可用于研究p53基因在眼睛发育过程中的功能。
致谢 感谢李红伍在大鼠种群建立及繁育中所做的工作。| [1] |
Chang F, Syrijänen S, Tervahauta A, et al. Tumourigenesis associated with the p53 tumour suppressor gene[J]. British Journal of Cancer, 1993, 68(4): 653-661. DOI:10.1038/bjc.1993.404 |
| [2] |
Hollstein M, Sidransky D, Vogelstein B, et al. p53 mutations in human cancers[J]. Science, 1991, 253(5015): 49-53. DOI:10.1126/science.1905840 |
| [3] |
Donehower LA, Lozano G. 20 years studying p53 functions in genetically engineered mice[J]. Nature Reviews Cancer, 2009, 9(11): 831-841. DOI:10.1038/nrc2731 |
| [4] |
Jacks T, Remington L, Williams BO, et al. Tumor spectrum analysis in p53-mutant mice[J]. Curr Biol, 1994, 4(1): 1-7. DOI:10.1016/S0960-9822(00)00002-6 |
| [5] |
Purdie CA, Harrison DJ, Peter A, et al. Tumour incidence, spectrum and ploidy in mice with a large deletion in the p53 gene[J]. Oncogene, 1994, 9(2): 603-609. |
| [6] |
Malkin D, Li FP, Strong LC, et al. Germ line p53 mutations in a familial syndrome of breast cancer, sarcomas, and other neoplasms[J]. Science, 1990, 250(4985): 1233-1238. DOI:10.1126/science.1978757 |
| [7] |
Jacob HJ. Functional genomics and rat models[J]. Genome Research, 1999, 9(11): 1013-1016. DOI:10.1101/gr.9.11.1013 |
| [8] |
Geurts AM, Cost GJ, Freyvert Y, et al. Knockout rats via embryo microinjection of zinc-finger nucleases[J]. Science, 2009, 325(5939): 433-433. DOI:10.1126/science.1172447 |
| [9] |
Tong C, Li P, Wu NL, et al. Production of p53 gene knockout rats by homologous recombination in embryonic stem cells[J]. Nature, 2010, 467(7312): 211-213. DOI:10.1038/nature09368 |
| [10] |
van Boxtel R, Kuiper RV, Toonen PW, et al. Homozygous and heterozygous p53 knockout rats develop metastasizing sarcomas with high frequency[J]. The American Journal of Pathology, 2011, 179(4): 1616-1622. DOI:10.1016/j.ajpath.2011.06.036 |
| [11] |
Amos-Landgraf JM, Kwong LN, Kendziorski CM, et al. A target-selected Apc-mutant rat kindred enhances the modeling of familial human colon cancer[J]. Proc Natl Acad Sci, 2007, 104(10): 4036-4041. DOI:10.1073/pnas.0611690104 |
| [12] |
Cotroneo M, Haag JD, Zan Y, et al. Characterizing a rat Brca2 knockout model[J]. Oncogene, 2007, 26(11): 1626-1635. DOI:10.1038/sj.onc.1209960 |
| [13] |
van Boxtel R, Toonen PW, van Roekel HS, et al. Lack of DNA mismatch repair protein MSH6 in the rat results in hereditary non-polyposis colorectal cancer-like tumorigenesis[J]. Carcinogenesis, 2008, 29(6): 1290-1297. DOI:10.1093/carcin/bgn094 |
| [14] |
Ikeda S, Hawes NL, Chang B, et al. Severe ocular abnormalities in C57BL/6 but not in 129/Sv p53-deficient mice[J]. Investigative Ophthalmology & Visual Science, 1999, 40(8): 1874-1878. |
| [15] |
Tendler Y, Pokroy R, Panshin A, et al. p53 protein subcellular localization and apoptosis in rodent corneal epithelium cell culture following μLtraviolet irradiation[J]. Int J Mol Med, 2013, 31(3): 540-546. DOI:10.3892/ijmm.2013.1247 |