miRNA是一类广泛存在于真核生物和病毒中的内源性非编码单链RNA,长度通常为19-24个核苷酸,在进化上具有高度保守性,主要参与转录后水平的基因表达与调控。miRNA最早是在动物中发现的[1],而植物miRNA的发现较晚。2002年,Reinhart等[2]在拟南芥(Arabidopsis thaliana)中鉴定了第一批植物miRNA,该项研究标志着植物miRNA系统研究的开始。
目前,miRNA的功能研究已成为植物分子生物学领域的研究热点之一,特别是在农作物和园艺植物中进行了大量的研究,而园林植物作为城市绿化和建设的重要植物类群,包括木本和草本的观花、观叶或观果植物,以及适用于园林、绿地和风景名胜区的防护植物与经济植物等,在该方面的研究却相对较少。近几年,随着一些园林植物的全基因组测序和转录组数据的获得,园林植物miRNA的鉴定也陆续开始(表 1)。miRNA作为一种内源的负调控因子,在园林植物的生长发育、次级代谢及信号转导和逆境胁迫等方面起着十分重要的作用,深入了解园林植物miRNA的生物学功能将为园林植物育种及应用奠定理论基础。
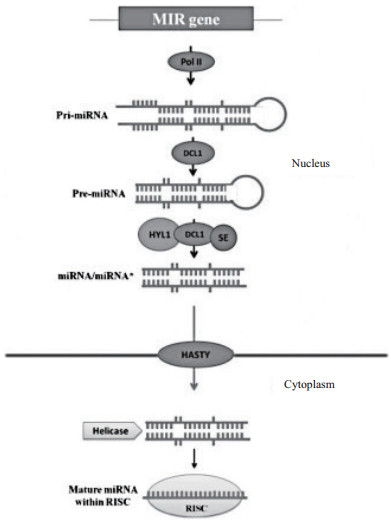
一般情况下,植物miRNA在合成过程中,先在细胞核中由RNA聚合酶Ⅱ转录成原初转录产物(pri-miRNA),然后由Dicer酶DCL1(Dicer-liker1)进行剪切加工,形成包含茎环结构的miRNA前体(pre-miRNA),pre-miRNA在HYL1(Hyponastic Leaves 1)和SE(Serrate)蛋白的协助下被DCL1进一步加工为成熟的miRNA双链复合体(miRNA:miRNA*)。miRNA:miRNA*经HEN1(Hua-Enhancer 1)甲基转移酶对其3' 端的尿嘧啶进行甲基化后,在Exportion-5的同源蛋白HASTY蛋白的协助下从细胞核运向细胞质中。miRNA*链被降解,另一条单链则选择性结合到AGO 1(Argonaute 1)蛋白上形成RISC(RNA Induced Silencing Complex)复合体(图 1)。
需要提到的是,通常认为生物体内miRNA*很容易被降解,表达水平也很低。然而在多种园林植物中都发现miRNA*的表达丰度很高,如苜蓿(Medicago sativa L.)[3]、日本落叶松(Larix kaempferi(Lamb.)Carr.)[4]、椰枣(Phoenix dactylifera L.)[5]等。以椰枣为例[6],在椰枣中鉴定的6个miRNA*(miR160a*、miR164b*、miR169b*、miR395f*、miR396a*和miR5225*)的表达水平都比它们相应的成熟miRNA的表达水平高,其中miR160a*和miR5225*的多数靶基因都是转座元件编码的转录本,miR395f*的靶基因大多是一些保守的转录因子,包括GRAS、MYB、HLH和F-box,说明这些miRNA*在园林植物中可能具有非常重要的功能。
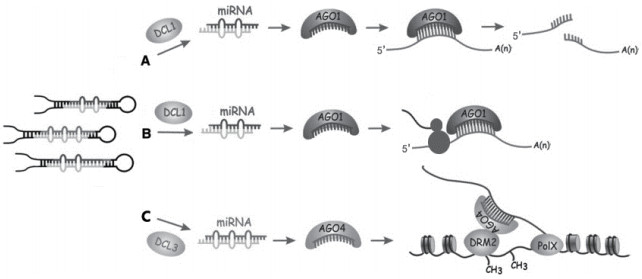
2 植物miRNA的作用机制miRNA在植物体内的作用方式主要有剪切、翻译抑制和DNA水平的甲基化3种(图 2)。
2.1 miRNA的剪切在植物中,miRNA对靶mRNA的剪切作用是主要的调控方式。若植物miRNA与其靶mRNA的碱基序列几乎完全互补配对,则RISC复合体中的miRNA在AGO1蛋白的作用下切割靶mRNA上的一个磷酸二酯键,导致mRNA降解。植物miRNA与其靶mRNA之间的理想互补错配数一般不超过3个,且第10、11位碱基不能有错配。但是最近的研究表明,有些园林植物miRNA的剪切位点会偏离第10与11位碱基,如中间锦鸡儿(Caragana intermedia Kuang)[7]和高山松[8]。
2.2 miRNA的翻译抑制当miRNA与其靶mRNA的碱基不完全互补配对时,miRNA则通过抑制靶mRNA的翻译来完成调控。此时,miRNA与靶mRNA的3' UTR(Untranslated regions)区结合并改变mRNA上核糖体密度或特异性降解新合成的多肽链来抑制mRNA的翻译。但是Voinnet等[9]以拟南芥为材料,通过遗传学手段筛选出一系列miRNA活性缺陷(miRNA-action deficient,mad)突变体,发现大多数miRNA既能切割靶标基因,也能抑制其翻译,并且切割与抑制协同进行。
2.3 miRNA介导的DNA甲基化除了以上两种方式外,植物miRNA还可以介导DNA的甲基化从而调控基因表达。Wu等[10]研究发现,水稻(Oryza sativa)中的miR1873可以介导其产生位点的胞嘧啶甲基化,甲基化位点集中在miRNA和miRNA*区域,并且在该研究中介导DNA甲基化的水稻miRNA是由DCL3加工剪切,最后结合到AGO 4蛋白上从而形成RISC复合体(图 2)。在小立碗藓(Physcomitrella patens)中,DICER-LIKE1a能够促进miRNA成熟,DICER-LIKE1b蛋白控制miRNA的靶位调控作用。当DICER-LIKE1b蛋白发生突变时,编码miRNA靶位点的基因则被甲基化并导致基因沉默[11]。实际上植物miRNA介导的DNA甲基化研究目前还处于起步阶段,许多具体的调控机制还不明晰,相信在不久的将来,随着分子生物学的发展和完善,这一调控机制的研究终将揭开其神秘的面纱。
3 园林植物miRNA的生物学功能自从2002年Reinhart等[2]在拟南芥中发现了第一批植物miRNA后,植物miRNA的功能研究在近20年迅速发展起来,并且成为植物分子生物学研究的热点。分子生物学和遗传学的研究证明miRNA广泛的参与园林植物的生长发育、次级代谢及信号转导等生物学过程并且在园林植物逆境胁迫中起着关键作用。
3.1 miRNA与园林植物的生长发育随着园林植物miRNA研究的不断深入,越来越多的证据表明miRNA参与调控园林植物生长发育的各个过程。
3.1.1 miRNA与胚胎发育已有的研究表明miRNA与园林植物的胚胎和种子发育有着密切的关系,Zhang等[12]对叶籽银杏(Ginkgo biloba var. epiphylla Mak.)叶生胚珠的发生机理进行了深入的研究分析,以着生叶生胚珠的叶片(EL)和正常叶片(NL)为样品,发现gbi-miRN02在EL中特异性表达,通过作用于靶基因CLV1参与叶生胚珠的发生和发育过程。与此相反,gbi-miR390在NL中上调表达,通过负调控其靶基因BAM1从而抑制胚珠发育,维持了叶片的正常形态;miR166家族成员和miRN40在EL表达量下调,而它们的靶基因HD-ZIPⅢ转录因子和BEL1-like protein上调,很有可能参与胚珠形成。此外,miR166也是植物体细胞胚发生的关键miRNA之一,该miRNA在细叶百合(Lilium pumilum DC. Fisch.)EC1(初始培养4周的胚性愈伤组织)阶段表达量积累,在EC2(初始培养6周的胚性愈伤组织)阶段表达量降低,随着体细胞胚发育,在CE(子叶形胚)阶段又呈现上调表达[13],说明在细叶百合体细胞胚发育的整个过程中,miR166通过多样性表达从而调控胚性细胞形成和体细胞胚的发生。Zhao等[14]系统分析了种植在南京和拉萨的高油和低油油菜品系胚胎发育早期miRNA的表达情况,发现miR390通过ta-siRNA介导的生长素信号途径从而调控早期的胚胎发育。此外,在胚胎发育后期,miR156、miR167和miR6029通过调控靶基因SPL、ARF和VIP1等多种途径影响油菜种子的含油量。
3.1.2 miRNA与叶片发育叶片的形态发育决定了园林植物的观赏价值和应用价值,已有的研究表明,许多miRNA在园林植物叶片形态调控过程中发挥重要作用。番木瓜cpa-miR-novel-7可能通过调控靶基因RTFL5导致叶片出现斑点等症状[15];将毛竹[Phyllostachys edulis(Carr.)Lehaie]的miR164b前体序列转入拟南芥中进行过表达,获得的T2代转基因拟南芥叶片畸形或合生而呈耳状叶或马蹄叶、叶片边缘有缺刻、叶柄融合,而且miR164b明显积累,靶基因CUC1与CUC2的表达量则明显下降[16],表明miR164b通过抑制其靶基因的表达从而参与毛竹叶片的形态建成。然而,相比于T2代植株叶边缘变异的表型,T3代植株的叶缘锯齿减少,更加光滑,同时叶片变小,莲座叶数量明显减少,长势较弱[16],这可能是由叶片形态建成的复杂调控网络决定的,同时也可能与拟南芥自身的修复能力有关。
3.1.3 miRNA与分枝发育园林植物的分枝决定着自身的发育状况和对环境的适应能力,如对光合作用的利用率、营养的运输、株型和结实量等,所以分枝发育状况对园林植物的观赏价值和经济价值具有至关重要的作用。miRNA在一定程度上调控着园林植物的分枝发育,但是迄今为止人们对其具体的作用机理还知之甚少。Shikata等[17]将拟南芥miR157b转入夏堇(Torenia fournieri Linden. ex Fourn.)中,获得的转基因植株表现出高度的分枝表型,同时叶片明显变小。同样,过表达35S∷Bna-miR1140的油菜阳性株分枝数明显增多,表现双主序表型,推测Bna-miR1140可能参与调控油菜的分枝发育;继续对pBna-miR1140∷GUS转基因油菜的不同组织和器官进行GUS染色分析,结果GUS只在叶柄和叶腋中表达,进一步证明Bna-miR1140与油菜的分枝发育有关[18]。研究表明生长素和细胞分裂素等植物激素在调控植物分枝发育过程中起关键作用[19],而Bna-miR1140的潜在靶基因为一种糖基转移酶和响应调节因子[20],它们与植物激素信号之间的作用关系还需进一步研究。
3.1.4 miRNA与花发育花发育以其复杂的调控机理在园林植物生长发育过程中发挥着关键的作用,近年来,越来越多的研究表明miRNA广泛的参与园林植物的花发育过程,如花期调控、花器官发育、花的育性等。朵丽蝶兰(Doritaenopsis hybrid)的Dh miR172能够导致拟南芥植株生长矮小,顶端优势被抑制以及花期延后[21]。另外,在短日照条件下,大岩桐(Sinningia speciosa(Lodd.)Hiern)的35S∷miR159a过表达株系延迟开花37(±4.93)d,而对miR159具有抑制作用的35S∷MIM159转基因株系提前开花20(±3.5)d,所以改变miR159的表达水平能够调控靶基因GAMYB的表达,从而对大岩桐的开花时间具有提前或推迟作用[22]。
miR172/AP2调控通路在园林植物花器官的发育和繁衍过程中起着至关重要的作用。近年来,猕猴桃(Actinidia Chinensis Planch)因其丰富的花色、多样的果实类型和较长的观赏期而作为优良的园林树种[23],缺失miR172导致其无限花序发育异常[24];墨兰(Cymbidium sinense(Jackson ex Andr.)Willd.)中的miR172能够通过调控其靶基因Ce AP2-like转录因子来决定墨兰花的结构[25]。同样的,在模式植物拟南芥中AP2类基因上的miR172结合位点发生突变,其花器官发育严重缺陷[26],而且miR172在内轮花中表达,并下调AP2基因,因为LEUNIG(LUG)和SEUSS(SEU)基因共同抑制miR172在外轮花的表达,这为阐释A-C拮抗的调控机制和miR172/AP2的调控通路提供了新的视角。
研究发现,一些保守的miRNA家族决定着园林植物花的育性。如文冠果(Xanthoceras sorbifolia Bunge)中的miR159、miR167、miR169和miR319在重瓣型中的上调表达可能与重瓣花的雌雄蕊发生瓣化完全不结实,育性降低有关[27];其中的miR159在苹果中则通过靶向6个MYB18亚家族基因从而影响花粉和花药的发育[28]。miR160d在芦笋(Asparagus officinalis)雌花中上调表达同时抑制生长素响应因子ARF的表达;miR396f在芦笋雄花中上调表达同时抑制生长调节因子GRF的表达,说明miR160d和miR396f可能分别通过调控其靶基因来决定芦笋的性别分化和雌雄花的发育[29]。
3.1.5 miRNA与果实发育园林植物的果实不仅营养丰富,可供食用,而且其诱人的色泽和外形为园林植物的应用增添了许多趣味性,miRNA作为园林植物生长发育过程中的重要调控因子,对于果实的形成及发育同样具有重要的作用。甜橙中的2对miRNA和靶基因:miR164-Cs5g10870和miR477a-3p-Cs6g19680参与调控果实的发育[30];Vv-miRNA(miR014、miR051、miR053、miR100、miR104和miR034)不仅参与葡萄果实的成熟过程,而且能显著响应外源赤霉素和乙烯处理[31]。海藻糖6-磷酸合酶/磷酸酶(Trehalose 6-phosphate synthase/phosphatase,TPS)在椰枣中首次被预测为miR167的靶基因,同时,它还被预测为pda-nov-miR062和pda-nov-miR215的靶基因,所以TPS可能对椰枣果实的发育和成熟具有重要的调控作用[32];京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)代谢通路分析表明,椰枣中pda-nov-miR110的靶基因被预测为蔗糖磷酸合酶(Sucrose phosphate synthase,SPS),它是蔗糖合成过程中的关键酶,在果实发育后期表达量较高;有3个编码β-淀粉酶的基因被预测为8个新的miRNA的靶基因,该酶是淀粉与蔗糖代谢过程中的关键酶。此外,pda-nov-miR215的一个靶基因为焦磷酸:果糖6-磷酸1-磷酸转移酶(Pyrophosphate:fructose 6-phosphate 1-phosphotransferase,PFP),在椰枣果实发育中的表达量逐渐上升。以上结果表明这些miRNA可能通过调控淀粉的转化及果糖和蔗糖的累积从而影响椰枣果实的发育[32]。
3.1.6 miRNA与发育时序的转变园林植物的一生要经历幼年、成年和生殖生长3个重要阶段,每个阶段都有其独自的特征,每个时序的转换也可以通过形态学的标记加以区分。园林植物发育时序的转变是由内源因素和环境条件共同决定的,而miRNA在其中的调控作用是必不可少的。
miR156被认为是一个植物年龄的分子标记,miR156-SPL调控机制在植物发育时序转变,特别是从幼年期到成年期的转变以及成花诱导方面起着主要调控作用[33]。如在加杨(Populus canadensis)中过表达miR156导致其靶基因SPL和miR172的表达降低,大大延长了幼年期,同时该研究还表明miR156在调控一年生草本植物和多年生木本植物的发育阶段转变中都具有进化上的保守性[34]。除了miR156,中间锦鸡儿cin-miR157a与cin-miR172b之间也存在一种相反的调控方式,即cin-miR157a在幼年期表达量最高,在向成年期转变的过程中逐渐降低,cin-miR172b则正好相反,在幼年期有较低的表达水平,成年期表达量最高;而它们的靶基因SPL和AP2恰好与其miRNA表现出相反的趋势[35],表明cin-miR157a和cin-miR172b通过其靶基因来调控中间锦鸡儿发育阶段的转变。此外,cin-miR396a在成年期营养器官中有较高的表达量,在其他时期和器官中表达量极低,而它的目标基因GRF(调控植物细胞分裂)则相反,说明中间锦鸡儿幼年期和生殖器官中细胞的分裂通过cin-miR396a负调控其靶基因GRF来维持,而成年期营养器官成熟细胞的再分裂则被抑制[35]。甜橙中的miR3954a能触发其靶基因产生phasiRNA,miR3954a超表达子代阳性植株与野生型相比,缩短了童期,但miR3954a触发产生phasiRNA的具体作用机理还并不清楚,有待进一步研究[31]。
3.2 miRNA与园林植物的次级代谢及信号转导近年来,越来越多的研究表明,miRNA对园林植物的次级代谢及信号转导具有一定的调控作用,其靶基因通常为一些与次级代谢产物相关的信号分子。例如,芦笋中的miR160d和miR396f很有可能通过激素信号转导途径控制着芦笋雌雄花的分化和性别决定[30]。在银杏胚珠的形成过程中,gbi-miR167c/e和gbi-miRN41的靶基因也均参与生长素合成与生长素信号转导途径,其中gbi-miR167的靶基因为ARF6/8[12],ARF6/8在生殖过程中还能激活其他生长素响应因子[36]。除了gbi-miR167以外,gbi-miR160通过作用于ARF10/16/17在叶籽银杏生长素信号转导途径中同样发挥重要的作用;gbi-miRN41和gbi-miRN46的靶基因分别为IAA7和TIR1/AFB auxin receptor protien,在叶籽银杏EL中表达量下调,从而促使生长素合成及信号转导;保守gbi-miR394的靶基因被预测为F-box蛋白,F-box蛋白在调控生长素、茉莉酸、赤霉素和乙烯等植物激素信号方面有重要作用[12],EL中显著上调的gbi-miR394可能通过抑制其靶基因F-box的表达来促进乙烯的合成。
3.3 miRNA与园林植物的逆境胁迫植物在其或长或短的生命进程中会受到各种各样的生物和非生物逆境胁迫,经过这些胁迫,植物演化出了特有的、复杂且精细的分子调控机制。园林植物也不例外,不同的逆境胁迫会使其相应miRNA不同程度地上调或下调表达,有时miRNA还会同时受几种逆境胁迫的诱导。许多miRNA在园林植物感受逆境胁迫并产生适应性的过程中发挥重要作用。
3.3.1 miRNA与生物逆境胁迫生物逆境胁迫主要包括真菌、病毒和昆虫等的侵染和伤害,严重危害园林植物的生长发育。马超等[37]在苹果抗性品种“鸡冠”中注射Md-miRLn11后接种斑点落叶病菌,96.5%的株系都不同程度地感染了斑点落叶病;在感病品种“富士”中注射Md-NBS基因,53.9%的株系对斑点落叶病具有抗性,29.5%的植株则表现出较严重的感病表型。该结果表明在苹果中Md-miRLn11可以通过调控其靶基因Md-NBS来改变植株对斑点落叶病的抗性。对欧美杨(Populus euramericana)进行E4强致病锈菌侵染不仅影响R2R3-MYBs的表达量,导致R2R3-MYBs表达的启动或关闭,而且R2R3-MYBs在转录后水平主要受miR159和miR858家族的调控[38]。芍药(Paeonia lactiflora Pall.)因易感葡萄孢菌而严重影响其观赏价值。Zhao等[39]初步鉴定了两个具有不同程度抗病性的芍药品种中差异表达的miRNA,并且预测了它们的靶基因,两者呈现出相反的表达模式,其中miR5254、miR165a-3p、miR3897-3p和miR6450a可能参与芍药对葡萄孢菌感染的响应。除了病菌侵染,miRNA同样响应昆虫的伤害。例如,在对菊花(Dendranthema morifolium(Ramat.)Kitamura)蚜虫抗性相关miRNA的分析中发现,在蚜虫胁迫的菊花叶片中miR393b-5p显著表达,而在另外两个对照样品(非胁迫对照和针刺机械伤害)中几乎不表达,说明miR393b-5p参与菊花响应蚜虫胁迫过程[40]。
3.3.2 miRNA与非生物逆境胁迫非生物逆境胁迫主要包括干旱胁迫、盐胁迫、温度胁迫、重金属胁迫和养分胁迫等,这些胁迫能够不同程度地上调或下调miRNA的表达,从而影响着园林植物的生命进程。
在干旱胁迫方面,Li等[41]利用高通量测序技术和miRNA芯片技术对胡杨耐旱节水的分子生物学机制进行了研究,他们发现104个胡杨miRNA能够响应干旱胁迫并且其表达量显著升高,而另外27个miRNA的表达量则降低,其中有23个miRNA在毛果杨和胡杨之间是保守的,在响应胁迫时差异表达;毛白杨(Populus tomentosa)在经过干旱胁迫后也有17个保守miRNA家族和9个新miRNA显著差异表达[42],而且miRNA和miRNA*都参与调控植物胁迫应答。phe-miR397和phe-miR1432在干旱处理后的毛竹(Phyllostachys heterocycla(Carr.)Mitford cv.Pubescens)中表达情况相反,phe-miR397的表达显著下调,phe-miR1432的表达显著上调,说明它们可能在毛竹应对干旱胁迫的过程中发挥重要的调控作用[43]。
在盐胁迫方面,中间锦鸡儿在经过盐胁迫处理后,SPL(cin-miR157a的目标基因)、HD-ZIPⅢ(cin-miR165a的目标基因)、AP2(cin-miR172b的目标基因)和GRF(cin-miR396a的目标基因)均先呈下调表达,随后与其相应miRNA呈现此消彼长的表达模式,而MYB在盐胁迫处理1 h后表达量先呈下降趋势,随后逐渐升高,与其目标基因cin-miR159a呈现相似的表达模式[7],表明MYB在盐胁迫处理初期受cin-miR159a调控,而随后可能受其他机制调控。在红树(Rhizophoraceae)的伴生植物海马齿(Sesuvium portulacastrum L.)中对高盐响应的miRNA在根和叶中表达量最多,其中miR167在根中表达量最多,推测其可能与海马齿的耐盐机制密切相关[44]。盐敏感植物青杨(Populus cathayana Rehd.)和耐盐植物旱柳(Salix matsudana Koidz)分别经过盐胁迫处理,结果miR398b和miR474c在旱柳中的表达量上调,但在青杨中的表达量降低[45],表明盐敏感植物和耐盐植物在盐胁迫下miRNA具有不同的表达模式。
在温度胁迫方面,Kim等[46]发现miR156-SPL3分子机制调节FT基因的表达,当植物响应外界环境温度变化时,miR156和FT之间的协同关系能够控制开花时间。与此相似的是,朵丽蝶兰在低温成花过程中也存在miR172-FT的调控途径,DhmiR172与其靶基因DhAP2、DhTOE1和DhTOE2间存在显著的负调控关系,但与DhFT的变化趋势却基本一致[21]。萱草[Hemerocallis fulva(L.)L. Hongbaoshi]中与低温胁迫相关的miRNA家族有miR391,miR393、miR396和miR397等[43];其中miR393在耐热型匍匐剪股颖(Agrostis stolonifera)中的作用正好相反,该miRNA在高温胁迫诱导后表达差异显著[48];miR396也被证明在向日葵(Helianthus annuus L.)响应高温的早期调控WRKY6的表达[49],该研究将抗miR396的WRKY6稳定转染拟南芥,结果相比野生型和无miR396抗性的WRKY6转基因植株而言,该植株长势更矮小并且积累更多的花青素,接着对两周龄的植株进行热激处理,导致具有miR396抗性的转基因植株产生致死性损伤,而其他植株则表现良好;同样的,miR397参与芍药的热胁迫响应,并且在耐热型品种中的表达量更高[50]。因此,上述研究表明这些miRNA在不同类型园林植物的温度胁迫方面可能具有不同的调控作用。
在重金属胁迫方面,Jin等[51]发现铜胁迫会不同程度地影响miRNA的表达,并且该研究小组初步鉴定了杨山牡丹(Paeonia ostii)中参与铜胁迫反应的miRNA,结果表明有12个保守miRNA和18个新的miRNA在铜胁迫后表达量有明显的变化,这些鉴定的miRNA可能与杨山牡丹铜胁迫反应有关。miR398在铜动态平衡中发挥着重要的作用,铜缺乏会诱导miR398表达量上调,从而导致其靶基因表达量下调,同样的,miR397、miR408和miR857在铜动态平衡中具有与miR398类似的功能,而且这3个铜响应的miRNA还可以帮助优化大多数含铜蛋白质中铜的供应[52]。此外,miR393和miR171与重金属镉胁迫相关[53]。
在营养胁迫方面,Lu等[54]通过Ⅰllumina测序从甜橙的缺硼根系中分离了52个上调表达和82个下调表达的miRNA,表明根系巨大的代谢灵活性可能对植株的耐缺硼性具有重要作用。缺铁条件下小金海棠(Malus xiaojinensis)的根和叶中miR394a的表达先上升后下降,且根部的响应较叶片更早,表明缺铁胁迫后,小金海棠的根部首先响应缺铁反应,miR394a先在根部表达,一段时间后,缺铁的长距离信号传至地上部,使地上部也产生缺铁反应,随之miR394a得到表达[55]。
4 展望近年来,随着对miRNA研究的不断深入,人们在拟南芥、水稻、小麦(Triticum aestivum L.)、大豆[Glycine max(L.)Merr.]和玉米(Zea mays)等模式植物,以及果树、蔬菜等园艺植物中鉴定并验证了大量的miRNA,并且对其功能研究较深入的多集中在基因组已被解析的植物上,而在园林植物中只进行了初步的分析,大部分还停留在发掘和鉴定阶段,所以在今后的研究中要加强对园林植物的关注。
miRNA一般通过负调控其靶基因在园林植物的生长发育、次级代谢及信号转导及逆境胁迫等方面发挥重要的作用,但随着对miRNA功能研究的深入,人们发现也未必都是这种情况,如椰枣中pda-nov-miR044、pda-nov-miR166、pda-nov-miR168、pda-nov-miR178、pda-nov-miR197、pda-nov-miR213和pda-nov-miR228等miRNA的表达均与其靶基因成正相关[32],这可能是由miRNA和其靶基因之间的共表达所产生的反馈调节导致的,类似的情况在拟南芥和水稻中也有报道[56-57]。对这些特殊分子机制的研究将为完善miRNA在园林植物中复杂的调控网络提供重要的线索。
花青素和类黄酮作为植物的次级代谢产物,对花色、果色的形成具有重要作用,近年来该方面的研究也备受关注,而miRNA通过负调控其靶基因从而控制着花青素和类黄酮的生物合成,Liu等[58]的研究表明,随着荔枝(Litchi chinensis Sonn.)中花青素的积累,miR156a的表达逐渐升高,同时,miR156a的上调表达导致其靶基因LcSPL1表达减弱,而LcSPL1通过与LcMYB1互作而负调控花青素的生物合成。香蕉(Musa nana Lour.)中的miR5538的靶标为二氢黄酮醇4-还原酶DFR(Dihydroflavonol-4-reductase),它是花青素合成途径的关键酶,miR5538通过作用于DFR来调控香蕉的花色[59]。但是在园林植物中关于miRNA调控花色形成的报道非常少,目前仅在芍药中初步鉴定了与黄色形成有关的miRNA[60],该研究表明,miR156可能通过负调控其靶基因SPL1从而控制芍药黄色花的形成。因此在今后的研究中需要发掘更多与园林植物花色形成相关的miRNA,争取早日弥补该研究领域的空白,为园林植物的育种及应用奠定良好的理论基础。
| [1] |
Lee R, Feinbaum R, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854. DOI:10.1016/0092-8674(93)90529-Y |
| [2] |
Reinhart BJ, Weinstein EG, Rhoades MW, et al. MicroRNAs in plants[J]. Genes Dev, 2002, 16(13): 1616-1626. DOI:10.1101/gad.1004402 |
| [3] |
Abolfazl L, Tariq P, Songtao J, et al. Role of microRNAs and their target genes in salinity response in plants[J]. Plant Growth Regul, 2017, 82: 377-390. DOI:10.1007/s10725-017-0277-0 |
| [4] |
Meng Y, Shao C, Gou L, et al. Construction of microRNA- and microRNA*-mediated regulatory networks in plants[J]. RNA Biology, 2011, 8(6): 1124-1148. DOI:10.4161/rna.8.6.17743 |
| [5] |
吴涛. 日本落叶松实生苗small RNA测序、microRNA鉴定及其目标基因差异表达分析[D]. 北京: 中国林业科学研究院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-82201-1012423505.htm
|
| [6] |
Xin C, Liu W, Lin Q, et al. Profiling microRNA expression during multi-staged date palm(Phoenix dactylifera L.)fruit development[J]. Genomics, 2015, 105(4): 242-251. DOI:10.1016/j.ygeno.2015.01.004 |
| [7] |
Zhu J, Li W, Yang W, et al. Identification of microRNAs in Caragana intermedia by high-throughput sequencing and expression analysis of 12 microRNAs and their targets under salt stress[J]. Plant Cell Reports, 2013, 32(9): 1339-1349. DOI:10.1007/s00299-013-1446-x |
| [8] |
Wan L, Zhang H, Lu S, et al. Transcriptome-wide identification and characterization of mi RNAs from Pinus densata[J]. BMC Genomics, 2012, 13: 132. DOI:10.1186/1471-2164-13-132 |
| [9] |
Voinnet O. Origin, biogenesis, and activity of plant microRNAs[J]. Cell, 2009, 136: 669-687. DOI:10.1016/j.cell.2009.01.046 |
| [10] |
Wu L, Zhou H, Zhang Q, et al. DNA methylation mediated by a microRNA pathway[J]. Molecular Cell, 2010, 38: 465-475. DOI:10.1016/j.molcel.2010.03.008 |
| [11] |
Khraiwesh B, Arif MA, Seumel GI, et al. Transcriptional control of gene expression by microRNAs[J]. Cell, 2010, 140: 111-122. DOI:10.1016/j.cell.2009.12.023 |
| [12] |
Zhang Q, Li J, Sang Y, et al. Identification and characterization of micro RNAs in Ginkgo biloba var. epiphylla Mak[J]. PLoS One, 2015, 10(5): e0127148. DOI:10.1371/journal.pone.0127148 |
| [13] |
Zhang J, Xue B, Gai M, et al. Small RNA and transcriptome sequencing reveal a potential miRNA-mediated interaction network that functions during somatic embryogenesis in Lilium pumilum DC. Fisch[J]. Frontiers in Plant Science, 2017, 8: 566. DOI:10.3389/fpls.2017.00566 |
| [14] |
Zhao Y, Wang M, Fu S, et al. Small RNA profiling in two Brassica napus cultivars identifies micro RNAs with oil production and development correlated expression and new small RNA classes[J]. Plant Physiology, 2012, 158(2): 813-823. DOI:10.1104/pp.111.187666 |
| [15] |
李崇奇. 番木瓜及巨桉等四种植物miRNA研究和生物信息学分析[D]. 海口: 海南大学, 2014.
|
| [16] |
王丽丽, 李利超, 孙化雨, 等. 毛竹miR164b前体的克隆及其在叶形态建成中的功能分析[J]. 植物科学学报, 2017, 35(4): 551-557. |
| [17] |
Shikata M, Yamaguchi H, Sasaki K, et al. Overexpression of Arabidopsis miR157b induces bushy architecture and delayed phase transition in Torenia fournieri[J]. Planta, 2012, 236: 1027-1035. DOI:10.1007/s00425-012-1649-3 |
| [18] |
董云. 油菜(Brassica napus)miRNA的鉴定及Bna-miR1140表达调控机制研究[D]. 石河子: 石河子大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10759-1013366669.htm
|
| [19] |
刘拥海, 俞乐, 丁君辉, 等. 植物激素对分枝发育的协同调控作用研究进展[J]. 植物生理学报, 2012, 48(10): 941-948. |
| [20] |
Miao Y, Yun D, Qiu X, et al. Identification of mi RNAs and their targets from Brassica napus by high-throughput sequencing and degradome analysis[J]. BMC Genomic, 2012, 13: 421. DOI:10.1186/1471-2164-13-421 |
| [21] |
李海荣. 朵丽蝶兰MIR172的克隆与功能分析[D]. 杭州: 浙江农林大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10341-1016044527.htm
|
| [22] |
李晓燕. miR159和miR172表达对大岩桐花发育的调控作用及其机理研究[D]. 杭州: 浙江大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013339938.htm
|
| [23] |
徐善坤. 猕猴桃树种在园林绿化中的应用探讨[J]. 现代园艺, 2015(19): 96-98. DOI:10.3969/j.issn.1006-4958.2015.19.056 |
| [24] |
Varkonyi G, Lough R, Moss S, et al. Kiwifruit floral gene APETALA2 is alternatively spliced and accumulates in aberrant indeterminate flowers in the absence of mi R172[J]. Plant Mol Biol, 2012, 78: 417-429. DOI:10.1007/s11103-012-9877-2 |
| [25] |
Yang F, Zhu G, Wang Z, et al. A putative mi R172- targeted Ce APETALA2-like gene is involved in floral patterning regulation of the orchid Cymbidium ensifolium[J]. Genet Mol Res, 2015, 14: 12049-12061. DOI:10.4238/2015.October.5.18 |
| [26] |
Grigorova B, Mara C, Hollender C, et al. LEUNIG and SEUSS co-repressors regulate mi R172 expression in Arabidopsis flowers[J]. Development, 2011, 138: 2451-2456. DOI:10.1242/dev.058362 |
| [27] |
敖妍, 赵磊磊, 姜常玉, 等. 文冠果不同花朵类型植株miRNA表达差异分析[J]. 华北农学报, 2014, 29(5): 16-22. |
| [28] |
Xia R, Zhu H, An Y, et al. Apple mi RNAs and tasi RNAs with novel regulatory networks[J]. Genome Biol, 2012, 13(6): R47. DOI:10.1186/gb-2012-13-6-r47 |
| [29] |
秦力. 芦笋雌雄花发育转录组分析及性别决定相关miRNA靶基因的鉴定[D]. 杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016124818.htm
|
| [30] |
刘元龙. 参与柑橘果实发育的miRNA和靶基因的挖掘与分析[D]. 武汉: 华中农业大学, 2015.
|
| [31] |
王晨. 葡萄microRNA及其靶基因的识别、鉴定及作用方式研究[D]. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013282859.htm
|
| [32] |
辛成齐. 椰枣microRNA鉴定及其在果实发育过程中的表达谱研究[D]. 北京: 中国科学院北京基因组研究所, 2015. http://cdmd.cnki.com.cn/Article/CDMD-80167-1015446364.htm
|
| [33] |
Yang L, Conway S, Poethig R. Vegetative phase change is mediated by a leaf-derived signal that represses the transcription of mi R156[J]. Development, 2011, 138(2): 245-249. DOI:10.1242/dev.058578 |
| [34] |
Wang J, Park M, Wang L, et al. MiRNA control of vegetative phase change in trees[J]. PloS Genet, 2011, 7: e1002012. DOI:10.1371/journal.pgen.1002012 |
| [35] |
朱建峰. 中间锦鸡儿MicroRNA发现及其目标基因鉴定与表达研究[D]. 北京: 中国林业科学研究院, 2013.
|
| [36] |
Liu N, Wu S, Van H, et al. Down-regulation of AUXIN RESPONSE FACTORS 6 and 8 by micro RNA 167 leads to floral development defects and female sterility in tomato[J]. J Exp Bot, 2014, 65(9): 2507-2520. DOI:10.1093/jxb/eru141 |
| [37] |
马超. '金冠'苹果miRNA克隆分析及Md-miRLn11靶向调控Md-NBS基因表达影响斑点落叶病抗性研究[D]. 北京: 中国农业大学, 2013.
|
| [38] |
李丹蕾, 张瑞芝, 王峰, 等. MicroRNA转录后调控欧美杨R2R3-MYBs抗锈菌表达[J]. 林业科学研究, 2017, 30(2): 254-259. |
| [39] |
Zhao D, Gong S, Hao Z, et al. Identification of miRNAs Responsive to Botrytis cinerea in herbaceous peony(Paeonia lactiflora PalL.)by high-throughput sequencing[J]. Genes, 2015, 6: 918-934. DOI:10.3390/genes6030918 |
| [40] |
邵亚峰. 菊花蚜虫抗性相关基因表达谱分析及microRNA发掘[D]. 南京: 南京农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10307-1014216343.htm
|
| [41] |
Li BS, Qin Y, Duan H, et al. Genome-wide characterization of new and drought stress responsive microRNAs in Populus euphratica[J]. J Exp Bot, 2011, 62(11): 3765-3779. DOI:10.1093/jxb/err051 |
| [42] |
Ren Y, Chen L, Zhang Y, et al. Identification of novel and conserved Populus tomentosa microRNA as components of a response to water stress[J]. Funct Integr Genom, 2012, 12(2): 327-339. DOI:10.1007/s10142-012-0271-6 |
| [43] |
王丽丽, 赵韩生, 孙化雨, 等. 毛竹miR397和miR1432的克隆及其逆境胁迫响应表达分析[J]. 林业科学, 2015, 51(6): 63-70. |
| [44] |
唐梦楠, 刘强, 张颖. 耐盐相关miRNA在红树伴生植物海马齿中对高盐生境的响应[J]. 分子植物育种, 2017, 15(3): 1137-1142. |
| [45] |
Zhou J, Liu M, Jiang J, et al. Expression profile of miRNAs in Populus cathayana L. and Salix matsudana Koidz under salt stress[J]. Molecular Biology Reports,, 2012, 39(9): 8645-8654. DOI:10.1007/s11033-012-1719-4 |
| [46] |
Kim JJ, Lee JH, Kim WH, et al. The micro RNA156-SQUAMOSA PROMOTER BINDING PROTEIN-LIKE3 module regulates ambient temperature-responsive flowering via FLOWERING LOCUS T in Arabidopsis[J]. Plant Physiol, 2012, 159: 461-478. DOI:10.1104/pp.111.192369 |
| [47] |
An F, Liang Y, Li J, et al. Construction and significance analysis of the microRNA expression profile of Hemerocallis fulva at low temperature[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78(3): 378-383. DOI:10.1080/09168451.2014.878214 |
| [48] |
刘海珍. 匍匐剪股颖高温响应microRNAs的鉴定及差异表达分析[D]. 北京: 北京林业大学, 2016.
|
| [49] |
Giacomelli J, Weigel D, Chan R, et al. Role of recently evolved miRNA regulation of sunflower HaWRKY6 in response to temperature damage[J]. New Phytol, 2012, 195(4): 766-773. DOI:10.1111/j.1469-8137.2012.04259.x |
| [50] |
Hao Z, Liu D, Gong S, et al. High throughput sequencing of herbaceous peony small RNAs to screen thermo-tolerance related microRNAs[J]. Genes Genom, 2017, 39: 397-408. DOI:10.1007/s13258-016-0505-4 |
| [51] |
Jin Q, Xue Z, Dong C, et al. Identification and characterization of microRNAs from tree peony(Paeonia ostii)and their response to copper stress[J]. PLoS One, 2015, 10(2): e0117584. DOI:10.1371/journal.pone.0117584 |
| [52] |
Zeng H, Wang G, Hu X, et al. Role of micro RNAs in plant responses to nutrient stress[J]. Plant and Soil, 2014, 374(1-2): 1005-1021. DOI:10.1007/s11104-013-1907-6 |
| [53] |
Ding Y, Zhu C. The role of microRNAs in copper and cadmium homeostasis[J]. Biochem Biophys Res Commun, 2009, 386(1): 6-10. DOI:10.1016/j.bbrc.2009.05.137 |
| [54] |
Lu Y, Yang L, Qi Y, et al. Identification of boron-deficiency-responsive microRNAs in Citrus sinensis roots by Illumina sequencing[J]. BMC Plant Biology, 2014, 14: 123. DOI:10.1186/1471-2229-14-123 |
| [55] |
于昌江, 孙瑞, 王忆, 等. 小金海棠缺铁胁迫相关miR394a的克隆与表达分析[J]. 中国农学通报, 2012, 28(28): 158-162. DOI:10.3969/j.issn.1000-6850.2012.28.029 |
| [56] |
Peng T, Sun H, Du Y, et al. Characterization and expression patterns of microRNAs involved in rice grain filling[J]. PLoS One, 2013, 8(1): e54148. DOI:10.1371/journal.pone.0054148 |
| [57] |
Yi R, Zhu Z, Hu J, et al. Identification and expression analysis of microRNAs at the grain filling stage in rice(Oryza sativa L.)via deep sequencing[J]. PLoS One, 2013, 8(3): e57863. DOI:10.1371/journal.pone.0057863 |
| [58] |
Liu R, Lai B, Hu B, et al. Identification of microRNAs and their target genes related to the accumulation of anthocyanins in Litchi chinensis by high-throughput sequencing and degradome analysis[J]. Frontiers in Plant Science, 2017, 7: 2059. |
| [59] |
柴娟. 香蕉microRNA及其靶基因的生物信息学预测与功能初步分析[D]. 海口: 海南大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10589-1014240100.htm
|
| [60] |
Zhao D, Wei M, Shi M, et al. Identification and comparative profiling of miRNAs in herbaceous peony(Paeonia lactiflora PalL.)with red/yellow bicoloured flowers[J]. Scientific Reports, 2017, 7: 44926. DOI:10.1038/srep44926 |