2. 天津科技大学生物工程学院 天津市工业微生物重点实验室,天津 300457
2. Tianjin Industrial Microbiology Key Lab, College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457
2,3-丁二醇是一种重要的化工原料,广泛用于化工、食品、燃料以及航空航天等多个领域[1-4]。目前,2,3-丁二醇的生产方法有化学合成法和生物发酵法两种。其中生物法既符合绿色化工的要求,又可以克服化学法生产的困难,受到了人们越来越多的关注。
迄今为止,2,3-丁二醇生产效率最高的菌株主要有Klebsiella pneumoniae[5]、Klebsiella oxytoca[6]以及Bacillus polymyxa[7]等菌种。肺炎克雷伯氏菌是肠杆菌科中的一种兼性厌氧菌,其宽广的底物利用范围,尤其是其优良的五碳糖利用能力,在木质纤维素类物质生物转化方面具有极大的应用潜力[4, 8]。木糖是木质纤维原料水解产物中含量仅次于葡萄糖的一种单糖,因此,充分利用纤维素原料中的木糖、提高木糖2,3-丁二醇的转化率是高效利用纤维素原料生产2,3-丁二醇的关键问题之一。目前,对2,3-丁二醇发酵的研究主要以葡萄糖为原料,并取得了较好的成果[5, 9]。以木糖为底物发酵产2,3-丁二醇的研究始于20世纪80年代初[10-11],但近年研究较少,且主要是葡萄糖和木糖混合发酵[12]。Yan等[13]指出,玉米秸秆酶法水解获得的水解液中,葡萄糖和木糖的比例约为2:1(W/W),而如果只有葡萄糖能够被利用,木质纤维素的利用率仅有约30%[14],在此前提下,将木糖进行有效利用,能将木质纤维素的利用率提高至50%以上[15],因此,找到一种可行的方法对木糖加以利用,能够有效提高木质纤维素的利用率,提高生产效率,降低成本。而在已经报道的利用木糖生产2,3-丁二醇的研究中,无论是产2,3-丁二醇的质量浓度还是转化率都不理想,尚无大规模生产的报道[16-20]。
菌种在生物转化过程中起着至关重要的作用,尤其是菌株对原料或产物及有毒副产物的耐受性。肺炎克雷伯氏菌是目前已知存在的天然2,3-丁二醇产量最高的菌株之一,前人对该菌株生产2,3-丁二醇的研究大都集中在不同底物和条件下表型优异菌株的筛选和发酵条件的优化以及少数基因的转录和表达上,对该菌株木糖耐受性的研究一直没有突破。微生物在不同环境胁迫下的耐受性对生物燃料和生物化学产品的高效生产具有重要意义,这些性状的改善往往是通过进化工程方法包括诱变剂诱变和连续传代。本研究通过适应性进化的方法以肺炎克雷伯氏菌株(KPG)为出发菌株,通过反复压力诱导和筛选不断提高菌株对木糖的耐受性,获得了高木糖耐性和高产2,3-丁二醇的突变株。同时,对突变株进行了转录组学分析,并通过响应面的方法优化了发酵条件,旨在提高2,3-丁二醇的产量,为2,3-丁二醇的生物转化提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种肺炎克雷伯氏菌(K. pneuoniae CICC 10781),购自中国工业微生物菌种保藏中心。
1.1.2 培养基LB培养基(g/L);蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH 7.0,121℃灭菌20 min。固体LB培养基需添加琼脂1.5%。种子培养基(g/L):碳源:木糖20.0,其它:酵母浸粉10.0,KH2PO4 6.0,K2HPO4 14.0,(NH4)2SO4 2.0,柠檬酸钠4.0,乙酸钠4.0,MgSO4·7H2O 0.4,pH 6.0。木糖发酵培养基(g/L):碳源:木糖120,其它:酵母浸粉10.0,KH2PO4 6.0,K2HPO4 14.0,(NH4)2SO4 2.0,柠檬酸钠4.0,乙酸钠4.0,MgSO4·7H2O 0.4,pH 6.0。
1.2 方法 1.2.1 适应性进化的方法KPG为出发菌株,在一定木糖浓度液体培养基中过夜培养,取1 mL菌液,离心洗涤后将获得的菌体涂布于对应木糖浓度的固体培养基上静置培养过夜,然后挑取其中最大的几个单菌落,再次在木糖液体培养基中培养,如此循环往复,每72 h向培养基中多加入5 g/L的木糖,以120 g/L初始木糖浓度作为筛选条件,通过压力筛选不断提高菌体对木糖的耐受性。初步筛选结束后,对获得的菌株利用浓度为120 g/L的木糖液体培养基进行摇瓶培养,定期取样测定发酵液中木糖的浓度和2,3-丁二醇的产量。
1.2.2 转录组学分析方法由于亲本菌株在发酵24 h以后基本不再耗糖,而通过适应性进化得到的突变株在24-48 h的耗糖速率与前24 h基本不变,如图 1所示,因此选择在发酵24 h的菌株作为转录组学测试菌株样品。
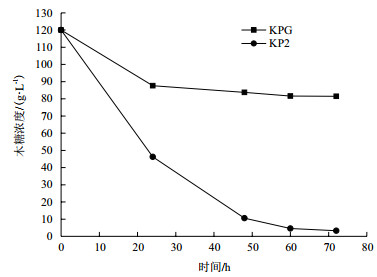
|
| 图 1 突变菌株KP2和亲本菌株KPG的木糖消耗曲线 |
使用Illumina HiSeq 2000系统在提取总RNA后进行mRNA选择,文库制备和测序,使用纳米光度计(IMPLEN,USA),qubit 2.0荧光计(生命技术公司)和安捷伦2100 RNA Nano 6000检测试剂盒(安捷伦,美国)评估mRNA样品的质量和数量。使用随机六聚体引物从具有高样品,高纯度和高完整性的mRNA样品中构建cDNA文库,在修饰和富集以连接到Illumina流动池后,使用Illumina HiSeq 2000对得到的cDNA文库产物进行测序,并且通过碱基调用将获得的数据翻译成原始数据。在序列组装和注释之前删除了低质量的数据,这些低质量数据包含适配器的一部分读取,一部分不确定碱基的比例超过5%的读取,其余的是质量得分低于20分,其中20分相当于1%的预期错误率。由于没有参考K. pneumonia CICC 10781基因组,因此选择Trinity软件包来组装其转录组(k-mer临界值为25),去除冗余之后进一步组装成Unigenes,用Phrap进行同源转录本聚类后,几个基因的高度相似性构成一个簇。选择FPKM计算所有unigenes的表达量,并用SOAP(错误率不超过0.01,多次差异超过2倍)显示差异表达unigenes,获得的差异表达unigenes向Gene Ontology数据库(http://www.geneontology.org/)的各个term映射,计算每个term的基因数目,然后应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著富集的GO条目。
KEGG是有关Pathway的主要公共数据库,Pathway显著性富集分析以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在差异表达unigenes中显著性富集的Pathway。
1.2.3 单因素实验设计方法在1 L发酵罐中装入发酵培养基700 mL,以7%的接种量接入诱导突变后的肺炎克雷伯氏菌(KP2),发酵72 h,每隔一段时间取一次样,不同通气量(0.2 L/min、0.5 L/min、0.8 L/min、1.1 L/min),不同转速(150 r/min、300 r/min、450 r/min),不同pH值(4、5.5、7)、不同温度(30℃、35℃、40℃)条件下进行木糖发酵的单因子影响试验,测定发酵液中2,3-丁二醇浓度、细胞浓度、木糖残留量以及副产物的浓度。
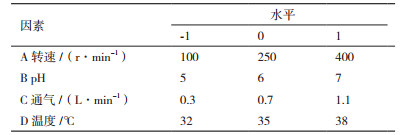
1.2.4 响应面实验设计方法在单因素实验的基础上,以2,3-丁二醇的产量为响应值,选取对2,3-丁二醇的产量影响显著的因素以及较好的水平区间,根据Box-Behnken中心组合设计原理[22-23],采用响应面分析法对发酵条件进行优化,以获得最优发酵条件。发酵条件响应面因素水平编码表如表 1所示。每组实验重复3次取平均值,方差法分析处理数据。
用响应面优化得到的发酵条件来发酵突变的肺炎克雷伯氏菌KP2,测得2,3-丁二醇的产量与未优化的普通发酵条件所得的2,3-丁二醇产量进行比较,验证响应面优化的效果。
1.2.6 分析方法木糖残留量、2,3-丁二醇浓度及副产物浓度的测定:采用高效液相色谱法[3];肺炎克雷伯氏菌干重测定(DCW):取样,将发酵液稀释10倍,在600 nm下检测吸光度值,对照吸光度(OD600)和细胞干重(DCW)的标准曲线,计算得到菌体干重。吸光度和细胞干重的标准曲线为y=0.467 2x-0.014 4,其中R2=0.99。2,3-丁二醇的得率为2,3-丁二醇生成量/木糖的消耗量(g/g)。
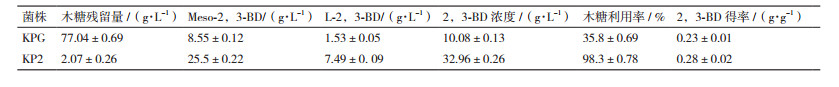
2 结果 2.1 适应性进化菌株的筛选本次研究将亲本肺炎克雷伯氏菌株对木糖耐受性阈值定为75 g/L,逐步提高木糖的浓度,以120 g/L初始木糖浓度作为筛选条件,通过适应性进化的方法反复筛选,最终获得了一株在120 g/L初始木糖培养基上生长速率较快及生长性能良好的菌株KP2,结果见图 2。所获得菌株与亲本菌株相比,木糖转化率提高了174.5%,亲本菌株产生的Meso-2,3-BD(内消旋型2,3-丁二醇)和L-2,3-BD(右旋型2,3-丁二醇)的产量分别为8.55 g/L和1.53 g/L,比例为5.6:1,突变菌株分别为25.5 g/L和7.49 g/L,比例3.4:1,2,3丁二醇的总体产量提高了227%(表 2)。

|
| 图 2 突变菌株KP2和亲本菌株KPG在120g/L木糖浓度下生长情况 |
对KP2和KPG菌株进行转录组分析,获得两菌株转录本信息,共计Unigene 4 539个,总长5 693 375 Nt,通过blastx将Unigene序列比对到蛋白数据库Nr、Swiss-Prot、KEGG和COG,并通过blastn将Unigene比对到核酸数据库Nt,得到该Unigene的蛋白功能注释信息。结果显示,Unigene注释到Nr、Nt、Swiss-Prot、KEGG、COG和GO数据库的数目分别为3 920、3 496、3 283、3 414、3 309、3 299和3 990。比对到NCBI Nr数据库的unigenes如图 3所示,其中33.4%的unigenes具有同源性,31.4%的unigenes具有较强的同源性,35.2%的unigenes具有非常强的同源性。
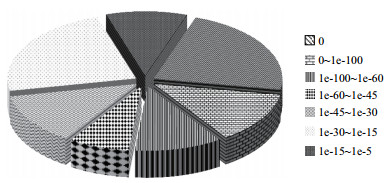
|
| 图 3 比对到Nr数据库中E-value的分布 |
COG注释的结果如图 4,按照基因功能分类,包含KPG和KP2两个样品的所有注释Unigene种类最多的四个类群分别为氨基酸转运和代谢(E)、碳水化合物运输代谢(G)、常规功能基因(R)和能量生成和转化(C),此外,无机离子运输代谢(P)、转录作用(K)和核糖体合成、RNA翻译(J)等功能基因群所占比例也比较大。
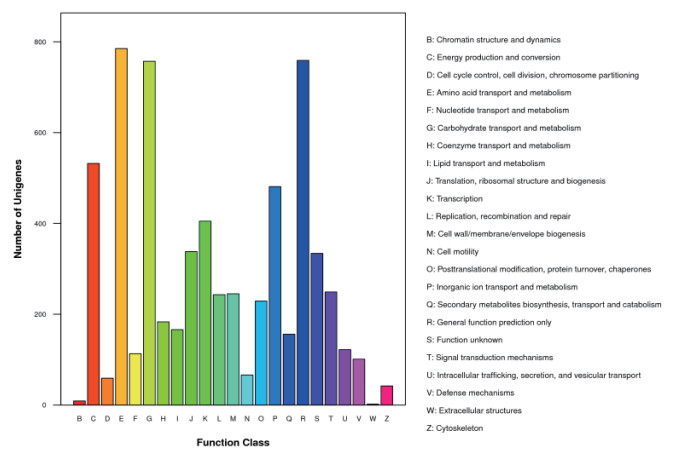
|
| 图 4 COG注释结果 |
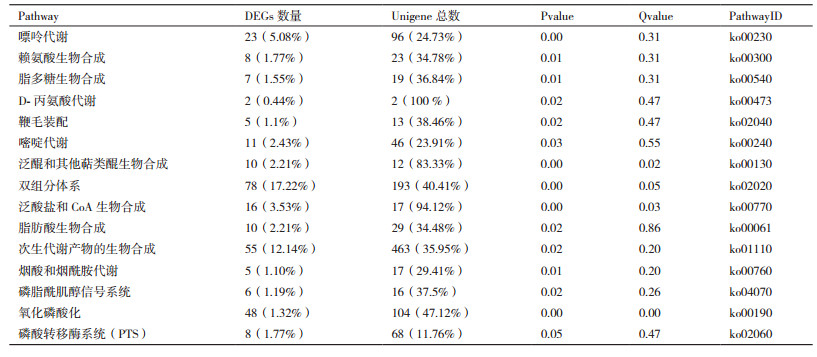
以KPG为对照,比较了KP2菌株基因表达情况,数据显示KP2菌株中差异表达基因总数为505个,其中有242基因上调和263个基因下调。对KP2相对KPG的差异表达基因进行Pathway分析,结果表明KP2的505个差异表达基因中共有453个差异基因比对至113个代谢途径中。KP2 Pathway分析所得含差异表达基因最多的代谢途径如表 3所示。
由表 3可知,通过适应性进化获得的菌株KP2与出发菌株KPG相比,在全局代谢途径(ko01110)、信号转导(ko02020、ko04070)、跨膜运输(ko00540、ko02040、ko02060)、碳水化合物代谢(ko00061、ko00760)、能量代谢(ko00190)、辅因子代谢(ko00130、ko00770)和其它物质代谢,如核苷酸代谢(ko00230、ko00240)和氨基酸代谢(ko00300、ko00473)等代谢途径中差异显著。
通过Unigene代谢通路分析,获得木糖代谢和产物合成直接相关差异表达基因如图 5所示,其涉及糖酵解、TCA循环、磷酸戊糖途径、氧化磷酸化、能量代谢、跨膜运输等多个生理生化过程,对木糖发酵生产2,3-丁二醇过程中木糖分解代谢、2,3-丁二醇和乙偶姻代谢、丙酮酸代谢、琥珀酸代谢、乳酸代谢、乙酸代谢有显著影响。
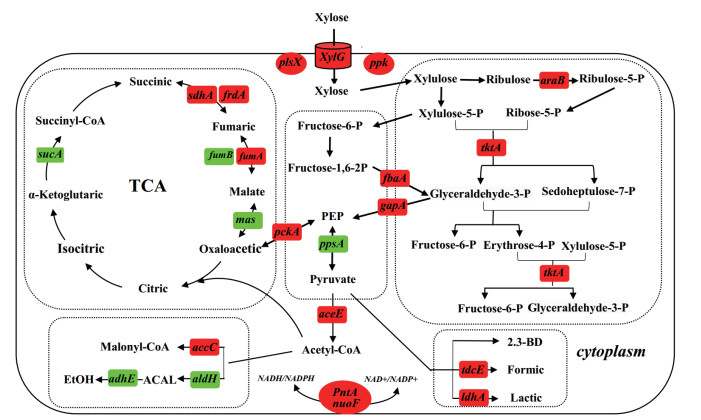
|
| 图 5 肺炎克雷伯氏菌的木糖代谢途径 红色表示上调,绿色表示下调(颜色标识见电子版) |
从肺炎克雷伯氏菌的木糖代谢途径可知,木糖转运蛋白(xylG编码)主要负责将木糖从胞外运输至胞内供微生物分解代谢。与KPG菌株相比,xylG在KP2菌中的表达量上调了2.9倍,提高了木糖进入胞内的效率。
在磷酸戊糖途径中的几个关键基因都有不同程度的上调,编码磷酸核酮糖差向异构酶的ybjT表达量上调了1.24倍,编码核酮糖激酶的araB表达量上调了2.3倍,编码转酮醇酶tktA表达量上调了1.2倍,这些基因的表达量上调提高了木糖向磷酸戊糖途径转化的能力,增强了生物体合成所需的还原力,提高了2,3-丁二醇的生产能力,同时磷酸戊糖途径的代谢流最终流向糖酵解途径,也加快了木糖的消耗,提高了木糖的利用能力。
编码磷酸烯醇式丙酮酸羧激酶的基因pckA其表达量上调了2.7倍,该基因在微生物的代谢途径中产生较多的ATP,为微生物的生长提供能量,从而加快了菌体的生长速度,提高了菌株的生长性能,为底物的消耗和产物的积累奠定基础。编码磷酸烯醇式丙酮酸合成酶的ppsA基因表达量为亲本菌株的0.16倍,说明由丙酮酸合成磷酸烯醇式丙酮酸的途径较亲本菌株减弱,使丙酮酸的代谢流向其他通路,包括生成2,3-丁二醇的途径,使2,3-丁二醇的产量增加。
在副产物乙醇的代谢途径中编码乙醛脱氢酶和乙醇脱氢酶的aldH和adhE基因的表达量分别下调了0.53和0.028,乙醛脱氢酶和乙醇脱氢酶是生成副产物乙醇的关键酶,乙醇的生成不但与2,3-丁二醇竞争碳源,还竞争生成2,3-丁二醇所需的还原力,这两个基因的下调即提高了碳源流向2,3-丁二醇的通量,也为2,3-丁二醇的生成提供更多的还原力。
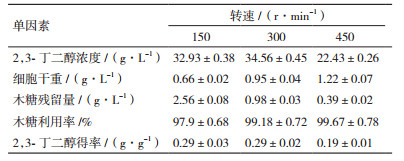
2.3 单因素优化试验 2.3.1 转速对发酵的影响初始木糖浓度为120 g/L,pH为5.5,通气量为0.5 L/min,接种量为7%,温度为35℃,实验中设置了150、300和450 r/min 3个转速梯度发酵72 h,结果如表 4所示。
由表 4可以看出,转速为300 r/min和150 r/min时,2,3-丁二醇的浓度和木糖的消耗速率差别不大,2,3-丁二醇的最大产量分别为34.56 g/L和33.86 g/L。当转速增大到450 r/min时,2,3-丁二醇的产量反而有所减少,最大2,3-丁二醇的产量仅为22.43 g/L。一般来说,过高的氧浓度不利于2,3-丁二醇的发酵,转速增大使得发酵液中溶解氧增加,过多的木糖用于菌体自身生长繁殖和生成副产物乙偶姻,用于生成2,3-丁二醇的量相对减少。在转速为450 r/min时,虽然木糖利用率达99.67%,而2,3-丁二醇的浓度低于转速在150 r/min和300 r/min的发酵条件下,由于转数过高木糖的消耗主要用于菌体生长,只有很少的部分用于合成目标产物。综合考虑2,3-丁二醇的产量,以及菌体的生物量,选择300 r/min为最合适转速。
2.3.2 pH对发酵的影响初始木糖浓度为120 g/L,通气量为0.5 L/min,接种量为7%,温度为35℃、转速为300 r/min,实验中设置了全程为4、5.5和7三个pH梯度发酵72 h,结果见表 5。菌体在较低pH值(pH4)时,木糖的利用率特别低,说明在发酵培养基中pH4时,菌株利用木糖被强烈的抑制。菌体细胞内的各种酶的活性除了与温度有关外,还与发酵液的pH值密切相关。当发酵培养基pH5.5时,2,3-丁二醇的浓度、得率以及木糖的消耗量和木糖利用率都高于pH7的条件下,这说明pH 7时不利于菌体利用木糖生成2,3-丁二醇,这与前人报道的略酸的环境有利于2,3-丁二醇的生成一致,综合考虑选择pH 5.5为最适的pH。
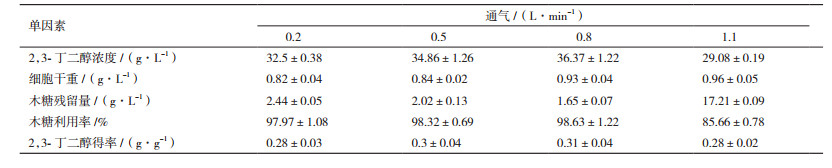
在初始木糖浓度为120 g/L,温度为35℃,接种量为7%,pH为5.5,搅拌速率为300 r/min,不同通气条件下发酵72 h,结果见表 6。在发酵周期内随着通气量的增大,菌体浓度逐渐增大,即通气量增加有利于菌体的生长繁殖;而通气量由0.2 L/min增加到0.8 L/min时,2,3-丁二醇的浓度和得率随之增加,在0.8 L/min时达到36.37 g/L,但通气增加到1.1 L/min时,2,3-丁二醇的浓度大幅度降低,说明过高的通气(供氧)不利于2,3-丁二醇的生成。综上所述,最优的通气量为0.8 L/min。
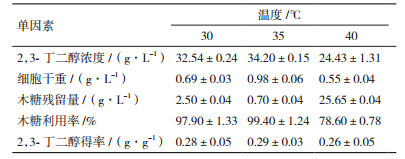
在初始木糖浓度为120 g/L,接种量为7%,pH为5.5,搅拌速率为300 r/min,通气量为0.8 L/min的条件下,对菌株在不同温度下发酵72 h,结果见表 7。随着温度的增大,菌体浓度表现为先增大后减小的趋势。当温度由30℃增加到40℃时,2,3-丁二醇的浓度和得率也先增大后减小,在35℃时,2,3-丁二醇的浓度达到最大为44.20 g/L,表明35℃为生产2,3-丁二醇的最适温度。
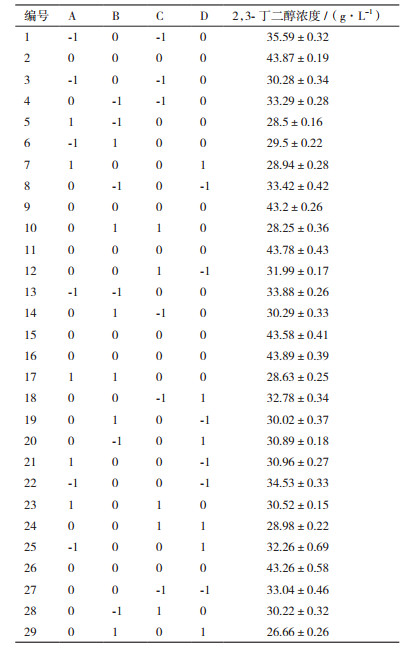
根据前面单因素实验的结果,对pH、温度、转速、通气量4个因素进行Box-Behnken实验设计,根据表 1因素的水平编码,进行Box-Behnken中心组合实验设计,方案与结果见表 8。
利用Design Exper软件对实验数据进行多元二次回归拟合,得到的回归方程模型为:2,3-BD=43.54-1.51A-1.32B-1.26C-1.04D+1.13AB+1.4AC-0.69CD-6.07A2-7.23B2-5.86C2-5.86D2。2,3-BD为2,3-丁二醇的浓度。回归方程及偏回归系数方差分析结果见表 9。由表 9可知,该回归模型P < 0.0001,失拟项P>0.05,说明该模型回归方程显著,失拟项不显著,模型可用。模型R2 = 0.996,Radj2 = 0.994,说明该模型与实验拟合程度较好,能较好地反映各因素与响应值变化的关系,可用于2,3-丁二醇产量的理论预测。回归方程中的A、B、C、D、AB、AC、CD、A2、B2、C2、D2对2,3-丁二醇产量影响显著。通过响应面的数字最优组合分析得到的最佳发酵条件为:温度34.75℃,pH 5.9,通气量0.65 L/min,转速227.85 r/min,理论预测2,3-丁二醇值为最高值43.84 g/L。
由图 6-C可知,当固定转速时,随着pH的升高,2,3-丁二醇的产量先升高后降低,趋势明显;当固定pH时,随着转速的增加,2,3-丁二醇产量先升高后降低,趋势平缓,升高幅度较小。响应面等高线密集,转速和pH的交互作用极显著。图 6-A、B分别为通气量和温度、转速和通气量之间的交互作用,由图 6-A、B可知,固定通气和转速、温度和通气量任一因素,随着另一因素的升高,2,3-丁二醇的产量均呈现先升高后下降的趋势。转速与通气量、通气量和温度之间的交互作用极显著。

|
| 图 6 温度和通气、通气和转速、pH和转速分别对2,3-丁二醇产量交互影响的响应面 A:温度和通气对2,3-丁二醇产量交互影响的响应面;B:通气和转速对2,3-丁二醇产量交互影响的响应面;C:pH和转速对2,3-丁二醇产量交互影响的响应面 |
响应面优化所得最优条件:温度34.75℃,pH 5.9,通气量0.65 L/min,转速227.85 r/min,理论预测2,3-丁二醇值为最高值43.84 g/L。考虑到发酵罐的控制问题,将通气量修正为0.7 L/min,转速修正为230 r/min,温度修正为35℃,pH修正为6.0,在此条件下实测2,3-丁二醇的含量为43.75 g/L,优化前仅为32.96 g/L,2,3-丁二醇的产量提高了32.7%。
3 讨论微生物在不同环境胁迫下的耐受性对于生物燃料和生物化学品的有效生产有重要意义,因此筛选具有高耐性的菌株成为人们的研究热点。人们在微生物菌种选育上也具有丰富的经验。首先是从微生物的自然生存环境中分离微生物,特别是具有特殊性状,如高温、耐温等微生物,但是从自然界直接分离到的野生型菌株积累产物的能力往往很低,无法满足工业生产的需要;其次经过诱变筛选具有优良遗传性状的菌株,诱变育种虽然突变率高,但其表型随机、遗传性质不稳定[24]。本研究通过适应性进化的方法在非致命压力的条件下,筛选出具有高木糖耐性并且其表型和遗传性质稳定的突变菌株。
目前,由于高耐受性生产菌株对于工业生产具有重要的意义,越来越多的人致力于耐受性及其分子机制的研究。Weidmann等[25]通过在乳酸乳球菌中过表达嗜酸酒球菌的sHsp,筛选出了具有耐热和耐酸的乳酸乳球菌,从而提高了工业菌株的生产性能。Amira等[26]将LmVHA-E1基因从盐藻属植物的叶子中分离出来,并转移到拟南芥中,以提高其对高盐度和干旱胁迫的耐受性。其研究结果表明,高盐度和耐干旱耐受性的提高是由于与应激相关基因(如AtNHX1 AtP5CS,AtCAT,AtSOD,AtPOD和AtLEA)表达水平的提高导致钠离子进入到液泡的能力,渗透调节的能力和转基因植物的活性氧清除能力提高。Gao等[27]通过随机插入缺失链交换诱变方法设计全局调控因子rpoD基因,筛选出了具有耐酸性的大肠杆菌突变体,结合转录组和表型分析结果表明,除耐酸性外,大肠杆菌发生差异的基因中95个有代表性的基因表达上调,178个基因的表达量下调,这些基因在代谢中涉及海藻糖的生物合成,核苷酸的生物合成,碳代谢,氨基酸的利用。一些主要调控因子(ArcA,EvgA,H-NS,RpoS)和基因/操纵子特异性转录因子(GadX,GadW,AppY,YdeO,KdgR)也受到调控。这些结果表明,RpoD作为大肠杆菌生长期的全局调节因子,从而提高了其耐酸性。虽然近年来越来越多的人们致力于耐受性菌株的研究,但对高糖耐性的研究较少。本研究通过适应性进化的方法筛选到了一株高木糖耐性并且高产2,3-丁二醇的肺炎克雷伯氏菌株KP2,与亲本菌株相比其木糖转化率提高了174.5%,2,3丁二醇的总体产量提高了227%。为了解释产生这种变化的原因,对其进行转录组学分析,结果表明与亲本菌株相比KP2菌株差异表达基因总数为505个,其中有242基因上调和263个基因下调。对差异表达基因的Pathway分析结果表明KP2的505个差异表达基因中共有453个差异基因比对至113个代谢途径中,其中与木糖代谢和产物合成直接相关差异表达基因涉及糖酵解、TCA循环、磷酸戊糖途径、氧化磷酸化、能量代谢、跨膜运输等多个生理生化过程。对木糖发酵生产2,3-丁二醇过程中木糖分解代谢、2,3-丁二醇和乙偶姻代谢、丙酮酸代谢、琥珀酸代谢、乳酸代谢、乙酸代谢有显著影响。这些结果说明了在适应性进化的条件下,微生物通过改变各个代谢途径来适应新环境,转录组学的分析解释了高木糖耐性菌株产生这种变化的机理,为以后的分子生物学改造提供参考。由此可见,适应性进化方法作为高耐性菌株的选育途径在工业生产中具有广阔的前景,转录组学的分析方法可以为微生物菌株的工业生产提供借鉴。
4 结论本研究通过适应性进化筛选出一株高木糖耐性并高产2,3-丁二醇的突变菌株KP2,并对原始菌株KPG和突变菌株KP2进行转录组分析。结果显示:KP2菌株差异表达基因总数为505,其中有242个基因上调和263个基因下调。差异表达基因Pathway分析表明,转录水平的变化主要表现在信号转导、跨膜运输、碳水化合物代谢、能量代谢和其它物质代谢。
在单因素实验的基础上,应用响应面分析法探究了pH、温度、转速、通气量对2,3-丁二醇产量的影响,得到最优发酵条件为:pH 5.9、温度35℃、转速230 r/min、通气量0.7 L/min,最优条件下2,3-丁二醇产量高达43.75 g/L,相比优化前提高32.7%。
本研究获得了高效利用木糖生产2,3-丁二醇的菌株,对表型变化产生的机理在分子水平上进行阐述,并得到了最优的发酵条件,结果可以为2,3-丁二醇的生物转化提供参考,对2,3-丁二醇的生物法生产具有一定的指导意义。
| [1] |
Van Haveren J, Scott EL, Sanders J. Bulk chemicals from biomass[J]. Biofuels Bioproducts & Biorefining, 2008, 2(1): 41-57. |
| [2] |
Celińska E, Grajek W. Biotechnological production of 2, 3-butanediol-current state and prospects[J]. Biotechnology Advances, 2009, 27(1): 715-725. |
| [3] |
Guo XW, Cao CH, Wang YZ, et al. Effect of the inactivation of lactate dehydrogenase, ethanol dehydrogenase, and phosphotransacetylase on 2, 3-butanediol production in Klebsiella pneumoniae strain[J]. Biotechnology for Biofuels, 2014, 7(1): 44. DOI:10.1186/1754-6834-7-44 |
| [4] |
Syu MJ. Biological production of 2, 3-butanediol[J]. Applied Microbiology & Biotechnology, 2001, 55(1): 10-18. |
| [5] |
Ma CQ, Wang A, Qin J, et al. Enhanced 2, 3-butanediol production by Klebsiella pneumoniae SDM[J]. Applied Microbiology & Biotechnology, 2009, 82(1): 49-57. |
| [6] |
Ji XJ, Huang H, Zhu JG, et al. Engineering Klebsiella oxytoca for efficient 2, 3-butanediol production through insertional inactivation of acetaldehyde dehydrogenase gene[J]. Applied Microbiology & Biotechnology, 2010, 85(6): 1751-1758. |
| [7] |
De Mas C, Jansen NB, Tsao GT. Production of optically active 2, 3-butanediol by Bacillus polymyxa[J]. Biotechnology & Bioengineering, 1988, 31(4): 366-377. |
| [8] |
Ji X J, Huang H, Ouyang PK. Microbial 2, 3-butanediol production:a state-of-the-art review[J]. Biotechnology Advances, 2011, 29(3): 351-364. DOI:10.1016/j.biotechadv.2011.01.007 |
| [9] |
Zhang L, Yang Y, Sun J, et al. Microbialproduction of 2, 3-butanediol by a mutagenized strain of Serratia marcescens H30[J]. Bioresource Technology, 2010, 101(6): 1961-1967. DOI:10.1016/j.biortech.2009.10.052 |
| [10] |
Jansen NB, Tsao GT. Bioconversion of pentoses to 2, 3-butanediol by Klebsiella pneumonia[J]. Advances in Biochemical Engineering/Biotechnology, 1983, 27: 85-99. DOI:10.1007/BFb0009100 |
| [11] |
Jansen NB, Flickinger MC, Tsao GT. Production of 2, 3-butanediolfrom D-xylose by Klebsiella oxytoca ATCC 8724[J]. Biotechnology & Bioengineering, 1984, 26(4): 362-369. |
| [12] |
Ji XJ, Huang H, Du J, et al. Developmentof an industrial medium for economical 2, 3-butanediol production through co-fermentation of glucose and xylose by Klebsiella oxytoca[J]. Bioresource Technology, 2009, 100(21): 5214-5218. DOI:10.1016/j.biortech.2009.05.036 |
| [13] |
Yan L, Zhang H, Chen J, et al. Dilutesul furicacid cyclespray flow-through pretreatmen to cornstover for enhancement of sugar recovery[J]. Bioresource Technology, 2009, 100(5): 1803-1808. DOI:10.1016/j.biortech.2008.10.001 |
| [14] |
Chandrankant P, BisariaVS. Simultaneous bioconversion of glucos and xylose to ethanol by Saccaromy cescerevisiae in the presence of xylose isomerase[J]. Applied Microbiology & Biotechnology, 2000, 53(3): 30-309. |
| [15] |
Perez J, Munoz-Dorado J, Rubia DLT, et al. Biodegradation and biologicalt-reatments of cellulose, hemicellulose and lignin:an overview[J]. International Microbiology, 2002, 5(2): 53-63. DOI:10.1007/s10123-002-0062-3 |
| [16] |
张翠英, 肖冬光, 韩宁宁, 等. 木糖发酵高产2, 3-丁二醇菌株的选育[J]. 食品研究与开发, 2011, 32: 168-170. |
| [17] |
肖冬光, 韩宁宁, 张翠英, 等. 木糖发酵产2, 3-丁二醇培养基的优化[J]. 酿酒科技, 2010, 190(4): 26-30. |
| [18] |
冯燕青, 夏黎明. Klebsiella oxytoca发酵木糖生产2, 3-丁二醇的研究[J]. 林产化学与工业, 2009, 29(1): 103-106. DOI:10.3321/j.issn:0253-2417.2009.01.022 |
| [19] |
Yu EK, Saddler JN. Enhanced production of 2, 3-butanediol by Klebsiella pneumoniae grown on high sugar concentrations in the presence of acetic acid[J]. Applied & Environmental Microbiology, 1982, 44(4): 777-784. |
| [20] |
Yu EK, Saddler JN. Fed-batch approach to production of 2, 3-butanediol by Klebsiella pneumoniae grown on high substrate concentrations[J]. Applied & Environmental Microbiology, 1983, 46(3): 630-635. |
| [21] |
Li R, Yu C, Li Y, et al. SOAP2:An improved μLtrafast tool for short read alignment[J]. Bioinformatics, 2009, 25(15): 1966-1967. DOI:10.1093/bioinformatics/btp336 |
| [22] |
Ferreira SLC, Bruns RE, Ferreira HS, et al. Box-Behnken design:An alternative for the optimization of analytical methods[J]. Analytica Chimica Acta, 2007, 597(2): 179. DOI:10.1016/j.aca.2007.07.011 |
| [23] |
Anjum MF, Tasadduq I, Al-Sultan K. Response surface methodology:A neural network approach[J]. European Journal of Operational Research, 1997, 101(1): 65-73. DOI:10.1016/S0377-2217(96)00232-9 |
| [24] |
聂明, 李怀波, 万佳蓉, 等. 工业微生物遗传育种的研究进展[J]. 现代食品科技, 2005, 21(3): 184-187. |
| [25] |
Weidmann S, Magali M, Laurent J, et al. Production of the small heat shock protein Lo18 from Oenococcus oeni in Lactococcus lactis improves its stress tolerance[J]. International Journal of Food Microbiology, 2017, 247: 18-23. DOI:10.1016/j.ijfoodmicro.2016.06.005 |
| [26] |
Amira D, Rania BS, Faical B, et al. Over-expression of a subunit E1 of a vacuolar H+-ATPase gene(Lm VHA-E1)cloned from the halophyte Lobularia maritima improves the tolerance of Arabidopsis thaliana to salt and osmotic stresses[J]. Environmental & Experimental Botany, 2017, 137: 128-141. |
| [27] |
Gao X, Jiang L, Zhu L, et al. Tailoring of global transcription sigma D factor by random mutagenesis to improve Escherichia coli tolerance towards low-pHs[J]. Journal of Biotechnology, 2016, 224: 55-63. DOI:10.1016/j.jbiotec.2016.03.012 |